Method Article
Kultur von embryonalen Maus Cochlear Explantate und Gentransfer durch Elektroporation
In diesem Artikel
Zusammenfassung
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
Zusammenfassung
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
Einleitung
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
Protokoll
HINWEIS: Alle Protokolle mit lebenden Tieren müssen überprüft und durch ein Institutional Animal Care und Verwenden Committee (IACUC) zugelassen worden sein und offiziell anerkannte Methoden für die Pflege und Verwendung von Labortieren folgen. Alle Sektionen sollte mit einer sterilen Technik auf eine saubere Sterilbank werden. Handschuhe und eine Maske, falls erwünscht, sollte bei diesem Verfahren getragen werden.
1. Präparation der embryonalen Maus-Ear-
- Einrichten für Corti-Organ Explantatkulturen:
- Sterilisieren der Laminarströmung Gewebekulturhaube durch Einschalten UV-Licht für ungefähr 30 min und desinfiziert die Oberfläche mit 70% igem Ethanol vor der Verwendung. Zusätzlich zu sterilisieren alle Dissektionsinstrumente einschließlich feiner Dissektion Werkzeuge und Sylgard-beschichtete Platten für Embryo Dissektion über Autoklaven oder durch Eintauchen in 70% Ethanol für mindestens 20 Minuten vor dem Gebrauch. Gießen Sie 70% Ethanol und lassen Sie die Speisen und Instrumente an der Luft trocknen in einem sauberen laminare Strömung clean Bank vor der Verwendung.
- Vorbereitung steriler Hanks Balanced Salt Solution (HBSS) / (4- (2-Hydroxyethyl) -1-piperazinethansulfonsäure) (HEPES) Mischung durch Zugabe von 10% 10x HBSS und 0,5% HEPES und den pH-Wert auf etwa 7,2 und Filter sterilisieren endgültige Lösung und bei 4 ° C. Führen Sie alle Sektionen in gekühlt HBSS / HEPES-Lösung zu einer besseren Erhaltung der Gewebe während des gesamten Verfahrens.
- Beschichtung von Glasbodenschalen mit Basalmembranmatrix durch Zugabe von 5 ml kaltem (4 ° C) sterile Dulbeccos Modified Eagle Medium (DMEM) zu einem 300 & mgr; l Aliquot von Basalmembran-Matrix in einem sterilen 15 ml-Polypropylenröhrchen. Vortexen Inhalt und mit 150 ul der Basalmembranmatrix-DMEM Mischung auf die Mitte jeder Kulturschale, so dass es den in der Mitte der Schale gut vorliegenden gesamte Kultur umfasst. Decken Sie die Speisen und an einem 37 ° C Inkubator für mindestens 45 Minuten vor dem Gebrauch.
- Gießen Sie 4-5 ml gekühlt HBSS umgree sterile Polystyrol-Petrischalen und verlassen in der Haube geschlossen ist.
- Bereiten Kulturmedium in einem sterilen 15 ml-Polypropylenröhrchen durch Zugabe von 9 ml DMEM werden 100 ul N2 Ergänzungen, 10 g / ml Cipro und 1 ml FBS.
- Die Isolierung der Embryonen:
HINWEIS: In diesem Verfahren zum Kultivieren von Cochlea-Explantate aus embryonalen Mäuse, Ernte Innenohren aus embryonalen Tag (E) 13 Schläfenbeine mit dem Tag nach der Befruchtung als E1 9 berücksichtigt. Das Protokoll kann auch mit embryonalen Maus inneren Ohren beginnend von E12 bis E18 verwendet werden.- Euthanize eine zeitgesteuerte schwangeren Maus mit CO 2 und opfern Tier durch Genickbruch oder entsprechend zugelassenen Protokollen. Führen Sie die Euthanasie von Laminar-Flow-Gewebekultur Haube, um die Sterilität in der Gewebekulturraum zu erhalten.
- Zeigen eingeschläfert Maus auf Papiertuch mit Bauch nach oben und desinfizieren Bauch mit 70% Ethanol.
- Öffnen Sie die Bauchhöhle durch Greifen der Hautmit einer gebogenen Pinzette mit einer Hand und schnitt Epidermis und Muskeln entlang der Mittellinie mit einer Schere mit einer anderen Hand. Machen Sie zwei senkrechte Schnitte auf beiden Seiten und ziehen Sie den Uterus sorgfältig durch Anheben bilateralen Gebärmutterhörner mit einer Pinzette und entfernen Sie sie von unten Binde mit Gewebe Schere.
- Setzen Sie den embryonalen Kette in einer Petrischale mit Kalt Dissektion Lösung (HBSS / HEPES-Gemisch) und Transfer zum Laminar-Flow-Sterilbank.
- Embryonen vorsichtig aus Plazenta und legen Sie sie in einem der sterile Petrischalen mit Dissektion Lösung. Wenn die Lösung färbt sich blutig, verschieben Sie sie in eine neue Petrischale.
HINWEIS: An dieser Stelle können Embryonen mit einem Theiler Inszenierung Führung statt. - Enthaupten Embryonen durch Kneifen im Halsbereich mit einem Paar von sauberen Pinzette oder Schere und legen die Köpfe in einer Petrischale mit frisch gekühlt Sezieren Lösung.
- Dissection der inneren Ohren:
- Ort one Embryokopf in einem sterilen Sylgard Schale mit kaltem Seziertisch
- Lösung. Arbeiten unter einem Binokular mit einer Vergrößerung von ~ 1,6X, immobilisieren den Embryo Kopf, indem Minutien Stifte oder um näher an Augenbereich (1A).
- Mit zwei Paar sterile Pinzette vorsichtig die Haut und die Öffnung des Schädels auf der Rückenseite entlang der Mittellinie (Abbildung 1B). Entfernen Gehirn von Schädelhöhle und Innenohren im Schläfenbeine befindet, kann in diesem Stadium (1C, D) identifiziert werden. Die Auskleidung des Blutgefäßes, die normalerweise um den Innenohren vorhanden ist, kann als Bezugspunkt für die Identifizierung des Innenohrs in dieser Phase (1D) verwendet werden.
- Präparieren Sie die Innenohr von der zeitlichen Knochen, indem die Zange unterhalb des Gewebes und Isolierung des Innenohrs von der Schädelbasis und in ein neues Gericht, das kalt Sezieren Lösung (1E, F).
2. Erzeugung von Corti-Organ Explantatkulturen
HINWEIS: In diesem Stadium der Entwicklung wird das Gewebe Knorpel und kann mit einer Pinzette leicht präpariert werden.
- Richten Sie das Innenohr, so dass Bauchseite nach oben zeigt (Abbildung 2A) und Stabilisierung des Innenohrs durch leichtes Einsetzen des scharfen Ende Minutien Stifte durch die vestibulären Teil des Innenohrs (2B).
- Mit ultrafeinen Zange aufgeschnitten das darüber liegende Knorpel durch einen Einschnitt mit einem Ende der Zange in der Nähe von dem ovalen Fenster und entfernen Sie vorsichtig den Knorpel aus der Hörschnecke (2C).
Hinweis: Es ist wichtig, sicherzustellen, dass Zange nicht zu tief in den Knorpel einge als darüberliegenden Knorpel wird manchmal mit dem Schneckengang in diesem Fall ist es hilfreich, geschlossener Zange verwenden, um Knorpel von dem darunterliegenden Schneckengang frei durch Abkratzen unter der kondensierte sberfl des Knorpels. In diesem Stadium der Entwicklung, ist die Spirale der Cochlea nur drei Viertel einer Umdrehung in der Länge. - Als nächstes setzen die Sinnesepithel indem die Zange in dem bevorzugten Bereich der Schneckengang entweder der Basis oder an der Spitze sehr, und sanft herausziehen das Dach der Cochlea (2D).
HINWEIS: Das Dach der Cochlea muss vollständig entfernt werden, da es die Sinnesepithel behindern die Analyse maskieren.
HINWEIS: Dieses Verfahren muss vorsichtig erfolgen, da es einfach ist, die Sinnesepithel reißen werden. - Als letzter Schritt, vorsichtig die zugrunde liegenden Bindegewebe von der freiliegenden Sinnesepithel so dass die Basis der Cochlea-Explantat gleichmäßig flach.
- Isolieren Sie die seziert Cochlea von der vestibulären Teil des Innenohrs mit einer Pinzette. Dies kann vor oder nach dem Schritt 2.4 (2E) durchgeführt werden.
- Übertragen Sie die seziert Cochlea Sinnesepithel in einen Keller membrane Matrix-beschichteten Kultur auch mit einem 1,5 mm sterile scooper (2F).
- Richten Sie die Cochlea-Explantat mit der Lumenoberfläche des Epithels nach oben ein und saugen Sie den Basalmembranmatrix-DMEM-Lösung sorgfältig zu glätten das Gewebe und ersetzen Sie es mit 150 ml frisches Kulturmedium durch sanftes Zugabe in die Schale. Ist darauf zu achten, um sicherzustellen, dass jedes Explantat haftet gut auf der beschichteten Glasdeckglas und wird nicht in das Kulturmedium schwimm werden. Stellen Sie sicher, dass die Spitze der Zange wird darauf hingewiesen, während der Anbringung des Glases auch um eine Beschädigung der Cochlea Explantation.
- Die Kulturschale vorsichtig Führung in eine sterile 150 mm Kulturschale und in eine Gewebekultur-Inkubator bei 37 ° C mit 5% CO 2 für eine gewünschte Zeitdauer, in der Regel 3-6 Tage in vitro (DIV). Nach 1 DIV, untersuchen Sie die Kulturen unter einem Binokular, um sicherzustellen, dass die Cochlea-Explantat wurde auch in die Kulturschale eingehalten werden.
- Nach dem incubation in vitro für die gewünschten Zeitdauern werden die Kulturen für die Immunhistochemie verarbeitet.
HINWEIS: Die Explantatkulturen Regel werden 6 DIV das entspricht Entwicklungsstufe, P0 inkubiert. Nach Inkubation in vitro können Kulturen für Downstream-Anwendungen wie die Immunhistochemie (3B) verarbeitet werden, RT-PCR, in situ-Hybridisierung und / oder Western Blot.
3. Elektroporation vermittelte Gentransfer
- Die Einrichtung für die Elektroporation:
- Sterilisieren Sie einen 100 mm Sylgard-beschichtete Glasschüssel durch Autoklavieren oder Eintauchen in 70% Ethanol für etwa 20 Minuten und an der Luft trocknen in einer Sterilbank vor der Verwendung.
- Bereiten DNA aus einem Expressionsvektor der Wahl mit geeigneten Maxi- oder Midi-Prep-Kits. Die in diesem Protokoll verwendeten Expressionsvektoren sind pIRES2-Atoh1.EGFP und pCLIG-NeuroD1.EGFP. Die Endkonzentration der DNA sollte mindestens 1 ug / ul in sterilem DNA sein /RNase-freies Wasser.
- Elektroporation DNA in embryonale Cochlea Explantate:
- Fügen Sie 10 ul der Plasmid-DNA-Lösung auf eine frische 100 mm Sylgard beschichtete Schale und übertragen eine komplett zerlegt Cochlea Explantation (aus Schritt 2.5 erhalten) in die DNA-Lösung.
- Mit Lumenoberfläche des Epithels nach oben, kippen Sie das Cochlea leicht, so dass es senkrecht zur Ebene der Schale.
- Die Elektrode Schaufeln auf beiden Seiten der Cochlea mit negativen Paddel (Kathode) in Richtung des sensorischen Epithels und der positiven Paddel (Anode), die benachbart zu der Basis der Cochlea.
Hinweis: Da die DNA negativ geladen ist, von negativ nach positiv Elektrode und durch die Plazierung einer Kathode Ende der Sonde angrenzend an das Riechepithel wandert es; die DNA wird vor allem durch die Oberfläche des Sinnesepithel gehen. - Mit Elektroporator liefern 9-10 Pulse von 24 mV, 30 ms Pulsdauer mit dem Fußschalter auf T-er Elektroporator, und fügen Sie 100 ul von warmem Kulturmedium, um die elektroporierten Cochlea.
- Die Schritte 3.2.1-4 für alle Cochlea Explantate und DNA der Gene von Interesse und übertragen die elektroporierten Cochleae in die Basalmembran-Matrix-beschichtete Schale zum Plattieren (Schritt 2.7). Kultur ganze elektroporiert Cochleae in einem 37 ° C, 5% CO 2 befeuchteten Inkubator für gewünschte Zeitdauern, die dann für Immunzytochemie verarbeitet werden.
HINWEIS: Die Schnecke aus einem ganzen Wurf von CD1 Maus (ungefähr 8-12 Welpen) isoliert werden, mikrodissezierten, elektroporiert und in <4 Stunden überzogen.
4. Analyse der Cochlear Explantatkulturen
HINWEIS: Die Kulturen werden in der Regel für 6 DIV, die äquivalent zu der Entwicklungsstufe, P0 ist, inkubiert. Nach Inkubation in vitro werden die Kulturen fixiert und für Immunzytochemie verarbeitet.
- Nach gewünschte Länge incubation Entfernen Kulturmedium schnell und gründlich die Cochlea Explantat in phosphatgepufferter Salzlösung (PBS) und Inkubation in 4% Paraformaldehyd (in PBS) für 15 min bei Raumtemperatur.
- 15 min Waschen Sie die Fixiermittel durch Zugabe von PBS und spülen in PBS dreimal.
- Permeabilisieren Verwendung von PBS-T (PBS + 0,5% Tween) für 30 min vor dem Blockieren mit PBS-T, enthaltend 10% Ziegenserum.
- Inkubiere in primären Antikörperlösung, die Primärantikörpers in PBS-T mit 1% Ziegenserum über Nacht bei 4 ° C.
- Dreimal Waschen Sie die Cochlea bei Raumtemperatur mit PBS-T jede 15 Minuten, bevor Sie entsprechende Alexa-konjugierten Sekundärantikörper.
- Da der Cochlea Explantat auf Glasdeckgläschen kultiviert sie können einzeln durch Isolierung des Deckglases von der Schale und die Montage auf einer Folie verarbeitet werden. Dies kann durch Eintauchen der Kulturschale in OS30 Lösungsmittel für mindestens 1 Stunde bei Raumtemperatur erreicht werden. Mit dem sterilen Rasierklinge, nehmen Sie den Deckglas aus der dish und montieren auf einer Folie und sichtbar unter einem Fluoreszenzmikroskop.
Ergebnisse
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
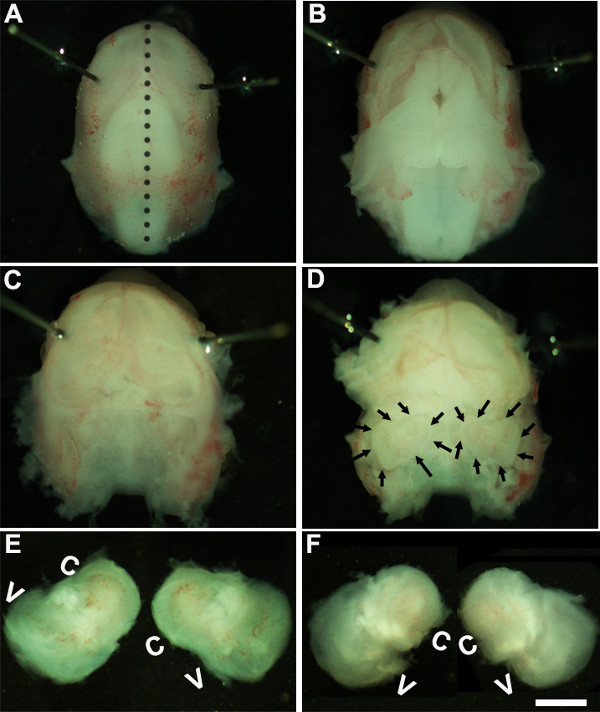
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
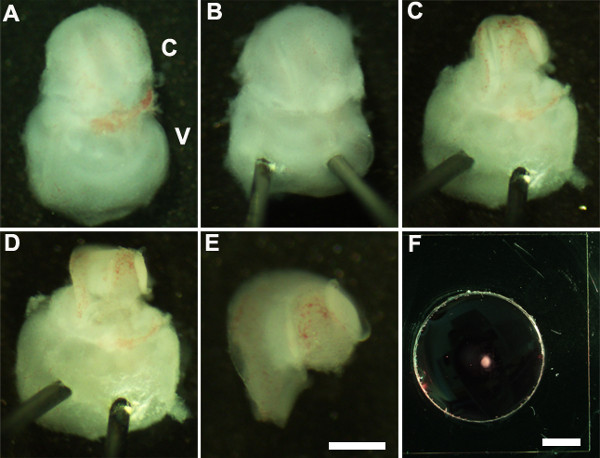
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
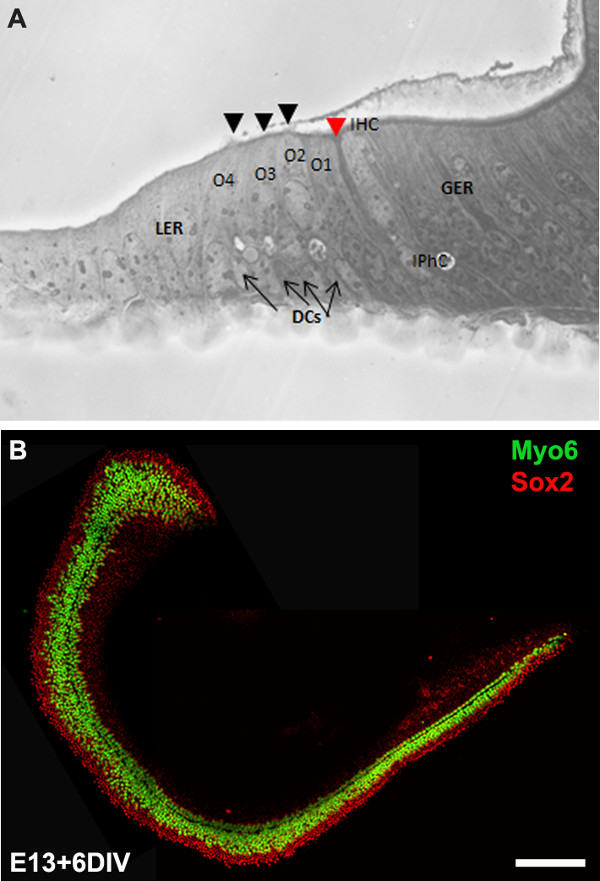
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
Diskussion
Alle Zellen innerhalb des membranösen Labyrinth des Maus Innenohres einschließlich sensorischer, nonsensory und die Spiralganglienneuronen sind alle aus placodally abgeleiteten otocyst benachbart zu dem Hinterhirn des Ektoderms rund E8 10-14 abgeleitet ist. Bei E11 ventralen Bereich des otocyst erstreckt, um den Schneckengang zu bilden, und die Entwicklung geht weiter, eine Gruppe von Epithelzellen in der Cochlea als auch in anderen Bereichen des otocyst, werden als prosensory Patches, anschließend Hieraus wird angegeben verschiedene Arten von mechanosensorischen Haarzellen und Stützzellen nonsensory. In der Entwicklung von Cochlea, können eine Reihe von inneren Haarzellen und drei Reihen von äußeren Haarzellen um E15.5 und E17 identifiziert werden kann, ist im Wesentlichen abgeschlossen Strukturierung mit einzelnen Reihe von inneren Haarzellen, Säule Zellen und drei Reihen von äußeren Haarzellen . In einer Zeitperiode, die von E11 überspannt, wenn der Schneckengang beginnt zuerst durch E17 wachsen alle difschiedlichen Zellschicksal Entscheidungen und Musterung kommen in der Entwicklung von Epithel, eine markante zelluläre Muster mit einem üblichen Ergänzung der Haarzellen und Stützzellen zu erzeugen. Verlust der Haarzellen und / oder Stützzellen ist die häufigste Ursache der Schwerhörigkeit. Da diese Zelltypen werden nur während einer relativ kompakten Zeitraum während der embryonalen Entwicklung erzeugt wird, ist es entscheidend, die molekularen und genetischen Signalwege, die jede dieser Zelltypen, die wichtige Einblicke in regenerative Strategien führen sollen angeben verstehen.
Cochlear Kultivierung und Elektroporation Techniken entwickelt worden, um die Genexpression im sich entwickelnden Maus manipulieren. In diesem Video haben wir gezeigt, Kultivierung Techniken zur Erzeugung von primären Explantaten und eine Elektroporation Technik für den Gentransfer in kultivierte embryonale Maus-Corti-Organ. Die primäre Explantate auf diese Weise hergestellt wurden, können für 7-10 Tage in vitro aufrechterhalten werden. Cochlear Explantate can verwendet werden, um die Genexpression durch pharmakologische Ansätze, die es uns ermöglichen, die Mechanismen, die Entwicklungsprozesse wie Schicksal Spezifikation, Engagement, Differenzierung und Strukturierung regeln verstehen zu manipulieren. Darüber hinaus ermöglicht diese Methode die Analyse von Entwicklungs Phänotypen der Mutanten embryonalen Mäuse, die nicht in der Vergangenheit E12 überleben.
Die Rechteck Elektroporation vermittelte Gentransfer Verfahren stellt einen Mechanismus zur Manipulation der Genexpression in sensorischen Haarzellen, Stützzellen und Zellen innerhalb GER und LER Regionen, um ihr Schicksal ex vivo zu visualisieren. Mit diesem Verfahren können wir herunterregulieren oder ektopisch exprimieren spezifische Gene in prosensory Zellen, Haarzellen und / oder Stützzellen in einem ansonsten Wildtyp-Hintergrund und ihre spezifischen Auswirkungen auf das Schicksal Spezifizierung und Differenzierung analysieren. Dies wird es uns ermöglichen, spezifische Gen-Funktion in der Entwicklung von Cochlea zu verstehen. Zum Beispiel, wie in gezeigt, 4 ist die erzwungene Expression Atoh1 2,4 oder NeuroD1 8 in Zellen innerhalb GER oder LER führt zur Bildung von ektopischen Haarzellen und Neuronen sind. Zusätzlich erlaubt diese Technik, um mehrere Kandidatengene 6,7 elektroporieren und prüft ihre Wirkung auf sensorischer Haarzellen und Stützzellen Bildung, Differenzierung und ihre Organisation. Gentransfertechnik mit adenoviralen Vektoren bietet breite Expression und wurden erfolgreich in das Innenohr 15,16 verwendet. Jedoch hängt diese Technik auf die Fähigkeit zu erzeugen und Reinigung der Viren, die häufig zeitaufwendig.
Obwohl cochear Kulturen kann so früh wie E12, die Elektroporation von Cochlea Explantate jünger als E12.5 hergestellt werden / E13 wird einer Beschädigung des Gewebes zur Folge, was es mühsam für die Analyse. Darüber hinaus wurde der Promotor des Expressionsvektors bestimmt, welche Zelltypen innerhalb der Cochlea du transfiziertct. Beispielsweise kann die menschliche Cytomegalovirus-Promotor enthaltenden Expressionsvektoren ergibt robust Transfektion in Kollikers 'Organ, während die Verwendung des frühen CMV-Enhancer / chicken beta-Aktin-Promotor führt zu einer höheren Effizienz der Transfektion in Zellen innerhalb des sensorischen Epithels. Die häufigsten Probleme bei der Elektroporation von embryonalen Cochlea Explantate begegnet sind übermäßige Zelltod und / oder Beschädigung des Gewebes und schlechte Transfektionseffizienz. Der geeignete Abstand der Elektroden und die DNA-Konzentration eine entscheidende Rolle beim Erhalten minimaler Schädigung und höhere Transfektionseffizienz. Insgesamt verbessert diese Techniken unsere Fähigkeit, die Genexpression über Gewinn oder Verlust der Funktion Strategien und pharmakologische Manipulationen zu manipulieren und eine große Hilfe in Sezieren Signale, die Musterbildung und Zellschicksal Entscheidungen zu beeinflussen.
Offenlegungen
No conflicts of interest declared.
Danksagungen
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
Materialien
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
Referenzen
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. The Atlas of Mouse Development. , Academic Press. San Diego. (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409(2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten