Method Article
Cultura della embrionali di topo cocleari espianti e Gene Transfer con elettroporazione
In questo articolo
Riepilogo
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
Abstract
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
Introduzione
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
Protocollo
NOTA: Tutti i protocolli che impiegano animali vivi deve essere esaminato e approvato da una cura e l'uso degli animali Comitato Istituzionale (IACUC) e deve seguire i metodi per la cura e l'uso di animali da laboratorio ufficialmente approvato. Tutte le dissezioni devono essere eseguiti con tecnica sterile su un banco a flusso laminare pulita. Guanti e una maschera, se desiderato, devono essere indossati durante questa procedura.
1. La dissezione del Ear embrionali di topo interno
- Impostazione per organo di culture espianto Corti:
- Sterilizzare la cappa coltura tissutale flusso laminare accendendo la luce UV per circa 30 minuti e disinfettare la superficie con etanolo al 70% prima dell'uso. Inoltre, sterilizzare tutti gli strumenti di dissezione tra cui strumenti di dissezione raffinati e piatti Sylgard rivestite di embrione dissezione tramite autoclave o per immersione in etanolo al 70% per almeno 20 minuti prima dell'uso. Eliminare il 70% di etanolo e lasciare i piatti e gli strumenti per aria secca in un flusso laminare Clea puliton panchina prima dell'uso.
- Preparare Balanced Salt Solution sterile di Hank (HBSS) / (4- (2-idrossietil) -1-acido piperazineethanesulfonic) (HEPES) miscela aggiungendo 10% di 10x HBSS e 0,5% HEPES e regolare il pH a circa 7,2 e sterilizzare il filtro soluzione finale e conservare a 4 ° C. Eseguire tutte le dissezioni di refrigerate soluzione HBSS / HEPES per conservare meglio il tessuto durante tutta la procedura.
- Piatti fondo di vetro a matrice Coat membrana basale aggiungendo 5 ml di freddo (4 ° C), sterile di Dulbecco modificato (DMEM) per un'aliquota di 300 ml di matrice membrana basale in una sterile 15 ml tubo di polipropilene. Mescolare vortexando contenuti e aggiungere 150 microlitri della miscela di matrice DMEM membrana basale al centro di ciascuna piastra di coltura in modo da coprire l'intera cultura ben presente al centro del piatto. Coprire i piatti e conservare in un 37 ° C incubatore per almeno 45 minuti prima dell'uso.
- Versare 4-5 ml refrigerate HBSS in three sterili piatti polistirene Petri e lasciare chiusi nella cappa.
- Preparare mezzo di coltura in una provetta da 15 ml di polipropilene sterile aggiungendo 9 ml di DMEM, 100 ml di integratori N2, 10 g / ml Cipro e 1 ml di FBS.
- Isolamento di embrioni:
NOTA: In questa procedura per la coltura di espianti cocleari da topi embrionali, raccolta orecchie interne dal giorno embrionale (E) 13 ossa temporali con il giorno dopo la fecondazione essere considerati come E1 9. Il protocollo può essere utilizzato anche con il mouse embrionale orecchio interno a partire dal E12 a E18.- Euthanize un mouse a tempo-incinta di CO 2 e sacrificare animali per dislocazione cervicale o appropriati protocolli approvati. Eseguire euthanization dalla cappa coltura tissutale a flusso laminare per mantenere la sterilità in sala coltura di tessuti.
- Posizionare il mouse eutanasia sul tovagliolo di carta con l'addome rivolto verso l'alto e disinfettare l'addome con il 70% di etanolo.
- Aprire la cavità addominale afferrando la pellecon pinze curve con una mano e dell'epidermide recisi e muscolo lungo la linea mediana con le forbici con un'altra mano. Fare due tagli perpendicolari su entrambi i lati e tirare fuori l'utero attentamente sollevando corna uterine bilaterali con una pinza e staccarla da sotto le forbici del tessuto connettivo con.
- Posizionare la catena embrionale in una capsula di Petri contenente soluzione raffreddata dissezione (miscela HBSS / HEPES) e trasferimento al banco pulito a flusso laminare.
- Rimuovere gli embrioni con attenzione di placenta e metterli in una delle piastre sterili contenenti soluzione dissezione. Se la soluzione diventa sanguinosa, spostarli in una nuova piastra di Petri.
NOTA: A questo punto, gli embrioni possono essere messo in scena con una guida messa in scena Theiler. - Decapitare embrioni pizzicando alla regione del collo con un paio di pinze o forbici pulite e posizionare le teste in un piatto fresco Petri contenente soluzione dissezione raffreddata.
- La dissezione delle orecchie interne:
- Luogo one testa embrione in un piatto Sylgard sterile contenente dissezione a freddo
- soluzione. Lavorando sotto un microscopio da dissezione con un ingrandimento di 1,6X ~, immobilizzare la testa dell'embrione posizionando perni Minutien intorno o più vicino alla zona degli occhi (Figura 1A).
- Utilizzando due coppie di pinze sterili rimuovere con attenzione la pelle e aprire il cranio sul lato dorsale lungo la linea mediana (Figura 1B). Rimuovere cervello dalla cavità cranica e orecchie interne situate all'interno ossa temporali possono essere identificate in questa fase (Figura 1C, D). Il rivestimento del vaso sanguigno, che di solito è presente intorno l'orecchio interno, può essere utilizzato come punto di riferimento per identificare l'orecchio interno in questa fase (Figura 1D).
- Sezionare l'orecchio interno dalle ossa temporali posizionando la pinza sotto il tessuto e isolando l'orecchio interno dalla base del cranio e trasferimento in un piatto contenente soluzione di dissezione a freddo (Figura 1E, F).
2. Generazione di Organo delle Culture Corti Explant
NOTA: In questa fase di sviluppo, il tessuto è cartilagineo e può essere facilmente sezionato con pinze.
- Orient l'orecchio interno in modo che parte ventrale è rivolto verso l'alto (Figura 2A) e stabilizzare l'orecchio interno inserendo dolcemente la punta di perni Minutien attraverso la porzione vestibolare dell'orecchio interno (Figura 2B).
- Uso pinze ultrafini tagliare aprire la cartilagine sovrastante facendo un'incisione con una estremità di pinze vicino alla finestra ovale e rimuovere la cartilagine dalla coclea (Figura 2C) con attenzione.
NOTA: È importante assicurarsi che pinze non sono inserite troppo profondamente nella cartilagine cartilagine sovrastante è talvolta fuso con il condotto cocleare nel qual caso è utile usare pinza chiusa per rilasciare la cartilagine dal condotto cocleare sottostante raschiando sotto la surface della cartilagine. A questo stadio di sviluppo, la spirale cocleare è solo tre quarti di giro in lunghezza. - Successivamente, esporre dell'epitelio sensoriale posizionando la pinza alla regione preferita del condotto cocleare, sia la base o per lo all'apice, e tirando delicatamente il tetto della coclea (Figura 2D).
NOTA: Il tetto della coclea deve essere completamente rimosso in quanto può mascherare dell'epitelio sensoriale ostacolare l'analisi.
NOTA: Questa procedura deve essere eseguita delicatamente come è facile da strappare dell'epitelio sensoriale. - Come ultima fase, rimuovere con attenzione il tessuto connettivo sottostante dall'epitelio sensoriale esposto modo che la base del trapianto cocleare è uniformemente piana.
- Isolare la coclea sezionato dalla parte vestibolare dell'orecchio interno con pinze. Questo può essere eseguito prima o dopo la fase 2.4 (figura 2E).
- Trasferire l'epitelio sensoriale cocleare sezionato in un seminterrato membrane matrix-rivestita cultura e con una paletta sterile 1,5 millimetri (Figura 2F).
- Orient espianto cocleare con la superficie luminale dell'epitelio rivolto verso l'alto e aspirare la membrana basale soluzione di matrice-DMEM per appiattire accuratamente il tessuto e sostituirlo con 150 ml di terreno di coltura fresco aggiungendo delicatamente al piatto. Si deve prestare attenzione per assicurarsi che ogni espianto aderisce bene alla coprioggetto vetro rivestito e non sta galleggiando nel mezzo di coltura. Assicurarsi che la punta della pinza è rivolta verso l'alto, mentre apponendo sul bene di vetro per evitare di danneggiare l'espianto cocleare.
- Trasferire delicatamente il piatto di cultura in un 150 millimetri piatto di coltura sterile e posto in un tessuto culturale incubatore a 37 ° C con il 5% di CO 2 per il periodo di tempo desiderato, di solito 3-6 giorni in vitro (DIV). Dopo 1 DIV, esaminare le culture sotto un microscopio da dissezione per assicurarsi che l'espianto cocleare aderisce bene al piatto di coltura.
- Dopo incubation in vitro per periodi di tempo desiderato, le culture sono trattati per immunoistochimica.
NOTA: Le culture espianto di solito vengono incubate per 6 DIV che è equivalente a stadio di sviluppo, P0. Dopo incubazione in vitro, le culture possono essere trattati per altre applicazioni a valle come immunoistochimica (Figura 3B), RT-PCR, ibridazione in situ, e / o Western Blot.
3. Elettroporazione mediata Gene Transfer
- Configurazione per elettroporazione:
- Sterilizzare uno 100 millimetri vetro piatto Sylgard rivestite in autoclave o immersione in etanolo al 70% per circa 20 minuti e lasciare asciugare in un banco pulito prima dell'uso.
- Preparare DNA da un vettore di espressione di scelta utilizzando opportuni kit simo o midi-preparazione. I vettori di espressione utilizzati in questo protocollo sono pIRES2-Atoh1.EGFP e pCLIG-NeuroD1.EGFP. La concentrazione finale di DNA deve essere di almeno 1 mg / mL in DNA sterile /Senza RNAse acqua.
- Electroporating DNA in espianti cocleari embrionali:
- Aggiungere 10 ml di soluzione di DNA plasmidico da 100 mm a piatto Sylgard rivestite fresco e trasferire un espianto cocleare completamente sezionato (ottenuto dalla fase 2.5) nella soluzione di DNA.
- Con superficie luminale dell'epitelio rivolto verso l'alto, inclinare la coclea leggermente in modo che sia perpendicolare al piano del piatto.
- Collocare le piastre di elettrodi su entrambi i lati della coclea con paddle negativo (catodo) verso l'epitelio sensoriale e la pala positivo (anodo) adiacente alla base della coclea.
NOTA: Poiché DNA è caricato negativamente, migra da negativo a elettrodo positivo e inserendo l'estremità del catodo della sonda adiacente dell'epitelio sensoriale; il DNA principalmente passare attraverso la superficie dell'epitelio sensoriale. - Utilizzando elettroporatore, consegnare 9 a 10 impulsi di 24 mV, 30 msec durata dell'impulso con l'interruttore a pedale su tegli elettroporatore e aggiungere 100 ml di terreno di coltura caldo alla coclea elettroporate.
- Ripetere i passaggi 3.2.1-4 per tutti gli espianti cocleari e per il DNA di tutti i geni di interesse e di trasferire il coclee elettroporate nel piatto di matrice rivestite membrana basale per la placcatura (passo 2,7). Culture tutte le coclee elettroporate a 37 ° C, 5% CO 2 incubatore umidificato per lunghezze desiderate di tempo che sarà poi elaborati per immunocitochimica.
NOTA: La coclea da un'intera cucciolata di CD1 mouse (circa 8-12 cuccioli) può essere isolato, microdissezione, elettroporate e placcato in <4 ore.
4. Analisi delle Culture Cochlear Explant
NOTA: Le colture vengono incubate per 6 solito DIV che è equivalente a stadio di sviluppo, P0. Dopo incubazione in vitro, le culture sono fissi e trattati per immunocitochimica.
- Dopo lunghezza desiderata di incubation, rimuovere terreno di coltura e rapidamente risciacquare l'espianto cocleare in soluzione salina tamponata con fosfato (PBS) e incubare in 4% paraformaldeide (preparato in PBS) per 15 minuti a temperatura ambiente.
- Lavare il fissativo aggiungendo PBS e sciacquare in PBS per tre volte per 15 min.
- Permeabilize con PBS-T (PBS + 0,5% Tween) per 30 minuti prima di bloccare con PBS-T contenente siero di capra 10%.
- Incubare in soluzione anticorpo primario contenente anticorpo primario in PBS-T con siero di capra 1% notte a 4 ° C.
- Lavare la coclea tre volte a temperatura ambiente utilizzando PBS-T 15 min ciascuna prima di aggiungere anticorpi secondari coniugati Alexa appropriate.
- Dal momento che l'espianto cocleare è colta sul vetrino di vetro può essere gestito individualmente isolando il vetrino dal piatto e montaggio su una diapositiva. Ciò può essere ottenuto immergendo il piatto di coltura in OS30 solvente per almeno 1 ora a temperatura ambiente. Utilizzando la lama di rasoio sterile, staccare il vetrino dal dish e montare su un vetrino e visualizzare sotto un microscopio a fluorescenza.
Risultati
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
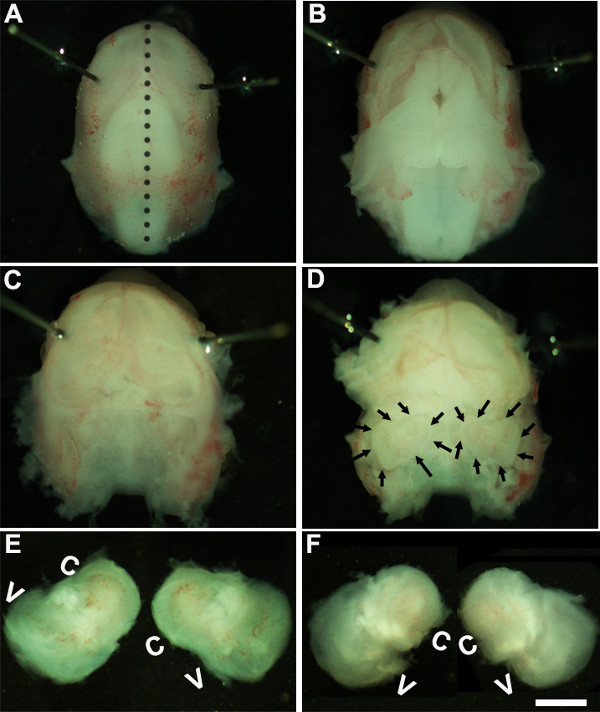
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
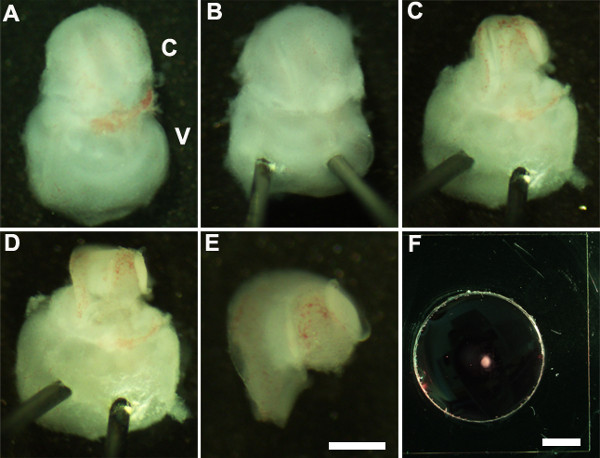
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
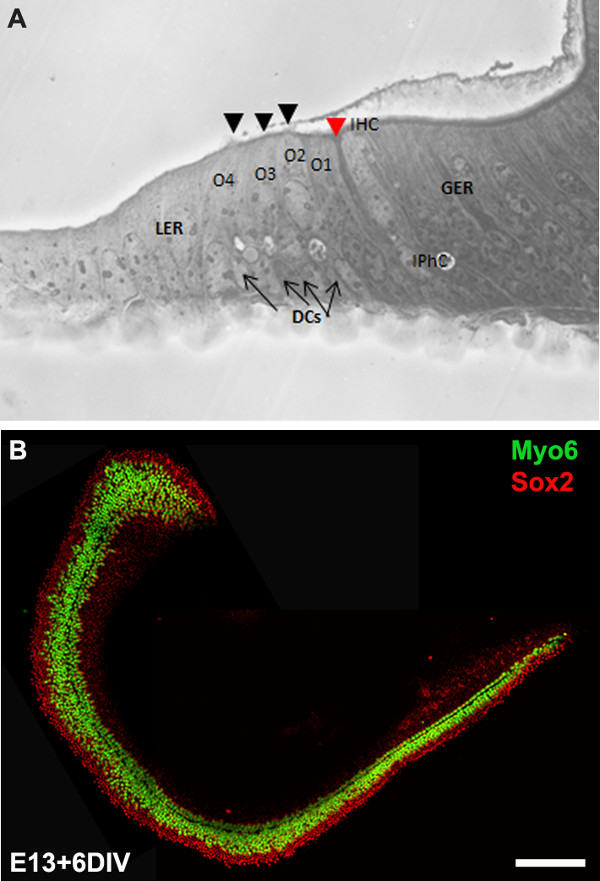
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
Discussione
Tutte le cellule all'interno del labirinto membranoso dell'orecchio interno del mouse inclusi sensoriale, nonsensory ei neuroni gangliari a spirale sono tutti derivati dallo placodally di derivazione otocyst adiacente al romboencefalo della ectoderma, intorno E8 10-14. Al E11, la regione ventrale del otocyst estende a formare il dotto cocleare e lo sviluppo continua, un gruppo di cellule epiteliali all'interno della coclea, così come in altre regioni del otocyst, diventano specificato come cerotti prosensory che saranno successivamente suscitare diversi tipi di cellule ciliate meccanosensoriali e cellule di supporto nonsensory. Nella coclea di sviluppo, una fila di cellule ciliate interne e tre file di cellule ciliate esterne possono essere identificati intorno E15.5 e E17, patterning è sostanzialmente completo di fila di cellule ciliate interne, le cellule pilastro e tre file di cellule ciliate esterne . In un periodo di tempo che va da E11 quando il condotto cocleare prima comincia a crescere attraverso E17 tutte le difdecisioni destino cellulare di- e patterning verificano all'interno dell'epitelio sviluppo per generare un modello cellulare che colpisce con una normale dotazione di cellule ciliate e cellule di supporto. La perdita delle cellule ciliate e / o cellule di supporto è la principale causa di lesioni all'udito. Dal momento che questi tipi di cellule sono generati solo per un periodo di tempo abbastanza compatto durante lo sviluppo embrionale, è fondamentale per comprendere i meccanismi molecolari e genetici che specificano ognuno di questi tipi di cellule che dovrebbero portare a una visione significativa nelle strategie di rigenerazione.
Tecniche di coltura e elettroporazione cocleari sono stati sviluppati per manipolare l'espressione genica nel topo sviluppo. In questo video, abbiamo dimostrato tecniche di coltura per la generazione di espianti primari e una tecnica di elettroporazione per la consegna gene in coltura organo murino embrionale di Corti. Gli espianti primari preparati in questo modo possono essere mantenute per 7-10 giorni in vitro. Espianti cocleari can essere utilizzato per manipolare l'espressione genica da approcci farmacologici che ci permetteranno di comprendere i meccanismi che regolano i processi di sviluppo, come specifica il destino, l'impegno, la differenziazione, e patterning. Inoltre, questo metodo facilita l'analisi dei fenotipi di sviluppo del mutante topi embrionale che non sopravvivono oltre E12.
La procedura di trasferimento genico onda quadra elettroporazione mediata fornisce un meccanismo per manipolare l'espressione genica in cellule sensoriali capelli, cellule di sostegno e cellule all'interno delle regioni GER e LER per visualizzare il loro destino ex vivo. Con questa procedura, possiamo downregulate o ectopica esprimere geni specifici nelle cellule prosensory, cellule ciliate e / o di sostegno delle cellule in un contesto altrimenti wild-type e analizzare i loro effetti specifici sulla specifica sorte e differenziazione. Questo ci permetterà di capire la funzione del gene specifico all'interno della coclea in via di sviluppo. Ad esempio, come mostrato in Figura 4, l'espressione forzata di Atoh1 2,4 o NeuroD1 8 in cellule entro GER o LER porta alla formazione di cellule cigliate ectopiche e neuroni rispettivamente. Inoltre, questa tecnica consente l'elettroporazione più geni candidati 6,7 ed esaminare il loro effetto sulle cellule sensoriali capelli e sostenere la formazione delle cellule, la differenziazione e la loro organizzazione. La tecnica di trasferimento genico coinvolto vettori adenovirali offre ampia espressione e sono stati utilizzati con successo nella parte interna dell'orecchio 15,16. Tuttavia, questa tecnica dipende dalla capacità di generare e purificare il virus che è spesso richiede tempo.
Anche se le culture cochear possono essere stabilite già nel E12, elettroporazione di espianti cocleari di età inferiore E12.5 / E13 si tradurrà in un danno al tessuto che lo rende ingombrante per l'analisi. Inoltre, il promotore del vettore di espressione utilizzato determina quali tipi di cellule sono transfettate all'interno cocleare duct. Ad esempio, il promotore del citomegalovirus umano contenenti vettori di espressione produce robusta trasfezione in organo Kollikers ', mentre l'uso di CMV precoce risultati enhancer / beta pollo promotore actina in maggiore efficienza di trasfezione in cellule all'interno dell'epitelio sensoriale. I problemi più comuni riscontrati durante l'elettroporazione di espianti cocleari embrionali sono morte cellulare eccessiva e / o danneggiamento del tessuto e scarsa efficienza di trasfezione. La spaziatura appropriata della elettrodi e DNA concentrazione gioca un ruolo cruciale nell'ottenere minimo danno e maggiore efficienza di trasfezione. In sintesi, queste tecniche aumenta la nostra capacità di manipolare l'espressione genica tramite guadagno o la perdita di strategie funzionali e manipolazioni farmacologiche e di grande aiuto in segnali che influenzano le decisioni di patterning e destino cellulare dissezione.
Divulgazioni
No conflicts of interest declared.
Riconoscimenti
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
Materiali
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
Riferimenti
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409 (2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon