Method Article
Культура эмбриональных мыши Cochlear эксплантов и Перенос генов путем электропорации
В этой статье
Резюме
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
Аннотация
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
Введение
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
протокол
ПРИМЕЧАНИЕ: Все протоколы, использующие живые животные должны быть рассмотрены и утверждены на уходу и использованию комитета Институциональная животных (IACUC) по и должны следовать официально одобренных методов по уходу и использованию лабораторных животных. Все вскрытия должны быть выполнены с использованием стерильной техники на чистом столе ламинарного потока. Перчатки и маски, если это необходимо, следует носить во время этой процедуры.
1. Рассечение эмбриональных Мышь внутреннего уха
- Настройка для органа Корти эксплантов культур:
- Стерилизацию ламинарного потока капот культуры ткани при включении УФ-светом в течение приблизительно 30 мин и дезинфицировать поверхность с 70% -ным этанолом перед использованием. Кроме того, все стерилизации инструментов, включая рассечение тонких инструментов рассечение и Sylgard покрытием блюд для вскрытия эмбриона через автоклаве или путем выдержки в 70% этаноле в течение по крайней мере 20 мин перед использованием. Вылейте 70% этанола и позволяют блюда и инструменты высохнуть на воздухе в Клеа потока чистой ламинарногоп скамейке перед использованием.
- Подготовка стерильного Хэнка сбалансированный солевой раствор (HBSS) / (4- (2-гидроксиэтил) -1-пиперазинэтансульфонова кислота) (HEPES) смеси путем добавления 10% 10x HBSS и 0,5% HEPES и доведени рН приблизительно до 7,2 и фильтр стерилизуют Конечный раствор, и хранят при температуре 4 ° С. Выполняйте все разборы в охлажденный раствор HBSS / HEPES лучше сохранять ткани на протяжении всей процедуры.
- Шерсть со стеклянным дном блюда с базальной мембраны матрицы путем добавления 5 мл холодного (4 ° С) стерильного Игла в модификации Дульбекко (DMEM) с 300 мкл аликвоты базальной мембраны матрицы в стерильной 15 мл полипропиленовую трубку. Смешайте встряхиванием содержимого и добавить 150 мкл базальной мембраны матрицы DMEM смеси в центре каждого культуральной чашке, так что она охватывает всю культуру также присутствующего в центральной части блюда. Обложка посуду и хранить в 37 ° C инкубаторе в течение по крайней мере 45 минут перед использованием.
- Залить 4-5 мл охлажденной HBSS в гоРи стерильные полистирол чашки Петри и оставить его закрытым в капюшоне.
- Подготовка питательной среды в стерильных 15-мл полипропиленовую трубку путем добавления 9 мл DMEM 100 мкл N2 добавок, 10 мкг / мл CIPRO и 1 мл ФБС.
- Выделение эмбрионов:
ПРИМЕЧАНИЕ: В этой процедуре для культивирования кохлеарные эксплантов из эмбриональных мышей, урожай внутреннее ухо из эмбриональных день (E) 13 височных костей с на следующий день после оплодотворения рассматривается как E1 9. Протокол также может быть использован с эмбриональных мышиных внутреннего уха, начиная с E12 с E18.- Эвтаназии приурочен беременной мышь с CO 2 и жертвенное животное путем смещения шейных позвонков или соответствующих утвержденных протоколов. Провести euthanization от ламинарного потока капот культуры ткани для поддержания стерильности в комнатной культуре ткани.
- Поместите эвтаназии мыши на бумажном полотенце с живота вверх и дезинфекции живота с 70% этанола.
- Вскрыть брюшную полость, захватывая кожус изогнутыми щипцами с одной стороны, и вырезать эпидермиса и мышцы вдоль средней линии с помощью ножниц, используя другой рукой. Сделайте две перпендикулярные разрезы с обеих сторон и вытащить матку осторожно подняв двусторонних рога матки щипцами и снять его из-под соединительной ткани с помощью ножниц.
- Поместите эмбриональных цепь в чашку Петри, содержащую охлажденный раствор рассечение (HBSS / HEPES смеси) и трансфер в ламинарном чистом столе.
- Удалить эмбрионов тщательно из плаценты и поместить их в одном из стерильные чашки Петри, содержащие рассечение решение. Если решение оказывается кровавый, переместите их в новую чашку Петри.
ПРИМЕЧАНИЕ: На данный момент, эмбрионы могут быть организованы с использованием промежуточного руководство Theiler. - Обезглавьте эмбрионов, зажимая в области шеи с парой чистых щипцов или ножниц и поместить головы в свежей чашке Петри, содержащей охлажденный раствор рассечение.
- Вскрытие внутреннего уха:
- Место Oпе глава эмбрион в стерильной Sylgard блюдо с холодной рассекающих
- Решение. Работа при вскрытии микроскопом при увеличении в ~ фактор 1.6, иммобилизации эмбрионов голову, поставив Minutien контакты вокруг или ближе к зрительному области (1А).
- Использование двух пар стерильных щипцов осторожно удалите кожу и открыть череп на спинной стороне вдоль средней линии (рис 1б). Удалить мозг от полость черепа и внутреннего уха, расположенные в височных костей можно определить на данном этапе (рисунок 1в, г). Подкладка из кровеносного сосуда, который обычно присутствует вокруг внутреннего уха, могут быть использованы в качестве ориентира для определения внутреннего уха на этой стадии (рис 1D).
- Проанализируйте внутреннее ухо от височных костей, помещая щипцы под ткани и выделения внутреннего уха от основания черепа и переход к новой блюдо с холодной решение рассекает (рис 1E, F),
2. Формирование органа Корти эксплантов культур
ПРИМЕЧАНИЕ: На этом этапе развития, ткань хрящевая и может быть легко расчлененный с помощью щипцов.
- Восточный внутреннее ухо, так что вентральной стороной вверх (фиг.2А) и стабилизировать внутреннее ухо, осторожно вставив острый конец Minutien штифтов через вестибулярной части внутреннего уха (фиг.2В).
- Использование ультратонкие щипцы разрезать лежащего хряща, сделав надрез, используя один конец пинцетом возле овального окна и осторожно снимите хряща от улитки (рис 2С).
ПРИМЕЧАНИЕ: Важно, чтобы убедиться, что щипцы не вставлена слишком глубоко в хрящ, как вышележащие хрящи иногда сливается с канала улитки, в этом случае было бы полезно использовать закрытые щипцы, чтобы освободить хрящ от основной улитки, очищая ниже сurface хряща. На данном этапе развития, кохлеарный спираль только три четверти оборота в длину. - Далее, подвергать сенсорного эпителия путем размещения щипцы предпочтительную область канала улитки, либо основание или на самой вершине, и, осторожно потянув за крышу улитки (рис 2D).
ПРИМЕЧАНИЕ: крыша улитки должны быть полностью удалены, как это может замаскировать сенсорного эпителия, препятствующих анализа.
ПРИМЕЧАНИЕ: Эта процедура должна быть сделано аккуратно, как это легко оторвать сенсорный эпителий. - В качестве последнего шага, аккуратно удалите подлежащей соединительной ткани с открытой сенсорного эпителия, так что база улитки эксплантата равномерно квартиру.
- Изолировать расчлененный улитки с вестибулярной части внутреннего уха с помощью щипцов. Это может быть выполнено до или после стадии 2,4 (рис 2Е).
- Передача расчлененный кохлеарной чувствующего эпителия на базальной Membraпе матрица покрытием культура и используя 1,5 мм стерильную ковшовой нории (рис 2F).
- Orient кохлеарной эксплантов с люменальной поверхности эпителия вверх и аспирации базальной мембраны матрица-DMEM решение тщательно сгладить ткани и заменить его 150 мкл свежей культуральной среды осторожно добавляя к блюду. Следует проявлять осторожность, чтобы убедиться, что каждый эксплантов хорошо прилипает к покрытой покровным стеклом и не плавают в культуральной среде. Убедитесь, что кончик пинцетом направлена вниз, а помещения на стеклянной хорошо, чтобы избежать повреждения кохлеарной эксплантов.
- Осторожно передачи культуры блюдо в стерильный 150 мм чашки для культивирования и место в инкубаторе тканевых культур при 37 ° С с 5% СО 2 в течение требуемого периода времени, обычно 3-6 дней в пробирке (DIV). После 1 DIV, рассмотрим культур при вскрытии микроскопом, чтобы убедиться, что кохлеарный эксплантов придерживается хорошо в чашку с культурой.
- После того как вcubation в пробирке для требуемой длины времени, культуры обрабатывали для иммуногистохимии.
ПРИМЕЧАНИЕ: эксплантов культуры, как правило, выдерживают в течение 6 DIV, что эквивалентно стадии развития, P0. После инкубации в пробирке, культуры могут быть обработаны для ниже по течению приложений, таких как иммуногистохимии (фиг.3В), ОТ-ПЦР, гибридизация и / или вестерн-блоттинга.
3. Электропорация-опосредованной Перенос генов
- Настройка для электропорации:
- Стерилизовать один 100 мм Sylgard покрытием стеклянной посуде в автоклаве или замачивания в 70% этанола в течение примерно 20 мин и дайте высохнуть на воздухе в чистом столе перед использованием.
- Подготовка ДНК из вектора экспрессии выбора, используя соответствующие макси- или миди-преп комплектов. Векторы экспрессии, используемые в настоящем Протоколе pIRES2-Atoh1.EGFP и pCLIG-NeuroD1.EGFP. Конечная концентрация ДНК должна быть не менее 1 мкг / мкл в стерильной ДНК /РНКазы свободной воды.
- Электропорации ДНК в эмбриональные кохлеарных эксплантов:
- Добавить 10 мкл раствора ДНК плазмиды к новому 100 мм Sylgard покрытием блюдо и передавать полностью расчлененный кохлеарной эксплантов (полученного на стадии 2.5) в раствор ДНК.
- С просвета поверхности эпителия вверх, наклон улитку слегка так, чтобы было перпендикулярно плоскости тарелки.
- Поместите электрод лопасти по обе стороны от улитки с отрицательной лопасти (катод) в направлении сенсорного эпителия и положительным лопасти (анод), расположенного рядом с основания улитки.
Примечание: С ДНК отрицательно заряженные, он переносит с отрицательного на положительный электрод и путем размещения на катодном конце зонда, примыкающей к сенсорного эпителия; ДНК в основном идут через поверхность сенсорного эпителия. - Использование электропоратора, доставить 9 до 10 импульсов 24 мВ, 30 Продолжительность мс импульс с датчика положения педали нога на Т-он Электропоратор, а затем добавить 100 мкл теплой культуральной средой, к электропорации улитки.
- Повторите шаги 3.2.1-4 для всех кохлеарных эксплантов и ДНК всех интересующих генов и передать электропорации cochleae в матрицу покрытием блюдо базальной мембраны для посева (шаг 2,7). Культура все электропорации cochleae в 37 ° C, 5% CO 2 увлажненном инкубаторе для требуемой длины времени, которые затем будут обработаны для иммуногистохимии.
ПРИМЕЧАНИЕ: улитка из всего помета CD1 мыши (примерно 8-12 детенышей), можно выделить, микродиссекции, электропорации и высевали в <4 ч.
4. Анализ Cochlear эксплантов культур
ПРИМЕЧАНИЕ: Культуры, как правило, выдерживают в течение 6 DIV, что эквивалентно стадии развития, P0. После инкубации в пробирке, культуры фиксированы и обработаны для иммуногистохимии.
- После требуемой длины Incubation, удалить культуральную среду и быстро промыть кохлеарный эксплантов в фосфатно-солевом буфере (PBS) и инкубируют в 4% параформальдегида (приготовленного в PBS) в течение 15 мин при комнатной температуре.
- Промыть фиксатор добавлением PBS и промыть в PBS три раза в течение 15 мин.
- Проницаемыми с помощью PBS-T (PBS + 0,5% твин) в течение 30 мин, после чего блокируют с PBS-T, содержащей 10% козьей сыворотки.
- Инкубируют в растворе первичного антитела, содержащий первичное антитело в PBS-T с 1% козьей сывороткой в течение ночи при 4 ° С.
- Промыть улитки три раза при комнатной температуре с использованием PBS-T 15 мин перед добавлением каждого соответствующие Alexa-конъюгированные вторичные антитела.
- С кохлеарной эксплантов культивировали на покровного стекла можно работать отдельно путем выделения покровное от блюда и монтажа на слайде. Это может быть достигнуто путем замачивания культуры блюдо в OS30 растворитель, по крайней мере, 1 часа при комнатной температуре. Использование стерильной лезвие, снимите покровное из диш и крепление на стекло и визуализировать под флуоресцентным микроскопом.
Результаты
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
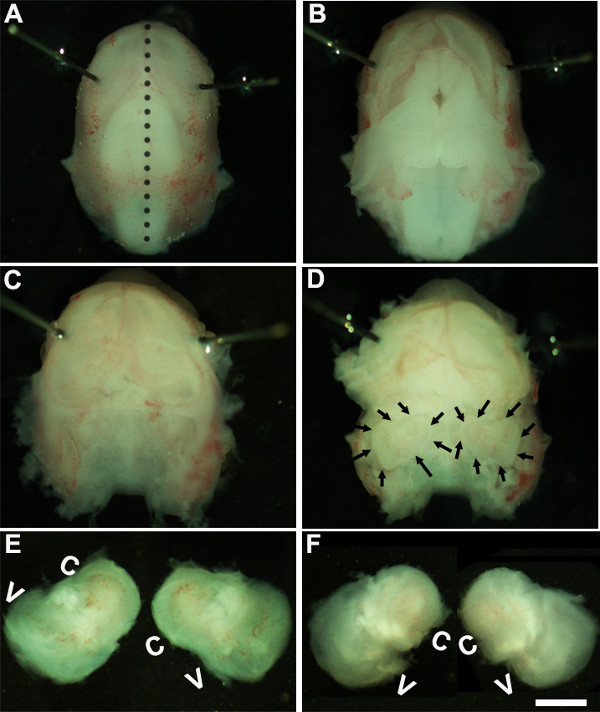
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
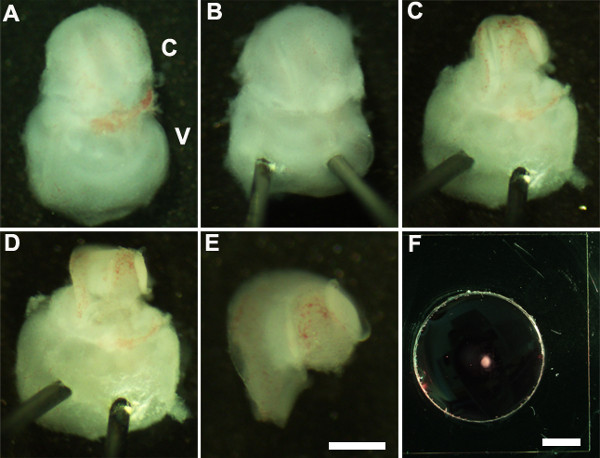
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
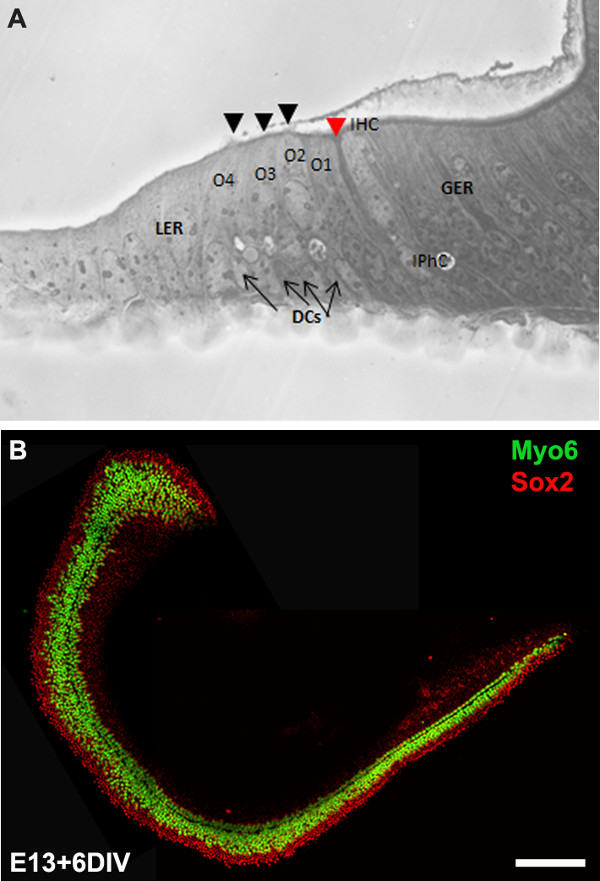
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
Обсуждение
Все клетки в мембранном лабиринте внутреннего уха мыши в том числе сенсорные, nonsensory и спирального ганглия нейронов получены из placodally полученных отоциста расположен рядом с мозге эктодермы, около 10-14 E8. В E11, брюшной области отоциста распространяется для формирования канала улитки, и как развитие продолжается, группа эпителиальных клеток в улитке, а также в других регионах отоциста, становятся определяется как prosensory патчей, которые впоследствии приведет к различные виды механосенсорных волосковых клеток и nonsensory поддерживающих клеток. В развивающихся улитки, один ряд внутренних волосковых клеток и три ряда наружных волосковых клеток могут быть идентифицированы по всему E15.5 и E17, рисунка, по существу, в комплекте с одного ряда внутренних волосковых клеток, опора клеток и тремя рядами наружных волосковых клеток , В течение периода времени, который охватывает от E11, когда канал улитки первой начинает расти через E17 все DIFных клеточных судеб решения и рисунка происходят в развивающихся эпителия генерировать поразительное ячеистой структуры с нормальным дополнением волосковых клеток и поддерживающих клеток. Потеря волос клеток и / или клеток поддержки является ведущей причиной ухудшения слуха. Так как эти типы клеток происходят только во время достаточно компактный периода времени во время эмбрионального развития, имеет решающее значение для понимания молекулярных и генетических путей, которые определяют каждый из этих типов клеток, которые должны привести к значительному проникновения в регенеративных стратегий.
Кохлеарные культивирования и электропорации методы были разработаны, чтобы манипулировать экспрессии генов в развивающемся мыши. В этом видео мы продемонстрировали культивирования методы для генерации первичных эксплантов и технику электропорации для доставки генов в культивируемые эмбрионального мышиного органа Корти. Первичные эксплантаты, полученные таким образом, можно поддерживать в течение 7-10 дней в пробирке. Cochlear экспланты окн использоваться, чтобы управлять генной экспрессии фармакологических подходов, которые позволят нам понять механизмы, которые регулируют процессы развития, такие, как судьба спецификации, обязательств, дифференциации и структурирования. Кроме того, этот метод облегчает анализ фенотипов развития мутантного эмбрионального мышей, которые не выжили мимо E12.
Меандр электропорации-опосредованной процедура переноса генов обеспечивает механизм для манипулирования экспрессию генов в волосковых клеток, поддерживающих клеток и клеток внутри ГЭР и Лер регионов с целью визуализации свою судьбу экс VIVO. Используя эту процедуру, мы можем подавляют или эктопически выразить определенные гены в prosensory клеток, волосковые клетки и / или опорных клеток в противном случае дикого типа фоновом режиме и анализировать их специфическое воздействие на спецификации судьбы и дифференциации. Это позволит нам понять специфическую функцию генов в развивающихся улитки. Например, как показано на фиг.4, вынуждены выражение Atoh1 2,4 или NeuroD1 8 в клетках в течение ГЭР или МПУ приводит к образованию эктопических волосковых клеток и нейронов соответственно. Кроме того, этот метод позволяет электропорации несколько генов-кандидатов 6,7 и исследовать их влияние на сенсорной клетки волос и формирования опорной клеток, их дифференциации и их организации. Техника переноса генов с участием аденовирусные векторы предлагает широкий выражение и были успешно использованы во внутреннем ухе 15,16. Тем не менее, этот метод зависит от мастерства, чтобы генерировать и очистить вирусы, которые часто отнимает много времени.
Хотя cochear культуры могут быть установлены еще в E12, электропорации улитки эксплантов моложе E12.5 / Е13 приведет к повреждению ткани, что делает его громоздким для анализа. Кроме того, промотор вектора экспрессии использовали определяет, какой типы клеток, трансфицированных течение кохлеарный дюКТ. Например, промотор цитомегаловируса человека, содержащий векторы экспрессии дает надежную трансфекции в органе Kollikers ', в то время как использование CMV результатов в начале энхансер / куриный бета-актина в более высокой эффективности трансфекции в клетки внутри сенсорного эпителия. Общие проблемы, возникшие в ходе электропорации эмбриональных кохлеарных эксплантов являются чрезмерными гибель клеток и / или повреждение ткани и низкой эффективности трансфекции. Соответствующий интервал между электродами и ДНК концентрации играет важную роль в получении минимальное повреждение и более высокую эффективность трансфекции. В целом, эти методы усиливает нашу способность манипулировать экспрессии генов с помощью прибыли или убытка стратегий функциональных и фармакологических манипуляций и значительно помочь в рассекает сигналы, которые влияют на формирования паттерна и клеточных судеб решения.
Раскрытие информации
No conflicts of interest declared.
Благодарности
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
Материалы
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
Ссылки
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409 (2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены