Method Article
Culture de souris embryonnaires cochléaires explants et Gene Transfer par électroporation
Dans cet article
Résumé
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
Résumé
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
Introduction
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
Protocole
REMARQUE: Tous les protocoles utilisant des animaux vivants doit être examiné et approuvé par un comité de protection des animaux et l'utilisation institutionnelle (IACUC) et doit suivre officiellement méthodes pour le soin et l'utilisation des animaux de laboratoire approuvé. Tous les dissections doivent être effectuées en utilisant une technique stérile sur un banc à flux laminaire propre. Gants et un masque, si vous le souhaitez, doivent être portés pendant cette procédure.
1. Dissection de l'oreille de la souris embryonnaires intérieure
- Mise en place pour orgue des cultures d'explants Corti:
- Stériliser la hotte à flux laminaire de culture de tissus en activant la lumière UV pendant environ 30 min et désinfecter la surface avec 70% d'éthanol avant utilisation. En outre, stériliser tous les instruments de dissection y compris les outils de dissection fine et plats Sylgard revêtus pour la dissection embryon par autoclave ou par trempage dans 70% d'éthanol pendant au moins 20 min avant utilisation. Verser 70% d'éthanol et permettre aux plats et instruments à l'air dans un flux laminaire propre CLEAn banc avant utilisation.
- Préparer une solution saline équilibrée de Hank stérile (HBSS) / (4- (2-hydroxyéthyl) -1-piperazineethanesulfonic) mélange (HEPES) en ajoutant 10% de HBSS 10x et 0,5% de HEPES et ajuster le pH à environ 7,2 et stériliser le filtre solution finale et conserver à 4 ° C. Effectuer toutes les dissections en réfrigérés solution HBSS / HEPES pour mieux préserver le tissu pendant toute la procédure.
- plats à fond de verre-manteau avec matrice de membrane basale par addition de 5 ml de milieu Eagle modifié de froid (4 ° C) stérile Dulbecco (DMEM) à une portion aliquote de 300 ul de matrice de membrane basale dans un tube de 15 ml en polypropylene stérile. Mélanger au vortex le contenu et ajouter 150 ul de la membrane basale mélange DMEM-matrice au centre de chaque boîte de culture de sorte qu'il couvre l'ensemble du puits de culture présent dans le centre du plat. Couvrez les plats et les conserver dans un incubateur à 37 ° pendant au moins 45 min avant utilisation.
- Verser 4-5 ml réfrigérés HBSS en eree plats polystyrène de Pétri stérile et le laisser fermé dans la hotte.
- Préparer un milieu de culture dans un tube de 15 ml en polypropylene stérile en ajoutant 9 ml de DMEM, 100 ul de suppléments N2, 10 g / ml Cipro et 1 ml de FBS.
- Isolement des embryons:
NOTE: Dans cette procédure pour la culture des explants de souris embryonnaires cochléaires, oreille interne récolte du jour embryonnaire (E) 13 os temporaux avec le jour après la fécondation étant considérés comme E1 9. Le protocole peut également être utilisé avec l'oreille interne de souris embryonnaire débutant à partir de E12 à E18.- Euthanasier une souris chronométré-enceinte de CO 2 et de sacrifier des animaux par dislocation cervicale ou protocoles approuvés appropriées. Effectuer l'euthanasie loin de la hotte à flux laminaire de culture de tissus pour maintenir la stérilité dans la chambre de culture de tissu.
- Placez la souris euthanasiés sur une serviette en papier avec de l'abdomen vers le haut et désinfecter abdomen avec 70% d'éthanol.
- Ouvrez la cavité abdominale en saisissant la peauavec une pince incurvés avec une main et de l'épiderme et le muscle coupées le long de la ligne médiane à l'aide de ciseaux avec une autre main. Faites deux coupes perpendiculaires des deux côtés et retirez soigneusement l'utérus en soulevant cornes utérines bilatérales avec une pince et le détacher de dessous des ciseaux de tissu conjonctif à l'aide.
- Placez la chaîne embryonnaire dans une boîte de Pétri contenant une solution glacée de dissection (mélange HBSS / HEPES) et transfert à l'banc propre à flux laminaire.
- Retirer soigneusement embryons à partir de placenta et les placer dans une des boîtes de Pétri stériles contenant une solution de dissection. Si la solution devient sanglante, les déplacer vers une nouvelle boîte de Pétri.
NOTE: A ce stade, les embryons peuvent être mis en scène à l'aide d'un guide de mise en scène Theiler. - Décapitez embryons par pincement à la région du cou avec une paire de pinces propres ou des ciseaux et placer les têtes dans un plat frais Petri contenant une solution de dissection froide.
- Dissection de l'oreille interne:
- Lieu otête de l'embryon ne dans un plat Sylgard stérile contenant dissection froide
- solution. Travailler sous un microscope de dissection à un grossissement de 1.6X ~, immobiliser la tête de l'embryon en plaçant épingles minuties autour ou près de la région de l'œil (figure 1A).
- L'utilisation de deux paires de pinces stériles retirer soigneusement la peau et ouvrir le crâne sur la face dorsale le long de la ligne médiane (figure 1B). Retirer le cerveau de la cavité crânienne et les oreilles intérieures situées dans os temporaux peuvent être identifiés à ce stade (figure 1C, D). La paroi de vaisseau sanguin, ce qui est habituellement présent dans l'oreille interne, peut être utilisé comme un point de repère pour l'identification de l'oreille interne à ce stade (figure 1D).
- Disséquer l'oreille interne des os temporaux en plaçant la pince sous le tissu et l'isolement de l'oreille interne de la base du crâne et le transfert à un nouveau plat contenant une solution de dissection froide (figure 1E, F).
2. Génération d'organes des cultures d'explants Corti
NOTE: A ce stade de développement, le tissu est cartilagineux et peut facilement être disséqué en utilisant une pince.
- Orientez le oreille interne afin que la face ventrale est orientée vers le haut (figure 2A) et de stabiliser l'oreille interne en insérant doucement l'extrémité pointue de broches minuties à travers la partie vestibulaire de l'oreille interne (figure 2B).
- Aide d'une pince ultrafines coupés ouvrir le cartilage sus-jacente en faisant une incision en utilisant une extrémité de forceps près de la fenêtre ovale et retirez soigneusement le cartilage de la cochlée (figure 2C).
NOTE: Il est important de se assurer que le forceps ne sont pas insérés trop profondément dans le cartilage que le cartilage recouvrant est parfois fusionné avec le canal cochléaire dans ce cas, il est utile d'utiliser des pinces fermées pour libérer le cartilage du conduit cochléaire sous-jacent par grattage en dessous de la surface du cartilage. A ce stade de développement, la spirale cochléaire est à seulement trois quarts de tour en longueur. - Ensuite, exposer l'épithélium sensoriel en plaçant les pinces à la région préférée du conduit cochléaire, la base ou au sommet très, et en tirant doucement sur le toit de la cochlée (figure 2D).
NOTE: Le toit de la cochlée doit être enlevée complètement, car elle peut masquer l'épithélium sensoriel entraver l'analyse.
NOTE: Cette procédure doit être fait doucement car il est facile à déchirer l'épithélium sensoriel. - Comme dernière étape, retirer délicatement le tissu conjonctif sous-jacent de l'épithélium sensoriel exposés, afin que la base de l'expiant cochléaire est uniformément plat.
- Isoler la cochlée disséqué de la partie vestibulaire de l'oreille interne en utilisant une pince. Ceci peut être réalisé avant ou après l'étape 2.4 (figure 2E).
- Transférer l'épithélium sensoriel cochléaire disséqué dans un membra du sous-solne matrice revêtu puits de culture en utilisant un scooper stérile de 1,5 mm (figure 2F).
- Orientez le explant cochléaire avec la surface luminale de l'épithélium vers le haut et aspirer la solution de la membrane basale matrice DMEM pour aplatir soigneusement le tissu et le remplacer par 150 pi de milieu de culture frais en ajoutant doucement pour le plat. Des précautions doivent être prises pour se assurer que chaque explant adhère bien à la lamelle de verre revêtue et ne flotte pas dans le milieu de culture. Assurez-vous que la pointe de la pince est dirigé vers le haut tout en apposant sur le bien de verre pour éviter d'endommager l'expiant cochléaire.
- Transférer doucement la boîte de culture dans une boîte de culture de 150 mm stérile et placer dans un incubateur de culture de tissus à 37 ° C avec 5% de CO 2 pour la période de temps désirée, généralement 3-6 jours in vitro (DIV). Après une DIV, examiner les cultures sous un microscope à dissection pour se assurer que l'expiant cochléaire a ainsi adhéré à la boîte de culture.
- Après encubation in vitro pour les longueurs souhaitées de temps, les cultures sont traitées pour l'immunohistochimie.
NOTE: Les cultures d'explants sont généralement incubées pendant 6 DIV qui est équivalent au stade de développement, P0. Après une incubation in vitro, les cultures peuvent être traitées pour d'autres applications en aval tels que l'immunohistochimie (Figure 3B), RT-PCR, l'hybridation in situ, et / ou Western blot en.
3. L'électroporation Gene Transfer médiée
- Mise en place pour l'électroporation:
- Stériliser une boîte de 100 mm revêtu de verre SYLGARD par autoclavage ou par trempage dans 70% d'éthanol pendant environ 20 min et laisser sécher à l'air dans un banc propre avant de l'utiliser.
- Préparer l'ADN d'un vecteur d'expression de choix en utilisant des kits de maxi- ou Midi-prep appropriées. Les vecteurs d'expression utilisés dans ce protocole sont pIRES2-Atoh1.EGFP et pCLIG-NeuroD1.EGFP. La concentration finale de l'ADN devrait être d'au moins 1 ug / ul dans l'ADN stérile /RNase-free de l'eau.
- Électroporation de l'ADN dans des explants embryonnaires cochléaires:
- Ajouter 10 ul de solution d'ADN plasmidique à une cuvette revêtue Sylgard 100 mm frais et transférer un explant cochléaire entièrement disséqué (obtenu à l'étape 2.5) dans la solution d'ADN.
- Avec surface luminale de l'épithélium vers le haut, incliner légèrement la cochlée de sorte qu'il est perpendiculaire au plan du plat.
- Placer les palettes d'électrodes de chaque côté de la cochlée à palette négative (cathode) vers l'épithélium sensoriel et la palette positive (anode) située adjacente à la base de la cochlée.
NOTE: L'ADN est chargé négativement, il migre de négative à l'électrode positive et en plaçant l'extrémité de cathode de la sonde adjacent à l'épithélium sensoriel; l'ADN sera surtout passer par la surface de l'épithélium sensoriel. - Utilisation électroporateur, livrer 9-10 impulsions de 24 mV, 30 durée d'impulsion ms avec le commutateur de pédale sur til électroporateur, puis ajouter 100 ul de milieu de culture chaude à la cochlée électroporation.
- Répétez les étapes 3.2.1-4 pour tous les explants cochléaires et de l'ADN de tous les gènes d'intérêt et de transférer la cochlée électroporation dans le plat de la matrice revêtu membrane basale pour le placage (étape 2.7). Culture tout le électroporé dans une cochlée 37 ° C, 5% de CO 2 incubateur humidifié pour des longueurs désirées de temps qui seront ensuite traités par immunocytochimie.
NOTE: La cochlée d'une portée entière de souris CD1 (environ 8 à 12 chiots) peut être isolé, microdissection, électroporation et plaqué dans <4 h.
4. Analyse des cultures d'explants Cochlear
REMARQUE: Les cultures sont incubées pendant 6 généralement DIV qui est équivalent au stade de développement, P0. Après une incubation in vitro, les cultures sont fixées et traitées pour immunocytochimie.
- Après longueur désirée de incubation, retirer le milieu de culture et rapidement rincer l'explant cochléaire dans une solution saline tamponnée au phosphate (PBS) et incuber à 4% de paraformaldehyde (préparé dans du PBS) pendant 15 min à température ambiante.
- Laver le fixateur en ajoutant du PBS et rincer trois fois dans du PBS pendant 15 min.
- Perméabiliser en utilisant du PBS-T (PBS + 0,5% de Tween) pendant 30 min avant le blocage avec du PBS-T contenant du sérum de chèvre à 10%.
- Incuber dans une solution d'anticorps primaire contenant l'anticorps primaire dans du PBS-T avec du sérum de chèvre à 1% pendant une nuit à 4 ° C.
- Laver trois fois la cochlée à la température ambiante en utilisant du PBS-T 15 min avant d'ajouter l'anticorps secondaire approprié conjugué Alexa.
- Depuis l'explant est cultivé cochléaire sur lamelle de verre, il peut être manipulé individuellement par l'isolement de la lamelle couvre-objet et de la boîte de montage sur une lame. Ceci peut être réalisé par trempage de la boîte de culture dans OS30 solvant pendant au moins 1 heure à température ambiante. Utilisation de la lame de rasoir stérile, détachez la lamelle de la dish et monter sur une lame et de visualiser au microscope à fluorescence.
Résultats
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
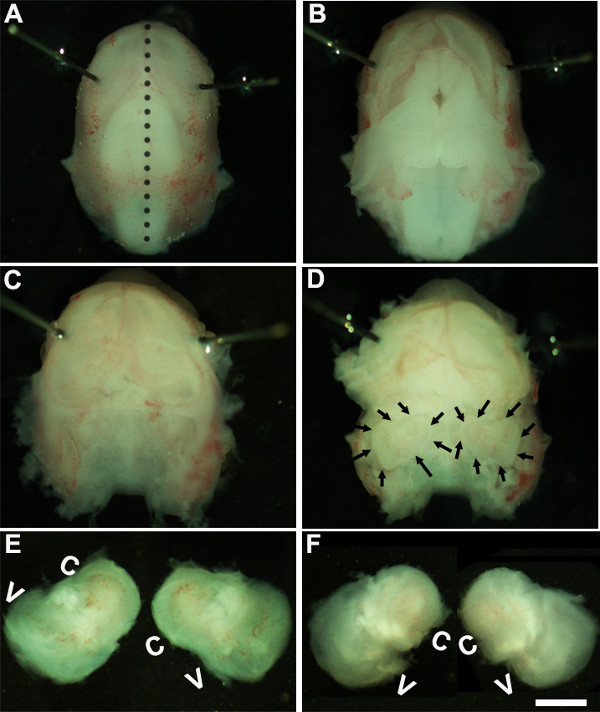
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
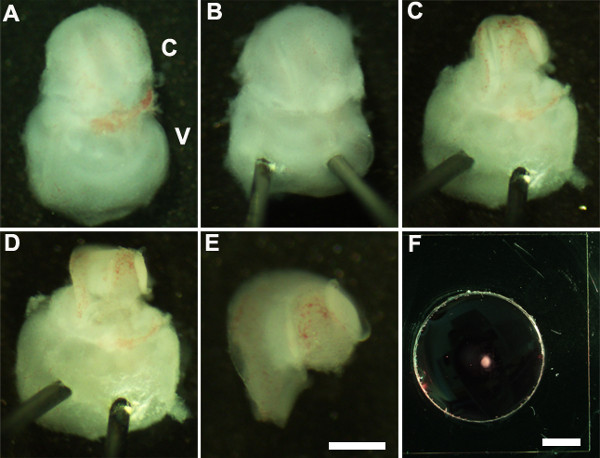
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
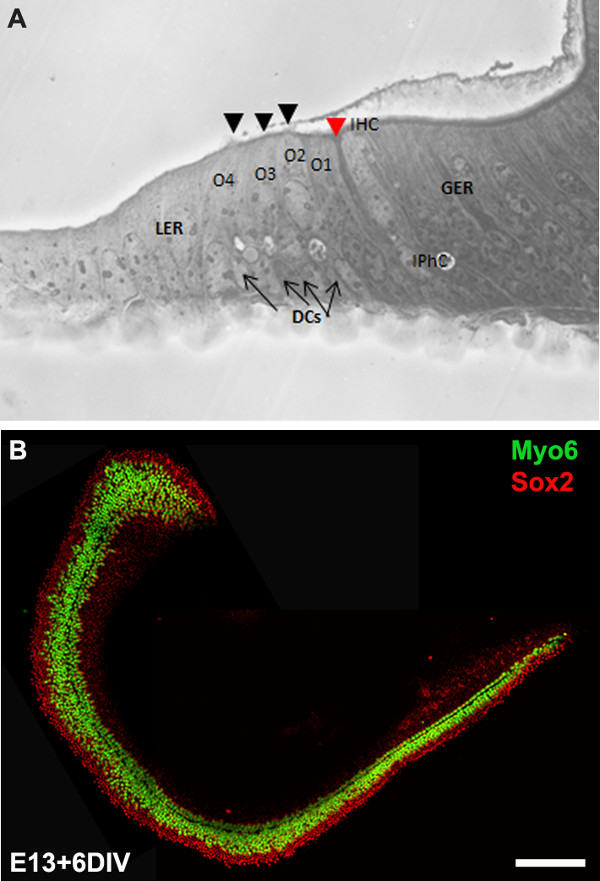
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
Discussion
Toutes les cellules à l'intérieur du labyrinthe membraneux de l'oreille interne de souris comprenant sensorielle, non sensorielle et les neurones du ganglion spiral sont toutes dérivées du dérivé placodally otocyste situé à côté du cerveau postérieur de l'ectoderme, autour de 10-14 E8. A E11, la région ventrale du otocyste se étend pour former le conduit cochléaire et que le développement se poursuit, un groupe de cellules épithéliales dans la cochlée, ainsi que dans d'autres régions du otocyste, devenir spécifié sous forme de plaques de prosensory qui seront ensuite donner lieu à différents types de cellules ciliées et des cellules de soutien mécano non sensorielles. Dans le développement de la cochlée, une rangée de cellules ciliées internes et trois rangées de cellules ciliées externes peuvent être identifiés autour E15.5 et par E17, la structuration est essentiellement complète avec une seule rangée de cellules ciliées internes, cellules des piliers et trois rangées de cellules ciliées externes . Dans un laps de temps qui se étend à partir de E11 lorsque le conduit cochléaire commence d'abord à se développer à travers la totalité de la E17 difdiffé- décisions du destin cellulaire et la structuration se produisent dans l'épithélium en développement à générer un motif cellulaire frappante avec un complément normal de cellules ciliées et des cellules de soutien. Perte de cellules ciliées et / ou des cellules de soutien est la principale cause de déficience auditive. Étant donné que ces types de cellules sont générées uniquement pendant une période de temps assez compact pendant le développement embryonnaire, il est crucial de comprendre les voies moléculaires et génétiques qui spécifient chacun de ces types de cellules qui devrait conduire à un aperçu significatif dans les stratégies de régénération.
Techniques de culture et électroporation cochléaires ont été développés pour manipuler l'expression génique chez la souris en développement. Dans cette vidéo, nous avons démontré la culture de techniques pour générer des explants primaires et une technique d'électroporation pour la livraison de gènes dans des organes embryonnaires murines cultivées de Corti. Les explants primaires préparées de cette manière peuvent être conservés pendant 7 à 10 jours in vitro. Explants cochléaires can être utilisée pour manipuler l'expression des gènes par des approches pharmacologiques qui nous permettront de comprendre les mécanismes qui régulent les processus de développement tels que la spécification du destin, l'engagement, la différenciation, et la structuration. En outre, cette méthode facilite l'analyse des phénotypes de développement embryonnaire de souris mutante qui ne survivent pas passé E12.
La procédure de transfert de gène onde carrée électroporation médiation fournit un mécanisme pour manipuler l'expression des gènes dans les cellules sensorielles de cheveux, des cellules de soutien, et les cellules dans les régions du REC et LER afin de visualiser leur sort ex vivo. En utilisant cette procédure, nous pouvons réguler à la baisse ou ectopique exprimer des gènes spécifiques dans les cellules prosensory, les cellules ciliées et / ou de cellules de soutien dans un contexte de type sauvage autrement et analyser leurs effets spécifiques sur la spécification du destin et de la différenciation. Cela nous permettra de comprendre la fonction des gènes spécifiques dans le développement de la cochlée. Par exemple, comme représenté sur la Figure 4, l'expression forcée de Atoh1 2,4 ou 8 dans NeuroD1 cellules dans TBS ou LER conduit à la formation de cellules et les neurones de cheveux ectopiques respectivement. En outre, cette technique permet d'électroporation plusieurs gènes candidats 6,7 et examiner leur effet sur la cellule sensorielle des cheveux et la formation des cellules de support, la différenciation et leur organisation. La technique de transfert de gènes impliquant des vecteurs adénoviraux et offre une large expression ont été utilisés avec succès dans l'oreille interne 15,16. Cependant, cette technique dépend de la compétence pour générer et purifier les virus qui est souvent beaucoup de temps.
Bien que les cultures cochear peuvent être établies dès E12, électroporation des explants cochléaires moins de E12.5 / E13 se traduira par des dommages aux tissus qui en fait lourde pour l'analyse. En outre, le promoteur du vecteur d'expression utilisé détermine les types de cellules qui sont transfectées à l'intérieur de la cochlée duct. Par exemple, le promoteur du cytomegalovirus humain, contenant les vecteurs d'expression donne la transfection solide dans l'organe de Kollikers, tandis que l'utilisation de CMV précoce résultats activateur / poulet promoteur de l'actine bêta en une plus grande efficacité de la transfection dans des cellules à l'intérieur de l'épithélium sensoriel. Les problèmes communs rencontrés lors de l'électroporation des explants embryonnaires cochléaires sont la mort cellulaire excessive et / ou des dommages du tissu et la mauvaise efficacité de la transfection. L'espacement approprié des électrodes et de l'ADN concentration joue un rôle crucial dans l'obtention d'un minimum de dommages et d'une plus grande efficacité de la transfection. En résumé, ces techniques améliore notre capacité à manipuler l'expression des gènes via gain ou la perte de stratégies de fonction et des manipulations pharmacologiques et grandement aider à disséquer signaux qui influencent structuration et destin cellulaire décisions.
Déclarations de divulgation
No conflicts of interest declared.
Remerciements
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
matériels
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
Références
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409 (2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon