Method Article
Cultura de embriones de ratón explantes cocleares y Gene Transfer por electroporación
En este artículo
Resumen
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
Resumen
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
Introducción
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
Protocolo
NOTA: Todos los protocolos que utilizan animales vivos debe ser revisado y aprobado por el Cuidado y Uso de un Comité Institucional Animal (IACUC) y debe seguir los métodos para el cuidado y uso de los animales de laboratorio homologado. Todas las disecciones se deben realizar utilizando una técnica estéril en un banco de flujo laminar limpio. Guantes y una máscara, si se desea, se deben usar durante este procedimiento.
1. La disección de la Oreja embrionarias de ratón Interior
- Configuración para órgano de cultivos de explantes Corti:
- Esterilizar el flujo laminar campana de cultivo de tejido mediante la activación de la luz UV durante aproximadamente 30 min y desinfectar la superficie con etanol al 70% antes de su uso. Además, esterilizar todos los instrumentos de disección, incluyendo herramientas de disección finas y platos recubiertos con Sylgard para la disección de embriones a través de autoclave o por inmersión en etanol al 70% durante al menos 20 min antes del uso. Verter 70% de etanol y permitir que los platos y los instrumentos se sequen al aire en un flujo laminar limpio CLEAn banco antes de su uso.
- Preparar solución salina equilibrada de Hank estéril (HBSS) / (4- (2-hidroxietil) -1-piperazinetanosulfónico) (HEPES) mediante la adición de mezcla de 10% de HBSS 10x y 0,5% HEPES y ajustar el pH a aproximadamente 7,2 y esterilizar el filtro solución definitiva y se almacena a 4 ° C. Llevar a cabo todas las disecciones en solución HBSS / HEPES enfriado para conservar mejor el tejido durante todo el procedimiento.
- Platos de fondo de cristal Escudo con matriz de membrana basal mediante la adición de 5 ml de medio Eagle modificado frío (4 ° C) estéril de Dulbecco (DMEM) a una alícuota de 300 l de matriz de membrana basal en un tubo de polipropileno de 15 ml estéril. Mezclar mediante agitación el contenido y añadir 150 l de la mezcla de la matriz de la membrana basal-DMEM al centro de cada placa de cultivo de modo que cubra la totalidad del pocillo de cultivo presente en el centro del plato. Cubra los platos y se guardan en una incubadora a 37ºC durante al menos 45 minutos antes de su uso.
- Vierta 4-5 ml refrigerados en HBSS ªree placas de Petri de poliestireno estériles y deje cerrada en la campana.
- Preparar medio de cultivo en un tubo de 15 ml de polipropileno estéril mediante la adición de 9 ml de DMEM, 100 l de suplementos de N2, 10 g / ml Cipro y 1 ml de FBS.
- Aislamiento de embriones:
NOTA: En este procedimiento para el cultivo de explantes cocleares de embriones de ratones, oídos internos cosecha desde el día embrionario (E) 13 huesos temporales con el día después de la fecundación siendo considerados como E1 9. El protocolo también se puede utilizar con el ratón embrionario oídos internos a partir de E12 a E18.- La eutanasia a un ratón oportuna embarazada de CO 2 y el sacrificio de los animales por dislocación cervical o protocolos aprobados apropiados. Llevar a cabo la eutanasia de distancia de flujo laminar campana de cultivo de tejido para mantener la esterilidad en la sala de cultivo de tejidos.
- Coloque la eutanasia del ratón sobre una toalla de papel con abdomen hacia arriba y desinfectar abdomen con etanol al 70%.
- Abra la cavidad abdominal por el acaparamiento de la pielcon pinzas curvas con una mano y la epidermis cortadas y los músculos a lo largo de la línea media con la tijera en la otra mano. Hacer dos cortes perpendiculares en ambos lados y tire del útero cuidadosamente levantando cuernos uterinos bilaterales con fórceps y separarla de debajo de las tijeras de tejido conectivo usando.
- Coloque la cadena de embriones en una placa de Petri que contiene solución enfriada disección (mezcla HBSS / HEPES) y traslado al flujo laminar banco limpio.
- Retire cuidadosamente embriones a partir de placenta y colocarlos en una de las placas de Petri estériles que contienen solución de disección. Si la solución se vuelve sangrienta, moverlos a una nueva placa de Petri.
NOTA: En este punto, los embriones pueden ser realizaron utilizando una guía de puesta en escena Theiler. - Decapitar embriones pellizcando en la región del cuello con un par de fórceps o tijeras limpias y colocar las cabezas en una placa de Petri fresco que contenía solución de disección fría.
- La disección de los oídos internos:
- Lugar ocabeza embrión ne en un plato Sylgard estéril que contiene disección fría
- solución. Trabajando bajo un microscopio de disección con un aumento de ~ 1.6X, inmovilizar la cabeza de embriones mediante la colocación de pasadores Minutien alrededor o cerca de región de los ojos (Figura 1A).
- El uso de dos pares de pinzas estériles retire con cuidado la piel y abrir el cráneo en el lado dorsal a lo largo de la línea media (Figura 1B). Retire cerebro de la cavidad craneal y oídos internos ubicados dentro huesos temporales pueden ser identificados en esta etapa (Figura 1 C, D). El revestimiento del vaso sanguíneo, que normalmente está presente alrededor de los oídos internos, se puede utilizar como un punto de referencia para identificar el oído interno en esta fase (Figura 1D).
- Diseccionar el oído interno de los huesos temporales mediante la colocación de las pinzas debajo del tejido y aislando el oído interno desde la base del cráneo y la transferencia a un nuevo plato que contiene la solución de disección fría (Figura 1E, F).
2. Generación de Órganos de las Culturas Corti explantes
NOTA: En esta etapa de desarrollo, el tejido cartilaginoso es y puede ser diseccionado fácilmente utilizando fórceps.
- Oriente el oído interno de manera que el lado ventral esté hacia arriba (Figura 2A) y estabilizar el oído interno mediante la inserción suavemente el extremo afilado de pasadores Minutien través de la porción vestibular del oído interno (Figura 2B).
- Utilizando unas pinzas ultrafinas cortar el cartílago suprayacente al hacer una incisión utilizando un extremo de fórceps cerca de la ventana oval y cuidadosamente retirar el cartílago de la cóclea (Figura 2C).
NOTA: Es importante asegurarse de que los fórceps no se insertan demasiado profundamente en el cartílago como el cartílago suprayacente a veces se fusiona con el conducto coclear en cuyo caso es útil usar unas pinzas cerradas para liberar el cartílago del conducto coclear subyacente por raspado por debajo de la surface del cartílago. En esta etapa de desarrollo, la espiral coclear es sólo tres cuartos de vuelta de longitud. - A continuación, exponer el epitelio sensorial mediante la colocación de las pinzas en la región preferida del conducto coclear, ya sea la base o en el mismo ápice, y tirando suavemente el techo de la cóclea (Figura 2D).
NOTA: El techo de la cóclea debe ser completamente eliminado, ya que puede enmascarar el epitelio sensorial dificultando el análisis.
NOTA: Este procedimiento debe hacerse con cuidado, ya que es fácil de rasgar el epitelio sensorial. - Como último paso, retirar cuidadosamente el tejido conectivo subyacente del epitelio sensorial expuesto de manera que la base del explante coclear es uniformemente plana.
- Aislar la cóclea disecados de la porción vestibular del oído interno con unas pinzas. Esto se puede realizar antes o después de la etapa 2.4 (Figura 2E).
- Transferir el epitelio sensorial coclear disecado en una membra sótanomatriz recubierta ne cultura bien usando un 1.5 mm cuchara estéril (Figura 2F).
- Oriente el explante coclear con la superficie luminal del epitelio hacia arriba y aspirar la solución de matriz-DMEM membrana basal para aplanar cuidadosamente el tejido y reemplazarla con 150 l de medio de cultivo fresco añadiendo suavemente al plato. Se debe tener cuidado para asegurarse de que cada explante se adhiere bien a la cubreobjetos de vidrio recubierto y no está flotando en el medio de cultivo. Asegúrese de que la punta de las pinzas se señaló arriba mientras que la colocación de al pozo de vidrio para evitar dañar el explante coclear.
- Transferir con cuidado la placa de cultivo en un 150 mm placa de cultivo estéril y colocar en una incubadora de cultivo de tejidos a 37 ° C con 5% de CO 2 para el período de tiempo deseado, generalmente 3-6 días in vitro (DIV). Después de 1 DIV, examinar las culturas bajo un microscopio de disección para asegurarse de que el explante coclear se ha adherido bien a la placa de cultivo.
- Después ende incubación in vitro para longitudes de tiempo deseado, las culturas se procesan para inmunohistoquímica.
NOTA: Los cultivos de explantes por lo general se incuban durante 6 DIV que es equivalente a la etapa de desarrollo, P0. Después de la incubación in vitro, los cultivos se pueden procesar para más aplicaciones posteriores como inmunohistoquímica (Figura 3B), RT-PCR, hibridación in situ, y / o Western blot.
3. La electroporación mediada por transferencia génica
- Configuración para la electroporación:
- Esterilizar uno 100 mm plato de vidrio recubiertos con Sylgard en autoclave o por inmersión en etanol al 70% durante aproximadamente 20 min y dejar secar al aire en un banco limpio antes de su uso.
- Preparar el ADN de un vector de expresión de elección utilizando kits maxi- o midi-prep apropiados. Los vectores de expresión utilizados en este protocolo son pIRES2-Atoh1.EGFP y pCLIG-NeuroD1.EGFP. La concentración final de ADN debe ser de al menos 1 g / l en el ADN estéril /RNasa libre de agua.
- Electroporación de ADN en explantes cocleares embrionarias:
- Añadir 10 l de solución de ADN de plásmido a un 100 mm plato de Sylgard recubierto fresco y transferir un explante coclear totalmente diseccionado (obtenido en la etapa 2.5) en la solución de ADN.
- Con la superficie luminal del epitelio hacia arriba, incline la cóclea ligeramente de modo que es perpendicular al plano del plato.
- Coloque las paletas de electrodos a ambos lados de la cóclea con paleta negativo (cátodo) hacia el epitelio sensorial y la pala positivo (ánodo) situado adyacente a la base de la cóclea.
NOTA: Dado que el ADN está cargado negativamente, que migra de negativo a electrodo positivo y colocando el extremo del cátodo de la sonda adyacente al epitelio sensorial; el ADN mayoría pasará a través de la superficie del epitelio sensorial. - Utilizando electroporador, entregar 9 a 10 pulsos de 24 mV, 30 ms duración del pulso con el interruptor de pedal en tél electroporador, y luego añadir 100 l de medio de cultivo cálido a la cóclea a electroporación.
- Repita los pasos 3.2.1-4 para todos los explantes cocleares y de ADN de todos los genes de interés y transferir el cochleae electroporación en el plato matriz recubiertos con membrana basal para chapado (paso 2.7). Cultura toda la cochleae electroporación en un 37 ° C, 5% de CO 2 humidificado incubadora para longitudes deseadas de tiempo que luego serán procesados por inmunocitoquímica.
NOTA: La cóclea de una camada entera de ratón CD1 (aproximadamente 8-12 crías) se puede aislar, microdissected, electroporación y chapada en <4 hr.
4. Análisis de las Culturas Coclear explantes
NOTA: Los cultivos se incubaron durante por lo general 6 DIV que es equivalente a la etapa de desarrollo, P0. Después de la incubación in vitro, los cultivos se fijaron y procesaron para inmunocitoquímica.
- Después de longitud deseada del incubation, eliminar el medio de cultivo y rápidamente enjuagar el explante coclear en solución salina tamponada con fosfato (PBS) y se incuban en 4% de paraformaldehído (preparado en PBS) durante 15 min a temperatura ambiente.
- Lave el fijador mediante la adición de PBS y enjuague en PBS tres veces durante 15 minutos.
- Permeabilizar utilizando PBS-T (PBS + 0,5% Tween) durante 30 min antes de bloquear con PBS-T que contiene 10% de suero de cabra.
- Incubar en solución de anticuerpo primario que contiene el anticuerpo primario en PBS-T con 1% de suero de cabra durante la noche a 4 ° C.
- Lavar la cóclea tres veces a temperatura ambiente usando PBS-T 15 min cada uno antes de la adición de anticuerpos secundarios conjugados Alexa-apropiados.
- Desde el explante coclear es cultivaron en cubreobjetos de vidrio puede ser manejado individualmente aislando el cubreobjetos de la placa de montaje y en una diapositiva. Esto se puede lograr por remojo la placa de cultivo en OS30 disolvente durante al menos 1 hora a temperatura ambiente. Uso de la hoja de afeitar estéril, extraiga el cubreobjetos de la dish y montar en un portaobjetos y visualizar bajo un microscopio fluorescente.
Resultados
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
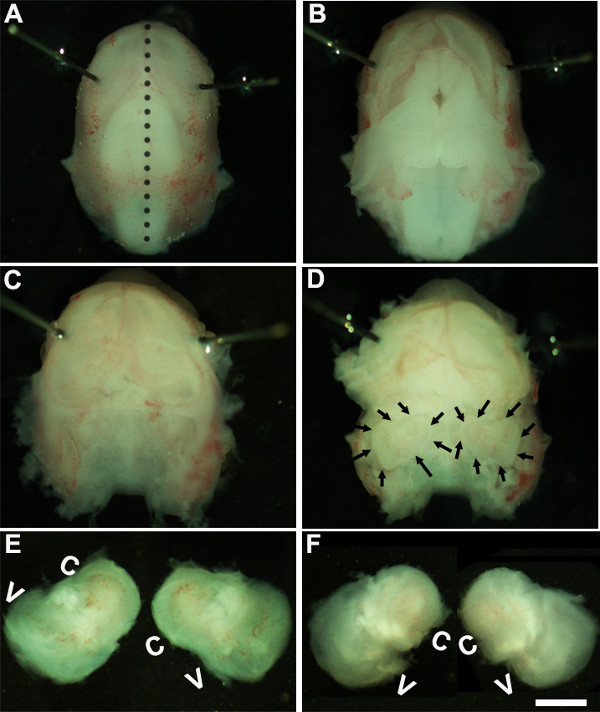
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
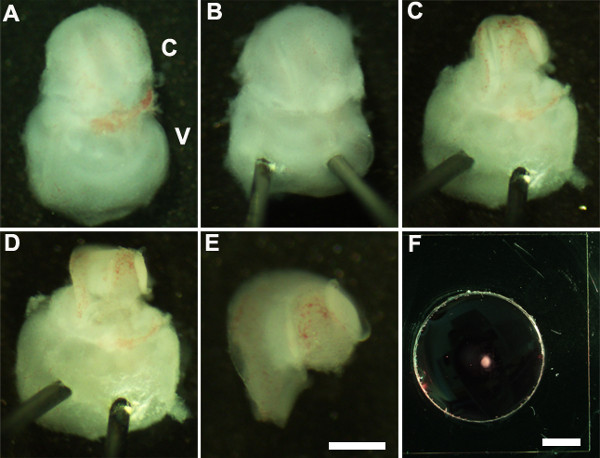
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
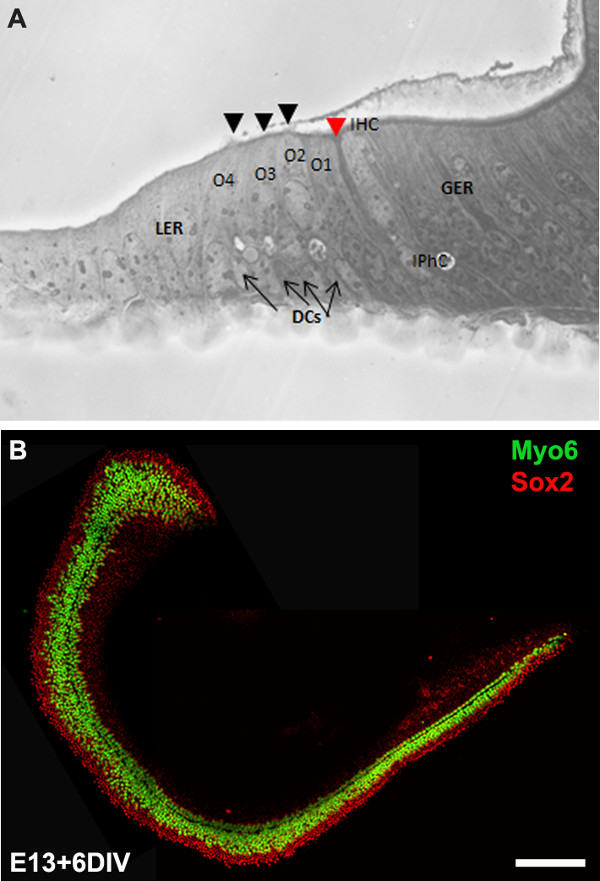
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
Discusión
Todas las células dentro de la laberinto membranoso del oído interno de ratón incluyendo sensorial, no sensorial y las neuronas del ganglio espiral se derivan de placodally derivados de otocyst situado adyacente a la parte posterior del cerebro del ectodermo, alrededor de 10-14 E8. En E11, la región ventral de la otocyst se extiende para formar el conducto coclear y como sigue el desarrollo, un grupo de células epiteliales dentro de la cóclea, así como en otras regiones del otocyst, convertido especifica como parches prosensoriales que posteriormente darán lugar a diferentes tipos de células ciliadas mechanosensory y células de soporte no sensoriales. En la cóclea en desarrollo, una fila de células ciliadas internas y tres hileras de células ciliadas externas pueden ser identificados alrededor de E15.5 y E17, el patrón es esencialmente completa con una sola hilera de células ciliadas internas, células pilares y tres hileras de células ciliadas externas . En un período de tiempo que abarca desde E11 cuando el conducto coclear primero comienza a crecer a través de E17 todo el DIFrentes decisiones del destino celular y patrones se producen en el epitelio de desarrollo para generar un patrón celular llamativo con un complemento normal de las células ciliadas y células de apoyo. La pérdida de células ciliadas y / o células de apoyo es la principal causa de discapacidad auditiva. Dado que estos tipos de células se generan sólo durante un periodo de tiempo bastante compacto durante el desarrollo embrionario, es crucial para entender los mecanismos moleculares y genéticos que especifican cada uno de estos tipos de células que deberían conducir a una información valiosa sobre estrategias regenerativas.
Técnicas de cultivo y la electroporación cocleares se han desarrollado para manipular la expresión génica en el ratón en desarrollo. En este vídeo, hemos demostrado el cultivo de técnicas para la generación de explantes primarios y una técnica de electroporación para la entrega de genes en cultivaron órgano de Corti embrionario murino. Los explantes primarios preparados de esta manera se pueden mantener durante 7-10 días in vitro. Explantes cocleares can ser utilizado para manipular la expresión génica mediante enfoques farmacológicos que nos permitan comprender los mecanismos que regulan los procesos de desarrollo tales como la especificación del destino, el compromiso, la diferenciación y el patrón. Además, este método facilita el análisis de los fenotipos de desarrollo de embriones de ratones mutantes que no sobreviven más allá de E12.
El procedimiento de transferencia génica mediada por electroporación de onda cuadrada proporciona un mecanismo para la manipulación de la expresión génica en células sensoriales de pelo, células de apoyo, y las células dentro de las regiones Ger y LER para visualizar su destino ex vivo. El uso de este procedimiento, se puede regular a la baja o ectópica expresar genes específicos en células prosensoriales, células de pelo y / o apoyo a las células en un fondo de otra forma de tipo salvaje y analizar sus efectos específicos en la especificación del destino y la diferenciación. Esto nos permitirá comprender la función de genes específicos dentro de la cóclea en desarrollo. Por ejemplo, como se muestra en Figura 4, la expresión forzada de Atoh1 2,4 o NeuroD1 8 en las células dentro de GER o LER conduce a la formación de las células ciliadas ectópicos y las neuronas, respectivamente. Además, esta técnica permite para electroporar múltiples genes candidatos 6,7 y examinar su efecto en la célula sensorial pelo y la formación de células de soporte, la diferenciación y su organización. La técnica de transferencia de genes que implica vectores adenovirales ofrece una amplia expresión y se han utilizado con éxito en el oído interno 15,16. Sin embargo, esta técnica depende de la habilidad para generar y purificar los virus que a menudo es mucho tiempo.
Aunque las culturas cochear pueden establecerse tan pronto como E12, la electroporación de los explantes cocleares menores de E12.5 / E13 dará lugar a daño al tejido por lo que es engorroso para el análisis. Además, el promotor del vector de expresión utilizado determina que se transfectan tipos de células dentro de la cóclea duct. Por ejemplo, el promotor de citomegalovirus humano que contiene los vectores de expresión produce la transfección robusta en el órgano Kollikers ', mientras que el uso de CMV potenciador / promotor de la actina de pollo beta temprana resultados en una mayor eficiencia de transfección en las células dentro del epitelio sensorial. Los problemas comunes encontrados durante la electroporación de explantes cocleares embrionarias son la muerte celular excesiva y / o daño del tejido y la mala eficiencia de transfección. El espaciamiento apropiado de los electrodos y la concentración de ADN juega un papel crucial en la obtención de un daño mínimo y una mayor eficiencia de la transfección. En resumen, estas técnicas aumenta nuestra capacidad de manipular la expresión génica a través de la ganancia o pérdida de las estrategias de función y las manipulaciones farmacológicas y mucho ayudar en la disección de las señales que influyen en las decisiones de modelado y destino celular.
Divulgaciones
No conflicts of interest declared.
Agradecimientos
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
Materiales
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
Referencias
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409 (2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados