Method Article
Electroporation에 의한 배아 마우스 달팽이의 Explants의 문화 유전자 전송
요약
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
초록
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
서문
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
프로토콜
참고 : 살아있는 동물을 사용하는 모든 프로토콜을 검토하고 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 공식적으로 실험 동물의 관리 및 사용 방법을 승인 따라야합니다. 모든 해부은 층류 클린 벤치에 무균 기술을 사용하여 수행되어야한다. 장갑과 마스크를 원하는 경우,이 절차를 수행하는 동안 착용해야합니다.
배아 마우스 내부 귀 1. 해부
- 코르티 이식편 문화의 기관에 대한 설정 :
- 약 30 분 동안 UV 광을 켜서 층류 조직 배양 후드를 소독하고 사용 전에 70 %의 에탄올로 표면을 소독. 또한, 미세 해부 도구와 오토 클레이브를 통해 배아 해부 또는 사용하기 전에 적어도 20 분 동안 70 % 에탄올에 몸을 담글하여 실 가드 코팅 요리를 포함한 모든 해부기구를 소독. 깨끗한 층류 클레아에서 자연 건조 요리와 악기를 70 % 에탄올을 붓고 허용N 벤치 사용 전에.
- 준비 멸균 행크의 균형 잡힌 염 용액 (HBSS) / (4- (2- 히드 록시 에틸) -1- 피페 라진 에탄 술폰산) HEPES 배 HBSS 및 0.5 %의 10 %를 첨가하여 약 7.2로 pH를 조정하고 필터 멸균함으로써 (HEPES) 혼합물 4 ° C에서 최종 솔루션 및 저장. 더 나은 절차 전반에 걸쳐 조직을 유지하기 위해 냉장 HBSS / HEPES 솔루션의 모든 해부를 수행합니다.
- 멸균 15 ml의 폴리 프로필렌 튜브에 기저막 매트릭스의 300 μL 분취 멸균 (39 ° C) 냉간 둘 베코 변형 이글 중간 (DMEM) 5 mL를 추가하여 기저막 매트릭스 코트 유리 바닥 접시. 내용을 텍싱하여 혼합하고 접시의 중앙에 잘 존재하는 전체 문화를 덮도록 각각의 배양 접시의 중앙에 기저막 매트릭스 DMEM 혼합물의 150 μl를 추가합니다. 사용하기 전에 적어도 45 분 동안 37 ° C를 인큐베이터에서 요리와 저장소를 커버.
- 일에 HBSS를 차게 4-5 ml에 붓고살균 폴리스티렌 페트리 접시를 REE 후드 폐쇄 둡니다.
- DMEM 9 ㎖, N2 보충제 100 ㎕, 10g / ㎖ 시프 FBS 및 1 ㎖를 첨가하여 15 ㎖의 멸균 된 폴리 프로필렌 튜브에서 배양 배지를 준비한다.
- 배아의 분리 :
참고 : 배아 마우스에서 인공 와우 절편을 배양이 절차에서는 수확 내이가 배아 일 (E)에서 수정 후 하루 13 시간 뼈 E1 (9)으로 간주된다. 프로토콜은 또한 E12 E18로부터 시작하여 마우스 배아 내이 함께 사용될 수있다.- CO 2 시간 초과 - 임신 한 마우스를 안락사와 자궁 경부 전위 또는 적절한 승인 프로토콜에 의해 동물을 희생. 조직 배양 무균 룸을 유지하는 거리 층류 유동 조직 배양 후드에서 euthanization을 수행.
- 이 위로 향하게 복부와 종이 타월에 안락사 마우스를 놓고 70 % 에탄올로 복부를 소독.
- 피부를 잡아 복강을 엽니 다다른 손을 사용하여 가위로 중간 선을 따라 곡선 한 손으로 집게와 컷 표피와 근육으로. 양쪽에 두 개의 수직 컷을 확인하고 집게로 양측 자궁 뿔을 들어 올려 조심스럽게 자궁을 끌어와 결합 조직을 이용하여 위 아래에서 분리.
- 층류 흐름 클린 벤치에 냉장 해부 솔루션 (HBSS / HEPES 혼합물) 및 전송을 포함하는 페트리 접시에 배아 체인을 놓습니다.
- 태반에서 조심스럽게 배아를 제거하고 해부 솔루션을 포함하는 멸균 페트리 접시 중 하나에 배치합니다. 이 솔루션은 피 묻은 켜지면 새로운 배양 접시로 이동합니다.
참고 :이 시점에서, 배아 Theiler의 준비 가이드를 사용하여 개최 할 수있다. - 깨끗한 집게 나 가위로 목 부위에 집어 배아 목을 벨 및 냉장 해부 솔루션을 포함하는 새로운 배양 접시에 머리를 배치합니다.
- 내이의 해부 :
- 장소 오차가운 해부를 포함하는 멸균 실 가드 접시에 북동 배아 머리
- 솔루션입니다. ~ 1.6 배의 배율로 해부 현미경 작업, 눈 영역 (도 1a)에 또는 주위 가까이 Minutien 핀을 배치하여 배아 헤드를 고정시킨다.
- 멸균 포셉 두 쌍을 사용하여 조심스럽게 피부를 제거하고 중간 선 (그림 1B)를 따라 등쪽에 두개골을 엽니 다. 두개강 및 시간 뼈에 위치한 내이가이 단계 (그림 1C, D)에서 확인할 수 있습니다에서 뇌를 제거합니다. 일반적으로 내측 귓전 존재 혈관의 라이닝은,이 단계 (도 1d)에서 내이를 식별하기위한 랜드 마크로서 사용될 수있다.
- 조직 아래에있는 집게를 배치하고 차가운 해부 솔루션을 포함하는 새 접시에 두개골 및 전송의 기지에서 내이 (內耳)를 분리하여 시간적 뼈 안쪽 귀를 해부하다 (그림 1E, F).
코르티 이식편 문화의 장기의 2 세대
주 :이 개발 단계에서 연골 조직되어 쉽게 집게를 사용하여 절개 될 수있다.
- 동양 복부 측면은 (그림 2A)을 위로 향하게 조심스럽게 내이 (그림 2B)의 전정 부분을 통해 Minutien 핀의 날카로운 끝을 삽입하여 내부 귀를 안정화되도록 내이.
- 사용하여 초 미세 집게는 달팽이관 (그림 2C)에서 연골을 제거 조심스럽게 원창 근처 집게의 한쪽 끝을 사용하여 절개를하여 상부 연골을 오픈.
참고 :이 위에있는 연골이 때때로 아래에 긁어 기본 인공 와우 덕트에서 연골을 해제 폐쇄 집게를 사용하는 것이 도움이되는 경우에 인공 와우 덕트와 융합 될 때 집게가 연골에 너무 깊이 삽입되지 않도록하는 것이 중요하다 에스연골의 urface. 이런 개발 단계에서, 달팽이관 나선 길이 차례 만 사분의 삼이다. - 다음으로,베이스 또는 매우 정점에 하나, 인공 와우 덕트의 선호 지역에 집게를 배치하여 감각 상피를 노출, 부드럽게 달팽이관 (그림 2D)의 지붕을 잡아 당겨.
참고 : 달팽이관의 지붕은 분석을 방해 감각 상피 마스크 수를 완전히 제거해야합니다.
참고 :이 감각 상피가 찢어 쉽기 때문에이 절차는 조심스럽게 수행해야합니다. - 인공 와우 이식편의 기초가 균일하게 평면이되도록 마지막 단계로, 신중하게 노출 된 감각 상피에서 기본 결합 조직을 제거합니다.
- 집게를 사용 내이의 전정 부분에서 해부 달팽이관을 분리합니다. 이 단계 전이나 2.4 (도 2E) 후에 수행 될 수있다.
- 지하 membra으로 해부하는 인공 와우 감각 상피로 이동네브라스카 매트릭스 코팅 문화가 아니라 1.5 mm 멸균 치우는 삽 (그림 2 층)를 사용.
- 동양은 상피 세포의 내강 표면에 인공 절편이 위를 향하도록 조심스럽게 조직을 평평하고 부드럽게 접시에 추가하여 신선한 배양액 150 μL로 교체하는 기저막 매트릭스 DMEM 솔루션을 대기음. 케어는 각 절편이 코팅 된 유리 커버 슬립에 잘 부착 및 배양 배지에 떠 있지 않도록주의해야한다. 인공 절편 손상을 방지하기 위해 유리 웰에 부착하는 동안 포셉의 팁까지 지적되어 있는지 확인합니다.
- 부드럽게 시간의 원하는 기간, 체외에서 일반적으로 3-6일 (DIV) 5 % CO 2와 37 ° C에서 조직 문화 인큐베이터에서 멸균 150mm 배양 접시와 장소에 배양 접시를 전송합니다. 1 DIV 후, 인공 절편이 배양 접시에 잘 부착되었는지 확인하기 위해 해부 현미경으로 문화를 검사합니다.
- 의 후시간의 원하는 길이에 대한 시험 관내에서 cubation는, 문화는 면역 조직 화학 염색에 대한 처리됩니다.
참고 : 절편 문화가 일반적으로 개발 단계, P0에 해당 6 DIV 동안 배양한다. 체외에서 배양 후, 문화가 면역 조직 화학 등 다운 스트림 응용 프로그램 (그림 3B)에 대해 처리 할 수있는, RT-PCR, 현장 하이브리드 및 / 또는 웨스턴 블롯에.
3. 일렉트로 매개 유전자 전달
- 전기에 대한 설정 :
- 고압 증기 멸균 또는 약 20 분 동안 70 % 에탄올에 몸을 담글에 의해 하나의 100mm를 실 가드 코팅 유리 접시를 소독하고 사용하기 전에 클린 벤치에서 자연 건조 할 수 있습니다.
- 적절한 붙여서 또는 미디 준비 키트를 사용하여 선택의 발현 벡터에서 DNA를 준비합니다. 이 프로토콜에서 사용 된 발현 벡터 및 pIRES2-Atoh1.EGFP pCLIG-NeuroD1.EGFP이다. DNA의 최종 농도는 균 DNA가 적어도 1 ㎍ / μL되어야 /의 RNA 분해 효소가없는 물을.
- 배아 인공 외식에 DNA를 Electroporating :
- 신선한 100mm의 실 가드 코팅 접시에 플라스미드 DNA 용액 10 μl를 추가하고 DNA 용액에 (단계 2.5에서 얻은) 완벽 해부 인공 절편을 전송합니다.
- 이 접시의면에 수직이다 있도록이 위를 향하도록 상피 세포의 내강 표면으로, 약간 달팽이관을 기울입니다.
- 감각 상피과 달팽이관의 기지에 인접 긍정적 인 패들 (양극)으로 부정적인 패들 (음극)과 달팽이관의 양쪽에 전극 패를 놓습니다.
주 : DNA는 음으로 대전되기 때문에,이 정극과 감각 상피에 인접한 프로브의 캐소드 단부를 배치하여 음극으로부터 마이그레이션; DNA는 주로 감각 상피의 표면을 통해 이동합니다. - electroporator를 사용하여, 24 MV의 9-10 펄스를 제공, t에 발 페달 스위치를 30 밀리 초 펄스 지속 시간그는 electroporator 다음 일렉트릭 달팽이관에 따뜻한 문화 매체의 100 μl를 추가합니다.
- 반복하여 모든 인공 와우 외식과 관심의 모든 유전자의 DNA에 대한 3.2.1-4 단계 및 (단계 2.7) 도금의 기저막 매트릭스 코팅 접시에 일렉트릭 cochleae을 전송합니다. 다음 면역 세포 화학 처리됩니다 시간의 원하는 길이가 37 ° C, 5 % CO 2 가습 인큐베이터 문화 모든 일렉트릭 cochleae.
참고 : CD1 마우스 (약 8 ~ 12 새끼)의 전체 쓰레기에서 달팽이관은 고립 microdissected, 일렉트로 및 <4 시간에서 도금 될 수있다.
4. 분석 달팽이 이식편 문화의
참고 : 문화는 일반적으로 개발 단계, P0에 해당 6 DIV 동안 배양한다. 체외에서 배양 후, 문화는 고정되어 면역 세포 화학 처리.
- Inc.의 원하는 길이 후ubation, 배지를 제거하고 신속 인산염 완충 식염수 (PBS)에 인공 이식편을 헹구고, 실온에서 15 분 동안 (PBS에서 제조) 4 % 파라 포름 알데히드에서 배양한다.
- 15 분 동안 세 번 추가 PBS에 의해 정착을 씻고 PBS에 헹군다.
- 10 % 염소 혈청을 함유하는 PBS-T로 차단되기 전에 30 분 동안 PBS-T (PBS + 0.5 % 트윈)을 사용 Permeabilize 하시려면.
- 4 ℃에서 하룻밤 1 % 염소 혈청 PBS-T에서 일차 항체를 포함하는 일차 항체 용액에 품어.
- 적절한 알렉사 - 복합 이차 항체를 추가하기 전에 PBS-T 15 분을 각각 사용하여 실온에서 달팽이관을 세 번 씻으십시오.
- 인공 절편 유리 커버 슬립에 배양이기 때문에 그것은 접시에서 커버 슬립을 분리하고 슬라이드에 장착하여 개별적으로 처리 할 수 있습니다. 이것은 실온에서 적어도 1 시간 동안 용매 OS30에서 배양 접시를 담글함으로써 달성 될 수있다. 멸균 면도날을 사용하여 D에서 커버 슬립을 분리흉내과 슬라이드에 탑재하고 형광 현미경으로 시각화.
결과
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
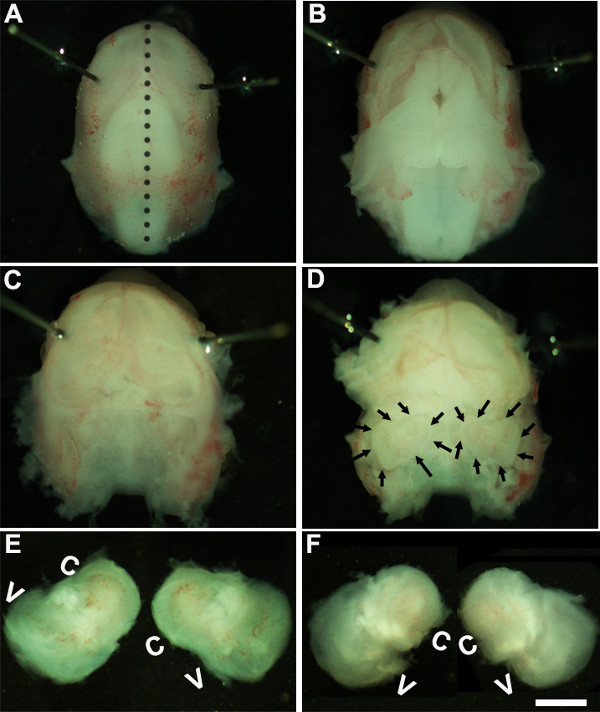
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
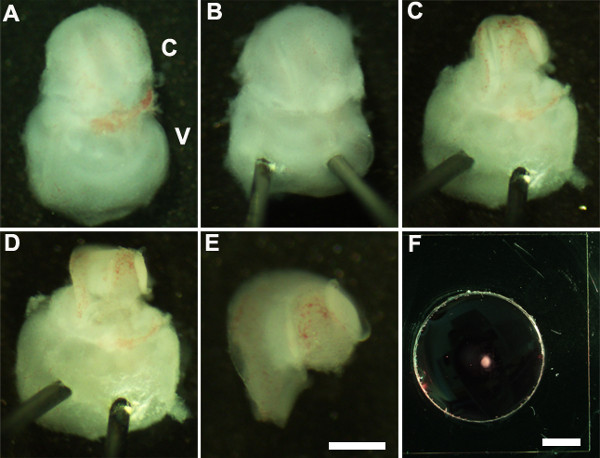
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
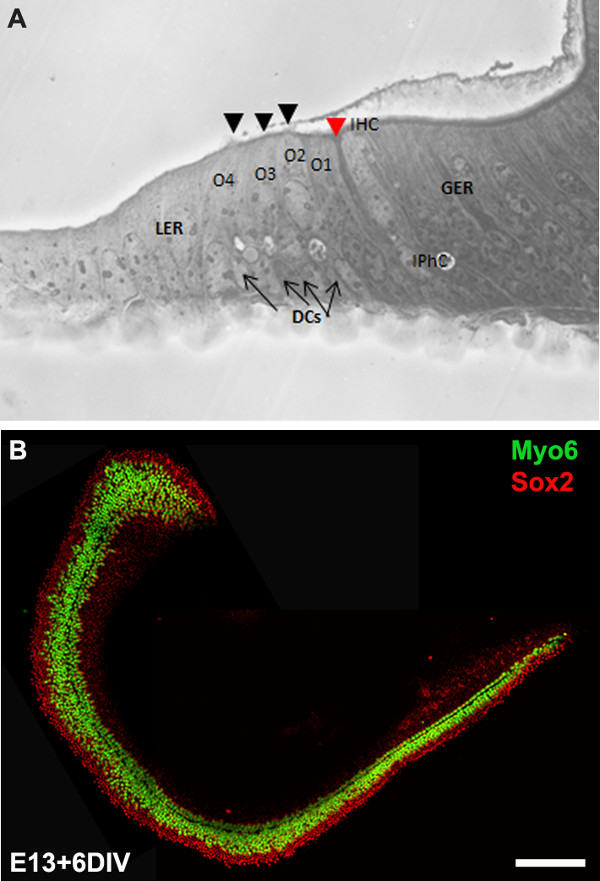
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
토론
를 포함하여 마우스 내이의 멤브레인 미로 내의 모든 세포 감각, nonsensory과 나선 신경절 신경 세포가 모든 E8 10-14 주위에, 외배엽의 후뇌에 인접 otocyst placodally 유래에서 파생됩니다. E11에서 otocyst의 복부 영역은 달팽이관 덕트를 형성하기 위해 확장 및 개발이 계속되고,되어 달팽이관 내의 상피 세포에서뿐만 아니라 otocyst의 다른 영역들의 그룹은이어서 야기 할 것이다 prosensory 패치로 지정된 mechanosensory 유모 세포와 nonsensory 지원하는 세포의 다른 유형. 현상 달팽이관 내부 머리 셀의 하나의 행 및 외측 모세포 3 열의는 E15.5 주위 및 E17에 의해 식별 될 수 있고, 패터닝 내측 유모 세포, 기둥 세포 외 모발 세포 세 행의 행이 하나 본질적으로 완료 . 인공 덕트를 통해 제 E17 DIF 모두를 성장하기 시작 E11에서 걸쳐 시간 주기로ferent 세포의 운명 결정과 패터닝 모세포 및지지 세포의 정상적인 보완과 함께 눈에 띄는 셀룰러 패턴을 생성하기 위해 개발 상피에서 발생. 유모 세포 및 / 또는 지원 세포의 손실은 청력 장애의 주요 원인이다. 이러한 유형의 세포가 배아 발생 동안 만 상당히 콤팩트 기간 동안 생성되어 있기 때문에, 회생 전략에 상당한 통찰로 연결되어야 이러한 세포 유형 각각을 지정 분자 유전 경로를 이해하는 것이 중요하다.
인공 배양 기술은 일렉트로 현상 마우스에서 유전자 발현을 조작하기 위해 개발되었다. 이 비디오에서는, 우리는 주요 외식과 코르티 배양 된 배아 쥐의 기관에 유전자 전달을위한 전기 기술을 생성하는 기술을 배양 증명하고있다. 이러한 방식으로 제조 된 기본 체외 이식편 7-10 일 동안 유지 될 수있다. 인공 와우 외식 캘리포니아이러한 N 운명 사양, 약속, 분화, 및 패터닝 등의 발달 과정을 조절하는 메카니즘을 이해 할 수있게된다 약리학 방식으로 유전자 발현을 조작하기 위해 사용될 수. 또한,이 방법은 과거 E12 생존하지 않는 돌연변이 생쥐 배아 발달 표현형 분석을 용이하게한다.
구형파 전기 천공 - 매개 된 유전자 전달 절차는 그들의 운명 생체를 시각화하기 위해 감각 유모 세포,지지 세포 및 GER LER 및 셀 영역 내에서 유전자 발현을 조작하기위한 메커니즘을 제공한다. 이 절차를 사용하여, 우리는 하향 조절 또는 ectopically 그렇지 않으면 야생형 배경에 prosensory 세포, 머리카락 세포 및 / 또는 지원하는 세포에서 특정 유전자를 표현하고 운명 사양과 분화에 미치는 구체적인 영향을 분석 할 수 있습니다. 이것은 현상 달팽이관 내의 특정 유전자 기능을 이해할 수있게 해줄 것이다. 예를 들어, 도시 된 바와 같이 도 4 GER LER 또는 세포 내에서 또는 2,4- Atoh1 NeuroD1 (8)의 강제 발현은 각각 이소성 유모 세포 및 신경 세포의 형성을 유도. 또한,이 기술은 다수의 후보 유전자 6,7 electroporate 감각 머리 셀과지지 셀 형성, 분화 및 조직에 미치는 영향을 조사 할 수있다. 아데노 바이러스 벡터를 포함하는 유전자 전달 기술은 광범위한 표현을 제공하며, 성공적으로 내이 15,16 사용되고있다. 그러나,이 방법은 종종 생성하고 시간 소모적 인 바이러스를 정제하는 기술에 의존한다.
cochear 문화가 조기 E12, E12.5 미만의 인공 와우 외식의 전기로 설립 할 수 있지만 / E13는 분석이 복잡하고 조직에 손상을 줄 것입니다. 또한, 발현 벡터의 프로모터는 세포 유형이 뒤 인공 와우 내에 형질하는지가 결정을 사용CT. 예를 들어, 발현 벡터를 포함하는 인간 거대 세포 바이러스 프로모터, Kollikers '장기 강력한 형질을 산출하는 동안 감각 상피 내 세포에서 형질의 높은 효율의 CMV 초기 증강 / 치킨 베타 액틴 프로모터 결과의 사용. 배아 인공 외식의 전기 중 발생하는 일반적인 문제는 과도한 세포 사멸 및 / 또는 조직과 가난한 형질 전환 효율의 손상이다. 전극 및 DNA 농도의 적절한 간격은 최소한의 손상과 높은 트랜 스펙 션 효율을 얻는데있어서 중요한 역할을한다. 요약하면, 이러한 기술은 이득 또는 기능 조작 전략 및 약리학의 손실을 통해 유전자 발현을 조작 크게 패터닝 및 세포 운명 결정에 영향을 해부 신호에 도움이되는 능력을 향상시킨다.
공개
No conflicts of interest declared.
감사의 말
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
자료
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
참고문헌
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409 (2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유