Method Article
תרבות של עוברי Explants שבלול העכבר וג'ין העברה על ידי Electroporation
In This Article
Summary
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
Abstract
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
Introduction
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
Protocol
הערה: כל הפרוטוקולים באמצעות בעלי חיים חייבת להיות נבדקו ואושרה על ידי הוועדה מוסדית טיפול בבעלי חיים והשימוש (IACUC) וחייבת לעקוב אושרה שיטות לטיפול ולשימוש בחיות המעבדה באופן רשמי. כל הניתוחים צריכים להתבצע באמצעות טכניקה סטרילית על ספסל זרימה למינרית נקי. כפפות ומסיכה, אם תרצה בכך, יש ללבוש במהלך הליך זה.
1. Dissection של האוזן הפנימית עכבר עוברי
- הגדרה לצורך האיבר של קורטי תרבויות explant:
- לעקר את מכסה המנוע תרבית רקמת הזרימה למינרית ידי הפעלת אור UV למשך כ 30 דקות ולחטא את המשטח עם אתנול 70% לפני השימוש. בנוסף, לעקר את כל מכשירי הנתיחה כולל כלים לנתיחה משובחים ומנות מצופות Sylgard לנתיחה עובר באמצעות החיטוי או על ידי השרייה באתנול 70% לפחות 20 דקות לפני השימוש. יוצקים את אתנול 70% ולאפשר את הכלים ומכשירים לייבוש באוויר בזרימה למינרית קליאה נקייהספסל n לפני השימוש.
- הכן תמיסת מלח מאוזנת של האנק סטרילית (HBSS) / (4 (2-hydroxyethyl) חומצת -1-piperazineethanesulfonic) תערובת (HEPES) על ידי הוספת 10% מ10x HBSS ו 0.5% HEPES ולהתאים את ה- pH של כ 7.2 ומסנן לעקר פתרון סופי ולאחסן ב 4 מעלות צלזיוס. לבצע את כל הניתוחים בפתרון HBSS / HEPES מקורר לשמר את הרקמה טובה יותר לאורך כל ההליך.
- כלים מזכוכית מעיל תחתון עם מטריצת קרום במרתף על ידי הוספת 5 מיליליטר של הנשר בינוני השתנה הקר (4 ° C) סטרילי של Dulbecco (DMEM) לaliquot 300 μl של מטריצת קרום במרתף בצינור פוליפרופילן סטרילי 15 מיליליטר. מערבבים על ידי vortexing את התוכן ולהוסיף 150 μl של תערובת המטריצה-DMEM קרום במרתף למרכז של כל מנה תרבות, כך שהוא מכסה את כל התרבות גם בהווה במרכז הצלחת. לכסות את הכלים וחנות בחממה 37 ° C לפחות 45 דקות לפני השימוש.
- יוצקים 4-5 מיליליטר מקורר HBSS לתוך הרי צלחות פטרי קלקר סטרילי ולהשאיר סגורים במכסת המנוע.
- להכין מדיום תרבות בצינור 15 מיליליטר פוליפרופילן סטרילי על ידי הוספת 9 מיליליטר של DMEM, תוספי N2 100 μl, 10 גר '/ מיליליטר Cipro ו 1 מיליליטר של FBS.
- בידוד של עוברים:
הערה: בהליך זה לculturing explants שבלול מעוברי עכברים, אוזניים פנימיות אסיף מיום עוברי (E) 13 עצמות זמניות עם היום לאחר הפריה נשקלות כ9 E1. גם הפרוטוקול ניתן להשתמש עם אוזניים פנימיות עכבר עוברי החל מE12 לE18.- להרדים עכבר מתוזמן בהריון עם CO 2 ולהקריב את בעלי החיים על ידי נקע בצוואר הרחם או פרוטוקולים שאושרו מתאימים. לבצע euthanization ממכסת מנוע בתרבית הרקמה למינרית זרימה כדי לשמור על סטריליות בחדר תרבית הרקמה.
- הנח עכבר מורדמים על מגבת נייר עם בטן כלפי מעלה ולחטא בטן עם אתנול 70%.
- פתח את חלל הבטן על ידי גרירה עורעם מלקחיים מעוקלים ביד אחת ועור חתוך ושרירים לאורך קו האמצע עם מספריים באמצעות יד אחרת. שני חתכים בניצב משני הצדדים ולשלוף את הרחם בקפידה על ידי הרמת קרן רחם דו-צדדית עם מלקחיים ולנתק אותו ממתחת מספריים רקמות באמצעות חיבור.
- מניחים את השרשרת העוברית בצלחת פטרי המכילה פתרון מקורר דיסקציה (תערובת HBSS / HEPES) והעברה לספסל הנקי מינרית הזרימה.
- הסר עוברים בזהירות מהשליה ולהכניס אותם לתוך אחת מנות סטרילי פטרי המכילות פתרון לנתיחה. אם הפתרון הופך עקוב מדם, להעביר אותם לצלחת פטרי חדשה.
הערה: בשלב זה, יכול להיות מבוים עובר באמצעות מדריך היערכות Theiler. - לערוף עוברים על ידי צביטה באזור הצוואר עם זוג מלקחיים או מספריים נקיים ומניח את הראשים בצלחת פטרי המכילה טרי פתרון לנתיחה מקורר.
- Dissection של האוזניים הפנימיות:
- o מקוםראש עובר ne בצלחת sylgard סטרילית המכילה לנתח קר
- פתרון. עבודה תחת מיקרוסקופ לנתח בהגדלה של ~ 1.6x, לשתק את ראש העובר על ידי הצבת סיכות Minutien מסביב או קרוב יותר לאזור עיניים (איור 1 א).
- באמצעות שני זוגות מלקחיים סטרילי להסיר בזהירות את העור ולפתוח את הגולגולת בצד הגב לאורך קו האמצע (איור 1). הסר מוח מחלל גולגולת ואוזניים פנימיות הנמצאות בתוך עצמות זמניות ניתן לזהות בשלב זה (איור 1 ג, ד). הציפוי הפנימי של כלי הדם, שהיא בדרך כלל נוכחים סביב האוזניים הפנימיות, יכול לשמש כנקודת ציון לזיהוי האוזן הפנימית בשלב זה (1D איור).
- לנתח את האוזן הפנימית מהעצמות הזמניות על ידי הצבת המלקחיים מתחת לרקמה ובידוד האוזן הפנימית מבסיס הגולגולת וההעברה לצלחת חדשה המכילה פתרון לנתח קר (איור 1E, F).
2. דור של איברים של תרבויות קורטי explant
הערה: בשלב זה של התפתחות, רקמת סחוס היא ויכולה להיות גזור בקלות באמצעות מלקחיים.
- אוריינט האוזן הפנימית, כך שהצד הגחוני פונה כלפי מעלה (איור 2 א) ולייצב את האוזן הפנימית על ידי בעדינות להכניס את הקצה החד של סיכות Minutien דרך חלק שיווי המשקל באוזן הפנימית (איור 2).
- מלקחיים ultrafine באמצעות לחתוך את הסחוס שמעליה על ידי ביצוע חתך באמצעות קצה אחד של מלקחיים ליד החלון הסגלגל ובזהירות להסיר את הסחוס משבלול האוזן (איור 2 ג).
הערה: חשוב לוודא כי מלקחיים אינם מוכנסים עמוק מדי לתוך הסחוס כסחוס שמעליה לעתים התמזגו עם צינור השבלול ובמקרה זה הוא מועיל להשתמש במלקחיים סגורים לשחרר סחוס מצינור השבלול הבסיסי על ידי גירוד מתחת ל surface של הסחוס. בשלב זה של התפתחות, ספירלת השבלול היא רק שלושה רבעים מתור באורך. - בשלב הבא, לחשוף את האפיתל החושית על ידי הצבת המלקחיים באזור המועדף של צינור השבלול, או הבסיס או לכל הקודקוד, ומשייכתו בעדינות את הגג של השבלול (איור 2 ד).
הערה: הגג של השבלול יש להסיר לחלוטין כפי שהוא יכול להסוות את האפיתל החושית פוגע הניתוח.
הערה: הליך זה חייב להיעשות בעדינות כפי שהוא קל לקרוע את האפיתל החושית. - כצעד אחרון, להסיר בזהירות את רקמת חיבור הבסיסית מהאפיתל החושית החשופה, כך שהבסיס של explant השבלול הוא אחיד שטוח.
- לבודד את השבלול גזור מחלק שיווי המשקל באוזן הפנימית באמצעות מלקחיים. זה יכול להתבצע לפני או אחרי 2.4 (2E איור) הצעד.
- העבר את האפיתל החושית השבלול גזור לתוך membra מרתףהתרבות גם באמצעות scooper סטרילי 1.5 מ"מ (איור 2F) מצופה מטריצת ne.
- אוריינט explant השבלול עם משטח lumenal של האפיתל פונה כלפי מעלה ולשאוב את פתרון המטריצה-DMEM קרום במרתף לשטח בזהירות את הרקמה ולהחליף אותו עם 150 μl של מדיום תרבות הטרי בעדינות על ידי הוספה לצלחת. יש להקפיד לוודא שכל explant שומר היטב לcoverslip הזכוכית המצופה ולא צף במדיום התרבות. ודא שקצה המלקחיים הוא הצביע למעלה בזמן ההדבקה ולזכוכית כדי למנוע נזק לexplant השבלול.
- בעדינות להעביר את המנה התרבות לתוך צלחת סטרילית 150 מ"מ תרבות ומקום בתרבית רקמת חממה ב 37 מעלות צלזיוס עם 5% CO 2 לתקופה רצויה של זמן, בדרך כלל 3-6 ימים במבחנה (DIV). לאחר DIV 1, לבחון תרבויות תחת מיקרוסקופ לנתח לוודא כי explant השבלול דבק גם למנת התרבות.
- לאחר בcubation במבחנה לאורכים רצויים של זמן, תרבויות מעובדות אימונוהיסטוכימיה.
הערה: תרבויות explant בדרך כלל טופחו במשך 6 DIV שהוא שווה ערך לשלב ההתפתחותי, P0. לאחר הדגירה במבחנה, יכולות להיות מעובד תרבויות עבור יישומים נוספים במורד הזרם כמו אימונוהיסטוכימיה (איור 3), RT-PCR, הכלאה באתר, ו / או כתם מערבי.
3. העברת גנים בתיווך Electroporation
- הגדרה לצורך electroporation:
- לעקר אחד 100 מ"מ צלחת זכוכית sylgard מצופה על ידי מעוקר או טבילה באתנול 70% לכ -20 דקות ולאפשר לאוויר יבש בספסל נקי לפני השימוש.
- הכן את ה- DNA מוקטור ביטוי של בחירה באמצעות ערכות maxi- או midi-הכנה מתאימות. וקטורי הביטוי בשימוש בפרוטוקול זה הם pIRES2-Atoh1.EGFP וpCLIG-NeuroD1.EGFP. הריכוז הסופי של ה- DNA צריך להיות מיקרוגרם / μl לפחות 1 בDNA סטרילי /-RNAse חופשית מים.
- Electroporating DNA לתוך explants שבלול עוברי:
- הוסף 10 μl של פתרון ה- DNA פלסמיד לצלחת Sylgard מצופה 100 מ"מ טרי ולהעביר explant גזור באופן מלא שבלול (המתקבל משלב 2.5) לפתרון ה- DNA.
- עם משטח lumenal של האפיתל פונה כלפי מעלה, להטות את השבלול מעט כל כך שזה ניצב למישור של המנה.
- מניחים את משוטי אלקטרודה משני הצדדים של השבלול עם ההנעה שלילית (קתודה) לקראת האפיתל החושית וההנעה החיובית (אנודה) הממוקמת בסמוך לבסיס של השבלול.
הערה: מאחר שה- DNA טעון שלילי, זה נודד משלילי להאלקטרודה חיובית ועל ידי הצבת סוף הקתודה של החללית בסמוך להאפיתל החושית; DNA בעיקר ילך דרך פני השטח של האפיתל החושי. - באמצעות electroporator, לספק 9 עד 10 פולסים של 24 mV, 30 משך דופק msec עם בורר דוושת רגל על tהוא electroporator, ולאחר מכן להוסיף של מדיום תרבות החם 100 μl לשבלול Electroporated.
- חזור על שלבים 3.2.1-4 לכל explants השבלול ולDNA של כל הגנים של עניין ולהעביר את cochleae electroporated לתוך הצלחת מצופה מטריצת קרום במרתף לציפוי (שלב 2.7). כל cochleae תרבות electroporated ב-37 מעלות צלזיוס, 5% 2 חממה humidified CO לאורכים רצויים של זמן שלאחר מכן ניתן יהיה מעובד לimmunocytochemistry.
הערה: השבלול מהמלטה שלמה של CD1 עכבר (כ 8-12 גורים) יכולה להיות מבודד, microdissected, electroporated ומצופית ב< 4 שעות.
4. ניתוח של תרבויות השבלול explant
הערה: התרבויות בדרך כלל טופחו במשך 6 DIV שהוא שווה ערך לשלב ההתפתחותי, P0. לאחר הדגירה במבחנה, התרבויות הם קבועים ומעובדים עבור immunocytochemistry.
- לאחר אורך רצוי של incubation, להסיר בינוני תרבות ובמהירות לשטוף את explant השבלול שבנאגר מלוח פוספט (PBS) דגירה בparaformaldehyde 4% (מוכן בPBS) במשך 15 דקות בטמפרטורת חדר.
- לשטוף את מקבע על ידי PBS הוספה ולשטוף בPBS שלוש פעמים במשך 15 דקות.
- Permeabilize באמצעות PBS-T (Tween + 0.5% PBS) למשך 30 דקות לפני החסימה עם PBS-T המכיל סרום עיזים 10%.
- דגירה בפתרון נוגדן ראשוני המכילה נוגדן ראשוני בPBS-T עם 1% עזים בסרום הלילה ב 4 מעלות צלזיוס.
- שטוף את השבלול שלוש פעמים בטמפרטורת חדר באמצעות PBS-T 15 דקות כל אחד לפני שמוסיף את נוגדנים משני Alexa מצומדות- מתאימים.
- מאז explant השבלול הוא בתרבית על coverslip זכוכית יכול להיות מטופלים בנפרד על ידי בידוד coverslip מצלחת והרכבה בשקופית. זו יכולה להיות מושגת על ידי השרייה המנה התרבות בOS30 ממס במשך שעה לפחות 1 בטמפרטורת חדר. באמצעות סכין גילוח סטרילי, לנתק את coverslip מדאיש והר בשקופית ולדמיין תחת מיקרוסקופ פלואורסצנטי.
תוצאות
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
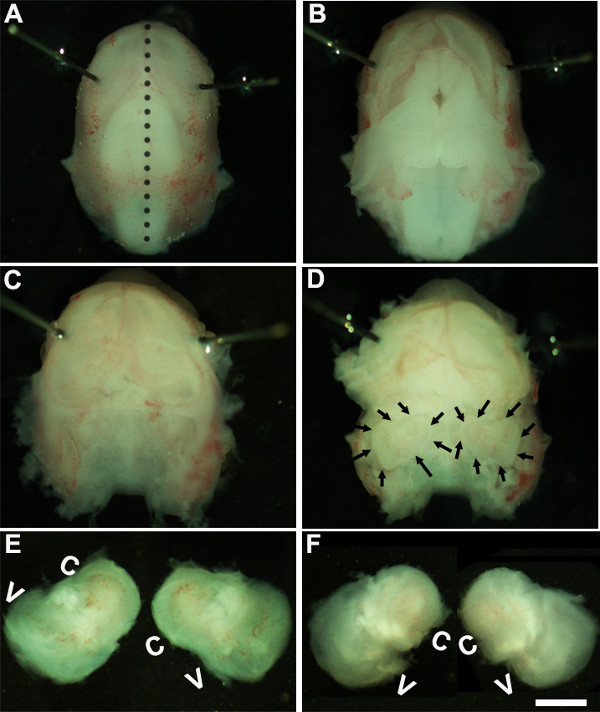
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
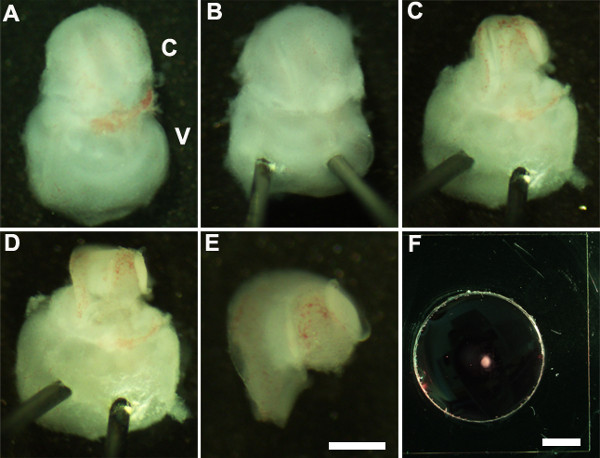
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
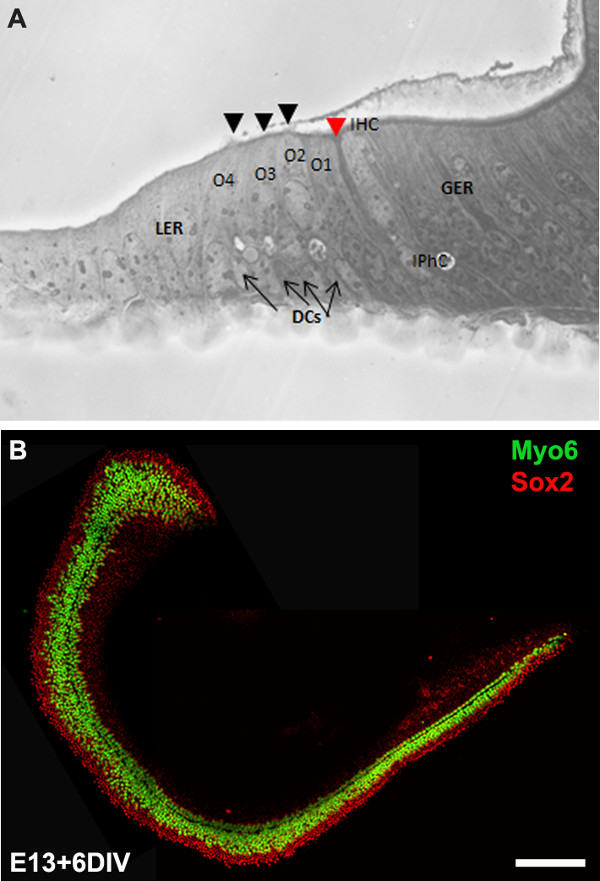
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
Discussion
כל התאים בתוך המבוך הקרומי של האוזן הפנימית העכבר כוללים חושי, nonsensory וכל הנוירונים הגנגליון הספירלה נגזרים מplacodally-נגזר otocyst ממוקם בסמוך למוח האחורי של האאקטודרם, סביב 10-14 E8. בE11, אזור הגחון של otocyst משתרע ליצירת צינור השבלול וכפיתוח ממשיך, קבוצה של תאי האפיתל בשבלול האוזן, כמו גם באזורים אחרים של otocyst, הפכה צוין ככתמים prosensory שיהיה בהמשך להצמיח סוגים שונים של תאי שיער ותאי mechanosensory תמיכה nonsensory. בשבלול הפיתוח, שורה אחת של תאי שיער פנימיים ושלוש שורות של תאי שיער חיצוניים ניתן לזהות סביב E15.5 ועל ידי E17, דפוסים הוא למעשה להשלים עם שורה אחת של תאי שיער פנימיים, תאי עמוד ושלוש שורות של תאי שיער חיצוניים . בתקופה של זמן, שישתרע מE11 כאשר צינור השבלול ראשון מתחיל לצמוח החוצה דרך E17 כל DIFהחלטות גורל תא שונים זו ודפוסים להתרחש בתוך האפיתל הפיתוח כדי ליצור דפוס סלולארי מרשים עם השלמה נורמלית של תאי שיער ותאי תמיכה. אובדן של תאי שיער ו / או בתאי תמיכה הוא הגורם המוביל לליקוי שמיעה. מכיוון שיש סוגי התאים נוצרים רק במהלך פרק זמן קומפקטי למדי במהלך התפתחות עוברית, הוא חיוני כדי להבין את המסלולים המולקולריים וגנטיים שציינו כל אחד מסוגי התאים אלה שאמור להוביל לתובנה משמעותית אסטרטגיות משובי.
טכניקות culturing וelectroporation שבלול פותחו כדי לתפעל ביטוי גנים בעכבר המתפתח. בסרטון הזה, יש לנו הפגין culturing טכניקות ליצירת explants ראשוני וטכניקת electroporation למסירת גן לתוך איבר עוברי בתרבית עכברית של קורטי. Explants הראשוני שהוכן באופן זה יכול להישמר במשך 7-10 ימים במבחנה. explants שבלול can לשמש כדי לתפעל ביטוי גנים על ידי גישות תרופתיות אשר תאפשר לנו להבין את המנגנונים המווסתים את התהליכים התפתחותיים כגון מפרט גורל, מחויבת, בידול, ודפוסים. יתר על כן, שיטה זו מאפשרת הניתוח של פנוטיפים ההתפתחותי של עוברי עכברים שעברו מוטציה שאינם שורדים עבר E12.
הליך העברת גנים בתיווך electroporation גל המרובע מספק מנגנון לטיפול בביטוי גנים בתאי חישה שיער, תאי תמיכה, ותאים בתוך אזורי GER והימלר כדי להמחיש גורל vivo לשעבר שלהם. באמצעות הליך זה, אנחנו יכולים downregulate או ectopically לבטא גנים מסוימים בתאי prosensory, תאי שיער ו / או תמיכה בתאים ברקע אחר wild-type ולנתח את ההשפעות הספציפיות שלהם על מפרט גורל ובידול. זה יאפשר לנו להבין את תפקוד גן ספציפי בתוך השבלול המתפתח. לדוגמא, כפי שמוצג ב איור 4, הביטוי הכפוי של Atoh1 2,4 או NeuroD1 8 בתאים בתוך GER או הימלר מוביל להיווצרות של תאי שיער מחוץ לרחם ותאי עצב בהתאמה. בנוסף, טכניקה זו מאפשרת לelectroporate גני מועמדים מרובים 6,7 ולבחון את השפיעו על תא חושי שיער והיווצרות תאי תמיכה, בידול והארגון שלהם. טכניקת העברת גנים מעורבות וקטורי adenoviral מציעה ביטוי רחב ושמשה בהצלחה באוזן הפנימית 15,16. עם זאת, טכניקה זו תלויה במיומנות כדי ליצור ולטהר את הווירוסים אשר לעתים קרובות זמן רב.
למרות שניתן להקים תרבויות cochear מוקדם ככל E12, electroporation של explants השבלול הצעיר מן E12.5 / E13 יגרום נזק לרקמה שהופך אותו מסורבל לניתוח. בנוסף, האמרגן של וקטור הביטוי בשימוש וקובע שסוגי תאים הם transfected בתוך שבלול duct. לדוגמא, אמרגן ציטומגלווירוס האנושי המכיל וקטורי ביטוי מניב transfection חזק באיברים "Kollikers, תוך שימוש בתוצאות אמרגן אקטין משפר / בטא עוף המוקדם CMV ביעילות גבוהה יותר של transfection בתאים בתוך האפיתל החושית. הבעיות הנפוצות נתקלו במהלך electroporation של explants שבלול העוברי הן מוות של תאים מופרזים ו / או נזק של הרקמה ויעילות transfection עניה. המרווח המתאים של ריכוז אלקטרודות וDNA ממלא תפקיד מכריע בהשגת מינימאלית נזק ויעילות transfection גבוהה יותר. לסיכום, טכניקות אלה משפרת את היכולת שלנו לתפעל ביטוי גנים באמצעות רווח או הפסד של אסטרטגיות פונקציה ומניפולציות תרופתיות ומאוד סיוע בניתוח אותות המשפיעים על החלטות דפוסים וגורל תא.
Disclosures
No conflicts of interest declared.
Acknowledgements
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
Materials
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
References
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409 (2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved