Method Article
Cultura da embrionárias mouse cocleares explantes e Gene Transferência de Eletroporação
Neste Artigo
Resumo
We present a method that describes isolation and culture of cochlear explants from embryonic mouse inner ear. We also demonstrate a method for gene transfer into cochlear explants via square-wave electroporation. The in vitro explant culture coupled with gene transfer technique enables researchers to study the effects of altering gene expression during development.
Resumo
Auditory hair cells located within the mouse organ of Corti detect and transmit sound information to the central nervous system. The mechanosensory hair cells are aligned in one row of inner hair cells and three rows of outer hair cells that extend along the basal to apical axis of the cochlea. The explant culture technique described here provides an efficient method to isolate and maintain cochlear explants from the embryonic mouse inner ear. Also, the morphology and molecular characteristics of sensory hair cells and nonsensory supporting cells within the cochlear explant cultures resemble those observed in vivo and can be studied within its intrinsic cellular environment. The cochlear explants can serve as important experimental tools for the identification and characterization of molecular and genetic pathways that are involved in cellular specification and patterning. Although transgenic mouse models provide an effective approach for gene expression studies, a considerable number of mouse mutants die during embryonic development thereby hindering the analysis and interpretation of developmental phenotypes. The organ of Corti from mutant mice that die before birth can be cultured so that their in vitro development and responses to different factors can be analyzed. Additionally, we describe a technique for electroporating embryonic cochlear explants ex vivo which can be used to downregulate or overexpress specific gene(s) and analyze their potential endogenous function and test whether specific gene product is necessary or sufficient in a given context to influence mammalian cochlear development1-8.
Introdução
The mammalian organ of Corti is comprised of a mosaic of specialized cell types, including two types of mechanosensory hair cells as well as at least four types of nonsensory supporting cells making it an ideal model system to study normal cellular processes like proliferation, fate specification, differentiation and patterning. In addition, the normal development of these different cell types is essential for normal hearing function. Hence, it is crucial to understand the factors, both molecular and cellular, that regulate their development. However, the small size of the mouse cochlea as well as its inaccessibility poses a particular challenge for gene expression studies. Moreover, most of the cell fate specification and patterning events occur during embryonic time periods and are mostly completed before birth. Therefore, identification and characterization of signaling events during embryonic time periods is essential to gain insight into the molecular basis of cochlear morphogenesis.
Here, we demonstrate a method to culture intact cochlea in vitro from embryonic mouse inner ears. The rationale behind the use of this technique is that cultured cochleae maintain their molecular and morphological characteristics thereby providing a valuable model for investigating potential candidate genes and exploring the mechanisms involved in cochlear morphogenesis. Although transgenic mice can be used for gene expression studies, an in vitro system is often needed for monitoring specific gene functions. Moreover, cochlear cultures can be established from transgenic mouse embryos so that their in vitro development and response to various soluble factors and antagonists can be studied. Although embryos at day 13 (E13) are used in this protocol, cultures from E12 or E14 to early postnatal inner ears can give similar results.
We also present a gene transfer technique in cultured embryonic cochlear explants using square wave electroporation. Following the isolation of the cochlear explants, electroporation can be used to express DNA plasmids of gene(s) of interest in individual cells within the cochlear duct. This technique serves as a complementary approach to studies utilizing transgenic mice to gain insight into the molecular pathways underlying cellular phenotype. Using this method of gene transfer, a variety of epithelial cell types within the embryonic cochlea are transfected, thereby enabling loss-and gain-of-function analyses at the single-cell level. In addition, electrophysiological studies can also be performed in cochlear explant cultures8. This method of in vitro electroporation is relatively simple and straightforward, combined with minimal damage to the tissue, has resulted in a rapid expansion of this technique.
Protocolo
NOTA: Todos os protocolos que utilizam animais vivos devem ser analisados e aprovados por um cuidado e uso de animais Comitê Institucional (IACUC) e deve seguir métodos para o cuidado e uso de animais de laboratório oficialmente aprovado. Todas as dissecações deve ser realizada utilizando uma técnica estéril em um banco de fluxo laminar limpo. Luvas e máscara, se desejado, deve ser usado durante este procedimento.
1. Dissecção da Orelha Embryonic Rato Inner
- Configuração para órgão de Corti culturas de explantes:
- Esteriliza-se o fluxo laminar capuz de cultura de tecidos, ligando a luz UV durante cerca de 30 min e desinfectar a superfície com etanol a 70% antes da utilização. Além disso, esterilizar todos os instrumentos de dissecação, incluindo ferramentas de dissecação finos e pratos Sylgard-revestidos para dissecção embrião via autoclave ou por imersão em etanol 70% por pelo menos 20 min antes do uso. Deitar fora 70% de etanol e permitir que os pratos e instrumentos para ar seco em um fluxo laminar clea limpon bancada antes de usar.
- Prepare a Solução Salina Equilibrada de Hank estéril (HBSS) / (4- (2-hidroxietil) -1-piperazinoetanossulfónico) (HEPES) mistura por adição de 10% de HBSS 10x e 0,5% de HEPES e ajustar o pH a aproximadamente 7,2 e esterilizar o filtro solução final e armazenar a 4 ° C. Realizar todas as dissecações em refrigerados solução HBSS / HEPES a melhor preservação do tecido durante todo o procedimento.
- Pratos de vidro de fundo casaco com matriz da membrana basal por adição de 5 mL de água fria (4 ° C) estéril de Dulbecco Modified Eagle Médium (DMEM) a uma alíquota de 300 ul de matriz de membrana basal num tubo de polipropileno de 15 ml estéril. Misturar em vortex o conteúdo e adicionar 150 uL da mistura da matriz da membrana basal DMEM-a do centro de cada placa de cultura de modo a que cubra a totalidade da cultura assim presente no centro do prato. Cubra os pratos e armazenar em um 37 ° C incubadora por pelo menos 45 min antes do uso.
- Despeje 5/4 ml refrigerados HBSS em three pratos de Petri de poliestireno e deixe fechado na capa.
- Prepare meio de cultura num tubo de polipropileno de 15 ml estéril por adição de 9 ml de DMEM, 100 ul de suplementos de N2, 10 g / ml e Cipro 1 ml de FBS.
- O isolamento de embriões:
NOTA: Neste procedimento para a cultura de explantes cocleares embrionárias de camundongos, ouvidos internos colheita do dia embrionário (E) 13 ossos temporais, com o dia após a fertilização sendo considerado como E1 9. O protocolo também pode ser utilizado com rato embrionário começando ouvidos internos de E12 a E18.- Euthanize um rato cronometrado-grávida de CO 2 e sacrificar animais por deslocamento cervical ou protocolos aprovados adequados. Realizar eutanásia longe de de fluxo laminar de cultura de tecidos capuz para manter a esterilidade na sala cultura do tecido.
- Coloque o mouse sacrificados em papel toalha com abdômen para cima e desinfectar abdômen com etanol 70%.
- Abra a cavidade abdominal, agarrando pelecom uma pinça curva com uma mão e epiderme de corte e muscular ao longo da linha média com tesoura usando uma outra mão. Faça dois cortes perpendiculares em ambos os lados e retirar o útero cuidadosamente levantando cornos uterinos bilaterais com uma pinça e retirá-la da parte de baixo do tecido conjuntivo com uma tesoura.
- Coloque a cadeia embrionárias em uma placa de Petri contendo solução refrigerada dissecção (mistura HBSS / HEPES) e transferir para o de fluxo laminar bancada limpa.
- Remover cuidadosamente a partir de embriões placenta e colocá-los em uma das placas de Petri estéreis contendo solução de dissecção. Se a solução se torna sangrenta, movê-los para uma nova placa de Petri.
NOTA: Neste ponto, os embriões podem ser encenado usando um guia de preparo Theiler. - Decapitar embriões por beliscar na região do pescoço com um par de fórceps limpas ou tesoura e coloque as cabeças em um prato fresco Petri contendo solução de dissecção gelada.
- Dissecção da orelha interna:
- Coloque ocabeça embrião ne em um prato Sylgard estéril contendo dissecação frio
- solução. Trabalhando sob um microscópio de dissecação com uma ampliação de 1.6X ~, imobilizar a cabeça do embrião, colocando Minutien pinos em torno ou mais próxima da região dos olhos (Figura 1A).
- Usando duas pinças estéreis cuidadosamente retire a pele e abrir o crânio no lado dorsal ao longo da linha média (Figura 1B). Remover cérebro de cavidade craniana e ouvidos internos localizados em ossos temporais podem ser identificadas nesta fase (Figura 1C, D). O forro do vaso sanguíneo, que normalmente está presente em torno das orelhas internas, pode ser utilizado como um ponto de referência para a identificação do ouvido interno, nesta fase (Figura 1D).
- Dissecar o ouvido interno dos ossos temporais, colocando a pinça debaixo do tecido e isolamento do ouvido interno a partir da base do crânio e a transferência de um novo prato de dissecação contendo solução fria (Figura 1E, F).
2. Geração de Órgão de Corti culturas de explantes
NOTA: Nesta fase de desenvolvimento, o tecido cartilaginoso é e pode ser facilmente dissecados com a pinça.
- Oriente o ouvido interno para que o lado ventral está virada para cima (Figura 2A) e estabilizar o ouvido interno através da inserção suavemente a extremidade aguçada da Minutien pinos através da porção vestibular do ouvido interno (Figura 2B).
- Usando fórceps ultrafinas cortar abrir a cartilagem sobrejacente, fazendo uma incisão utilizando uma ponta de pinça perto da janela oval e cuidadosamente remover a cartilagem da cóclea (Figura 2C).
NOTA: É importante ter a certeza que os fórceps não são inseridos muito profundamente na cartilagem como cartilagem sobrejacente às vezes é fundido com o dueto coclear no caso em que é útil para utilizar uma pinça fechada para libertar cartilagem do ducto coclear subjacente por raspagem abaixo do surface da cartilagem. Nesta fase de desenvolvimento, a espiral da cóclea é de apenas três quartos de um turno de comprimento. - Em seguida, expor o epitélio sensorial, colocando a pinça na região preferida do ducto coclear, quer a base ou no vértice, e puxando para fora o telhado da cóclea (Figura 2D).
NOTA: O telhado da cóclea deve ser removido completamente, uma vez que pode mascarar o epitélio sensorial impedindo a análise.
NOTA: Este procedimento deve ser feito com cuidado, pois é fácil de rasgar o epitélio sensorial. - Como um último passo, cuidadosamente remover o tecido conjuntivo subjacente do epitélio sensorial exposta de modo que a base do explante coclear é uniformemente plana.
- Isolar a cóclea dissecada da porção vestibular do ouvido interno com a pinça. Isto pode ser realizado antes ou após a etapa 2.4 (Figura 2E).
- Transferir o epitélio sensorial da cóclea dissecado em uma membra porãopoço de cultura utilizando um cinzel estéril 1,5 milímetros (Figura 2F) ne-matriz revestida.
- Oriente o explante da cóclea com a superfície luminal do epitélio virado para cima, e aspirar a solução de matriz de membrana basal DMEM para achatar cuidadosamente o tecido e substituí-la com 150 ul de meio de cultura fresco adicionando suavemente para o prato. Deve ser tomado cuidado para assegurar que cada explante adere bem à lamela de vidro revestido e não está a flutuar no meio de cultura. Certifique-se de que a ponta do fórceps, é apontado para cima, enquanto a fixação do poço de vidro para evitar danificar o explante da cóclea.
- Suavemente transferir a placa de cultura estéril num prato de cultura de 150 milímetros e colocar numa incubadora de cultura de tecidos a 37 ° C com 5% de CO 2 durante período de tempo desejado, normalmente 3-6 dias in vitro (DIV). Depois de 1 DIV, examinar as culturas sob um microscópio de dissecação para certificar-se que o explante da cóclea aderiu bem à placa de cultura.
- Depois de emcubation in vitro para comprimentos desejados de tempo, as culturas são processados para imuno-histoquímica.
NOTA: As culturas de explantes geralmente são incubadas durante 6 DIV, que é equivalente a fase de desenvolvimento, P0. Após a incubação in vitro, as culturas podem ser processados em aplicações a jusante, como imuno-histoquímica (Figura 3B), RT-PCR, a hibridização in situ, e / ou Western blot.
3. A electroporação mediada por Transferência de Genes
- Configuração para eletroporação:
- Esterilizar um Sylgard 100 milímetros prato de vidro revestido por autoclavagem ou imersão em etanol a 70% durante cerca de 20 min e deixar secar ao ar numa bancada limpa antes da utilização.
- Prepare o DNA de um vector de expressão de escolha utilizando Maximiliano ou midi-prep kits adequados. Os vectores de expressão utilizados neste protocolo são pIRES2-Atoh1.EGFP e pCLIG-NeuroD1.EGFP. A concentração final de ADN deve ser de pelo menos 1 ug / uL de ADN estéril /Livre de RNAse água.
- Electroporating ADN em explantes da cóclea embrionárias:
- Adicionar 10 ul de solução de ADN de plasmídeo para um novo Sylgard 100 milímetros revestida prato e transferir um explante da cóclea totalmente dissecados (obtido a partir do passo 2.5) para a solução de ADN.
- Com a superfície luminal do epitélio virado para cima, a cóclea inclinar ligeiramente de modo que é perpendicular ao plano do prato.
- Coloque as pás de eléctrodos em ambos os lados da cóclea com pá negativo (cátodo) para o epitélio sensorial e a pá positivo (ânodo) localizada adjacente à base da cóclea.
Observação: Uma vez que o ADN tem carga negativa, que migra de negativo para positivo e do eléctrodo, colocando a extremidade do cátodo da sonda adjacente ao epitélio sensorial; o DNA principalmente ir através da superfície do epitélio sensorial. - Usando electroporator, entregar 9-10 pulsos de 24 mV, 30 ms duração do pulso com o interruptor do pedal em tele electroporator, e em seguida, adicione 100 ml de meio de cultura quente para a cóclea electroporado.
- Repita os passos 3.2.1-4 para todos os explantes da cóclea e para o DNA de todos os genes de interesse e transferir as cócleas electroporadas na membrana basal revestida de matriz prato para o plaqueamento (passo 2.7). Cultura todas as cócleas electroporados em uma temperatura de 37 ° C, 5% de CO 2 incubadora humidificada para comprimentos de tempo desejados, que serão depois processadas para imunocitoquímica.
NOTA: A cóclea de uma ninhada inteira de CD1 rato (aproximadamente 8-12 filhotes) pode ser isolado, microdissecados, electroporado e banhado em <4 horas.
4. Análise das Culturas Coclear explantes
NOTA: As culturas são geralmente incubados durante 6 DIV, que é equivalente a fase de desenvolvimento, P0. Após a incubação in vitro, as culturas são fixadas e processadas para imunocitoquímica.
- Depois de comprimento desejado de incubation, remover o meio de cultura e lavar rapidamente o explante da cóclea em solução salina tamponada com fosfato (PBS) e incuba-se em paraformaldeído a 4% (em PBS) durante 15 min à temperatura ambiente.
- Lavar o fixador por adição de PBS e lavar três vezes em PBS durante 15 min.
- Permeabilizar utilizando PBS-T (PBS + Tween a 0,5%) durante 30 min antes de bloqueio com PBS-T contendo 10% de soro de cabra.
- Incubar em solução de anticorpo primário contendo o anticorpo primário em PBS-T com 1% de soro de cabra durante a noite a 4 ° C.
- Lava-se a cóclea três vezes à temperatura ambiente utilizando PBS-T 15 min antes da adição de cada anticorpos secundários conjugados com Alexa adequadas.
- Uma vez que o explante é cultivado sobre coclear lamela de vidro que pode ser tratado individualmente pelo isolamento da lamela do prato de montagem e sobre a lâmina. Isto pode ser conseguido por imersão da placa de cultura em OS30 solvente para pelo menos 1 hora à temperatura ambiente. Usando a lâmina estéril, retire a lamela do dish e montar em um slide e visualizar em um microscópio fluorescente.
Resultados
We describe a method to isolate cochlea from embryonic inner ears and micro-dissect to expose the sensory epithelium. Once dissected, it may be plated and cultured as an intact cochlear duct (Figure 3) and analyzed by immunohistochemistry. The cultured cochlear explants provide a useful assay to examine the effect of variety of soluble factors and pharmacological drugs on cochlear development. Following dissection of cochlear explants, electroporation technique can be used to misexpress genes of interest and examine their effect on cochlear morphogenesis. The results presented here demonstrate that forced expression of basic helix-loop-helix (bHLH) transcription factor, Atoh1 into cultured cochlear explants established from E13 inner ears leads to ectopic hair cell formation. In contrast, forced expression of another bHLH transcription factor, NeuroD1 in prosensory cells and nonsensory epithelial cells within GER leads to the formation of ectopic neurons.
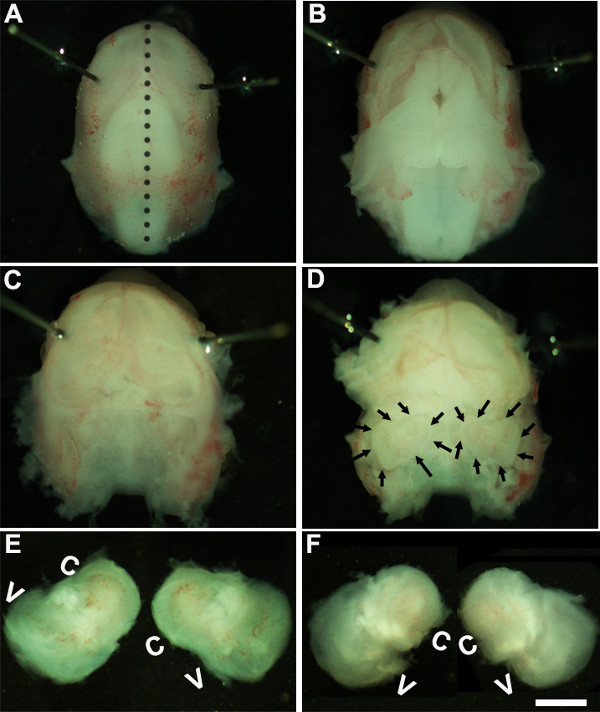
Figure 1: Dissection of the embryonic cochlea. Dissection steps involved in isolating developing cochleae from E13 mouse head as discussed in Part 1. Dotted line in (A) indicates dorsal midline and the borders of inner ears are indicated by arrows in (D). In (E), C indicates cochlea and V, vestibule. Scale bar: 1.0 mm.
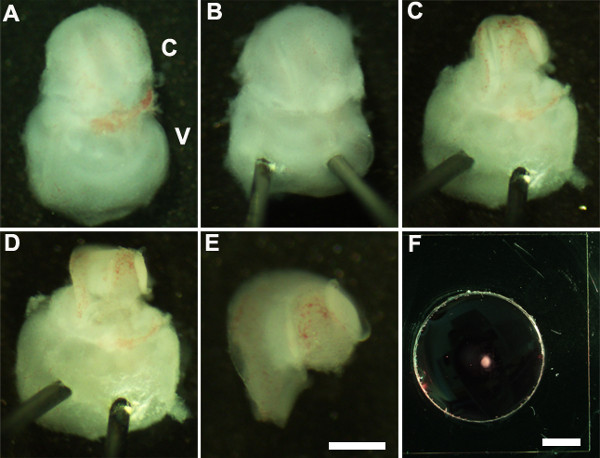
Figure 2: Generation of embryonic cochlear explant cultures. Panels (A-F) illustrate key steps in the dissection of the cochlea down to the sensory epithelium as described in Part 2. C, cochlea; V, vestibule. Scale bar: A-E, 100 m; F, 10 mm.
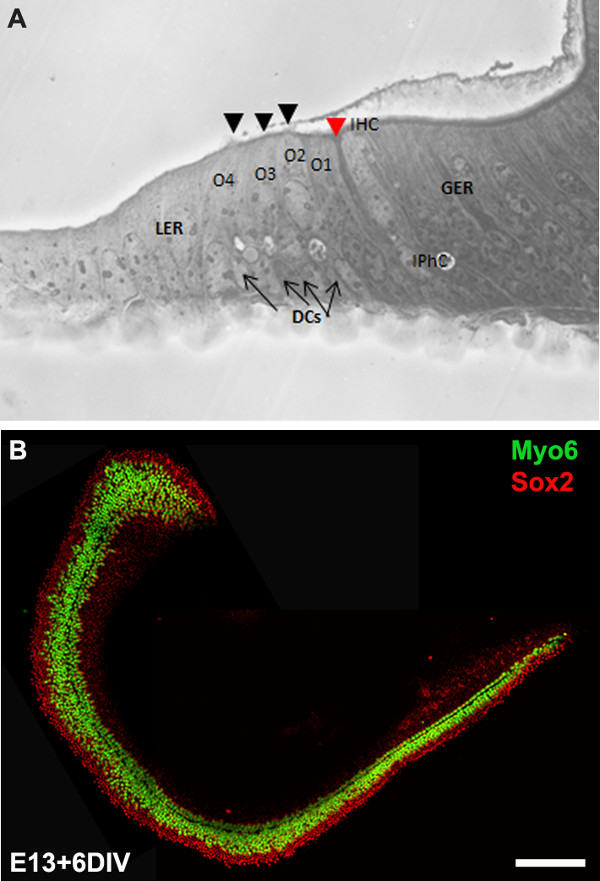
Figure 3: The development of the organ of Corti in cochlear cultures. The formation of hair cells and supporting cells occurs normally in cultured explants. Cross-sectional view of E13 cochlear explant incubated for 6 DIV (equivalent to P0) (B) and top-down view of a whole-mount cochlear explant immuno-stained with Myo7a in green and Sox2 in red demonstrates the presence of one inner and 3-4 rows of outer hair cells and surrounding support cells. Arrows point to Deiters’ cells and black arrowheads indicate the presence of stereociliary bundles within the cochlear explant. Arrowhead in red indicates the depression formed by the prominent pillar cell projection. IHC, inner hair cell; O1,2,3, three outer hair cells, DCs, Deiters’ cells; IPhC, inner phalangeal cell; GER, greater epithelial ridge which includes nonsensory epithelial cells present on the modiolar side of the epithelium; LER, lesser epithelial ridge, includes nonsensory epithelial cells present on strial edge of the sensory epithelium. Scale bar: B, 100 µm.

Figure 4: Electroporation of Atoh1.EGFP (A-C) and NeuroD1 into the organ of Corti explant culture. Embryonic (E) day 13 cochlear explants were established from WT CD1 mouse pups and electroporated with Atoh1.EGFP (A-C), NeuroD1-EGFP (D-F) reporter constructs as described and immunolabeled with hair cell-specific marker anti-Myo7a or neuronal marker, TuJ1 (β-tubulin III) in red. Electroporated cells which can be visualized by EGFP expression are seen throughout the GER, LER and sensory epithelium (SE) cells. The NeuroD1 transfected cochlear epithelial cells after 5 DIV acquire neuronal phenotype with dendritic processes, most of which are positive for TuJ1 while Atoh1 transfected cells are positive for Myo7a expression. SE, sensory epithelium; GER, greater epithelial ridge. Scale bar: A-C, 20 µm; D-F, 50 µm. Please click here to view a larger version of this figure.
Discussão
Todas as células dentro do labirinto membranoso do ouvido interno de rato, incluindo sensorial, não-sensorial e os neurónios do gânglio da espiral são todos derivados de placodally derivado otocyst localizado adjacente à parte posterior do cérebro da ectoderme, cerca de 10-14 E8. Em E11, a região ventral do otocyst estende-se para formar o ducto coclear e como desenvolvimento continua, um grupo de células epiteliais no interior da cóclea, bem como em outras regiões do otocyst, tornar-se como emplastros prosensory especificado que, subsequentemente, dão origem a diferentes tipos de células ciliadas mecanosensorial e células de suporte não-sensorial. Na cóclea em desenvolvimento, uma linha de células ciliadas internas e três fileiras de células ciliadas externas podem ser identificados em torno de E15.5 e por E17, padronização é essencialmente completa com uma única linha de células ciliadas internas, células pilares e três fileiras de células ciliadas externas . Em um período de tempo que se estende desde E11 quando o dueto coclear primeiro começa a crescer para fora através E17 toda a diferendife- decisões destino celular e padronização ocorrer dentro do epitélio em desenvolvimento para gerar um padrão celular impressionante com um complemento normal de células ciliadas e células de suporte. A perda de células ciliadas e / ou células de apoio é a principal causa de deficiência auditiva. Uma vez que estes tipos de células são gerados apenas durante um período de tempo bastante compacto durante o desenvolvimento embrionário, é crucial para compreender as vias moleculares e genéticos que especificam cada um desses tipos de células que deverá conduzir a uma visão significativa nas estratégias regenerativas.
Técnicas de cultura e electroporação cocleares têm sido desenvolvidos para manipular a expressão génica no rato em desenvolvimento. Neste vídeo, demonstramos técnicas de cultura para a geração de explantes primários e uma técnica de electroporação para a entrega de genes em cultura de órgãos embrionários de murídeo de Corti. Os explantes primários preparados desta forma pode ser mantida durante 7-10 dias in vitro. Explantes cocleares can ser usada para manipular a expressão do gene por abordagens farmacológicas que nos permitam compreender os mecanismos que regulam os processos de desenvolvimento, tais como especificação de destino, o compromisso, diferenciação e padronização. Além disso, este método facilita a análise de fenótipos de desenvolvimento embrionário de murganhos mutantes que não sobrevivem passado E12.
O procedimento de transferência do gene de onda quadrada electroporação mediada fornece um mecanismo para manipular a expressão de genes em células sensoriais capilares, células de suporte e células dentro das regiões de RGE e LER, a fim de visualizar o seu destino ex vivo. Usando este procedimento, podemos regular negativamente ou ectopically expressar genes específicos em células prosensory, células ciliadas e / ou células de suporte em um fundo de outra forma de tipo selvagem e analisar seus efeitos específicos na especificação e diferenciação destino. Isto irá permitir-nos compreender a função do gene específico dentro da cóclea em desenvolvimento. Por exemplo, como mostrado na Figura 4, a expressão forçada de Atoh1 2,4 ou NeuroD1 8 em células dentro ou GER LER leva à formação de células ciliadas ectópicos e neurónios respectivamente. Além disso, esta técnica permite a electroporar múltiplos genes candidatos 6,7 e examinar o seu efeito sobre células sensoriais do cabelo e a formação de células de suporte, a diferenciação e a sua organização. A técnica de transferência de genes envolvendo vectores adenovirais oferece expressão ampla e têm sido utilizados com sucesso no ouvido interno, 15,16. No entanto, esta técnica depende da habilidade para gerar e purificar o vírus, que é muitas vezes demorado.
Embora a cultura cochear pode ser criado logo em E12, eletroporação de explantes cocleares menores de E12.5 / E13 irá resultar em danos ao tecido tornando-se complicado para análise. Além disso, o promotor do vector de expressão utilizado determina quais os tipos de células são transfectadas na cóclea duct. Por exemplo, o promotor de citomegalovírus humano contendo vectores de expressão produz transfecção robusto no órgão Kollikers ', enquanto que a utilização de CMV precoce resultados potenciador / promotor da actina de galinha beta em maior eficiência de transfecção em células dentro do epitélio sensorial. Os problemas comuns encontradas durante a electroporação de explantes da cóclea embrionárias são morte celular excessiva e / ou dano do tecido e pobre a eficiência da transfecção. O espaçamento adequado de eléctrodos e a concentração do ADN desempenha um papel crucial na obtenção de dano mínimo e uma maior eficiência de transfecção. Em resumo, estas técnicas aumenta nossa capacidade de manipular a expressão do gene através de ganho ou perda de estratégias de função e manipulações farmacológicas e de grande ajuda em dissecar os sinais que influenciam as decisões de padronização e destino da célula.
Divulgações
No conflicts of interest declared.
Agradecimentos
We would like to acknowledge Dr. Bradley Schulte for comments on this protocol. This work was supported by National Institutes of Health grant R00 (5R00DC010220). This project was performed in a renovated laboratory space supported by Grant C06RR014516.
Materiais
| Name | Company | Catalog Number | Comments |
| HBSS | Gibco | 14065-056 | |
| HEPES | Gibco | 15630-080 | |
| Dulbecco’s Modified Medium | Gibco | 12430-054 | |
| Fetal bovine serum | Gibco | 10082 | |
| N-2 Supplement (100x) | Gibco | 17502-048 | |
| Ciprofloxacin hydrochloride | Cellgro | 61-277-RF | |
| Glass Dish 60 mm | Kimble Chase | 23062-6015/23064-6015 | |
| Glass Dish 100 mm | Kimble Chase | 23064-10015/23062-10015 | |
| Minutien pins | Fine Science Tools | 26002-15 | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Pulse generator | Protech International Inc | CUY21Vivo-SQ | |
| Glass bottom culture dishes | MatTek | P35G-0-10-C | |
| Matrigel matrix | BD Biosciences | 356237 | |
| Culture dish, 60 x 15 mm | Becton Dickinson | 353037 | |
| Tissue culture dishes | Greiner Bio-one | 639160 | |
| Phosphate buffered saline | Gibco | 10010-023 | |
| OS-30 | Dow Corning | 4021768 | |
| Fluoromount | Southern Biotech | 0100-01 | |
| Conical tubes, 15 ml | Greiner Bio-one | 188261 | |
| Myosin 6 | Proteus Biosciences Inc | 25-6791 | |
| Myosin 7a | Proteus Biosciences Inc | 25-6790 | |
| TuJ1 | Sigma | T2200 |
Referências
- Sobkowicz, H. M., Bereman, B., Rose, J. E. Organotypic development of the organ of Corti in culture. J Neurocytol. 4 (5), 543-572 (1975).
- Zheng, J. L., Gao, W. Q. Overexpression of Math1 induces robust production of extra hair cells in postnatal rat inner ears. Nat Neurosci. 3 (6), 580-586 (2000).
- Zheng, J. L., Shou, J., Guillemot, F., Kageyama, R., Gao, W. Q. Hes1 is a negative regulator of inner ear hair cell differentiation. Development. 127 (21), 4551-4560 (2000).
- Woods, C., Montcouquiol, M., Kelley, M. W. Math1 regulates development of the sensory epithelium in the mammalian cochlea. Nat Neurosci. 7 (12), 1310-1318 (2004).
- Jones, J. M., Montcouquiol, M., Dabdoub, A., Woods, C., Kelley, M. W. Inhibitors of differentiation and DNA binding (Ids) regulate Math1 and hair cell formation during the development of the organ of Corti. J Neurosci. 26 (2), 550-558 (2006).
- Dabdoub, A., et al. Sox2 signaling in prosensory domain specification and subsequent hair cell differentiation in the developing cochlea. Proc. Natl. Acad. Sci. U.S.A. 105 (47), 18396-18401 (2008).
- Doetzlhofer, A., Basch, M. L., Ohyama, T., Gessler, M., Groves, A. K., Segil, N. Hey2 regulation by FGF provides a Notch-independent mechanism of maintaining pillar cell fate in the organ of Corti. Dev Cell. 16 (1), 58-69 (2009).
- Puligilla, C., Dabdoub, A., Brenowitz, S. D., Kelley, M. W. Sox2 induces neuronal formation in the developing cochlea. J Neurosci. 20 (2), 714-722 (2010).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1995).
- Sher, A. E. The embryonic and postnatal development of the inner ear of the mouse. Acta Otolaryngol Suppl. 285, 1-77 (1971).
- Torres, M., Giraldez, F. The development of the vertebrate inner ear. Mech Dev. 71 (1-2), 5-21 (1998).
- Brown, S. T., Martin, K., Groves, A. K. Molecular basis of inner ear induction. Curr Top Dev Biol. 57, 115-119 (2003).
- Puligilla, C., Kelley, M. W. Building the world’s best hearing aid; regulation of cell fate in the cochlea. Curr Opin Genet Dev. 19 (4), 368-373 (2009).
- Wu, D. K., Kelley, M. W. Molecular mechanisms of inner ear development. Cold Spring Harb Perspect Biol. 4 (8), a008409 (2012).
- Holt, J. R. Viral-mediated gene transfer to study the molecular physiology of the mammalian inner ear. Audiol Neurootol. 7 (3), 157-160 (2002).
- Stone, I. M., Lurie, D. I., Kelley, M. W., Poulsen, D. J. Adeno-associated virus-mediated gene transfer to hair cells and support cells of the murine cochlea. Mol Ther. 11 (6), 843-848 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados