Method Article
Süreksiz Sukroz Degrade'yi kullanma Sinaptik Plazma Membran ve postsinaptik Yoğunluk Proteinlerin Hazırlanması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makalede, bir sükroz gradyanı üzerinde süreksiz bir ultra-santrifüj ile sinaptik plazma membranı ile bağlantılı proteinlerin zenginleştirme göstermektedir. Post-sinaptik yoğunluk proteinlerin takip eden hazırlama de tarif edilmektedir. Protein preparatları western blotting ya da 2 boyutlu DIGE analiz için uygundur.
Özet
Nöronal hücre altı bölme teknikleri ve sinaps kaçırılan proteinlerin ölçülmesine olanak sağlar. Başlangıçta 1960 lerin sonlarında tarif edildiği gibi, sinaptik plazma membranı ile ilgili proteinlerin bir sükroz yoğunluk gradyanında ultrasantrifugasyon sureti ile izole edilebilir. Sinaptik membranlar izole edildikten sonra, sinaptik sonrası yoğunluğu olarak tanımlanır, makromoleküler bir komplekstir, daha sonra nedeniyle deterjan çözülemediği için izole edilebilir. Sinaptik plazma zarları ve post-sinaptik yoğunluklu proteinleri izole etmek için kullanılan teknikler, esas olarak 40 yıl sonra aynı kalır, ve yaygın olarak mevcut nörolojik araştırma kullanılır. Bu makalede, sinaptik plazma membranı ve post-sinaptik yoğunluk kesintili bir sakroz gradyanı kullanılarak, ilişkili proteinlerin fraksiyonasyon göstermektedir. Elde edilen protein preparatları, batı lekeleme ya da 2 boyutlu DIGE analiz için uygundur.
Giriş
Nöronlar, sinaps ile iletişim kurmak ve bu haberleşme kalitesi sinaps proteinlerin bileşiminde değişikliklerle büyük ölçüde kontrol edilir. Özel olarak, sinaptik sonrası yoğunluğu bulunan proteinlerin sinyal iletim sistemleri 1 ile iyice iskele nörotransmiter reseptörleri nöronal iletişiminde yer. Ayrıca, sinaptik etkinliğinin gücü kalıcı değişiklikler, sinaptik sonrası yoğunluğu 1-6 de ekleme ya da reseptörleri ayrılmasıyla kontrol edilir. Bu nedenle, sinaptik proteinlerin izolasyon ve miktar nöronlar uyaranlara ve sinaptik etkinliğini 7 değiştirmek yanıt yolları içgörü kazanmak için gerekli ve yararlı bir tekniktir. Bu makale süreksiz sakaroz Yokuşta ultrasantrifugasyon kemirgen beyin dokusundan sinaptik proteinler izole etmek ortak bir teknik anlatılmaktadır. Sinaptik plazma zarı fraksiyonu zenginleştirilmiş olabilir dayanan ve izoleampirik olarak 1.2 M sukroz ile benzer olduğu tespit edilmiştir sukroz yoğunluk,.
Biyolojik bir soru ile ilgili olarak, alt-hücresel fraksiyonlar sakaroz veya Percoll ya sürekli ya da süreksiz gradyentlerin ayrılabilir. Sürekli eğimleri çok sayıda kısmın içine proteinlerin ayrıştırılması için; Bu, belirli bir payın 8 içindeki proteinlerin birlikte-lokalizasyonunu göstermek için özellikle yararlı olabilir. Bununla birlikte, sürekli geçişlerini hazırlanması daha zahmetlidir ve birçok uygulama için gerekli değildir. Süreksiz gradyanlar hazırlamak için nispeten kolay olan ve az, genellikle tanımlanmış fraksiyonlar halinde proteinleri ayırmak için kullanılabilir. Artan molaritede üç sükroz katmanlardan oluşan çok süreksiz değişim ölçüleri geniş ölçüde sinaptik plazma zarı (SPM) ile ilişkili proteinler izole etmek için kullanılmıştır. Bu sinaptik plazma membranı fraksiyonu, sinaptik sonrası yoğunluk fraksiyonu yok etmek için işlenebilir;Deterjan-çözünmeyen fraksiyon deterjan muamelesi ile izolasyonu ve n, (PSD).
Bu işlem, ilk olarak 1960 de tarif 9,10 zaman, elektron mikroskopi kabaca sinaptik membranı ve post-sinaptik yoğunluğu 9-14 fraksiyonları tanımlamak organel ve membranlar göstermek için kullanılmıştır. Bu çalışmalar öncesi ve post-sinaptik zar ve SPM fraksiyonunda sinaptik veziküllerin dahil olduğunu gösterdi; Deterjan tedavisi öncelikle elektron-yoğun sonra sinaptik sonrası yoğunluğu görünür. Prosedürde, hipotonik şok hücre gövdesi 10 gelen sinaptik süreçleri çimdik için kullanılır. Bu adım, mitokondri ozmotik şoka, daha dayanıklı ve sağlam kalır ve bu nedenle bu yöntem sukroz gradyanı ile (Şekil 1) altındaki çöktürmek gerçeğinden yararlanır.
Bu aynı zenginleştirme tekniği kullanarak, SPM ve PSD fraksiyonlar biyokimyasal ilk idipoliakrilamid jel elektroforezi ve ana protein bileşenlerinin 15-17 sekans ile tanımlanmıştır. Daha sonra, western blot analizi (Şekil 2), bu kısımlar daha fazla tespit etmek ve tanımlamak sinaptik proteinlerin seviyelerini ölçmek ve kullanılmıştır. Biz Slc6a3 odağının farelerde 18 yineleniyor meydana dopamin taşıyıcı sinaptik seviyelerindeki değişiklikleri ölçmek için laboratuarlarda bu tekniği kullandık. Ayrıca DISC1 interactome 19 bir parçası olan proteinlerin sinaps özgü azalma ortaya çıkarmak için, NMDA reseptörü eksik olan farelerde, bu tekniği kullanılmıştır.
Bu fraksiyonlar SPM sinaptik vezikül zar proteinleri, endozom belirteçler, mitokondriyal protein, zar bağlı sentetik enzimler ve sinyal iletim molekülü olarak post-sinaptik yoğunluk tamamlayıcı bileşenleri ve sinaptik plazma zarlarını içeren 20-23, western blot analizi bellidir. Even PSD kısımlar bol mitokondriyal proteinleri ile kirlenmemiş olması ve bunları 13 ayrılması için bir ikinci meyilli sedimentasyon ya da ek saflaştırma adımları gerçekleştirmek gerekli olabilir. Son zamanlarda, tek başına nicel kütle spektrometrisi, sinaptik-sonrası yoğunluğu 100 proteinlerin bir listesi, aynı zamanda bu bileşenlerin 24,25 nispi bolluk bir gösterge sağlamıştır.
Protokol
Aşağıdaki protokol Hayvan Bakımı Kanada Konseyi yönergelerine uygun ve Toronto Üniversitesi Tıp ve Eczacılık Hayvan Bakım Komitesi Fakültesi tarafından onaylanmıştır.
Tablo 1 Açıklandığı gibi 1. Gerekli Reaktifler hazırlayın
- Tablo 1 'de belirtilen tüm konsantrasyonlarda sakkaroz, tampon maddeler, proteaz ve fosfataz (gerekirse) inhibitörleri eklenir ve GKD 2 O. ÖNEMLİ: Deneyin başlamasından önce, reaktifler ve ekipman her 4 ° C'de tüm adımları gerçekleştirmek ve ön-soğutma. Kalıcı bir kalem ile ultrasantrifüjdeki tüpler de dahil, tüm tüpler Etiket.
Uygun Beyin Bölgesi 2. Diseksiyon
- Servikal dislokasyon veya başları kesilerek hayvan kurban. Ev ve hayvan bakımı üzerine kurumsal ve hükümet politikaları doğrultusunda hayvanları euthanize.
- Hızla th kaldırBir soğutulmuş diseksiyon blokta kafatası ve yerden e beyin.
- Taze dokudan uygun bir beyin bölgesini incelemek ve Adım 3'e geçin.
Motorlu Cam-Teflon Homogenizer 3. Doku Homojenizasyon
- 0.32 M HEPES-tamponlu sukroz çözeltisi 4 ml su ihtiva eden bir işaretli 13 mi polipropilen tüp içinde kesilmiş doku (SPM), 50-100 mg, ya da (PSD) 100-200 mg yerleştirin. 15 ml konik cam-teflon doku taşlama / homojenleştirici için örnek aktarmak, 900 rpm (7 ayar) için motor sürücüsünü ayarlayın ve 30 saniye süren 12 vuruş ile örnek homojenize. Numuneler arasında farklı bir cam-teflon homojenizatör kullanın, ya da numuneler arasındaki soğuk distile su ile Homojenleştiriciyi durulayın ve bir Kimwipe ile kurulayın. Not: doku 4 g kadar ancak uygun fraksiyonlama sağlamak için daha az doku kullanmak tavsiye edilir, 0.32 M HEPES-tamponlu sukroz çözeltisi 4 ml homojenize edilebilir.
- T geri homojenize örnek aktarınaynı 13 ml polipropilen tüp o. Yedek miktar daha sonra da protein ve toplam protein fraksiyonunun Western blot analizi için -80 ° C 'de ve mağaza homojenat 100 ul.
4. Düşük Hız Santrifugasyon Nükleer Kesir Kaldır (Getirileri Supernatant S1)
- Santrifüj, 4 ° C'de 10 dakika boyunca 900 xg'de sabit açılı rotor homojenat. Yeni etmek için yüzer maddeyi (S1) Transfer 13 ml tüp etiketlenmiş ve 0.32 M HEPES-tamponlu sukroz 500 ul fraksiyon nükleer pelet (P1) yeniden süspanse edin. Not: (P1) fraksiyonu -80 ° C'de saklandı ve çekirdek kısmının Western blot analizi için kullanılabilir.
Ham sinaptosomal Kesir 5. Zenginleştirme (Getirileri Pelet P2)
- 4 ° C'de 15 dakika boyunca 10,000 x g'de süpernatan (S1) santrifüjleyin. Bir mikrosantrifüj tüpü içinde 500 ul daha sonra da protein kant boyunca -80 ° C'de saklamak için bir süpernatan (S2) ve rezerv kaldırUS-PS ve sitosolik / hafif membran fraksiyonunun western lekeleme analizi. 0.32 M HEPES-tamponlu sukroz çözeltisi 1 ml geri kalan ham sinoptozomal fraksiyonu pelet (P2) yeniden süspanse edin ve daha sonra başka bir 3 mi 0.32 M HEPES-tamponlu sükroz solüsyonunu ilave edin.
- 4 ° C'de 15 dakika boyunca 10,000 x g'de santrifüjleyin. Daha sonra da protein miktar ve sitosolik / hafif membran fraksiyonunun Western blot analizi için -80 ° C'de saklamak için bir mikrosantrifüj tüpü içinde bir süpernatan (S2 ') ve rezerv 500 ul çıkarın. Polipropilen tüp içinde yıkanmıştır Ham sinaptozomal pelet (P2) kaydedin.
Ham sinaptosomal Kesir 6. Parçalama (Hypoosmotic Şok)
- GKD 2 O, 1 ml olarak yeniden süspanse edilerek polipropilen tüp içinde lize Ham sinaptozomal pelet (P2 ') GKD 2 O başka bir 3 mi, 3 darbelerle elle bir cam-teflon homojenizatör doku transfer ve homojenize ekleyin. NOT: Bu önemlidirçabuk mümkün olduğunca hızlı bu adımı gerçekleştirmek ve 6.2 adıma geçin.
- Tekrar aynı 13 mi polipropilen tüp içine hızla homojenleştirici transfer örnekler 1 M HEPES çözeltisi 16 ul geri 4 mM HEPES numunenin ayarlamak karıştırmak için ters.
- 30 dakika tam yok edilmesi sağlamak için 4 ° C'de örnekleri döndürün.
Sinaptosomal Membran Kesir 7. Zenginleştirme (P3)
- 4 ° C'de 20 dakika boyunca 25,000 x g'de santrifüjleyin. Ham yüzer kısım veziküler (S3) sökülmesi ve daha sonra da protein ölçülmesi ve Western blot analizi için -80 ° C'de saklamak için 5 ml'lik bir tüp içinde tutar. 0.32 M HEPES-tamponlu sukroz çözeltisi 1 ml sinaptosomal membran fraksiyonu (P3) yeniden süspanse edin.
Sürekli olmayan, sukroz gradyanlı 8. hazırlanması
- Pipet tam 3.5 ml 1.2 M HEPES-tamponlu sükroz solüsyonu ve tam 3.0 ml her 1.0 M ve 0.8 M HIPE arasındaAyrı 6 ml S-tamponlu sakaroz çözüm kap tüpleri oturtun. Not: Bu sakroz gradyanı yapmak için kullanılan tamponların hacimleri önceden ölçülmesi için yapılır. Hacimlerinin kesin ölçüm çıkan geçişlerini ultrasantrifiij için dengeli olacak sağlamak için önemlidir.
- Bir cam Pasteur pipet ve ampul kullanarak, 12 ml poliallomer ultrasantrifüjdeki tüp 1.2 M HEPES-tamponlu sakaroz çözeltisini aktarın. Dikkatle 1.2 M HEPES-tamponlu sakaroz çözeltisinin üstünde 1.0 M HEPES-tamponlu sükroz çözeltisi tabaka. Son olarak, 1.0 M HEPES-tamponlu sakaroz çözeltisinin üstünde 0.8 M HEPES-tamponlu sükroz çözeltisi tabaka. Her sakaroz çözüm için taze bir Pastör pipet kullanın ve sakaroz degrade bozmamaya özen gösterin. Bir tezgah girdabı veya mikrosantrifüjden titreşimler degrade bütünlüğünü rahatsız edecektir.
- Pasteur pipeti kullanılarak, hazırlanan süreksiz sukroz gradyanın tepesinde yeniden süspansiyon haline getirilmiş sinaptosomal membran fraksiyonu (P3) katmanı.Geçişlerini sallanan bir kova rotor kova içinde onları tartarak dengeli olduğundan emin olun. Kovalar dengeli değilse, dikkatli rotor kova degrade üstüne 0.32 M HEPES-tamponlu sükroz eklemek ve dengelemek için bir P200 pipetlemeyin kullanın.
Synaptic Plazma Membran 9. Fraksiyonu (SPM)
- 4 ° C'de 2 saat boyunca 150,000 x g hızında bir sallanan kepçeli rotor içinde Ultrasantrifüj. Dikkatle ultrasantrifüjdeki kovalar sakaroz geçişlerini çıkarın. Bir 18 G iğne ve 1 ml'lik bir şırıngayı kullanarak, 1.0 M / 1.2 M HEPES-tamponlu sukroz çözeltisi interfaz altındaki tüp delinme ve sinaptik plazma membran tabakası (SPM) geri.
- Her SPM numune 1 ml şırınga kapladığı hacim not edin. Her örnek ayarlamak olmuştur sonra tam 4 mM HEPES 2.5 hacim 0.32 M'ye 1.2 M den sakaroz konsantrasyonunu ayarlamak eklemek, 3.5 ml kalın duvar ultrasantrifüjdeki tüplerde toplanan SPM katmanı yerleştirinEd, 0.32 M sukroz, 0.32 M HEPES-tamponlu sukroz çözeltisi ile boru denge.
- 4 ° C'de 30 dakika boyunca 200,000 x g'de bir sabit açılı rotor Ultrasantrifüj. Çıkarın ve süpernatant atın. 50 mM HEPES / 2 mM EDTA çözeltisi 300 ul plazma zarı sinaptik pelet (SPM) yeniden süspanse edin. -80 ° C'de saklayın örnekleri batı lekeleme için kullanılana kadar.
Yoğunluk postsinaptik Fraksiyon 10. Hazırlama (PSD)
- Buz üzerinde SPM örnekleri çözülme.
- 50 mM HEPES / 2 mM EDTA çözelti içinde% 0.54 Triton X-100 ihtiva eden bir çözelti yapın.
- 5 ml'lik bir tüp içinde polistiren, Triton X-100 / HEPES / EDTA çözeltisi ve 300 ul fraksiyon SPM 2,7 mi birleştirmek ve 4 ° C'de 15 dakika boyunca örnek döndürmek
- 4 ° C'de 20 dakika boyunca 32,000 x g 'de 3.5 ml, kalın duvarlı bir ultra santrifüj tüpleri ve santrifüj örnekleri transfer örnekleri.
- -80 ° C'de bir süpernatan (Triton X-100 çözünür fraksiyon [TS]) ve mağaza ayıracağı; ° C. NOT: Bu aşamada, topak "PSD-1T" bölümünü temsil eder. Deterjan ile bir ikinci işlem bir "PSD-2T" fraksiyonu üretecektir. PSD-1T fraksiyonu isteniyorsa, 10,6 adıma geçin.
- PSD-2T kısmını üretmek için, 50 mM HEPES / 2 mM EDTA çözeltisi içinde 3 mi% 0.5 Triton X-100 pelet yeniden süspanse edin. 4 ° C'de 15 dakika boyunca numune döndürün. 4 ° C'de 20 dakika boyunca 32.000 x g'de santrifüje örnekleri ve 10,6 adıma devam edin.
- Süpernatantı atın ve 50 mM HEPES / 2 mM EDTA çözeltisi postsinaptik (PSD) pelletini. Not: yeniden süspansiyon hacmi topağın boyutuna bağlı olabilir; 50-75 ul bir hacim önerilir. PSD fraksiyon deterjan çözünmeyen fraksiyon olduğu için, proteinin tam olarak yeniden süspansiyon sağlamak için,% 0.5 SDS 1-2 ul ilave edilmesi çoğunlukla gereklidir. -80 ° C'de saklayın örnekleri batı lekeleme için kullanılana kadar.
Sonuçlar
Sükroz yoğunluk gradyanı preparasyonu sukroz (0.8, 1.0 ve 1.2 M sükroz) üç mol çözümler net bir ayrım ile sonuçlanmalıdır. Protein numunesi ilave edilmeden önce, gradyanın bir örnek için bakınız Şekil 3A. Degrade önceden çok hazırlanır, ya da diğer ekipmanların gelen titreşim ile bir tezgah yüzeyi üzerinde hazırlanmış ise, degrade tehlikeye olacak ve uygun ayırma elde edilemez olacaktır. Üç çözümler net bir ayrım görünür değilse, bu protein örneği eklemeden önce, yeni bir gradyanı yapılması tavsiye edilir. Sukroz aşamasına göre, protein numune ilave edilir (siyah ok) bir örnek için bakınız Şekil 3B.
Santrifüjlemeyi takiben, her bir ara yüzeyinde protein fraksiyonlarının açık bant olmalıdır (0.32 / 0.8 / 1.0 0.8, 1.0 / 1.2). Buna ek olarak, bir pelet, tüpün alt kısmında görünür olmalıdır. Bir örnek olarak Şekil 3CUltrasantrifüje edildikten sonra fraksiyon bantların. Fraksiyonlar sadece interfaz diffüz varsa, bu gradyan tatlıya ve ileri işleme tavsiye edilmez olasıdır.
Fare striatum toplam SPM ve PSD1T protein örneklerinin western lekelenmesi, Şekil 2'de gösterilmiştir. GluR1, PSD95 ve CaMKII gibi sinaptik proteinlerin zenginleştirme toplam SPM protein (10 ug) sabit bir miktarının yatırılması ile görselleştirilebilir , ve PSD kesirler. Dopamin taşıyıcısı (DAT) gibi perisynaptic proteinler SPM fraksiyonunda zenginleştirilmiş, ancak PSD zenginleştirme sürecinin müteakip deterjan adımlarla elimine edilir.
Eşdeğer yükleme sağlamak için, protein düzeylerinin büyük Ponceau Kırmızı 26 ile lekeleme ile western lekeleme zar üzerinde görüntülenebilir. Antikor bazlı "yükleme kontrol" sık sık literatürde rapor edilmiştir, ancak sinaptik proteinler fark olabilir çünkü bu yanlış isim olabilir,erentially deneysel tedavi gruplarında düzenlenir. Bir antikor-bazlı "yükleme kontrol" isteniyorsa, ilk olarak Ponceau lekelemesi ile eşdeğer bir protein yükleme belirlenmesi ve daha sonra, farklı deney gruplarında değişiklik anlardır tanımlamak için çeşitli referans protein test edilmesi önerilir.
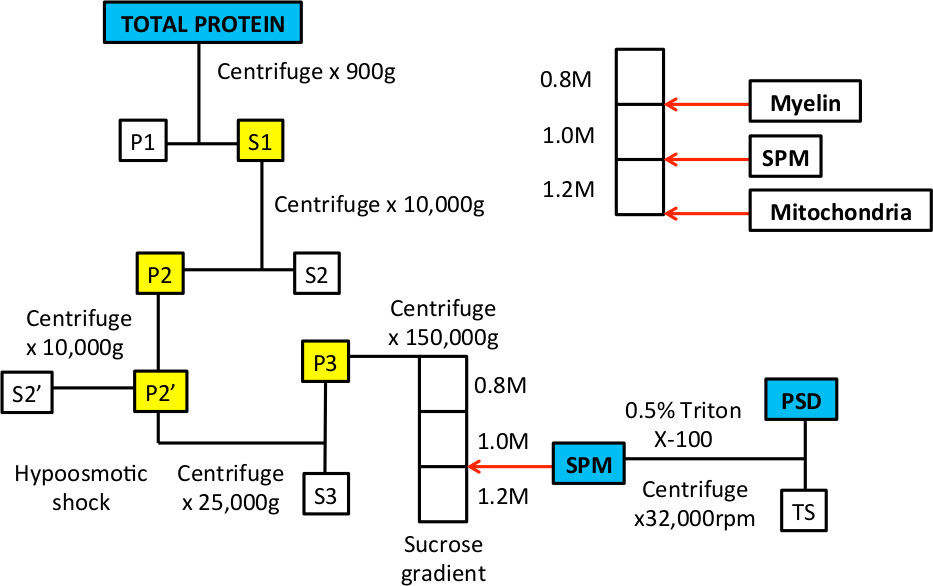
Subselüler fraksiyonasyonunun Şekil 1. İş Akışı SPM ve PSD protein fraksiyonları zenginleştirmek.

Fare striatum Şekil 2. Temsilcisi batı toplam SPM leke ve PSD1T protein. Protein ekstresi ug SDS-kaybetmesinden çözüldü 10,% 10 akrilikamid jelleri, ve PVDF zarlarına transfer edilir. Daha sonra, bu lekeleri, sinaptik-sonrası yoğunluk bileşenlerdir αCaMKII, GluR1 PSD-93 ve PSD-95 için primer antikorlar ile inkübe edildi. Bu duruma göre, bu proteinlerin, SPM ve PSD fraksiyonlar açısından zenginleştirilmiştir. Alternatif olarak, lekeler striatumda presinaptik zarlarında bulunmaktadır DAT için bir birincil antikor ile enkübe edildi. DAT SPM fraksiyonu bakımından zengin iken, bu PSD kompleksinin bir parçası değildir ve imünoreaktivite PSD fraksiyonunda gözlenmez. Bazı deney koşulları hem de bu proteinlerin düzeyini etkileyebilir, ancak, aktin ya da sodyum / potasyum ATPaz (Na / K pompası) karşı antikorlar, yükleme kontrol olarak kullanılabilir ve böylece uygun yükleme kontrol deneysel olarak tespit edilmelidir.

Şekil 3. sukroz gradyanı temsili örnekleri arasında önce ve ultra-santrifüj sonrası. Gradyan hazırlanır C. sonra, tüp ışığa tutulduğu zaman, üç faz görebilir olmalıdır. Beyaz oklar 0.8 / 1.0 M sukroz çözümler ve 1.0 / 1.2 M sukroz çözümler arasındaki interfazda göstermektedir. B. Örnek gradyanın tepesinde yüklendiğinde, bir 0.32 M sukroz çözeltisinde ve 0.8 üst kısmına gelir M sükroz katmanı. C'de santrifüje edilmesinden sonra, homojenat pek çok fraksiyona ayırmak olur. 0.8 / 1.0 M sukroz solüsyonunun interfaz yüzen fraksiyon miyelin zarlarında zengin olacak. 1.0 / 1.2 M sukroz solüsyonunun interfaz fraksiyon bir iğne ve şırınga ile toplanır SPM fraksiyonu temsil eder. Tüpün alt Topak mitokondriyal protein için zenginleştirilmiştir.
| Soluyonlar | HEPES-tamponlu sakaroz | Proteaz inhibitörleri | * Fosfataz inhibitörleri |
| 1 M HEPES pH 7.4 | 0.32 M sukroz, 4 mM HEPES (pH 7.4) içinde | 0.25 PMSF (etanol içinde 250 mM, 1,000x) | 10 mM Sodyum Florür (stok 500 mM, 50x) |
| 4 mM HEPES pH 7.4 | 0.8 M sukroz, 4 mM HEPES (pH 7.4) içinde | 1.5 ug / ml aprotinin (stok 1.5 mg / ml 1,000x) | 2.5 mM Sodyum Pirofosfat (stok 250 mM, 100x) |
| GKD 2 O | 1.0 M sukroz, 4 mM HEPES (pH 7.4) içinde | 10 ug / ml Löpeptin (stok 10 mg / ml 1,000x) | 1.0 mm B-gliserolfosfat (stok 200 mM, 200x) |
| 50 mM HEPES (pH 7.4), 2 mM EDTA | 1.2 M sukroz, 4 mM HEPES (pH 7.4) içinde | 0.1 mg / ml benzamidin (stok 100 mg / ml 1,000x) | 5.0mM sodyum ortovanadat (stok 500 mM, 100x) |
| 10 ug / ml Pepstatin (stoku, 5 mg / mL etanol içinde, 500x) |
Tablo 1. Gerekli Reaktifler
| Fraksiyon | Protein parçası | Protein işaretleyici |
| P1 | nükleer | histon H1 27 |
| S1 | Sitosol / membranlar | calnexin 28 (endoplazmik retikulum), a-tubulin 29 (iskeleti), GAPDH 30 (sitosol), 58K Golgi Proproteindir 31 (Golgi aygıtı) |
| , P2 ve P2 ' | Ham sinaptozomlar | AMPA ve NMDA reseptör alt birimleri 32 |
| S2 ve S2 ' | Sitosol / hafif membranlar | nNOS1 29 (sitosol), GAPDH (sitosol), LAMP1 33 (lizozom), PEX14 34 (peroksizom) |
| P3 | sinaptosom / mitokondri | SSVD 35 (mitokondri), AMPA ve NMDA reseptör alt birimleri (sinaptosom) |
| S3 | sinaptik vezikül | SV2 8, sinaptofizin 8 |
| 0.8 M / 1.0M | m Yelin | miyelin temel proteini 36 |
| , 1.0 M / 1.2 M | SPM | AMPA ve NMDA reseptör alt birimleri, presinaptik işaretleyici (SNAP25 8), neurexin 32, 32 neuroligin |
| 1,2 MP | mitokondri | SSVD 35 |
| PSD (1T) | PSD | PSD93 32, PSD95 32 AMPA ve NMDA reseptör alt birimleri, neuroligin, PICK1 32, 32 CaMKII |
| TS | presinaptik membranlar | SNAP25, Munc18 37, Fagot 38, neurexin |
| zenginleştirilmiş PSD | PSD95 AMPA ve NMDA reseptör alt birimleri, PICK1, CaMKII |
Protein markerleri Tablo 2. listesi sub-hücresel fraksiyonları ayırmak
Tartışmalar
Başarılı bir sonuç için kritik olan prosedür birkaç adım vardır. 3. adımda, bu homojenleştirme tutarlı bir derecesi, her bir numune için elde edilmesi önemlidir. Motor tahrikli homojenleştirici ile dokuyu, bir homojenizatör zaman, sabit hız havan eli döndürülmesi için değil, aynı zamanda vuruş sayısı ile de kullanılmaktadır. Hipotonik bir solüsyon içerisinde uzun bir homojen hale getirme ya da mitokondri lize edildi ve inkübasyon SPM örneği kontamine çünkü ozmotik şok, inkübasyon süresi, kesin olmalıdır.
Diğer bir kritik adım reaktifler, özellikle sukroz solüsyonunun hazırlanmasında olduğu; sakaroz çözeltisinin molaritesi yanlış ise, prosedür çalışmaz. Bu nedenle, sükroz çözeltiler, daha sonra kesin nihai hacme 4 mM HEPES ilave 4 mM HEPES çözelti içinde eritilmesi, sükroz tartılarak hazırlanmalıdır. Sorun giderme ipucu: tr için hazırlanan sakaroz çözümleri ile bir test degrade oluşturmakdegrade düzgün monte emin olun. Bromofenol mavisi arasında değişen konsantrasyonlarda üç sukroz solüsyonunun iki ya da üç farklı katmandan görselleştirilmesine yardımcı olmak için (% 0.005 ağırlık / hacim olarak% -0.02, örneğin, nihai konsantrasyon) ilave edin.
Bu degrade monte edildiğinde ve tüpler santrifüjlenmiş zaman arasında geçen zaman miktarını azaltmak için çok önemlidir. Normal difüzyon zamanla degrade yok edecek, ve degrade saklandığı bankta titreşim varsa bu hızlanır. Hassas hacimleri cam Pasteur pipet ile pipetlenebilir için ayrı kısma çözümleri Öncesi pipetleme sağlar. Bu aynı zamanda gradyan toplanma ve Ultrasantrifügasyon arasındaki süreyi azaltır. Sorun ipucu: deney için sukroz dereceleri ile aynı zamanda, yukarıda tarif edildiği gibi bromofenol mavi boyası ile bir "test gradyanı" oluştururlar. Degrade bütünlüğü böylece zamanla izlenebilir. Test degrade bir olarak hizmet verecekdifüzyon göstergesi geçişlerini çok önceden monte edilir ya da titreşime maruz kalırsanız.
Son olarak, bu da daha sonra su ile 2.5 hacim numunesinin seyreltilmesi için gerekli olmadığından, mümkün olduğu kadar küçük bir hacim içinde SPM örnek toplamak için önemlidir. İdeal olarak, numune, 1 cc şırınga kullanılarak 0.4-0.7 ml lik bir hacim içinde toplanmalıdır. Bu degrade montaj ve Ultrasantrifügasyon arasındaki zamanı sınırlamak için 7. adımda son 20 dakika spin sırasında süreksiz geçişlerini oluşturmak için tavsiye edilir.
Protokol farklı parçacıkların her ayırmak ve bir sonraki analiz için -80 ° C'de bu depolamak için tavsiye içermektedir. Biz, bu kısımların sadece birkaç Şekil 2'de post-sinaptik proteinlerin zenginleştirme göstermiştir. Bununla birlikte betonun kendi dağıtım anlamak için fraksiyonların her bir proteinin-faiz seviyelerini ölçmek için tavsiye edilir. Distrib Karşılaştırılmasıdiğer alt-hücresel işaretleme proteinleri fraksiyonların bir proteinin Katkı da deney koşulları, arzu edilen bir fraksiyonlanma elde onaylamak için yardımcı olacaktır. Tablo 2 paylarına ayırma aşamaları göstergeleri olarak kullanılabilen yaygın olarak kullanılan protein belirleyicisi özetlemektedir 8,27- 38.
Kesikli sükroz gradyanı Kullanımı çok sinaptik plazma zarları zenginleştirmek için kullanılır. Bu yöntem yapmak daha kolay ve özel ekipman gerektirmeyen süreksiz sakaroz geçişlerini sürekli Perkol geçişlerini üzerinde bir avantaja sahiptir. Bununla birlikte, bu yöntem tam olarak ilgili bir proteini lokalize etmek için yeterli olmayabilir, ve bu uygulamalar için bir Percoll tercih edilebilir.
Açıklamalar
The authors have no conflicts of interest to disclose.
Teşekkürler
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
Referanslar
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır