Method Article
إعداد متشابك غشاء البلازما والبروتينات الكثافة بعد المشبكي باستخدام التدرج السكروز متقطع
* These authors contributed equally
In This Article
Summary
تفاصيل هذه المادة في إثراء البروتينات المرتبطة متشابك غشاء البلازما بواسطة تنبيذ فائق على التدرج السكروز متقطع. كما يوصف إعداد لاحق من البروتينات كثافة بعد متشابك. الاستعدادات البروتين هي مناسبة لالنشاف الغربي أو تحليل 2D DIGE.
Abstract
تقنيات تجزئة التحت خلوية العصبية تسمح الكمي من البروتينات التي يتم الاتجار من وإلى المشبك. كما هو موضح في الأصل في أواخر عام 1960، البروتينات المرتبطة متشابك غشاء البلازما يمكن عزلها بواسطة تنبيذ فائق على التدرج كثافة السكروز. مرة واحدة يتم عزل الأغشية متشابك، مجمع الجزيئات المعروفة باسم الكثافة آخر متشابك يمكن عزل لاحقا بسبب إينسولوبيليتي المنظفات لها. لا تزال التقنيات المستخدمة لعزل أغشية البلازما والبروتينات متشابك كثافة بعد متشابك في الأساس نفسه بعد 40 عاما، وتستخدم على نطاق واسع في أبحاث علم الأعصاب الحالي. تفاصيل هذه المقالة تجزئة البروتينات المرتبطة متشابك غشاء البلازما وكثافة بعد متشابك يستخدم التدرج السكروز متقطع. مما أدى الاستعدادات البروتين هي مناسبة لالنشاف الغربي أو تحليل 2D DIGE.
Introduction
الخلايا العصبية التواصل من خلال نقاط الاشتباك العصبي، وينظم نوعية هذا التواصل إلى حد كبير تغييرات في تكوين البروتينات في المشبك. على وجه الخصوص، والبروتينات الموجودة في كثافة بعد متشابك تشارك في الاتصالات العصبية من مستقبلات الناقل العصبي السقالات وثيق مع أنظمة نقل الإشارة الخاصة بهم 1. وعلاوة على ذلك، يتم التحكم التغييرات دائمة في قوة فعالية متشابك من خلال إضافة أو إزالة مستقبلات في كثافة بعد متشابك 1-6. ولذلك، فإن العزلة والكمي للبروتينات متشابك هي تقنية ضرورية ومفيدة لاكتساب نظرة ثاقبة الطرق أن الخلايا العصبية تستجيب للمنبهات وتغيير فعالية متشابك 7. توضح هذه المقالة تقنية شائعة لعزل البروتينات متشابك من أنسجة الدماغ عن طريق القوارض تنبيذ فائق على التدرجات السكروز متقطع. في جزء متشابك غشاء البلازما يمكن إثراء والمعزولة على أساسكثافته في السكروز، والتي تم تحديدها تجريبيا لتكون مشابهة إلى 1.2 M السكروز.
اعتمادا على هذه المسألة البيولوجية، والكسور التحت خلوية يمكن فصلها عن طريق التدرجات مستمرة أو متقطعة إما السكروز أو Percoll. التدرجات مستمرة تسمح لفصل البروتينات إلى كسور متعددة؛ هذا يمكن أن يكون مفيدا بشكل خاص للتدليل على المشاركة في توطين البروتينات داخل جزء معين 8. ومع ذلك، فإن إعداد التدرجات مستمرة أكثر شاقة وغير ضروري للعديد من التطبيقات. التدرجات متقطعة هي أسهل نسبيا للتحضير، ويمكن استخدامها لفصل البروتينات إلى بضع، والكسور يعرف عموما. التدرجات المتقطعة التي تتألف من ثلاث طبقات السكروز زيادة المولية وقد استخدمت على نطاق واسع لعزل البروتينات المرتبطة متشابك غشاء البلازما (SPM). هذا جزء متشابك غشاء البلازما يمكن معالجتها إلى مزيد من fractio كثافة بعد متشابكن (PSD) عن طريق العلاج المنظفات وعزل جزء المنظفات غير قابلة للذوبان.
عندما كان أول وصف هذه العملية في 9،10 في عام 1960، تم استخدام المجهر الإلكتروني لإثبات عضيات والأغشية التي تحدد تقريبا غشاء البلازما متشابك والكسور كثافة بعد متشابك 9-14. وأظهرت هذه الدراسات إدراج الأغشية قبل وبعد متشابك والحويصلات المشبكية في جزء SPM. بعد العلاج المنظفات في المقام الأول على الإلكترون الكثيفة، كانت كثافة بعد متشابك مرئية. في الإجراء، يتم استخدام صدمة ناقص التوتر لقرصة قبالة عمليات متشابك من خلايا الجسم 10. هذه الخطوة يستفيد من حقيقة أن الميتوكوندريا هي أكثر مقاومة للصدمة التناضحي وتبقى سليمة، وحتى الرواسب في قاع التدرج السكروز (الشكل 1).
باستخدام هذه التقنية نفس تخصيب، كانت SPM وPSD الكسور أولا كيميائيايحددها الكهربائي هلام بولي أكريلاميد وتسلسل مكونات البروتين الرئيسية 15-17. وقد استخدم تحليل لطخة الغربي في وقت لاحق لكشف وقياس مستويات البروتينات متشابك وتحديد هذه الكسور أكثر (الشكل 2). وقد استخدمنا هذه التقنية في مختبراتنا لقياس التغيرات في مستويات متشابك من نقل الدوبامين التي تحدث عند تكرار موضع Slc6a3 في الفئران 18. وقد استخدمنا هذه التقنية أيضا في NMDA مستقبلات الفئران ناقصة لكشف المشبك تخفيضات محددة في البروتينات التي هي جزء من interactome DISC1 19.
ويتضح من تحليل لطخة غربية أن الكسور SPM تحتوي على البروتينات متشابك غشاء الحويصلة، وعلامات دخلول؛ جسيم داخلي، بروتينات الميتوكوندريا، غشاء المرتبطة الاصطناعية الانزيمات والجزيئات نقل الإشارة، فضلا عن عناصر لا تتجزأ من كثافة بعد متشابك والأغشية البلازما متشابك 20-23. Eيمكن الكسور PSD فين يكون التلوث مع بروتينات الميتوكوندريا وفيرة، وأنه قد يكون من الضروري إجراء الترسيب التدرج الثاني أو خطوات تنقية إضافية لإزالتها 13. مؤخرا، قدمت الطيف الكتلي الكمي قائمة تضم أكثر من 100 البروتينات في كثافة بعد متشابك وحدها، وكذلك مؤشرا على الوفرة النسبية لهذه المكونات 24،25.
Protocol
بروتوكول التالية يتوافق مع المبادئ التوجيهية للمجلس الكندي للرعاية الحيوان وتمت الموافقة من قبل كلية الطب والصيدلة جنة رعاية الحيوان في جامعة تورونتو.
1. إعداد الكواشف المطلوبة كما هو موضح في الجدول 1
- إضافة البروتيني والفوسفاتيز (إذا لزم الأمر) مثبطات لجميع الحلول السكروز، ومخازن وDDH 2 O بتركيزات المبينة في الجدول 1. هام: إجراء كافة الخطوات في 4 درجات مئوية وباردة قبل كل من الكواشف والمعدات قبل بدء التجربة. تسمية جميع الأنابيب، بما في ذلك أنابيب نابذة فائقة السرعة، مع علامة دائمة.
2. تشريح منطقة الدماغ المناسبة
- التضحية الحيوانية خلع عنق الرحم أو قطع الرأس. المنزل والموت ببطء الحيوانات وفقا للسياسات المؤسسية والحكومية في رعاية الحيوان.
- بسرعة إزالة عشرالبريد الدماغ من الجمجمة ومكان على كتلة تشريح المبردة.
- تشريح الدماغ المنطقة المناسبة من الأنسجة الطازجة والمضي قدما إلى الخطوة 3.
3. الأنسجة التجانس مع بالمواتير الزجاج تفلون الخالط
- وضع 50-100 ملغ (للSPM)، أو 100-200 ملغ (للPSD) من الأنسجة تشريح في صفت 13 مل أنبوب البولي بروبلين التي تحتوي على 4 مل من محلول السكروز 0.32 M HEPES مخزنة. نقل العينة إلى 15 مل مدبب الأنسجة الزجاجية تفلون طاحونة / الخالط، تعيين محرك السيارات إلى 900 دورة في الدقيقة (وضع 7) والتجانس العينة مع 12 السكتات الدماغية على مدى فترة 30 ثانية. استخدام مختلف الخالط الزجاج تفلون بين العينات، أو شطف الخالط بالماء البارد المقطر بين العينات ويمسح الجافة مع Kimwipe. ملاحظة: ما يصل إلى 4 غرام من الأنسجة يمكن المتجانس في 4 مل من محلول السكروز 0.32 M HEPES مخزنة، ومع ذلك فإنه من المستحسن استخدام الأنسجة أقل لضمان تجزئة المناسبة.
- نقل العينة المتجانس الظهر ريا نفس 13 مل أنبوب البولي بروبلين. الاحتياطي 100 ميكرولتر من جناسة وتخزينها في -80 درجة مئوية لاحق الكمي البروتين وتحليل لطخة الغربي من إجمالي نسبة البروتين.
4. انخفاض سرعة الطرد المركزي لإزالة جزء النووي (العائد طاف S1)
- الطرد المركزي جناسة في الدوار زاوية ثابتة عند 900 x ج لمدة 10 دقيقة في 4 درجات مئوية. نقل طاف (S1) الى مستوى جديد، وصفت أنبوب 13 مل و resuspend بيليه جزء النووي (P1) في 500 ميكرولتر من السكروز 0.32 M HEPES مخزنة. ملاحظة: يمكن تخزين (P1) جزء في -80 درجة مئوية وتستخدم في تحليل لطخة الغربي من جزء النووي.
5. تخصيب جزء من الخام Synaptosomal (العائد بيليه P2)
- أجهزة الطرد المركزي لطاف (S1) في 10،000 x ج لمدة 15 دقيقة على 4 درجات مئوية. إزالة طاف (S2) واحتياطي 500 ميكرولتر في أنبوب microcentrifuge لتخزين في -80 درجة مئوية لاحقة البروتين ضليع في الرياضياتification وتحليل لطخة الغربي من عصاري خلوي / ضوء جزء الغشاء. Resuspend والمتبقية synaptosomal الخام جزء بيليه (P2) في 1 مل من محلول السكروز 0.32 M HEPES مخزنة ثم قم بإضافة حل آخر 3 مل من السكروز 0.32 M HEPES مخزنة.
- الطرد المركزي في 10،000 ز س لمدة 15 دقيقة في 4 درجات مئوية. إزالة طاف (S2 ") واحتياطي 500 ميكرولتر في أنبوب microcentrifuge لتخزين في -80 درجة مئوية لاحق الكمي البروتين وتحليل لطخة الغربي من عصاري خلوي / ضوء جزء الغشاء. حفظ غسلها synaptosomal الخام بيليه (P2 ') في أنبوب البولي بروبلين.
6. Lysing (Hypoosmotic صدمة) من الكسر الخام Synaptosomal
- ليز بيليه synaptosomal الخام (P2 ') في أنبوب البولي بروبلين عن طريق إعادة التعليق في 1 مل من DDH 2 O. إضافة 3 مل أخرى من DDH 2 O، ونقل إلى الأنسجة الخالط الزجاج تفلون، والتجانس باليد مع 3 السكتات الدماغية. ملاحظة: من المهملتنفيذ هذه الخطوة بأسرع وقت ممكن وبسرعة انتقل إلى الخطوة 6.2.
- نقل عينات من الخالط مرة أخرى في نفس 13 مل أنبوب البولي بروبلين وبسرعة ضبط العينة إلى 4 ملي HEPES مع 16 ميكرولتر من 1 M HEPES الحل، عكس إلى المزيج.
- تدوير العينات عند 4 درجة مئوية لمدة 30 دقيقة لضمان lysing كاملة.
7. تخصيب جزء من غشاء Synaptosomal (P3)
- الطرد المركزي في 25،000 ز س لمدة 20 دقيقة في 4 درجات مئوية. إزالة وطاف جزء الحويصلي الخام (S3) نحتفظ في أنبوب 5 مل لتخزين في -80 درجة مئوية لاحق الكمي البروتين وتحليل لطخة الغربي. Resuspend وجزء الغشاء synaptosomal (P3) في 1 مل من محلول السكروز 0.32 M HEPES مخزنة.
8. إعداد متقطع التدرج السكروز
- الماصة بالضبط 3.5 مل من محلول السكروز 1.2 M HEPES مخزنة وبالضبط 3.0 مل كل من 1.0 و 0.8 M M HEPEمخزنة S حل السكروز منفصلة في 6 مل المفاجئة أنابيب الغطاء. ملاحظة: يتم ذلك إلى ما قبل قياس حجم المخازن المؤقتة التي تستخدم لجعل التدرج السكروز. القياس الدقيق لحجم مهم لضمان التدرجات الناتجة سوف تكون متوازنة لتنبيذ فائق.
- باستخدام الزجاج باستور الماصة ومصباح، ونقل 1.2 M-مخزنة HEPES حل السكروز إلى 12 مل أنبوب polyallomer نابذة فائقة السرعة. طبقة بعناية الحل السكروز 1.0 M HEPES مخزنة على رأس من الحل السكروز 1.2 M HEPES مخزنة. أخيرا، طبقة الحل السكروز 0.8 M HEPES مخزنة على رأس من الحل السكروز 1.0 M HEPES مخزنة. استخدام الماصة باستور جديدة لكل حل السكروز والحرص على عدم تعكير صفو التدرج السكروز. سوف الاهتزازات من دوامة مقاعد البدلاء أو ميكروسنتريفوج تخل سلامة التدرج.
- باستخدام الماصة باستور، طبقة كسر الغشاء synaptosomal معلق (P3) على رأس التدرج السكروز متقطع استعداد.تأكد من أن التدرجات ومتوازنة من وزنها لهم داخل دلو من الدوار الدلو المتأرجح. إذا الدلاء ليست متوازنة، واستخدام الماصة P200 لإضافة بعناية السكروز 0.32 M HEPES مخزنة إلى الجزء العلوي من التدرج وتحقيق التوازن بين الدلاء الدوار.
9. تجزئة من غشاء البلازما متشابك (SPM)
- نابذة فائقة السرعة في دلو الدوار يتأرجح في 150،000 x ج لمدة 2 ساعة في 4 درجات مئوية. إزالة بعناية التدرجات السكروز من الدلاء نابذة فائقة السرعة. باستخدام إبرة 18 G وحقنة 1 مل، ثقب أنبوب في الجزء السفلي من 1.0 م / 1.2 M HEPES مخزنة محلول السكروز البيني وسحب طبقة غشاء البلازما متشابك (SPM).
- جعل علما وحدة التخزين التي تحتل كل عينة SPM في حقنة 1 مل. وضع طبقة SPM جمعها في 3.5 مل سميكة الجدران أنابيب نابذة فائقة السرعة، إضافة بالضبط حجم 2.5 من 4 ملي HEPES لضبط تركيز السكروز من 1.2 متر إلى 0.32 م مرة واحدة وقد تم ضبط كل عينةإد إلى 0.32 M السكروز، وتوازن الأنابيب مع حل السكروز 0.32 M HEPES مخزنة.
- نابذة فائقة السرعة في الدوار زاوية ثابتة في 200،000 x ج لمدة 30 دقيقة على 4 درجات مئوية. إزالة وتجاهل طاف. Resuspend وبيليه متشابك غشاء البلازما (SPM) في 300 ميكرولتر من 50 ملي HEPES / 2 ملي EDTA الحل. تخزين العينات في -80 درجة مئوية حتى استخدامها لالنشاف الغربي.
10. إعداد جزء الكثافة بعد المشبكي (PSD)
- ذوبان الجليد عينات SPM على الجليد.
- جعل محلول 0.54٪ تريتون X-100 في 50 ملي HEPES / 2 ملي EDTA الحل.
- في أنبوب 5 مل البوليسترين، والجمع بين 2.7 مل من تريتون X-100 / HEPES / حل EDTA و 300 ميكرولتر SPM جزء وتدوير العينة لمدة 15 دقيقة على 4 ° C
- نقل العينات إلى 3.5 مل أنابيب نابذة فائقة السرعة سميكة الجدار وعينات الطرد المركزي في 32،000 x ج لمدة 20 دقيقة على 4 درجات مئوية.
- حجز طاف (تريتون X-100 للذوبان جزء [TS]) وتخزينها في -80، ° C. ملاحظة: في هذه المرحلة، يمثل بيليه في "PSD-1T" الكسر. وهناك العلاج الثانية مع المنظفات إنتاج "PSD-2T" الكسر. إذا كان المطلوب جزء PSD-1T، انتقل إلى الخطوة 10.6.
- لإنتاج جزء PSD-2T، resuspend الكرية في 3 مل من 0.5٪ تريتون X-100 في 50 ملي HEPES / 2 الحل ملي EDTA. تدوير عينات لمدة 15 دقيقة في 4 درجات مئوية. عينات من أجهزة الطرد المركزي في 32،000 x ج لمدة 20 دقيقة في 4 درجة مئوية، وانتقل إلى الخطوة 10.6.
- تجاهل طاف و resuspend بعد المشبكي (PSD) بيليه في 50 ملي HEPES / 2 ملي EDTA الحل. ملاحظة: قد يتوقف حجم إعادة تعليق على حجم الكرية. ويوصى حجم 50-75 ميكرولتر. لأن جزء مديرية الأمن العام هو جزء المنظفات غير قابلة للذوبان، فمن الضروري في كثير من الأحيان لإضافة 1-2 ميكرولتر من 0.5٪ SDS لتمكين إعادة تعليق كامل للبروتين. تخزين العينات في -80 درجة مئوية حتى استخدامها لالنشاف الغربي.
النتائج
إعداد التدرج كثافة السكروز ينبغي أن يؤدي إلى فصل واضح من الحلول الثلاثة المولي من السكروز (0.8، 1.0، و 1.2 M السكروز). انظر الشكل 3A للحصول على مثال التدرج قبل إضافة عينة البروتين. إذا تم إعداد التدرج كثيرا مقدما، أو إذا تم إعداده على سطح مقاعد البدلاء مع الاهتزاز من المعدات الأخرى، سوف يثير الشبهة ولن يتحقق الفصل السليم التدرج. إذا فصل واضح من الحلول الثلاثة غير مرئي، فإنه من المستحسن لجعل التدرج الجديد قبل إضافة عينة البروتين. انظر الشكل 3B للحصول على مثال التدرج السكروز عند إضافة العينة البروتين (السهم الأسود).
بعد الطرد المركزي، ينبغي أن يكون هناك فرق واضح من الكسور البروتين في كل البيني (0.32 / 0.8، 0.8 / 1.0، 1.0 / 1.2). وبالإضافة إلى ذلك ينبغي أن يكون بيليه مرئية في الجزء السفلي من الأنبوب. انظر الشكل 3C للحصول على مثالجزء من العصابات بعد تنبيذ فائق. إذا الكسور موجودة منتشرة في الطور البيني فقط، فمن المرجح أن التدرج تعرض للخطر وليس ينصح مزيد من المعالجة.
ويتجلى النشاف الغربي من الكل، SPM والبروتين PSD1T عينات من الماوس المخطط في الشكل 2. وإثراء البروتينات متشابك مثل GluR1، PSD95، وكمكي، يمكن تصور عن طريق تحميل كمية ثابتة من البروتين (10 ميكروغرام) من المجموع، SPM ، والكسور مديرية الأمن العام. يتم إثراء البروتينات Perisynaptic مثل نقل الدوبامين (DAT) في جزء SPM، ولكن خرج من المنظفات الخطوات اللاحقة في عملية تخصيب مديرية الأمن العام.
لضمان تحميل ما يعادلها، ومستويات البروتين يمكن تصور على الغشاء طخة الغربي من تلطيخ مع الشقائقية الأحمر 26. وكثيرا ما ذكرت "الضوابط تحميل" القائم على الأجسام المضادة في الأدب، ولكن هذا قد يكون تسمية خاطئة منذ البروتينات متشابك قد يكون فرقينظم erentially في مجموعات العلاج التجريبي. إذا كان المطلوب على "السيطرة تحميل" القائم على الأجسام المضادة، فإنه من المستحسن أن أولا تحديد ما يعادل البروتين تحميل بواسطة الشقائقية تلطيخ، ومن ثم اختبار عدة بروتينات إشارة إلى تحديد تلك التي لا تتغير في المجموعات التجريبية المختلفة.
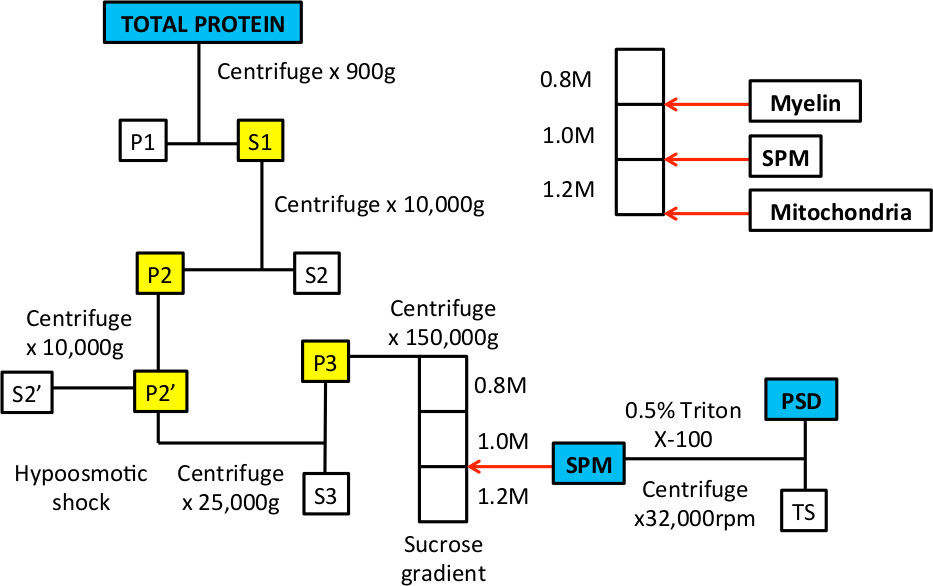
الرقم 1. سير العمل من تجزئة التحت خلوية لإثراء SPM وكسور البروتين مديرية الأمن العام.

الشكل 2. صمة عار التمثيلية الغربية من الكل، SPM، والبروتين PSD1T من الماوس المخطط. تم حل 10 ميكروغرام من استخراج البروتين في SDS-تغيير طبيعة، 10٪ الاكريليكالأميد المواد الهلامية، ونقل إلى الأغشية PVDF. بعد ذلك حضنت هذه البقع مع الأجسام المضادة الأولية لαCaMKII، GluR1، PSD-93، وPSD-95، وهي كلها مكونات كثافة بعد متشابك. وفقا لذلك، يتم إثراء هذه البروتينات في SPM والكسور مديرية الأمن العام. بالتناوب، وحضنت البقع مع الأجسام المضادة الأولية لDAT، الذي يقع في أغشية قبل المشبكي في المخطط. في حين تم تخصيب DAT في جزء SPM، فإنه ليس جزءا من مجمع PSD، وليس لوحظ مناعية في جزء مديرية الأمن العام. الأجسام المضادة ضد الأكتين أو الصوديوم / البوتاسيوم أتباز (نا / K مضخة) يمكن استخدام الضوابط تحميل، على الرغم من بعض الظروف التجريبية قد تؤثر على مستويات هذه البروتينات وكذلك ولذا يجب أن تحدد السيطرة تحميل المناسبة تجريبيا.

الرقم 3. أمثلة التمثيلية للالتدرج السكروز قبل وبعد تنبيذ فائق. A. بعد إعداد التدرج، ينبغي أن يكون هناك ثلاث مراحل التي هي واضحة عند عقد أنبوب يصل إلى النور. الأسهم البيضاء تشير إلى الطور البيني بين 0.8 / 1.0 M حلول السكروز و1.0 / 1.2 M حلول السكروز. B. عندما يتم تحميل العينة على رأس التدرج، هو في حل السكروز 0.32 M وستقع على رأس 0.8 M طبقة السكروز. C. بعد الطرد المركزي، فإن جناسة فصل إلى عدة كسور. سيتم إثراء جزء عائم في الطور البيني من 0.8 / 1.0 M حلول السكروز في الأغشية المايلين. الكسر في الطور البيني من 1.0 / 1.2 M حلول السكروز يمثل جزء SPM التي يتم تجميعها مع إبرة وحقنة. وأثرى بيليه في أسفل الأنبوب للبروتينات الميتوكوندريا.
| SOLUستعقد | السكروز HEPES مخزنة | مثبطات الأنزيم البروتيني | * مثبطات Phophatase |
| 1 M HEPES الرقم الهيدروجيني 7.4 | 0.32 M السكروز في 4 ملي HEPES (7.4 درجة الحموضة) | 0.25 ملي PMSF (250 ملي الأسهم في الإيثانول، 1،000x) | 10 ملي فلوريد الصوديوم (الأسهم 500 ملم، 50X) |
| 4 ملي HEPES الرقم الهيدروجيني 7.4 | 0.8 M السكروز في 4 ملي HEPES (7.4 درجة الحموضة) | 1.5 ميكروغرام / مل أبروتينين (الأسهم 1.5 ملغ / مل، 1،000x) | 2.5 ملي الصوديوم بيروفوسفيت (الأسهم 250 ملم، 100X) |
| DDH 2 O | 1.0 M السكروز في 4 ملي HEPES (7.4 درجة الحموضة) | 10 ميكروغرام / مل Leupeptin (الأسهم 10 ملغ / مل، 1،000x) | 1.0 ملي ب-غليسروفسفات (الأسهم 200 ملم، 200X) |
| 50 ملي HEPES (الرقم الهيدروجيني 7.4) 2 ملي EDTA | 1.2 M السكروز في 4 ملي HEPES (7.4 درجة الحموضة) | 0.1 ملغ / مل Benzamidine (الأسهم 100 ملغ / مل، 1،000x) | 5.0ملي الصوديوم Orthovanadate (الأسهم 500 ملم، 100X) |
| 10 ميكروغرام / مل Pepstatin (الأسهم 5 ملغ / مل في الإيثانول، 500X) |
الجدول 1. المطلوبة الكواشف
| جزء | نسبة البروتين | علامة البروتين |
| P1 | النووية | هيستون H1 27 |
| S1 | العصارة الخلوية / الأغشية | calnexin 28 (شبكية هيولي باطني)، وتويولين 29 (الهيكل الخلوي)، GAPDH 30 (العصارة الخلوية)، 58K جولجي المواليةبروتين 31 (جهاز جولجي) |
| P2 وP2 " | synaptosomes الخام | أمبا ومستقبلات NMDA مفارز 32 |
| S2 و S2 " | العصارة الخلوية / الأغشية الخفيفة | nNOS1 29 (العصارة الخلوية)، GAPDH (العصارة الخلوية)، LAMP1 33 (يحلول)، PEX14 34 (تاكسدي) |
| P3 | جسيم مشبكي / الميتوكوندريا | VDAC 35 (الميتوكوندريا)، أمبا وNMDA مفارز مستقبلات (جسيم مشبكي) |
| S3 | حويصلة متشابك | SV2 8، 8 synaptophysin |
| 0.8 M / M 1.0 | م يلين | البروتين الأساسي المايلين 36 |
| 1.0 M / M 1.2 | SPM | أمبا ومستقبلات NMDA مفارز، علامة قبل المشبكي (SNAP25 8)، neurexin 32، neuroligin 32 |
| 1.2 MP | الميتوكوندريا | VDAC 35 |
| PSD (1T) | PSD | PSD93 32، PSD95 32، أمبا ومستقبلات NMDA مفارز، neuroligin، PICK1 32، كمكي 32 |
| TS | أغشية قبل المشبكي | SNAP25، Munc18 37، الباسون 38، neurexin |
| PSD المخصب | PSD95، أمبا ومستقبلات NMDA مفارز، PICK1، كمكي |
الجدول 2. قائمة من علامات البروتين للتمييز الكسور التحت خلوية
Discussion
هناك العديد من الخطوات في الإجراء التي تعتبر بالغة الأهمية لتحقيق نتيجة ناجحة. في الخطوة 3، فمن المهم أن يتم التوصل إلى درجة من التجانس متسقة لكل عينة. عندما المجانسة الأنسجة مع بالمواتير الخالط، ويستخدم بسرعة ثابتة ليس فقط بالنسبة للدوران مدقة، ولكن أيضا مع عدد من السكتات الدماغية. فترة حضانة خلال صدمة التناضحي يجب أن يكون دقيقا، لأن التجانس الموسعة أو الحضانة في محلول ناقص التوتر وليز الميتوكوندريا وتلوث العينة SPM.
خطوة حاسمة أخرى هي في إعداد الكواشف، وخاصة حلول السكروز. إذا كان المولية من الحل السكروز غير صحيح فإن الإجراء لا تعمل. ولذلك، ينبغي عن طريق وزن السكروز، حل في 4 ملي HEPES حل ثم إضافة 4 ملي HEPES إلى الحجم النهائي الدقيق إعداد حلول السكروز. استكشاف الأخطاء وإصلاحها نصيحة: بناء الانحدار اختبار مع حلول السكروز مستعدة لENتأكد أن التدرج يتم تجميعها بشكل صحيح. إضافة تركيزات مختلفة من برموفينول الأزرق (على سبيل المثال، تركيز النهائي من 0.005٪ -0.02٪ ث / ت) لاثنين من السكروز ثلاثة حلول للمساعدة في التصور من ثلاث طبقات متميزة.
من المهم للحد من مقدار الوقت بين عندما يتم تجميع التدرج وعندما يتم طرد الأنابيب. سيتم نشر العادي تدمير التدرج مع مرور الوقت، وهذا هو تسارع إذا كان هناك اهتزاز على مقاعد البدلاء حيث يتم تخزين التدرج. قبل pipetting لمن الحلول الفردية إلى مأخوذة يسمح لكميات دقيقة إلى أن pipetted مع الماصة الزجاج باستور. هذا أيضا يقلل من الوقت بين التجمع وتنبيذ فائق التدرج. استكشاف الأخطاء وإصلاحها نصيحة: بناء "اختبار التدرج" مع برموفينول صبغة زرقاء كما هو موضح أعلاه في نفس الوقت التدرجات السكروز للتجربة. وهكذا يمكن رصد سلامة التدرج مع مرور الوقت. سوف التدرج الاختبار بمثابةمؤشر الانتشار إذا يتم تجميع التدرجات بعيدا جدا مقدما أو يتعرضون للاهتزاز.
أخيرا، من المهم لجمع العينة في SPM صغير كوحدة تخزين ممكن، لأنه من الضروري في وقت لاحق لتمييع العينة مع 2.5 كميات من الماء. من الناحية المثالية ينبغي جمع عينة في حجم 0.4-0.7 مل باستخدام حقنة سم مكعب 1. فإنه من المستحسن لبناء التدرجات متقطعة خلال المباراة النهائية 20 دقيقة تدور في الخطوة 7 للحد من الوقت بين التجمع وتنبيذ فائق التدرج.
ويشمل البروتوكول على توصية لحجز كل من كسور مختلفة وتخزين هذه في -80 درجة مئوية لتحليلها لاحقا. لقد أثبتنا في إثراء البروتينات آخر متشابك في الشكل 2 فقط في عدد قليل من هذه الكسور. ومع ذلك، فإنه من المستحسن لقياس مستويات من البروتين من الفائدة في كل من الكسور لفهم التوزيع. مقارنة DISTRIBسوف ution من البروتين في الكسور مع غيرها من البروتينات علامة التحت خلوية تساعد أيضا للتأكد من أن الظروف التجريبية حققت تجزئة المطلوب. يلخص الجدول 2 علامات البروتين شائعة الاستخدام التي يمكن استخدامها كمؤشرات لمراحل تجزئة 8،27- 38.
ويستخدم على نطاق واسع استخدام التدرج السكروز متقطع لإثراء أغشية البلازما متشابك. هذا الأسلوب له ميزة على التدرجات Percoll مستمرة في هذا التدرجات السكروز متقطعة هي أسهل لجعل ولا تتطلب معدات متخصصة. ومع ذلك، وهذه الطريقة قد لا تكون كافية لتوطين بالضبط بروتين من الفائدة، وهذه التطبيقات قد يفضل التدرج Percoll.
Disclosures
The authors have no conflicts of interest to disclose.
Acknowledgements
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
Materials
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
References
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved