Method Article
Vorbereitung der synaptischen Plasmamembran und Postsynaptische Dichte Proteinen mit einer diskontinuierlichen Saccharosegradienten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt die Anreicherung von Proteinen mit den synaptischen Plasmamembran durch Ultrazentrifugation auf einem diskontinuierlichen Saccharosegradienten verbunden. Die anschließende Herstellung der postsynaptischen Dichte Proteine wird ebenfalls beschrieben. Proteinpräparate eignen sich für Western-Blot-oder 2D-DIGE-Analyse.
Zusammenfassung
Neuronale subzellulärer Fraktionierung Techniken erlauben die Quantifizierung von Proteinen, die in und aus der Synapse gehandelt werden. Wie ursprünglich in den späten 1960er Jahren beschrieben, können Proteine, die mit den synaptischen Plasmamembran assoziiert durch Ultrazentrifugation auf einem Saccharose-Dichtegradienten isoliert werden. Sobald synaptischen Membranen isoliert werden, kann der makromolekularen Komplex postsynaptischen Dichte bekannt anschließend aufgrund seiner Unlöslichkeit Reinigungsmittel isoliert werden. Die zur synaptischen Plasmamembranen und postsynaptischen Dichte Proteine zu isolieren Techniken im Wesentlichen gleich bleiben nach 40 Jahren, und sind weit verbreitet in der aktuellen neurowissenschaftlichen Forschung. Dieser Artikel beschreibt die Fraktionierung von Proteinen mit der synaptischen Plasmamembran und postsynaptischen Dichte mit einem diskontinuierlichen Saccharosegradienten verbunden. Resultierenden Proteinpräparate eignen sich für Western-Blot-oder 2D-DIGE-Analyse.
Einleitung
Neuronen kommunizieren über Synapsen und die Qualität dieser Kommunikation wird durch Veränderungen in der Zusammensetzung der Proteine an der Synapse weitgehend reguliert. Insbesondere die Proteine in der postsynaptischen Dichte liegt in der neuronalen Kommunikation teilnehmen, die durch inniges Gerüst Neurotransmitter-Rezeptoren mit ihren Signalübertragungssysteme 1. Weiterhin sind dauerhafte Änderungen in der Stärke der synaptischen Wirksamkeit durch Zugabe oder Entfernung von Rezeptoren an der postsynaptischen Dichte 1-6 gesteuert. Daher ist die Isolierung und Quantifizierung der synaptischen Proteinen eine notwendige und nützliche Technik, um einen Einblick in die Möglichkeiten, die Nervenzellen reagieren auf Reize und verändern synaptischen Wirksamkeit 7 zu gewinnen. Dieser Artikel beschreibt eine übliche Technik, synaptischen Proteinen aus Hirngewebe von Nagern durch Ultrazentrifugation auf diskontinuierlichen Saccharose-Gradienten zu isolieren. Die synaptischen Plasmamembranfraktion angereichert und isoliert werden, basierend aufseine Dichte in Saccharose, die empirisch bestimmt worden ist, ähnlich zu 1,2 M Saccharose ist.
Je nachdem welche biologischen Frage kann subzellulären Fraktionen durch kontinuierlichen oder diskontinuierlichen Gradienten von Saccharose oder Percoll getrennt werden. Kontinuierlichen Gradienten ermöglichen die Trennung von Proteinen in mehrere Fraktionen; Dies kann besonders nützlich sein, um die Co-Lokalisierung von Proteinen in einer gegebenen Fraktion 8 zeigen. Jedoch ist die Herstellung von kontinuierlichen Gradienten mühsamer und unnötig für viele Anwendungen. Diskontinuierlichen Gradienten vergleichsweise leichter herzustellen und kann verwendet werden, um Proteine in wenigen, allgemein definierten Fraktionen zu trennen. Diskontinuierlichen Gradienten, der aus drei Schichten von Saccharose Erhöhung Molarität bestehen in großem Umfang verwendet, um Proteine, die mit den synaptischen Plasmamembran (SPM) zugeordnet isolieren. Diese synaptischen Plasmamembranfraktion kann weiter auf der postsynaptischen Dichte fractio verarbeitet werdenn (PSD) durch Detergensbehandlung und Isolierung der Waschmittel-unlöslichen Fraktion.
Wenn dieses Verfahren wurde zuerst in den 1960er Jahren 9,10 beschrieben wurde Elektronenmikroskopie verwendet, um die Organellen und Membranen, die in etwa definieren die synaptischen Plasmamembran und postsynaptischen Dichte Fraktionen 9-14 demonstrieren. Diese Studien zeigten, die Aufnahme von prä-und postsynaptischen Membranen und synaptischen Vesikeln in der SPM-Fraktion; nach Detergens-Behandlung vor allem die Elektronendichte, waren postsynaptischen Dichten sichtbar. In dem Verfahren wird ein hypotonischen Schock verwendet, um aus dem Zellkörper 10 abzuklemmen die synaptischen Prozessen. Dieser Schritt nutzt die Tatsache, dass Mitochondrien sind resistenter gegen osmotischen Schock und intakt bleiben, so dass sie an der Unterseite des Saccharosegradienten (Figur 1) zu sedimentieren.
Mit dem gleichen Anreicherungstechnik, waren die SPM und PSD-Fraktionen erste biochemischdurch Polyacrylamid-Gelelektrophorese und Sequenzierung der Hauptproteinkomponenten 15-17. Anschließend Western Blot-Analyse wurde verwendet, um zu detektieren und zu quantifizieren, die Pegel der synaptischen Proteinen und definieren diese Fraktionen weiter (Figur 2). Wir haben diese Technik in unseren Laboratorien verwendet, um Änderungen in der synaptischen Ebenen der Dopamin-Transporter, wenn das SLC6A3-Locus in der Maus 18 doppelt auftreten, zu quantifizieren. Wir haben auch diese Technik in NMDA-Rezeptor-defizienten Mäusen verwendet, um Synapse-spezifische Verringerung der Proteine, die Teil des DISC1 Interaktom 19 aufzudecken.
Es ist aus Western-Blot-Analyse, die SPM Fraktionen enthalten synaptische Vesikel Membranproteine, Endosomen-Marker, mitochondriale Proteine, membranassoziierten synthetische Enzyme und Signaltransduktion Moleküle sowie als integrierte Komponenten der postsynaptischen Dichte und synaptischen Plasmamembranen 20-23. Even PSD Fraktionen Kontamination mit reichlich mitochondriale Proteine und es kann notwendig, um einen zweiten Gradienten Sedimentation oder zusätzliche Reinigungsschritte durchzuführen, um diese 13 zu entfernen. Kürzlich wurde die quantitative Massenspektrometrie eine Liste von über 100 Proteinen in der postsynaptischen Dichte allein, sowie einen Hinweis auf die relative Menge dieser Komponenten 24,25 vorgesehen.
Protokoll
Das folgende Protokoll entspricht den Richtlinien des Canadian Council der Tierpflege und wurde von der Fakultät für Medizin und Pharmazie Animal Care Committee an der Universität von Toronto genehmigt worden.
1. Bereiten Sie benötigten Reagenzien, wie in Tabelle 1 beschrieben,
- Hinzufügen Protease und Phosphatase (falls erforderlich) Inhibitoren für alle Saccharoselösungen, Puffer und ddH 2 O, die in Tabelle 1 angegebenen Konzentrationen. Wichtig: Führen alle Schritte bei 4 ° C und vor-kühlen alle Reagenzien und Ausrüstung vor dem Start des Experiments. Kennzeichnen Sie alle Rohre, einschließlich Ultrazentrifuge Rohre, mit Permanentmarker.
2. Präparation der entsprechende Hirnregion
- Opfern das Tier durch Genickbruch oder Enthauptung. Haus und einschläfern Tiere in Einklang mit den institutionellen und Regierungspolitik auf die Tierpflege.
- Schnell zu entfernen the Gehirn aus dem Schädel und Platz auf einer gekühlten Dissektion Block.
- Präparieren Sie die entsprechende Hirnregion aus frischem Gewebe und fahren Sie mit Schritt 3 fort.
3. Gewebehomogenisierung mit Motor Driven Glas-Teflon-Homogenisator
- Zeigen 50-100 mg (für SPM) oder 100-200 mg (PSD) des sezierten Gewebe in einem markierten 13 ml Polypropylen-Röhrchen mit 4 ml 0,32 M HEPES-gepufferte Saccharose-Lösung. Übertragen Sie die Probe in ein 15 ml Glas-Kegel Teflon Gewebemühle / Homogenisator, stellen Sie den Motorantrieb bis 900 Umdrehungen pro Minute (Stufe 7) und homogenisieren die Probe mit 12 Schlägen über einen Zeitraum von 30 Sekunden. Verwenden Sie eine andere Glas-Teflon-Homogenisator zwischen den Proben, oder spülen Sie den Homogenisator mit kaltem destilliertem Wasser zwischen den Proben und wischen Sie mit einem trockenen Kimwipe. HINWEIS: Bis zu 4 g Gewebe kann in 4 ml 0,32 M HEPES-gepufferten Saccharoselösung homogenisiert werden jedoch ratsam, weniger Gewebe verwenden, um die richtige Fraktionierung gewährleisten, ist es.
- Übertragen Sie die Probe homogenisiert zurück to die gleiche 13 ml Polypropylen-Röhrchen. Reserve 100 ul Homogenat und bei -80 ° C für die anschließende Proteinquantifizierung und Western-Blot-Analyse des Gesamtproteinfraktion.
4. Zentrifugation bei niedriger Geschwindigkeit, um die Kernfraktion entfernen (Renditen Überstand S1)
- Zentrifuge das Homogenat in einem Festwinkelrotor bei 900 × g für 10 min bei 4 ° C ist. Den Überstand (S1) zu einem neuen, markierten 13-ml-Röhrchen und resuspendieren Kernfraktion Pellet (P1) in 500 ul 0,32 M HEPES-gepufferter Saccharose. HINWEIS: Die (P1) Fraktion kann bei -80 ° C gelagert und für die Western-Blot-Analyse der Kernfraktion benutzt werden.
5. Anreicherung des Crude Synaptosomale Fraktion (Pellet Renditen P2)
- Zentrifugieren der Überstand (S1) bei 10.000 × g für 15 min bei 4 ° C ist. Entfernen Sie den Überstand (S2) und Reserve 500 ul in einem Mikrozentrifugenröhrchen bei -80 ° C für die spätere Protein Quant speichernkation und Western-Blot-Analyse der cytosolischen / Licht Membranfraktion. Resuspendieren verbleibende rohe synaptosomale Fraktion Pellet (P2) in 1 ml 0,32 M HEPES-gepufferter Saccharose-Lösung und dann einen weiteren 3 ml 0,32 M HEPES-gepufferter Saccharose-Lösung.
- Zentrifuge bei 10.000 x g für 15 min bei 4 ° C ist. Den Überstand (S2) und Reserve 500 ul in einem Mikrozentrifugenröhrchen bei -80 ° C für die anschließende Proteinquantifizierung und Western-Blot-Analyse der cytosolischen / Licht Membranfraktion zu speichern. Speichern Sie die gewaschene rohe synaptosomale Pellet (P2 ') in der Polypropylen-Röhrchen.
6. Lysing (Hypoosmotische Shock) der rohen Synaptosomale Fraktion
- Lyse der rohe synaptosomale Pellet (P2 ') in Polypropylenröhrchen durch Resuspendieren in 1 ml ddH 2 O. Fügen Sie weitere 3 ml ddH2O, Transfer zu einem Glas-Teflon-Gewebe-Homogenisator und homogenisieren von Hand mit 3 Schlägen. HINWEIS: Es ist wichtig,diesen Schritt so schnell wie möglich durchzuführen und schnell gehen Sie zu Schritt 6.2.
- Übertragungs Proben aus dem Homogenisator in denselben 13 ml Polypropylenröhrchen und schnell einstellen Probe wieder auf 4 mM HEPES mit 16 ul 1 M HEPES-Lösung zum Mischen umgekehrt.
- Drehen Proben bei 4 ° C für 30 Minuten, um eine vollständige Lyse sicherzustellen.
7. Anreicherung des Synaptosomale Membranfraktion (P3)
- Zentrifuge bei 25.000 x g für 20 min bei 4 ° C ist. Entfernen des rohen vesikulären Fraktion Stand (S3) und behalten sie in einem 5-ml-Röhrchen bei -80 ° C für die anschließende Proteinquantifizierung und Western-Blot-Analyse zu speichern. Resuspendieren synaptosomalen Membranfraktion (P3) in 1 ml 0,32 M HEPES-gepufferter Saccharose-Lösung.
8. Vorbereitung der diskontinuierlichen Saccharosegradienten
- Pipette genau 3,5 ml 1,2 M HEPES-gepufferter Saccharose-Lösung und exakt 3,0 ml von 1,0 M und 0,8 M HEPES-gepufferte Saccharose-Lösung in separate 6 ml Snap Cap Röhren. ANMERKUNG: Dies geschieht vor Messung der Volumina der Puffer, die verwendet werden, um den Saccharose-Gradienten bilden. Genaue Messung der Volumina ist wichtig, um sicherzustellen, dass die resultierenden Verläufe für Ultrazentrifugation ausgeglichen werden.
- Mit einer Glaspasteurpipette und Birne, übertragen 1.2 M HEPES-gepufferten Saccharoselösung zu den 12 ml Polyallomer Ultrazentrifugenröhrchen. Schicht sorgfältig die 1,0 M HEPES-gepufferter Saccharose-Lösung auf der Oberseite der 1,2 M HEPES-gepufferter Saccharose-Lösung. Schließlich Schicht das 0,8 M HEPES-gepufferter Saccharose-Lösung auf der Oberseite der 1,0 M HEPES-gepufferter Saccharose-Lösung. Verwenden Sie eine frische Pasteur-Pipette für jedes Saccharose-Lösung und kümmern uns nicht um die Saccharose-Gradienten zu stören. Vibrationen von einer Bank oder Mikrowirbel wird die Integrität des Gradienten zu stören.
- Verwendung einer Pasteur-Pipette resuspendiert Schicht die synaptosomale Membranfraktion (P3) auf der Oberseite des vorbereiteten diskontinuierlichen Saccharosegradienten.Stellen Sie sicher, dass die Gradienten durch Wiegen sie in den Eimer des Schwingbecherrotor ausgeglichen. Wenn die Eimer nicht ausgeglichen sind, verwenden Sie ein P200-Pipette vorsichtig hinzufügen 0,32 M HEPES-gepufferte Saccharose an die Spitze des Gradienten und das Gleichgewicht der Rotorschaufeln.
9. Fraktionierung der synaptischen Plasmamembran (SPM)
- Ultrazentrifuge in einem Schwingbecher-Rotor bei 150.000 × g für 2 h bei 4 ° C ist. Die Saccharose-Gradienten vorsichtig aus dem Eimer Ultrazentrifuge. Verwendung einer 18 G-Nadel und einer 1 ml-Spritze durchstoßen das Rohr an der Unterseite der 1,0 M / 1,2 M HEPES-gepufferter Saccharose-Lösung Interphase und zieht die synaptischen Plasmamembranschicht (SPM).
- Notieren Sie sich die Lautstärke, die jedes SPM Probe in der 1 ml Spritze einnimmt. Legen Sie die gesammelten SPM Schicht in 3,5 ml dickwandigen Rohren Ultrazentrifuge, fügen Sie genau 2,5 Volumen 4 mM HEPES, um die Saccharose-Konzentration von 1,2 m bis 0,32 M. einstellen Sobald jeder Probe wurde einstellened auf 0,32 M Saccharose, mit 0,32 M HEPES-gepufferte Saccharose-Lösung das Gleichgewicht der Rohre.
- Ultrazentrifuge in einem Festwinkelrotor bei 200.000 × g für 30 min bei 4 ° C ist. Entfernen und entsorgen Sie den Überstand. Resuspendieren synaptischen Plasmamembranpellet (SPM) in 300 ul 50 mM HEPES / 2 mM EDTA-Lösung. Proben bei -80 ° C bis zur Western-Blot verwendet.
10. Herstellung der postsynaptischen Dichte Fraktion (PSD)
- Auftauen SPM Proben auf Eis.
- Machen Sie eine Lösung von 0,54% Triton X-100 in 50 mM HEPES / 2 mM EDTA-Lösung.
- In einem 5 ml-Polystyrolröhrchen, kombinieren 2,7 ml Triton X-100 / HEPES / EDTA-Lösung und 300 ul SPM Fraktion und Drehen der Probe für 15 min bei 4 ° C
- Übertragungs Proben zu 3,5 ml dickwandiger Rohre Ultrazentrifuge und Zentrifugenproben bei 32.000 × g für 20 min bei 4 ° C ist.
- Reservieren Sie den Überstand (Triton X-100 löslichen Fraktion [TS]) und bei -80, ° C. HINWEIS: In dieser Stufe wird das Pellet stellt die "PSD-1T" Fraktion. Eine zweite Behandlung mit Reinigungsmittel ein "PSD-2T" Fraktion zu produzieren. Wenn eine PSD-1T-Fraktion gewünscht wird, gehen Sie zu Schritt 10.6.
- Um ein PSD-2T Fraktion produzieren, das Pellet in 3 ml 0,5% Triton X-100 in 50 mM HEPES / 2 mM EDTA-Lösung. Drehen Proben für 15 min bei 4 ° C ist. Zentrifugieren Sie die Proben bei 32.000 g für 20 min bei 4 ° C und gehen Sie zu Schritt 10.6.
- Überstand verwerfen und resuspendieren postsynaptischen (PSD) Pellet in 50 mM HEPES / 2 mM EDTA-Lösung. HINWEIS: Die Resuspension Volumen kann von der Größe der Pellets ab; ein Volumen von 50-75 ul empfohlen. Weil der PSD-Fraktion eine Waschmittel-unlöslichen Fraktion, ist es oft notwendig, 1-2 ul 0,5% SDS in den vollständigen Resuspendierung des Proteins zu ermöglichen. Proben bei -80 ° C bis zur Western-Blot verwendet.
Ergebnisse
Die Vorbereitung der Saccharosedichtegradienten sollten in einer klaren Trennung der drei Mol-Lösungen von Saccharose (0,8, 1,0 und 1,2 M Saccharose) führen. Siehe 3A ein Beispiel des Verlaufs bevor die Proteinprobe zugegeben. Wenn der Gradient zu viel im Voraus vorbereitet, oder wenn es auf einer Arbeitsfläche, mit Vibrationen von anderen Geräten hergestellt, wird der Gradient verglichen werden kann und korrekte Trennung nicht erreicht werden. Wenn eine klare Trennung der drei Lösungen nicht sichtbar ist, ist es ratsam, einen neuen Farbverlauf vor der Zugabe der Proteinprobe zu machen. Siehe 3B ein Beispiel für die Saccharose-Gradienten, wenn die Proteinprobe zugegeben (schwarzer Pfeil).
Nach der Zentrifugation, sollte es klare Banden von Proteinfraktionen an jeder Zwischenphase sein (0,32 / 0,8, 0,8 / 1,0, 1,0 / 1,2). Zusätzlich sollte ein Pellet am Boden des Röhrchens angezeigt. Siehe 3C ein Beispielder Bruchbänder nach Ultrazentrifugation. Wenn Fraktionen sind nur diffus an der Interphase vorhanden ist, ist es wahrscheinlich, dass der Gradient wurde kompromittiert und Weiterverarbeitung wird nicht empfohlen.
Western-Blot von Gesamt, SPM und PSD1T Proteinproben aus der Maus striatum wird in Abbildung 2 gezeigt. Anreicherung von synaptischen Proteinen wie GluR1, PSD95 und CaMKII, kann durch Laden einer konstanten Menge an Protein (10 ug) von insgesamt SPM sichtbar gemacht werden, und PSD-Fraktionen. Perisynaptic Proteinen wie den Dopamin-Transporter (DAT) in der SPM-Fraktion angereichert ist, sind jedoch in den nachfolgenden Schritten des Waschmittel PSD Anreicherungsprozess eliminiert.
Um äquivalente Belastung zu gewährleisten, können Proteinspiegel auf der Western-Blot-Membran durch Färben mit Ponceau Rot 26 visualisiert werden. Antikörper-basierte "Ladekontrollen" sind oft in der Literatur berichtet, aber das kann irreführend sein, da synaptischen Proteine können diff seinerentially in experimentellen Behandlungsgruppen geregelt. Wenn ein Antikörper-basierte "Ladekontrolle" gewünscht wird, ist es ratsam, zuerst festzustellen, gleichwertige Eiweißbelastung durch Ponceau-Färbung, und testen Sie dann mehrere Referenz Proteine an diejenigen, die nicht in den verschiedenen Versuchsgruppen nicht verändern zu identifizieren.
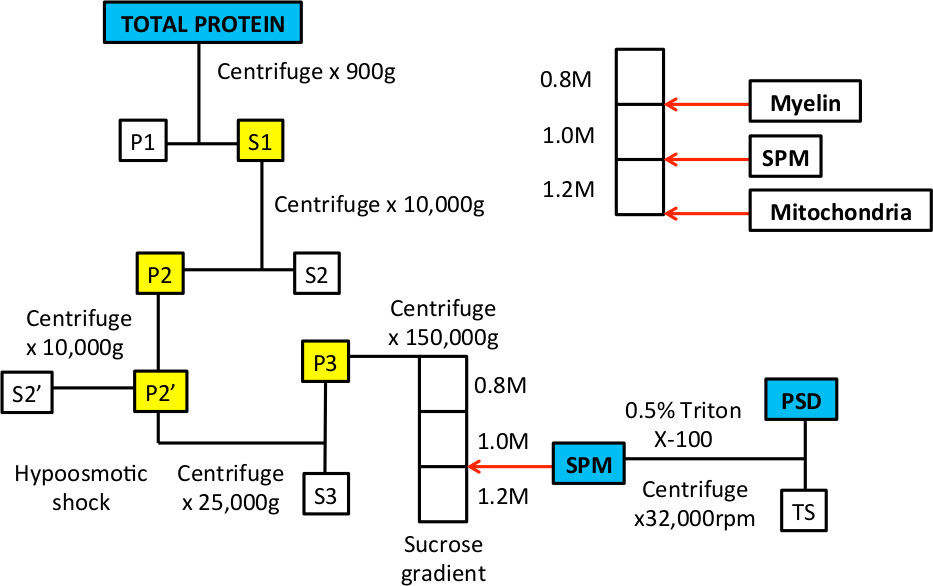
Abbildung 1. Workflow-subzellulärer Fraktionierung zu SPM und PSD Proteinfraktionen zu bereichern.

Abbildung 2. Repräsentative Western-Blot von Gesamt, SPM, und PSD1T Protein aus der Maus Striatum. 10 ug Proteinextrakt wurden auf SDS-Denaturierung gelöst, 10% AcrylAmid-Gelen und auf PVDF-Membranen transferiert. Anschließend werden diese Blots wurden mit primären Antikörpern für αCaMKII, GluR1, PSD-93 und PSD-95, die alle Komponenten der postsynaptischen Dichte inkubiert. Daher werden diese Proteine in der SPM und PSD Fraktionen angereichert. Alternativ wurden die Blots mit einem primären Antikörper für DAT, die in der präsynaptischen Membranen im Striatum wird inkubiert. Während DAT in der SPM-Fraktion angereichert ist, ist es nicht Teil des PSD-Komplex und Immunoreaktivität nicht in der PSD-Fraktion beobachtet. Antikörper gegen Actin oder Natrium / Kalium-ATPase (Na / K-Pumpe) als Ladesteuerungen verwendet werden, obwohl einige experimentelle Bedingungen können die Mengen dieser Proteine als auch beeinflussen und so muss die entsprechende Ladesteuerung empirisch bestimmt werden.

Figur 3. Repräsentative Beispiele von Saccharose-Gradienten vor und nach Ultrazentrifugation. A. Nach der Gradient hergestellt wird, sollte es drei Phasen, die sichtbar sind, wenn das Rohr gegen das Licht gehalten werden. Die weißen Pfeile zeigen die Interphase zwischen 0,8 / 1,0 M Saccharoselösung und 1,0 / 1,2 M Saccharoselösung B. Wenn die Probe an der Spitze des Gradienten geladen, es ist in einer 0,32 M Saccharoselösung und auf der Oberseite der 0,8 Ruhe M Saccharose-Schicht. C. Nach der Zentrifugation wird das Homogenat in mehrere Fraktionen zu trennen. Der Anteil an der schwimmenden Interphase von 0,8 / 1,0 M Saccharose-Lösungen werden in Myelinmembranen angereichert werden. Der Anteil an der Interphase von 1,0 / 1,2 M Saccharose-Lösungen stellt die SPM-Fraktion, die mit einer Nadel und einer Spritze gesammelt. Das Pellet am Boden des Röhrchens für mitochondriale Proteine bereichert.
| Solugen | HEPES-gepufferter Saccharose | Protease-Inhibitoren | * Phosphatase-Inhibitoren |
| 1 M HEPES pH 7,4 | 0,32 M Saccharose in 4 mM HEPES (pH 7,4) | 0,25 mM PMSF (Lager 250 mM in Ethanol, 1,000x) | 10 mM Natriumfluorid (Lager 500 mm, 50x) |
| 4 mM HEPES pH 7,4 | 0,8 M Saccharose in 4 mM HEPES (pH 7,4) | 1,5 ug / ml Aprotinin (Aktien 1,5 mg / ml, 1,000x) | 2,5 mM Natriumpyrophosphat (Lager 250 mm, 100x) |
| ddH2O | 1,0 M Saccharose in 4 mM HEPES (pH 7,4) | 10 ug / ml Leupeptin (Lager 10 mg / ml, 1,000x) | 1,0 mm b-Glycerophosphat (Lager 200 mm, 200x) |
| 50 mM HEPES (pH 7,4), 2 mM EDTA | 1,2 M Saccharose in 4 mM HEPES (pH 7,4) | 0,1 mg / ml Benzamidin (Lager 100 mg / ml, 1,000x) | 5,0mM Natriumorthovanadat (Lager 500 mm, 100x) |
| 10 ug / ml Pepstatin (Stock 5 mg / ml in Ethanol, 500x) |
Tabelle 1. Erforderliche Reagenzien
| Fraktion | Proteinfraktion | Protein-Marker |
| P1 | Atom- | Histon H1 27 |
| S1 | Cytosol / Membranen | Calnexin 28 (endoplasmatischen Retikulum), ein 29-Tubulin (Zytoskelett), GAPDH 30 (Cytosol), 58K Golgi proProtein 31 (Golgi-Apparat) |
| P2 und P2 ' | Rohöl Synaptosomen | AMPA und NMDA-Rezeptor-Untereinheiten 32 |
| S2 und S2 ' | Cytosol / Licht-Membranen | nNOS1 29 (Cytosol), GAPDH (Cytosol), LAMP1 33 (Lysosomen), Pex14 34 (Peroxisomen) |
| P3 | Synaptosom / Mitochondrien | VDAC 35 (Mitochondrien), AMPA und NMDA-Rezeptor-Untereinheiten (Synaptosomen) |
| S3 | synaptischen Vesikel | SV2 8, 8 Synaptophysin |
| 0,8 M / 1,0 M | m Yelin | Myelinbasisprotein 36 |
| 1,0 M / 1,2 M | SPM | AMPA und NMDA-Rezeptor-Untereinheiten, präsynaptischen Marker (SNAP25 8), neurexin 32, 32 Neuroligin |
| 1,2 MP | Mitochondrien | VDAC 35 |
| PSD (1T) | PSD | PSD93 32, PSD95 32, AMPA und NMDA-Rezeptor-Untereinheiten, Neuroligin, PICK1 32, 32 CaMKII |
| TS | präsynaptischen Membranen | SNAP25, Munc18 37, Fagott 38, neurexin |
| angereicherten PSD | PSD95, AMPA und NMDA-Rezeptor-Untereinheiten, PICK1, CaMKII |
Tabelle 2. Liste der Protein-Marker zur subzellulären Fraktionen unterscheiden
Diskussion
Es gibt mehrere Schritte in der Prozedur, die entscheidend für ein erfolgreiches Ergebnis sind. In Schritt 3 ist es wichtig, dass ein gleichmäßiger Grad der Homogenisierung wird für jede Probe erreicht. Beim Homogenisieren Gewebe mit dem Motor angetrieben Homogenisator wird eine konstante Geschwindigkeit nicht nur für die Drehbewegung des Stößels, sondern auch mit der Anzahl von Hüben. Die Inkubationszeit bei der osmotischen Schock sollten präzise sein, da längere Homogenisierung oder Inkubation in der hypotonischen Lösung Mitochondrien lysieren und verunreinigen das SPM Probe.
Ein weiterer kritischer Schritt bei der Herstellung der Reagenzien, insbesondere die Saccharoselösungen; wenn die Molarität der Saccharose-Lösung ist falsch das Verfahren wird nicht funktionieren. Daher sollte Saccharoselösungen durch Wiegen Saccharose, gelöst in 4 mM HEPES-Lösung, dann Zusatz von 4 mM HEPES auf die genaue Endvolumen hergestellt werden. Tipp zur Fehlerbehebung: Aufbau einer Test Gradienten mit den vorbereiteten Saccharoselösungen nach ENsicher, dass die Steigung richtig zusammengesetzt ist. Hinzufügen unterschiedlichen Konzentrationen von Bromphenolblau (zB Endkonzentration von 0,005% -0.02% w / v) zu zwei der drei Saccharoselösungen in der Visualisierung von drei verschiedenen Schichten zu unterstützen.
Es ist wichtig, die Zeitdauer zwischen dem Zeitpunkt der Gradient zusammengebaut und, wenn die Röhrchen zentrifugiert begrenzen. Normale Diffusion wird die Steigung mit der Zeit zu zerstören, und dies wird beschleunigt, wenn es Schwingungen auf der Bank, wo der Gradient gespeichert. Pre-Pipettieren von Lösungen in einzelne Teilmengen ermöglicht eine genaue Volumina mit einem Glas Pasteur-Pipette pipettiert werden. Dies verringert auch die Zeit zwischen den Gradienten der Montage und Ultrazentrifugation. Tipp zur Fehlerbehebung: Aufbau einer "Test gradient" mit Bromphenolblau-Farbstoff, wie oben in der gleichen Zeit wie die Saccharose-Gradienten für das Experiment beschrieben. Die Integrität des Gradienten kann daher über die Zeit überwacht werden. Der Test wird als Gradienten dienenIndikator für die Diffusion, wenn die Gradienten zu weit im Voraus zusammengebaut oder Vibrationen ausgesetzt sind.
Schließlich ist es wichtig, dass das SPM-Probe in einem möglichst kleinen Volumen zu sammeln, da es erforderlich ist, um anschließend die Probe zu verdünnen mit 2,5 Volumina Wasser. Idealerweise sollte die Probe in einem Volumen von 0,4-0,7 ml mit einer 1 ml-Spritze gesammelt. Es ist ratsam, die diskontinuierlichen Gradienten während der letzten 20 min Spin in Schritt 7 zu bauen, um Zeit zwischen Montage und Gradienten-Ultrazentrifugation begrenzen.
Das Protokoll enthält die Empfehlung an all die verschiedenen Fraktionen behalten und speichern diese bei -80 ° C für die nachfolgende Analyse. Wir haben die Anreicherung von post-synaptischen Proteinen in Figur 2 nur ein paar von diesen Fraktionen nachgewiesen. Es ist jedoch ratsam, die Mengen des Proteins von Interesse in jeder der Fraktionen zu messen, seine Verteilung zu verstehen. Vergleicht man die distribution eines Proteins in den Fraktionen mit anderen subzellulären Markerproteinen wird auch helfen, zu bestätigen, dass die Versuchsbedingungen die gewünschte Fraktionierung erreicht. Tabelle 2 fasst üblicherweise verwendeten Protein-Marker, die als Indikatoren für die Stufen der Fraktionierung benutzt werden kann 8,27- 38.
Verwendung des diskontinuierlichen Saccharosegradienten wird häufig zur synaptischen Plasmamembranen anreichern. Diese Methode hat den Vorteil gegenüber kontinuierlichen Percoll Gradienten dass diskontinuierlichen Saccharose-Gradienten sind einfacher zu machen und nicht spezielle Ausrüstung erforderlich. Jedoch kann dieses Verfahren nicht ausreichend, um ein Protein von Interesse genau lokalisieren zu können, und für diese Anwendungen eine Percoll-Gradienten kann bevorzugt sein.
Offenlegungen
The authors have no conflicts of interest to disclose.
Danksagungen
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
Materialien
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
Referenzen
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten