Method Article
Подготовка Synaptic плазматической мембраны и Постсинаптических белков плотности с использованием разрывной градиента сахарозы
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной статье подробно обогащение белков, ассоциированных с плазматической мембраны синаптической с помощью ультрацентрифугирования на разрывной градиенте сахарозы. Последующая подготовка постсинаптических белков плотности также описывается. Белковые препараты подходят для вестерн-блоттинга или анализа 2D ПГЛП.
Аннотация
Нейронные субклеточные методы фракционирования позволит количественно оценить белков, которые продают в и из синапса. Как первоначально описано в конце 1960-х, белки, ассоциированные с плазматической мембраны синаптической может быть выделен с помощью ультрацентрифугирования на градиенте плотности сахарозы. После того, как синаптических мембран изолированы, макромолекулярный комплекс известен как постсинаптической плотности может быть затем выделяют в связи с его нерастворимости моющего средства. Методы, используемые для изоляции синаптических мембран в плазме и пост-синаптические белки плотности остаются практически то же самое после 40 лет, и широко используются в современных исследованиях в области нейронаук. Эта статья подробно описывает фракционирование белков, связанных с синаптической мембраны плазмы и постсинаптического плотность с помощью прерывистой градиенте сахарозы. Полученные белковые препараты подходят для вестерн-блоттинга или анализа 2D ПГЛП.
Введение
Нейроны взаимодействуют через синапсов, и качество этой связи регулируется в значительной степени от изменений в составе белков в синапсах. В частности, белки, расположенные в постсинаптической плотности участие в нейронной связи путем тщательного лесов рецепторов нейромедиаторов с их системами передачи сигнала 1. Кроме того, длительные изменения в силе синаптической контролируются добавления или удаления рецепторов на постсинаптической плотности 1-6. Таким образом, изоляция и количественная оценка синаптических белков является необходимым и полезным методом, чтобы разобраться в путях, что нейроны реагируют на стимулы и изменять синаптическую эффективность 7. В этой статье описывается общий метод, чтобы изолировать синаптические белки из грызунов мозговой ткани ультрацентрифугированием на разрывных градиентах сахарозы. Синаптической плазмы мембранную фракцию можно обогатить и изолированных основеего плотность в сахарозе, которые были определены эмпирически, чтобы быть похожими на 1,2 М сахарозы.
В зависимости от биологической вопрос, субклеточные фракции могут быть разделены с помощью непрерывных или прерывистых градиентах сахарозы или любой перколлом. Непрерывные градиенты позволяют для разделения белков в нескольких фракций; это может быть особенно полезно, чтобы продемонстрировать совместную локализацию протеинов в пределах данного фракции 8. Тем не менее, получение непрерывных градиентов более трудоемким и не является необходимым для многих приложений. Разрывные градиенты сравнительно легче подготовить и может быть использован для разделения белков в несколько, как правило, определенных фракций. Разрывные градиенты, которые состоят из трех сахарозы слоев увеличением молярностью были широко использованы для выделения белков, связанных с синаптической мембране плазмы (СЗМ). Это синаптической плазмы мембранную фракцию может быть дополнительно обработан в постсинаптической плотности fractioN (PSD) путем обработки моющим средством и изоляции моющего средства нерастворимые фракции.
Когда этот процесс был впервые описан в 1960-х годах 9,10, электронную микроскопию использовали для демонстрации органеллы и мембраны, что примерно определяют синаптическую мембрану плазмы и пост-синаптические плотности фракции 9-14. Эти исследования показали, включение до и после синаптических мембран и синаптических пузырьков в СЗМ фракции; после моющего средства лечения, прежде всего, электронно-плотного, пост-синаптические плотности были видны. В процедуре, гипотоническая шок используется отщипнуть синаптические процессы от тела клетки 10. Этот шаг использует тот факт, что митохондрии являются более устойчивыми к осмотического шока и остался нетронутым, и поэтому они оседают на дне градиенте сахарозы (Рисунок 1).
Используя эту же технику по обогащению, СЗМ и PSD фракции были первые биохимическиопределяется с помощью электрофореза в полиакриламидном геле и последовательности основных белковых компонентов 15-17. Затем вестерн-блот анализ был использован для обнаружения и количественной оценки уровней синаптических белков и дальнейшего определения этих фракций (рисунок 2). Мы использовали эту технику в наших лабораториях для количественного изменения в синаптических уровней переносчика дофамина, которые происходят, когда локус Slc6a3 дублируется на мышах 18. Мы также использовали эту технику в рецепторных NMDA дефицитных мышей, чтобы раскрыть синапсов конкретных сокращений белков, которые являются частью DISC1 интерактома 19.
Как видно из Вестерн-блоттинга, что СЗМ фракции содержат синаптические везикулы мембранные белки, эндосоме маркеры, митохондриальные белки, мембранные связано синтетические ферменты и молекулы передачи сигнала, а также с составными элементами пост-синаптической плотности и синаптические плазменные мембраны 20-23. EVEN PSD фракции может иметь загрязнения с обильным митохондриальных белков и это может быть необходимо для выполнения второго градиента седиментации или дополнительных стадий очистки, чтобы удалить их 13. В последнее время количественный масс-спектрометрии предоставила список из более чем 100 белков в одиночку постсинаптической плотности, а также указание на относительное обилие этих компонентов 24,25.
протокол
Следующий протокол соответствует принципам канадского Совета уходу за животными и был одобрен факультета медицины и фармации Комитета по уходу за животными в Университете Торонто.
1 Подготовьте Требуемые реагенты, как описано в таблице 1
- Добавить протеазы и фосфатазы (при необходимости) ингибиторы ко всем растворов сахарозы, буферы и DDH 2 O в концентрациях, указанных в таблице 1. ВАЖНО: Выполните все шаги при 4 ° С и предварительно круто все реагенты и оборудование до начала эксперимента. Этикетка все трубы, в том числе Ультрацентрифуга труб, с постоянным маркером.
2 Рассечение оптимальных Brain области
- Жертвоприношение животного путем смещения шейных позвонков или обезглавливания. Дом и эвтаназии животных в соответствии с институциональными и государственной политики по уходу за животными.
- Быстро удалить йэ мозг из черепа и место на охлажденной рассечение блока.
- Проанализируйте соответствующую область мозга от свежей ткани и перейдите к шагу 3.
3 Tissue Усреднение Motor Driven Гласса-гомогенизаторе из тефлонового
- Поместите 50-100 мг (для СЗМ), или 100-200 мг (для PSD) из рассеченной ткани в меченого 13 мл полипропиленовую пробирку, содержащую 4 мл 0,32 М HEPES-буферном растворе сахарозы. Трансфер образца в 15 мл конической стекло-тефлон ткани мясорубки / гомогенизатор, установить привод мотора до 900 оборотов в минуту (установка 7) и гомогенизации образца с 12 ударов более периода 30 сек. Используйте другую стекло-тефлоновую гомогенизатора между образцами, или промойте гомогенизатора с холодной дистиллированной водой между образцами и вытрите насухо Kimwipe. Примечание: до 4 г ткани может быть гомогенизировали в 4 мл 0,32 М HEPES-буферным раствором сахарозы, однако желательно, чтобы использовать меньше ткани, чтобы обеспечить надлежащее фракционирования.
- Трансфер гомогенизированный образец обратно то том же 13 мл полипропиленовую трубку. Резервный 100 мкл гомогената и хранить при температуре -80 ° С для последующего количественного белка и Вестерн-блот-анализа общей белковой фракции.
4 низкоскоростного центрифугирования для удаления ядерного фракции (Урожайность Супернатант S1)
- Центрифуга гомогенат в ротор с фиксированным углом в 900 мкг в течение 10 мин при 4 ° С. Передача супернатант (S1) на новый, помечены 13 мл трубку и ресуспендируют ядерной фракции гранул (P1) в 500 мкл 0,32 М HEPES-буферном сахарозы. Примечание: (Р1) фракцию можно хранить при -80 ° С и использовали для Вестерн-блот-анализа ядерной фракции.
5 Обогащение Фракции Сырая синаптосомальные (Урожайность пеллет P2)
- Центрифуга супернатант (S1) при 10000 х г в течение 15 мин при 4 ° С. Удалить супернатант (S2) и резерв 500 мкл в микроцентрифужных трубки для хранения при -80 ° С для последующего кванта белкафикация и вестерн-блот анализ цитозольной / светло-мембранной фракции. Ресуспендируют Оставшийся неочищенный синаптосомальные фракции осадок (P2) в 1 мл 0,32 М HEPES-буферным раствором сахарозы, а затем добавить еще 3 мл 0,32 М HEPES-буферного раствора сахарозы.
- Центрифуга при 10000 х г в течение 15 мин при 4 ° С. Удалить супернатант (S2 ') и резервный 500 мкл в микроцентрифужных трубки для хранения при -80 ° С для последующего количественного белка и Вестерн-блот-анализа цитозольной / светло-мембранной фракции. Сохранить промытый сырой синаптосомальные осадок (P2 ') в полипропиленовую пробирку.
6 Lysing (гипоосмотическими Shock) из фракции сырой синаптосомальные
- Лизировать сырой Синаптосомальное осадок (Р2 ') в полипропиленовую пробирку на повторное суспендирование его в 1 мл DDH 2 O. Добавить еще 3 мл DDH 2 O, трансфер в тканевом гомогенизаторе стекло-тефлоновой, и гомогенизации вручную с 3 ударов. ПРИМЕЧАНИЕ: Важночтобы выполнить этот шаг как можно быстрее и быстрее перейти к шагу 6.2.
- Образцы трансфера из гомогенизатора обратно в том же 13 мл полипропиленовую трубку и быстро настроить образец обратно до 4 мм HEPES с 16 мкл 1 М раствора HEPES, инвертировать перемешать.
- Поворот образцов при 4 ° С в течение 30 мин, чтобы обеспечить полное лизиса.
7 Обогащение фракции Синаптосомальное мембраны (P3)
- Центрифуга при 25000 х г в течение 20 мин при 4 ° С. Снимите сырой везикулярного фракции супернатанта (S3) и оставляем его в 5 мл трубке для хранения при -80 ° С для последующего количественного белка и Вестерн-блоттинга. Ресуспендируют синаптосомальных мембранной фракции (С-3) в 1 мл 0,32 М HEPES-буферном растворе сахарозы.
8 Подготовка разрывным градиентом сахарозы
- Внесите точно 3,5 мл 1,2 М HEPES-буферном растворе сахарозы и точно 3,0 мл каждого из 1,0 М и 0,8 М HEPES-буферный раствор сахарозы в отдельные 6 мл оснастки крышки пробирки. ПРИМЕЧАНИЕ: Это делается для предварительного измерения объемов буферов, которые используются, чтобы сделать градиенте сахарозы. Точное измерение объемов важно обеспечить, чтобы в результате градиенты будет сбалансирован для ультрацентрифугирования.
- Используя стеклянную Пастера пипетки и колбы, передать 1,2 М HEPES-буферный раствор сахарозы к 12 мл polyallomer ультрацентрифуга труб. Тщательно слое 1,0 М HEPES-буферный раствор сахарозы в верхней части 1,2 М HEPES-буферном растворе сахарозы. И, наконец, слой с 0,8 М HEPES-буферный раствор сахарозы в верхней части 1,0 М HEPES-буферном растворе сахарозы. Используйте свежий Пастера пипетки для каждого раствора сахарозы и заботиться, чтобы не нарушить градиенте сахарозы. Вибрации от скамейке вихря или микроцентрифуги будет нарушать целостность градиента.
- С помощью пипетки Пастера, ресуспендировали слое синаптосомальные мембранную фракцию (P3) в верхней части приготовленной прерывистой градиенте сахарозы.Убедитесь, что градиенты уравновешиваются весом их в ведре ротора Бакет. Если ведра не сбалансированы, использовать P200 пипетки тщательно добавить 0,32 М HEPES-буферный сахарозы в начало градиента и балансировка ротора ведра.
9 Фракционирование Synaptic плазматической мембраны (SPM)
- Ультрацентрифуга в ведро ротора качающейся на 150000 мкг в течение 2 ч при 4 ° С. Осторожно снимите сахарозы градиенты от Ультрацентрифуга ведра. Использование 18 G иглу и шприц емкостью 1 мл, прокол трубки в нижней части 1,0 м / 1,2 М HEPES-буферном растворе сахарозы интерфазы и вывести на плазматической мембраны синаптической слой (SPM).
- Обратите внимание на объем, что каждый образец СПМ занимает в 1 мл шприца. Поместите собранную SPM слой в 3,5 мл толстостенных Ультрацентрифуга труб, добавить точно 2,5 объема 4мМ HEPES регулировать концентрацию сахарозы от 1,2 м до 0,32 М. После каждый образец был отрегулироватьред до 0,32 М сахарозы, сбалансировать трубки с 0,32 М HEPES-буферном растворе сахарозы.
- Ультрацентрифуга в роторе с фиксированным углом в 200 000 мкг в течение 30 мин при 4 ° С. Снимите и выбросьте супернатант. Ресуспендируют синаптическую плазматической мембраны гранул (СЗМ) в 300 мкл 50 мМ раствора HEPES / 2 мМ ЭДТА. Образцы хранить при температуре -80 ° С до использования для вестерн-блоттинга.
10. Подготовка постсинаптической плотности фракции (PSD)
- Оттепель образцы СПУ на льду.
- Сделать решения 0,54% Triton X-100 в 50 мМ раствора HEPES / 2 мМ ЭДТА.
- В 5 мл полистирола трубки, сочетают 2,7 мл Тритона Х-100 / HEPES / EDTA и раствора 300 мкл фракции СПУ и поворачивать образец в течение 15 мин при 4 ° C
- Образцы Трансфер в 3,5 мл толстостенных ультрацентрифуг труб и Центрифуга образцов при 32000 мкг в течение 20 мин при 4 ° С.
- Резервный супернатант (Тритон Х-100 растворимую фракцию [TS]) и хранить при -80; ° C. ПРИМЕЧАНИЕ: На этом этапе, осадок представляет собой "PSD-1T" фракции. Вторая обработка моющим средством будет производить "PSD-2Т" фракции. Если фракция PSD-1T желательно, перейдите к шагу 10,6.
- Для получения СДП-2T фракцию, ресуспендируют осадок в 3 мл 0,5% Тритон Х-100 в 50 мМ HEPES / 2 мМ раствора ЭДТА. Поворот образцов в течение 15 мин при 4 ° С. Центрифуга образцов при 32000 мкг в течение 20 мин при 4 ° С и перейдите к шагу 10,6.
- Жидкость над осадком сливают и вновь суспендируют в постсинаптической (PSD) гранул в 50 мМ раствор HEPES / 2 мМ ЭДТА. Примечание: Объем ресуспендирования может зависеть от размера гранул; Объем 50-75 мкл рекомендуется. Поскольку PSD фракция представляет собой моющее средство нерастворимые фракции, часто бывает необходимо добавить 1-2 мкл 0,5% SDS, чтобы обеспечить полное ресуспендирования белка. Образцы хранить при температуре -80 ° С до использования для вестерн-блоттинга.
Результаты
Получение градиента плотности сахарозы должно привести к четкого разделения трех молярных растворов сахарозы (0,8, 1,0 и 1,2 М сахарозы). Смотрите фиг.3А показан пример градиента до того, как образец белка добавляется. Если градиент готовят слишком много заранее, или, если он подготовлен на скамейке поверхности с вибрацией от другого оборудования, градиент будет снижаться, правильное разделение не будет достигнута. Если четкое разделение трех решений не видно, то целесообразно сделать новый градиент перед добавлением образца белка. Смотрите фиг.3В показан пример в градиенте сахарозы, когда образец белка добавляют (черная стрелка).
После центрифугирования, должно быть четкие полосы белковых фракций в каждом интерфазе (0,32 / 0,8, 0,8 / 1,0, 1,0 / 1,2). Кроме того гранул должен быть виден в нижней части трубки. Смотрите фиг.3С для примераиз фракции полос после центрифугирования. Если фракции только диффузно присутствует в интерфазе, вполне вероятно, что градиент была нарушена, и дальнейшая обработка не рекомендуется.
Вестерн-блоттинга всех, СЗМ и PSD1T белковых образцов из мыши полосатого показано на рисунке 2. Обогащение синаптических белков, как GluR1, PSD95 и CaMKII, могут быть визуализированы загрузке постоянное количество белка (10 мкг) от общего количества, SPM и PSD фракции. Perisynaptic белки, такие как переносчика дофамина (DAT) обогащены СЗМ фракции, но устраняются в последующих стадий моющего средства PSD процесса обогащения.
Для обеспечения эквивалентного нагрузку, уровень белка могут быть визуализированы на западной блот мембраны окрашиванием Ponceau Красной 26. На основе антител "контроль" Загрузка часто сообщалось в литературе, но это может быть неправильным, так как синаптические белки могут быть безerentially регулируется в экспериментальных группах. Если на основе антител "загрузка контроль" желательно, целесообразно сначала определить эквивалентную нагрузку белка путем окрашивания Ponceau, а затем проверить несколько эталонных белков для выявления тех, которые не меняются в различных экспериментальных групп.
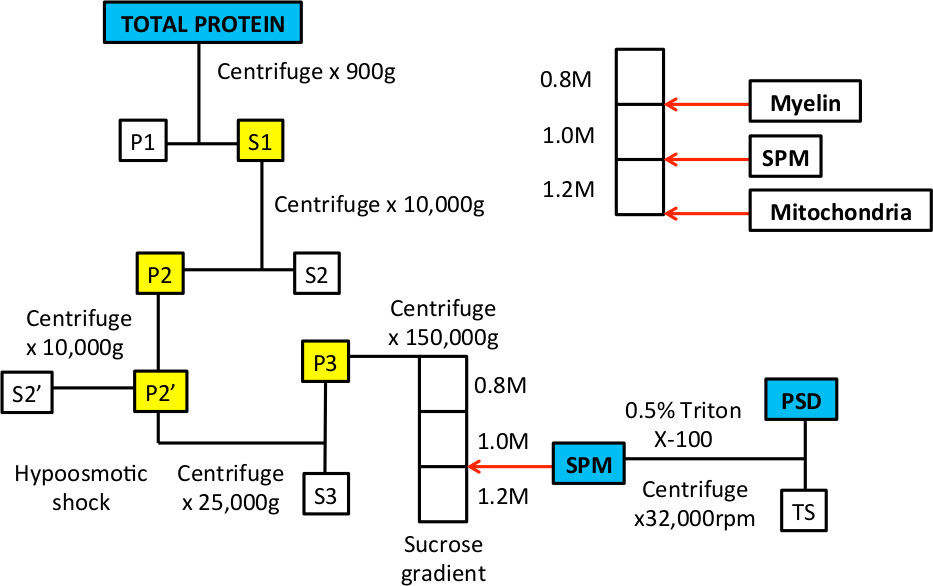
Рис.1 Технологическая схема внутриклеточного фракционирования обогащать SPM и PSD белковые фракции.

Рисунок 2 Представитель вестерн-блот общего, SPM и PSD1T белок от мыши стриатуме. 10 мкг белкового экстракта были решены на SDS-денатурации, 10% акриламидные гели и переносили на мембраны ПВДФ. Впоследствии эти кляксы инкубировали с первичными антителами для αCaMKII, GluR1, PSD-93, и PSD-95, которые все компоненты постсинаптической плотности. Таким образом, эти белки, обогащенный SPM и PSD фракций. С другой стороны, кляксы инкубировали с первичными антителами для DAT, который находится в пресинаптических мембран в стриатуме. В то время как DAT обогащается в СЗМ фракции, это не является частью PSD комплекса, и иммунореактивности не наблюдается в PSD фракции. Антитела против актина или натрий / калий АТФазы (Na / K насоса) может быть использован в качестве контроля нагрузки, хотя некоторые экспериментальные условия могут влиять на уровни этих белков, а также и, таким образом, соответствующий контроль загрузки должны быть определены эмпирически.

Рисунок 3. Типичные примеры градиенте сахарозы до и после центрифугирования. А. После градиент готовят, там должно быть три фазы, которые видны, когда труба проходит на свет. Белые стрелки указывают межфазной между 0,8 / 1,0 М растворов сахарозы и 1,0 / 1,2 М растворов сахарозы. B. Когда образец наносили на верхней части градиента, то есть в 0,32 М растворе сахарозы и будет лежать в верхней части 0,8 М сахарозы слой. С. После центрифугирования гомогената будет разделяться на несколько фракций. Фракция плавающей на интерфазы 0,8 / 1,0 м растворов сахарозы будет обогащаться в миелиновых оболочек. Фракция в интерфазы 1,0 / 1,2 м растворов сахарозы представляет SPM фракцию, которая собирается с помощью иглы и шприца. Осадок на дне пробирки обогащена митохондриальных белков.
| Солуные | HEPES буфером сахарозы | Ингибиторы протеазы | * ингибиторы фосфатазы |
| 1 М HEPES рН 7,4 | 0,32 М сахарозы в 4 мМ HEPES (рН 7,4) | 0,25 мМ PMSF (складе 250 мМ в этаноле, 1,000x) | 10 мМ фторид натрия (сток 500 мм, 50x) |
| 4 мМ HEPES рН 7,4 | 0,8 М сахарозы в 4 мМ HEPES (рН 7,4) | 1,5 мкг / мл апротинина (сток 1,5 мг / мл, 1,000x) | 2,5 мМ пирофосфат натрия (сток 250 мм, 100x) |
| DDh 2 O | 1,0 М сахарозы в 4 мМ HEPES (рН 7,4) | 10 мкг / мл лейпептина (складе 10 мг / мл, 1,000x) | 1.0 мм б-глицерофосфат (сток 200 мм, 200x) |
| 50 мМ HEPES (рН 7,4), 2 мМ ЭДТА | 1,2 М сахарозы в 4 мМ HEPES (рН 7,4) | 0,1 мг / мл бензамидина (складе 100 мг / мл, 1,000x) | 5.0мМ ортованадата натрия (сток 500 мм, 100x) |
| 10 мкг / мл Пепстатин (складе 5 мг / мл в этаноле, 500x) |
Таблица 1 Необходимые реактивы
| Фракция | Белок доля | Белковый маркер |
| P1 | ядерная | гистона H1 27 |
| S1 | цитозольные / мембраны | калнексину 28 (эндоплазматическая сеть),-тубулина 29 (цитоскелета), GAPDH 30 (цитозоль), 58K Гольджи пробелок 31 (аппарат Гольджи) |
| P2 и P2 ' | сырые синаптосомы | Субъединицы рецепторов АМРА и NMDA 32 |
| S2 и S2 ' | цитозольные / легкие мембраны | nNOS1 29 (цитозоль), GAPDH (цитозоль), LAMP1 33 (лизосом), PEX14 34 (пероксисом) |
| P3 | синаптосом / митохондрии | VDAC 35 (митохондрии), субъединицы рецепторов АМРА и NMDA (синаптосом) |
| S3 | синаптических пузырьков | SV2 8, синаптофизин 8 |
| 0,8 М / 1,0 М | м Елин | основного белка миелина 36 |
| 1,0 М / 1,2 М | SPM | Субъединицы АМРА и NMDA-рецепторов, пресинаптический маркер (SNAP25 8), нейрексина 32, neuroligin 32 |
| 1.2 MP | Митохондрии | VDAC 35 |
| PSD (1T) | PSD | PSD93 32, PSD95 32, субъединицы рецепторов АМРА и NMDA, neuroligin, pick1 32, CaMKII 32 |
| TS | пресинаптические мембраны | SNAP25, Munc18 37, Фагот 38, нейрексина |
| Обогащенный PSD | Рецепторные субъединицы PSD95, АМРА и NMDA, pick1, CaMKII |
Таблица 2 Список белковых маркеров, чтобы отличить субклеточные фракции
Обсуждение
Есть несколько шагов, в порядке, которые важны для успешного исхода. В шаге 3, важно, чтобы соответствовать степени гомогенизации достигается для каждого образца. При гомогенизации ткани с приводом от двигателя гомогенизатор, константа скорости используется не только для вращения пестиком, но также и с числом ударов. Инкубационный период во время осмотического шока должны быть точными, так как расширенный гомогенизации или инкубационный в гипотонического раствора будет лизировать митохондрии и загрязнять образец СПМ.
Еще один важный шаг в подготовке реагентов, особенно растворов сахарозы; если молярность раствора сахарозы является ошибочной процедура не будет работать. Таким образом, растворы сахарозы должны быть получены путем взвешивания сахарозу, растворением в 4 мМ HEPES раствору затем добавлением 4 мМ HEPES, чтобы точного конечного объема. Поиск и устранение неисправностей совет: построить тестовую градиент с приготовленных растворов сахарозы в ваннойуверен, что градиент собрана. Добавить различные концентрации бромофенола голубого (например, конечной концентрации 0,005% -0,02% в / о), чтобы два из трех растворов сахарозы для оказания помощи в визуализации трех отдельных слоев.
Важно, чтобы ограничить количество времени между тем, когда градиент собран и когда Пробирки центрифугируют. Нормальная диффузии уничтожит градиент с течением времени, и это ускоряется, если есть вибрация на скамейке, где градиент хранится. Предварительно пипетирование решений в отдельные аликвоты позволяет точные объемы быть пипеткой со стеклянной Пастера пипетки. Это также уменьшает время между градиента собраний и ультрацентрифугированием. Поиск и устранение неисправностей совет: построить "тест градиент" с бромфеноловым синего красителя, как описано выше, в то же время, что и градиентов сахарозы для эксперимента. Целостность градиента таким образом, может контролироваться в течение долгого времени. Тест градиент будет служитьИндикатор диффузии, если градиенты собраны слишком далеко вперед или подвергаются воздействию вибрации.
И, наконец, важно, чтобы собрать образец SPM в качестве небольшого объема, как это возможно, так как необходимо, чтобы впоследствии разбавить образец с 2,5 объемами воды. В идеале образец должен быть собран в объеме 0,4-0,7 мл с использованием 1 куб шприц. Желательно, чтобы построить разрывных градиентов во время окончательного отжима 20 мин в шаге 7, чтобы ограничить время между градиента сборки и ультрацентрифугирования.
Протокол включает рекомендацию, чтобы зарезервировать все различных фракций и сохранять их при -80 ° С для последующего анализа. Мы показали, обогащение пост-синаптических белков в рисунке 2, в только несколько из этих фракций. Тем не менее, желательно, чтобы измерить уровни белка интересов, в каждой из фракций, чтобы понять его распределение. Сравнивая Distribution белка во фракциях с другими внутриклеточными белками маркеров также поможет, чтобы подтвердить, что экспериментальные условия достигнуто желаемое фракционирование. В таблице 2 приведены часто используемые маркеры белка, которые можно использовать в качестве индикаторов стадий фракционирования 8,27- 38.
Использование в прерывистом градиенте сахарозы широко используется для обогащения синаптических мембран в плазме. Этот метод имеет преимущество над непрерывными градиентов Перколл в разрывных градиентах сахарозы легче сделать и не требуют специального оборудования. Тем не менее, этот метод не может быть достаточно, чтобы точно локализовать белок, представляющий интерес, и для этих приложений градиент Перколла может быть предпочтительным.
Раскрытие информации
The authors have no conflicts of interest to disclose.
Благодарности
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
Ссылки
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены