Method Article
הכנת Synaptic פלזמה ממברנה וחלבוני צפיפות Postsynaptic באמצעות שיפוע סוכרוז רציף
* These authors contributed equally
In This Article
Summary
מאמר זה מפרט את ההעשרה של חלבונים הקשורים עם קרום הפלזמה הסינפטי על ידי ultracentrifugation על שיפוע סוכרוז רציף. ההכנה הבאה של חלבוני צפיפות פוסט סינפטי מתואר גם. הכנות חלבון מתאימות למערבי סופג או ניתוח 2D DIGE.
Abstract
טכניקות חלוקה subcellular עצביות מאפשרות כימות של חלבונים שנסחרים ומסינפסה. כפי שתואר במקור בשנתי ה -1960 מאוחר, חלבונים הקשורים עם קרום הפלזמה הסינפטי יכולים להיות מבודדים על ידי ultracentrifugation בשיפוע צפיפות סוכרוז. ברגע שקרומים הסינפטי מבודדים, המורכב macromolecular ידוע כצפיפות פוסט סינפטי יכול להיות מבודד לאחר מכן בשל insolubility חומר הניקוי שלה. הטכניקות המשמשות כדי לבודד ממברנות פלזמה הסינפטי וחלבוני צפיפות פוסט סינפטי יישארו זהה במהות לאחר 40 שנים, ונמצאות בשימוש נרחב במחקר מדעי המוח נוכחי. מאמר זה מפרט את חלוקה של חלבונים הקשורים עם קרום הפלזמה הסינפטי וצפיפות פוסט סינפטי באמצעות שיפוע סוכרוז רציף. הכנות חלבון וכתוצאה מכך מתאימות למערבי סופג או ניתוח 2D DIGE.
Introduction
נוירונים לתקשר באמצעות סינפסות, ואיכות תקשורת זה מוסדרת במידה רבה על ידי שינויים בהרכב החלבונים בסינפסה. בפרט, החלבונים הממוקמים בצפיפות פוסט סינפטי להשתתף בתקשורת עצבית על ידי קולטני הנוירוטרנסמיטר אינטימי פיגומים עם מערכות העברת האותות שלהם 1. יתר על כן, שינויים מתמשכים בכוחו של היעילות הסינפטית נשלטים על ידי התוספת או גריעה של קולטנים בצפיפות פוסט סינפטי 1-6. לכן, הבידוד והכימות של חלבונים סינפטיים הוא טכניקה הכרחית ושימושית כדי לקבל תובנה הדרכים שנוירונים מגיבים לגירויים ולשנות יעילות הסינפטית 7. מאמר זה מתאר טכניקה נפוצה לבודד חלבונים סינפטיים מרקמת המוח של מכרסמים על ידי ultracentrifugation על הדרגתיים סוכרוז רציף. חלק קרום פלזמה הסינפטי יכול להיות מועשר ומבודד המבוסס עלצפיפותה בסוכרוז, שנקבע באופן אמפירי להיות דומה ל1.2 M סוכרוז.
בהתאם לשאלה הביולוגית, ניתן להפריד שברים subcellular על ידי הדרגתיים רציף או רציף של שני סוכרוז או Percoll. הדרגתיים רציף יאפשר להפרדת חלבונים לשברים מרובים; זו יכולה להיות שימושית במיוחד כדי להדגים את שיתוף הלוקליזציה של חלבונים בתוך שבריר נתון 8. עם זאת, הכנת הדרגתיים רציף היא מפרכת יותר, ואין צורך ליישומים רבים. הדרגתיים רציף קלים יותר יחסית להכנה וניתן להשתמש בם כדי להפריד בין חלבונים לכמה שברים, בדרך כלל מוגדרים. הדרגתיים רציף שמורכבים משלוש שכבות סוכרוז של molarity הגדלת היה בשימוש נרחב לבודד את חלבונים הקשורים לממברנה הסינפטי הפלזמה (SPM). חלק קרום פלזמה הסינפטי זה יכול להיות מעובד בהמשך לfractio צפיפות פוסט סינפטיn (PSD) על ידי טיפול בחומר ניקוי ובידוד של חלק חומר הניקוי מסיס.
כאשר תהליך זה תואר לראשונה בשנתי ה -1960 9,10, במיקרוסקופ אלקטרונים שימש כדי להדגים את האברונים וקרומים כי בערך להגדיר את קרום הפלזמה הסינפטי ושברים צפיפות פוסט סינפטי 9-14. מחקרים אלה הוכיחו את ההכללה של ממברנות של לפני ואחרי הסינפטי ושלפוחית סינפטית בשבריר SPM; לאחר טיפול חומר ניקוי בעיקר האלקטרונים צפופים, צפיפות פוסט סינפטי היתה גלויות לעין. בהליך, הלם hypotonic משמש ללצבוט את התהליכים סינפטיים מהגוף התא 10. צעד זה מנצל את העובדה שהמיטוכונדריה הן עמידה יותר בפני זעזועים האוסמוטי ונותרה על כנן, ולכן הם המשקע בתחתית שיפוע סוכרוז (איור 1).
שימוש באותה טכניקת העשרה זו, שברי SPM וPSD היו ראשון ביוכימיתשהוגדר על ידי ג'ל אלקטרופורזה polyacrylamide ורצף של רכיבי החלבון העיקריים 15-17. ניתוח כתם בהמשך המערבי נעשה שימוש כדי לזהות ולכמת את הרמות של חלבונים סינפטיים ועוד להגדיר שברים אלה (איור 2). יש לנו להשתמש בטכניקה זו במעבדות שלנו לכמת את השינויים ברמות הסינפטי של טרנספורטר דופאמין המתרחשות כאשר מוקד Slc6a3 משוכפל בעכברים 18. יש לנו גם השתמשתי בטכניקה זו בעכברים חסרי קולטן NMDA לחשוף ירידות סינפסה הספציפית בחלבונים שהם חלק מinteractome DISC1 19.
זה בא לידי ביטוי מניתוח כתם מערבי שברי SPM מכילים חלבונים סינפטיים קרום שלפוחית, סמני endosome, חלבוני המיטוכונדריה, אנזימים סינטטיים קרום הקשורים ומולקולות הולכים אותות, כמו גם רכיבים נפרד מצפיפות פוסט סינפטי וממברנות פלזמה הסינפטי 20-23. Eשברים PSD ven יכולים להיות זיהום עם חלבוני המיטוכונדריה בשפע וייתכן שיהיה צורך לבצע שקיעת שיפוע שנייה או שלבים לטיהור נוספים כדי להסיר אותם 13. לאחרונה, ספקטרומטריית מסה כמותית סיפקה רשימה של מעל 100 חלבונים בצפיפות פוסט סינפטי לבד, כמו גם אינדיקציה לשפע היחסי של רכיבים אלה 24,25.
Protocol
הפרוטוקול הבא תואם את ההנחיות של המועצה הקנדית לטיפול בבעלי חיים ואושר על ידי הפקולטה לרפואה וטיפול בבעלי חיים ועדת רוקחות באוניברסיטת טורונטו.
.1 הכינו חובה ריאגנטים כפי שהיא מתוארת בטבלה 1
- הוספת פרוטאז וphosphatase (במידת צורך) מעכבים לכל פתרונות, מאגרי סוכרוז וDDH 2 O בריכוזים המפורטים בטבלה 1. חשוב: בצע את כל השלבים על 4 מעלות צלזיוס וטרום מגניב כל חומרים כימיים והציוד לפני תחילת הניסוי. לייבל כל הצינורות, כולל צינורות ultracentrifuge, עם סמן קבוע.
.2 Dissection של מוח האזור המתאים
- להקריב בעלי החיים על ידי עקירה או עריפת ראש בצוואר הרחם. בית ולהרדים חיות בהתאם למדיניות מוסדית וממשלתית בטיפול בבעלי חיים.
- מהירות להסיר את המוח דואר מהגולגולת ומניחים על בלוק נתיחה מצונן.
- לנתח את האזור במוח המתאים מרקמות טריות והמשך לשלב 3.
Homogenization רקמות .3 עם זכוכית הטפלון Homogenizer מנוע מונע
- הנח 50-100 מ"ג (לSPM), או 100-200 מ"ג (לPSD) של הרקמה גזור בצינור פוליפרופילן 13 מ"ל שכותרת המכיל 4 מ"ל של תמיסת סוכרוז 0.32 HEPES שנאגר M. להעביר את המדגם למטחנה / homogenizer רקמת זכוכית טפלון מחודד 15 מ"ל, להגדיר את כונן מנוע ל900 סל"ד (הגדרת 7) וhomogenize המדגם עם 12 משיכות במשך תקופה 30 שניות. השתמש homogenizer זכוכית טפלון שונה בין דגימות, או לשטוף את homogenizer עם מים מזוקקים קרים בין דגימות ולנגב יבשים עם Kimwipe. הערה: עד 4 גרם של רקמה ניתן הומוגני ב4 מ"ל של תמיסת סוכרוז 0.32 HEPES שנאגר M, עם זאת רצוי להשתמש בפחות רקמה כדי להבטיח חלוקה נכונה.
- העבר את המדגם הומוגני בחזרה to באותו צינור פוליפרופילן 13 מ"ל. מילואים של homogenate וחנות 100 μl ב-80 ° C לכימות חלבון שלאחר מכן וניתוח כתם מערבי בסך הכל חלק קטן חלבון.
.4 מהירות נמוכה צנטריפוגה להסיר חלק הגרעיני (תשואות Supernatant S1)
- צנטריפוגה homogenate בהרוטור זווית קבועה ב900 XG 10 דקות ב 4 ° C. מעבירים את supernatant (S1) לחדש, שכותרתו 13 צינור מ"ל וresuspend גלולה שבריר הגרעיני (P1) ב500 μl של 0.32 סוכרוז HEPES שנאגר M. הערה: החלק (P1) יכול להיות מאוחסן על -80 מעלות צלזיוס ומשמש לניתוח כתם מערבי של השבר הגרעיני.
.5 העשרה של חלק הגולמי Synaptosomal (תשואות גלולה P2)
- צנטריפוגה supernatant (S1) ב 10,000 XG במשך 15 דקות ב 4 ° C.. הסר את supernatant (S2) ובמילואים 500 μl בצינור microcentrifuge לאחסן ב-80 ° C לקוואנט חלבון שלאחר מכןification וניתוח כתם מערבי של cytosolic / חלק קרום האור. Resuspend גלולה שנותר synaptosomal הגולמי שבריר (P2) ב1 מ"ל של תמיסת סוכרוז HEPES שנאגר 0.32 M ולאחר מכן להוסיף עוד פתרון סוכרוז HEPES שנאגר 3 מ"ל של 0.32 M.
- צנטריפוגה ב g x 10,000 ל15 דקות ב 4 ° C.. הסר את supernatant (S2 ') וμl 500 מילואים בצינור microcentrifuge לאחסן ב-80 ° C לכימות חלבון שלאחר מכן וניתוח כתם המערבי של cytosolic / חלק קרום האור. להציל את כדור synaptosomal הגולמי שטף (P2 ') בצינור פוליפרופילן.
.6 Lysing (Hypoosmotic הלם) של חלק הגולמי Synaptosomal
- Lyse גלולה synaptosomal הגולמי (P2 ') בצינור פוליפרופילן על ידי resuspending זה ב 1 מ"ל של DDH 2 O. להוסיף עוד 3 מ"ל של DDH 2 O, להעביר לhomogenizer רקמת זכוכית טפלון, וhomogenize ביד עם 3 משיכות. הערה: חשובלבצע שלב זה במהירות אפשרית ובמהירות המשך לשלב 6.2.
- העברת דגימות מhomogenizer בחזרה לתוך צינור פוליפרופילן 13 מ"ל ובמהירות להתאים את המדגם חזרה ל4 HEPES מ"מ עם 16 μl של 1 פתרון M HEPES, להפוך לערבב.
- סובב דגימות על 4 מעלות צלזיוס למשך 30 דקות כדי להבטיח lysing מלא.
.7 העשרה של חלק Synaptosomal ממברנה (P3)
- צנטריפוגה ב g x 25,000 עבור 20 דקות ב 4 ° C.. הסר את supernatant הגולמי לפוחי שבריר (S3) ולהזמין אותו בצינור 5 מ"ל לאחסון ב-80 ° C לכימות חלבון שלאחר מכן וניתוח כתם מערבי. Resuspend חלק קרום synaptosomal (P3) ב 1 מ"ל של תמיסת סוכרוז 0.32 HEPES שנאגר M.
.8 הכנת רציף סוכרוז Gradient
- Pipet בדיוק 3.5 מ"ל של תמיסת סוכרוז HEPES שנאגר 1.2 M ובדיוק 3.0 מ"ל כל אחד מ1.0 M ו0.8 M HEPEתמיסת סוכרוז נאגר S לתוך נפרד 6 מ"ל הצמד צינורות כובע. הערה: זה נעשה מראש למדוד את ההיקפים של המאגרים הנמצאים בשימוש על מנת להפוך את שיפוע סוכרוז. מדידה מדויקת של הכמויות חשוב לוודא שהשיפועים וכתוצאה מכך יהיו מאוזנת לultracentrifugation.
- באמצעות pipet פסטר זכוכית ונורה, להעביר 1.2 M-נאגר HEPES תמיסת סוכרוז ל12 מ"ל צינור ultracentrifuge polyallomer. שכבה בזהירות את תמיסת סוכרוז HEPES שנאגר 1.0 M על גבי תמיסת סוכרוז HEPES שנאגר 1.2 M. לבסוף, שכבת תמיסת סוכרוז HEPES שנאגר 0.8 M על גבי תמיסת סוכרוז HEPES שנאגר 1.0 M. השתמש pipet פסטר טרי עבור כל תמיסת סוכרוז ודואג שלא להפריע את שיפוע סוכרוז. תנודות ממערבולת ספסל או microcentrifuge יפריעו את השלמות של השיפוע.
- באמצעות pipet פסטר, שכבת שבריר synaptosomal resuspended הקרום (P3) על גבי שיפוע סוכרוז רציף מוכן.ודא שההדרגות מאוזנת במשקלם בתוך הדלי של הרוטור דלי מתנדנד. אם הדליים אינם מאוזנים, להשתמש pipet P200 להוסיף בזהירות 0.32 סוכרוז HEPES שנאגר M לחלק העליון של השיפוע ולאזן את דליי הרוטור.
.9 פלזמה של Synaptic פלזמה ממברנה (SPM)
- Ultracentrifuge ברוטור מתנדנד דלי ב150,000 XG לשעה 2 ב 4 ° C.. מוציא בזהירות את שיפועי סוכרוז מדליי ultracentrifuge. באמצעות מחט G 18 ומזרק 1 מ"ל, לנקב את הצינור בחלק התחתון של שלבי הביניים פתרון סוכרוז HEPES שנאגר 1.0 M / M 1.2 ולמשוך את השכבה הסינפטית קרום פלזמה (SPM).
- רשום לעצמך את עוצמת הקול שכל דגימת SPM תופסת במזרק 1 מ"ל. מניחים את שכבת SPM שנאסף בצינורות ultracentrifuge עבה קיר 3.5 מ"ל, להוסיף בדיוק 2.5 כרכים של 4 HEPES מ"מ כדי להתאים את ריכוז סוכרוז מ1.2 M ל0.32 מ 'ברגע שכל דגימה הייתה להתאיםed ל0.32 M סוכרוז, לאזן את הצינורות עם 0.32 תמיסת סוכרוז HEPES שנאגר M.
- Ultracentrifuge בהרוטור זווית קבוע ב200,000 XG ל30 דקות ב 4 ° C. להסיר ולסלק supernatant. Resuspend גלולה קרום פלזמה הסינפטי (SPM) ב300 μl של 50 פתרון HEPES מ"מ / 2 מ"מ EDTA. דגימות חנות ב -80 ° C עד המשמשות למערביות סופג.
10. הכנת חלק צפיפות Postsynaptic (PSD)
- להפשיר דגימות SPM על קרח.
- בצע פתרון של 0.54% טריטון X-100 ב50 פתרון HEPES מ"מ / 2 מ"מ EDTA.
- בצינור 5 מ"ל קלקר, לשלב 2.7 מ"ל של-100 X / שבריר טריטון HEPES / פתרון EDTA ו300 μl SPM ולסובב את המדגם עבור 15 דקות ב 4 ° C
- העברת דגימות ל3.5 מ"ל צינורות ultracentrifuge עבה קיר ודגימות צנטריפוגות ב XG 32,000 עבור 20 דקות ב 4 ° C..
- שומרים לעצמנו את supernatant (טריטון X-100 חלק מסיס [TS]) ולאחסן ב -80; ° C. הערה: בשלב זה, את הכדור מייצג את החלק היחסי "PSD-1T". טיפול שני עם חומר ניקוי יהיה לייצר חלק "PSD-2T". אם חלק PSD-1T הוא רצוי, המשך לשלב 10.6.
- כדי לייצר חלק PSD-2T, resuspend גלולה ב 3 מ"ל של .0.5% טריטון X-100 ב50 HEPES מ"מ / 2 פתרון mM EDTA. סובב דגימות ל15 דקות ב 4 ° C.. צנטריפוגה דגימות 32,000 XG ל20 דקות ב 4 ° C והמשיכו לשלב 10.6.
- בטל supernatant וresuspend גלולה postsynaptic (PSD) ב50 פתרון HEPES מ"מ / 2 מ"מ EDTA. הערה: resuspension הנפח עשוי להיות תלוי בגודל של גלולה; נפח של 50-75 μl מומלץ. בגלל חלק PSD הוא חלק חומר ניקוי מסיס, זה לעתים קרובות יש צורך להוסיף 1-2 μl של .0.5% SDS כדי לאפשר resuspension של חלבון מלא. דגימות חנות ב -80 ° C עד המשמשות למערביות סופג.
תוצאות
הכנת שיפוע צפיפות סוכרוז צריכה לגרום להפרדה ברורה של שלושה פתרונות הטוחנות של סוכרוז (0.8, 1.0, ו1.2 M סוכרוז). ראה איור 3 א לדוגמא של השיפוע לפני מדגם החלבון הוא הוסיף. אם השיפוע מוכן יותר מדי מראש, או אם הוא מוכן על משטח ספסל עם רטט מציוד אחר, השיפוע יהיה בסכנה והפרדה ראויה לא תושג. אם הפרדה ברורה של שלושה הפתרונות אינה נראה לעין, מומלץ להפוך את שיפוע חדש לפני הוספת מדגם החלבון. ראו איור 3 ב לדוגמא של שיפוע סוכרוז (חץ שחור) כאשר מדגם החלבון הוא הוסיף.
בעקבות צנטריפוגה, שלא צריך להיות להקות ברורות של שברים חלבון בכל שלבי ביניים (0.32 / 0.8, 0.8 / 1.0, 1.0 / 1.2). בנוסף גלולה צריכה להיות גלויה בחלק התחתון של הצינור. ראו איור 3 ג לדוגמאשל להקות שבריר לאחר ultracentrifugation. אם שברים הם רק diffusely נוכחים בשלבי הביניים, סביר להניח כי השיפוע היה בסיכון ועיבוד נוסף לא מומלץ.
מערבי סופג בסך הכל, SPM וחלבון PSD1T דגימות מסטריאטום העכבר בא לידי ביטוי באיור 2. ההעשרה של חלבונים סינפטיים כמו GluR1, PSD95, וCaMKII, ניתן דמיין ידי טעינת סכום קבוע של חלבון (10 מיקרוגרם) מכולל, SPM , ושברים PSD. חלבוני Perisynaptic כמו טרנספורטר דופאמין (DAT) מועשרים בשבריר SPM, אך בוטלו בצעדי חומר ניקוי הבאים של תהליך העשרת PSD.
כדי להבטיח טעינה שווה ערך, יכולות להיות דמיינו רמות חלבון על קרום הכתם המערבי על ידי צביעה עם Ponceau אדום 26. "פקדי טעינה" המבוסס על נוגדן לעתים קרובות דווח בספרות, אבל זה עשוי להיות מטעה שכן חלבונים סינפטיים יכולים להיות הבדלמוסדר erentially בקבוצות טיפול ניסיוניות. אם "שליטת טעינה" המבוסס על נוגדן היא רצויה, מומלץ ראשון לקבוע העמסת חלבון שווה ערך על ידי צביעת Ponceau, ולאחר מכן לבדוק כמה חלבוני התייחסות לזהות את אלה שלא לשנות בקבוצות ניסוי השונות.
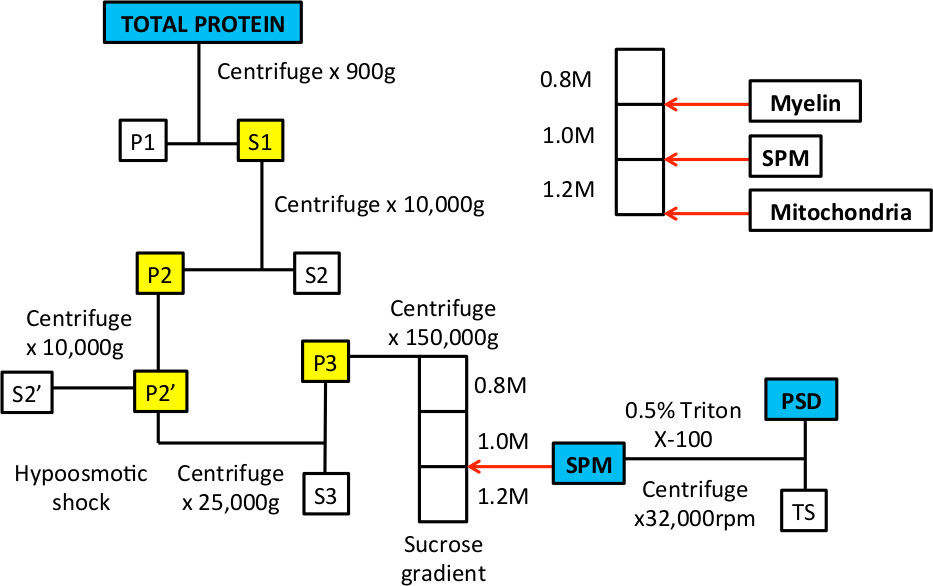
איור 1 זרימת עבודה של חלוקה subcellular להעשיר SPM ושברים חלבון מסוג PSD.

איור 2 כתם הנציג מערבי בסך הכל, SPM, וחלבון PSD1T מסטריאטום העכבר. 10 מיקרוגרם של תמצית חלבון נפתרו על SDS-denaturing, אקריל 10%ג'לים אמיד, והועבר לממברנות PVDF. בהמשך לכך כתמים אלה הודגרו עם נוגדנים ראשוניים לαCaMKII, GluR1, PSD-93, וPSD-95, אשר כל הרכיבים של צפיפות פוסט סינפטי. בהתאם לכך, חלבונים אלה מועשרים בSPM והשברים PSD. לחלופין, כתמים הודגרו עם נוגדן ראשוני לDAT, הממוקם בקרומי presynaptic בסטריאטום. בעוד DAT מועשר בשבריר SPM, זה לא חלק ממכלול PSD, וimmunoreactivity לא נצפה בחלק PSD. נוגדנים נגד אקטין או נתרן / אשלגן ATPase (משאבת Na / K) יכולים לשמש כבקרת טעינה, למרות שחלקם תנאי ניסוי עשויים להשפיע על הרמות של חלבונים אלה, כמו גם וכך שליטת הטעינה המתאימה צריכה להיקבע באופן אמפירי.

איור 3. דוגמאות מייצגות של שיפוע סוכרוז לפני ואחרי ultracentrifugation. א לאחר השיפוע מוכן, לא צריך להיות שלושה שלבים הנראים כאשר הצינור מתקיים עד האור. החצים הלבנים מצביעים על שלבי הביניים בין 0.8 / 1.0 M פתרונות סוכרוז ו1.0 / 1.2 M פתרונות סוכרוז. B. כאשר המדגם נטען על גבי השיפוע, זה בתמיסת סוכרוז 0.32 M וינוח על גבי 0.8 שכבת סוכרוז M. ג לאחר צנטריפוגה, homogenate יפריד לכמה שברים. החלק צף בשלבי הביניים של פתרונות סוכרוז 0.8 / 1.0 M יהיה מועשר בממברנות המיאלין. החלק בשלבי הביניים של פתרונות סוכרוז 1.0 / 1.2 M מייצג את חלק SPM שנאסף עם מחט ומזרק. גלולה בחלק התחתון של הצינור היא מועשרת לחלבונים במיטוכונדריה.
| Soluמשא | סוכרוז HEPES שנאגר | מעכבי פרוטאז | * מעכבי Phophatase |
| 1 M HEPES pH 7.4 | 0.32 M סוכרוז ב4 HEPES מ"מ (pH 7.4) | 0.25 מ"מ PMSF (מניית 250 מ"מ באתנול, 1,000x) | 10 מ"מ נתרן פלואוריד (מניית 500 מ"מ, 50x) |
| 4 HEPES מ"מ pH 7.4 | 0.8 M סוכרוז ב4 HEPES מ"מ (pH 7.4) | 1.5 מיקרוגרם / מ"ל Aprotinin (מ"ג 1.5 המניה / מ"ל, 1,000x) | 2.5 מ"מ נתרן Pyrophosphate (מניית 250 מ"מ, 100x) |
| DDH 2 O | 1.0 M סוכרוז ב4 HEPES מ"מ (pH 7.4) | 10 מיקרוגרם / מ"ל leupeptin (מניית 10 מ"ג / מ"ל, 1,000x) | 1.0 ב-glycerophosphate מ"מ (מניית 200 מ"מ, 200x) |
| 50 HEPES מ"מ (pH 7.4) 2 מ"מ EDTA | 1.2 M סוכרוז ב4 HEPES מ"מ (pH 7.4) | 0.1 מ"ג / מ"ל Benzamidine (מניית 100 מ"ג / מ"ל, 1,000x) | 5.0מ"מ נתרן Orthovanadate (מניית 500 מ"מ, 100x) |
| 10 מיקרוגרם / מ"ל Pepstatin (מניית 5 מ"ג / מ"ל באתנול, 500x) |
טבלה 1 ריאגנטים הנדרש
| חלק | חלק חלבון | סמן חלבון |
| P1 | גרעיני | H1 היסטון 27 |
| S1 | cytosol / ממברנות | calnexin 28 (reticulum endoplasmic), טובולין 29 (שלד תא), 30 GAPDH (cytosol), 58K Golgi פרוהחלבון ה31 ב( מנגנון Golgi) |
| P2 ו P2 ' | synaptosomes הגולמי | יחידות משנה קולטן AMPA וNMDA 32 |
| S2 וS2 ' | cytosol / ממברנות אור | nNOS1 29, GAPDH (cytosol) (cytosol), LAMP1 33 (הליזוזום), PEX14 34 (peroxisome) |
| P3 | synaptosome / מיטוכונדריה | VDAC 35 (מיטוכונדריה), יחידות משנה קולטן AMPA וNMDA (synaptosome) |
| S3 | שלפוחית הסינפטית | SV2 8, synaptophysin 8 |
| 0.8 M / M 1.0 | מ ' ילין | חלבון המיאלין בסיסי 36 |
| 1.0 M / M 1.2 | SPM | תת יחידות AMPA וNMDA קולטן, סמן סינפטי (SNAP25 8), neurexin 32, neuroligin 32 |
| 1.2 MP | מיטוכונדריה | 35 VDAC |
| PSD (1T) | PSD | 32 PSD93, PSD95 32, תת יחידות AMPA וNMDA קולטן, neuroligin, 32 PICK1, CaMKII 32 |
| TS | ממברנות presynaptic | SNAP25, Munc18 37, בסון 38, neurexin |
| PSD המועשר | יחידות משנה קולט PSD95, AMPA וNMDA, PICK1, CaMKII |
רשימת טבלת 2 של סמני חלבון להבחין שברי subcellular
Discussion
יש כמה שלבים בהליך שהם קריטיים לתוצאה מוצלחת. בשלב 3, חשובה שמידת הומוגניות עקבית מושגת עבור כל דגימה. כאשר מאחד רקמה עם homogenizer המנוע מונע, מהירות קבועה משמשת לא רק לסיבוב של העלי, אלא גם עם מספר משיכות. זמן הדגירה בהלם אוסמוטי צריך להיות מדויק, שכן יצירת הומוגניות או דגירה ממושכת בפתרון hypotonic תהיה lyse מיטוכונדריה ולזהם את מדגם SPM.
עוד צעד קריטי בהכנה של חומרים כימיים, במיוחד פתרונות סוכרוז; אם molarity של תמיסת סוכרוז הוא שגוי ההליך לא יעבוד. לכן, צריכים להיות מוכנים פתרונות סוכרוז על ידי שקילת סוכרוז, ההמסה ב4 פתרון HEPES מ"מ לאחר מכן הוספת 4 HEPES מ"מ לנפח הסופי המדויק. טיפ פתרון בעיות: לבנות שיפוע מבחן עם פתרונות סוכרוז מוכנים enבטוח שהשיפוע מורכב כראוי. הוספת ריכוזים שונים של כחול bromophenol (לדוגמא, ריכוז סופי של 0.005% -0.02% w / v) לשתיים משלושת פתרונות סוכרוז לסייע בהדמיה של שלוש שכבות נפרדות.
חשוב להגביל את כמות הזמן בין כאשר השיפוע מורכב וכאשר צינורות centrifuged. דיפוזיה רגילה תהרוס את השיפוע לאורך זמן, וזה האיץ אם יש רטט על הספסל שבו השיפוע מאוחסן. טרום pipetting של פתרונות לaliquots פרט מאפשר לכרכים מדויקים לpipetted עם pipet פסטר זכוכית. זה גם מקטין את הזמן בין הרכבה וultracentrifugation שיפוע. טיפ פתרון בעיות: לבנות "שיפוע מבחן" עם צבע כחול bromophenol כפי שתואר לעיל באותו הזמן כהדרגתי סוכרוז לצורך הניסוי. היושרה של השיפוע ובכך יכולה להיות במעקב לאורך זמן. שיפוע הבדיקה ישמש כמחוון של דיפוזיה אם הדרגתיים הם התאספו מדי זמן רב מראש או חשופים לרעידות.
לבסוף, חשוב לאסוף את דגימת SPM בקטן כמו נפח ככל האפשר, שכן יש צורך לדלל לאחר מכן את המדגם עם 2.5 כרכים של מים. באופן אידיאלי המדגם צריך להיות שנאסף בנפח של 0.4-.7 מ"ל באמצעות מזרק 1 סמ"ק. מומלץ לבנות הדרגתיים רציף במהלך ספין 20 דקות האחרונות בשלב 7 להגביל את הזמן בין הרכבה וultracentrifugation שיפוע.
הפרוטוקול כולל את ההמלצה להזמין את כל השברים השונים ולאחסן את אלה ב-80 ° C לניתוח שלאחר מכן. אנחנו הוכחנו ההעשרה של חלבונים לאחר הסינפטי באיור 2 רק כמה מהשברים הללו. עם זאת, מומלץ למדוד את הרמות של חלבון של ריבית בכל אחד מהשברים כדי להבין ההפצה שלה. השוואת distribution של חלבון בשברים עם חלבוני סמן subcellular אחרים גם יעזור כדי לוודא שתנאי הניסוי השיגו חלוקה הרצויה. טבלה 2 מסכמת סמני חלבון נפוץ בשימוש שיכול לשמש כמדדים לשלבים של חלוקה 8,27- 38.
ניצול שיפוע סוכרוז רציף נעשה שימוש נרחב כדי להעשיר את ממברנות פלזמה הסינפטי. לשיטה זו היתרון על פני מילויים Percoll רציפים בכך שהפרשי סוכרוז רציפים קלות יותר לעשות ואינו דורש ציוד מיוחד. עם זאת, שיטה זו לא יכולה להיות מספיק כדי למקם חלבון של עניין בדיוק, ועבור יישומים אלה שיפוע Percoll עשוי להיות מועדף.
Disclosures
The authors have no conflicts of interest to disclose.
Acknowledgements
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
Materials
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
References
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved