Method Article
Préparation de Synaptic membrane plasmique et de protéines de densité post-synaptique en utilisant un gradient discontinu de saccharose
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article décrit l'enrichissement de protéines associées à la membrane plasmique synaptique par ultracentrifugation sur un gradient discontinu de saccharose. La préparation ultérieure des protéines de densités postsynaptiques est également décrite. préparations de protéines sont adaptés pour western blot ou analyse 2D DIGE.
Résumé
Techniques de fractionnement subcellulaire de neurones permettent la quantification de protéines que l'on traite et à partir de la synapse. Comme décrit à l'origine à la fin des années 1960, des protéines associées à la membrane plasmique synaptique peuvent être isolées par ultracentrifugation sur un gradient de densité de saccharose. Une fois les membranes synaptiques sont isolés, le complexe macromoléculaire appelé la densité post-synaptique peut être ensuite isolé en raison de son insolubilité de détergent. Les techniques utilisées pour isoler les membranes plasmiques synaptiques et les protéines de la densité post-synaptiques demeurent essentiellement les mêmes après 40 ans, et sont largement utilisés dans la recherche en neurosciences en cours. Cet article décrit le fractionnement de protéines associées à la membrane plasmique synaptique et la densité post-synaptique en utilisant un gradient discontinu de saccharose. Résultant des préparations de protéines sont adaptés pour western blot ou analyse 2D DIGE.
Introduction
Les neurones communiquent par des synapses, et la qualité de cette communication est régulé dans une large mesure par des modifications de la composition des protéines au niveau de la synapse. En particulier, les protéines qui se trouvent dans la densité post-synaptique des neurones participent à la communication par les récepteurs des neurotransmetteurs échafaudage intimement avec leurs systèmes de transduction de signaux 1. En outre, des modifications durables de la force de l'efficacité synaptique sont contrôlés par l'ajout ou le retrait de récepteurs à la densité post-synaptique 6.1. Par conséquent, l'isolement et la quantification des protéines synaptiques est une technique nécessaire et utile pour mieux comprendre la façon dont les neurones répondent à des stimuli et modifier l'efficacité synaptique 7. Cet article décrit une technique courante pour isoler les protéines synaptiques à partir de tissu cérébral des rongeurs par ultracentrifugation sur gradient de saccharose discontinu. La fraction de membrane synaptique de plasma peut être enrichie et isolées en se basant sursa densité en saccharose, qui a été déterminé de manière empirique pour être semblable à 1,2 M de saccharose.
En fonction de la question biologique, des fractions subcellulaires peuvent être séparés par des gradients continus ou discontinus de Percoll ou saccharose soit. Gradients continus pour permettre la séparation de protéines en plusieurs fractions; cela peut être particulièrement utile pour démontrer la co-localisation des protéines dans une fraction donnée 8. Cependant, la préparation de gradients continus est plus laborieux et n'est pas nécessaire pour de nombreuses applications. Gradients discontinus sont relativement plus faciles à préparer et peuvent être utilisées pour séparer les protéines en quelques fractions, généralement définies. Gradients discontinus qui sont composées de trois couches de saccharose d'augmenter la molarité ont été largement utilisés pour isoler les protéines associées à la membrane plasmique synaptique (SPM). Cette fraction synaptique de la membrane plasmatique peut être encore traitée pour la FRACTIO densité post-synaptiquen (PSD) par traitement avec un détergent et de l'isolement de la fraction insoluble dans le détergent.
Lorsque ce procédé a été décrit pour la première dans les années 1960, 9,10, la microscopie électronique a été utilisé pour démontrer les organelles et de membranes qui définissent approximativement la membrane plasmique synaptique et les fractions de densité post-synaptiques 9-14. Ces études ont démontré l'inclusion des membranes pré-et post-synaptiques et des vésicules synaptiques dans la fraction de SPM; après le traitement au détergent essentiellement la dense aux électrons, la densité post-synaptiques sont visibles. Dans la procédure, un choc hypotonique est utilisé pour pincer les processus synaptiques à partir du corps de la cellule 10. Cette étape prend avantage du fait que les mitochondries sont plus résistants aux chocs osmotiques et restent intacts, et ainsi ils sédimentent au fond du gradient de saccharose (figure 1).
En utilisant la même technique d'enrichissement, les SPM et PSD fractions ont d'abord été biochimiquementdéfini par électrophorèse sur gel de polyacrylamide et la séquence des composantes majeures de protéines de 15 à 17. Par la suite l'analyse par transfert de Western a été utilisée pour détecter et quantifier le niveau de protéines synaptiques et en outre définir ces fractions (Figure 2). Nous avons utilisé cette technique dans nos laboratoires pour quantifier les changements dans les niveaux synaptiques du transporteur de la dopamine qui se produisent lorsque le lieu SLC6A3 est dupliqué chez la souris 18. Nous avons également utilisé cette technique dans les souris déficientes en récepteurs de NMDA pour découvrir la réduction spécifique à la synapse en protéines qui font partie de la DISC1 interactome 19.
Il est évident à partir de l'analyse western blot que les fractions SPM contiennent synaptiques protéines de la membrane des vésicules, des marqueurs de endosome, les protéines mitochondriales, associées à la membrane enzymes synthétiques et des molécules de transduction de signaux, ainsi que des parties intégrantes de la densité post-synaptique et les membranes de plasma synaptiques 20-23. Efractions PSD VEN peuvent avoir une contamination par des protéines mitochondriales abondantes et il peut être nécessaire d'effectuer une deuxième sédimentation de gradient ou des étapes supplémentaires de purification pour les 13 retirer. Récemment, la spectrométrie de masse quantitative a fourni une liste de plus de 100 protéines de la densité post-synaptique seul, ainsi qu'une indication de l'abondance relative de ces éléments 24,25.
Protocole
Le protocole suivant est conforme aux lignes directrices du Conseil canadien de protection des animaux et a été approuvé par la Faculté de Pharmacie Comité de protection des animaux et la médecine à l'Université de Toronto.
1 Préparer requis réactifs comme indiqué dans le tableau 1
- Ajouter protease et de phosphatase (si nécessaire) des inhibiteurs de l'ensemble des solutions de saccharose, des tampons et le trou DDH 2 O à des concentrations indiquées dans le tableau 1. IMPORTANT: Effectuez toutes les étapes à 4 ° C et pré-cool tous les réactifs et le matériel avant le début de l'expérience. Étiqueter tous les tubes, y compris les tubes d'ultracentrifugation, avec un marqueur permanent.
2 Dissection de la région du cerveau appropriée
- Sacrifier l'animal par dislocation cervicale ou décapitation. Maison et euthanasier les animaux conformément aux politiques institutionnelles et gouvernementales sur les soins aux animaux.
- Retirer rapidement les ee cerveau du crâne et les placer sur un bloc de dissection froide.
- Disséquer la région du cerveau appropriée de tissus frais et passez à l'étape 3.
3. homogénéisation des tissus entraînés par un moteur de verre Téflon Homogenizer
- Placer 50 à 100 mg (pour SPM), ou 100 à 200 mg (pour PSD) du tissu découpé dans un tube de 13 ml en polypropylene marqué contenant 4 ml de solution 0,32 M de saccharose tamponné à l'HEPES. Transférer l'échantillon dans un 15 ml conique tissu de verre Téflon broyeur / homogénéisateur, réglez la commande de moteur à 900 tours par minute (réglage 7) et homogénéiser l'échantillon avec 12 coups sur une période de 30 secondes. Utilisez un autre verre-téflon homogénéisation entre les échantillons, ou rincer l'homogénéisation avec de l'eau distillée froide entre les échantillons et essuyez avec un Kimwipe. NOTE: jusqu'à 4 g de tissu peut être homogénéisé dans 4 ml de sucrose 0,32 M de solution tampon HEPES, cependant il est préférable d'utiliser moins de tissu pour assurer un fractionnement convenable.
- Transférer l'échantillon homogénéisé dos to le même tube de 13 ml en polypropylene. Réserve 100 pi d'homogénat et conserver à -80 ° C pour la quantification de protéines et d'une analyse western blot de la fraction protéique total.
4. basse vitesse de centrifugation pour éliminer la fraction nucléaire (rendements surnageant S1)
- Centrifugeuse le broyat dans un rotor à angle fixe à 900 g pendant 10 min à 4 ° C. Transférer le surnageant (S1) pour une nouvelle, marquée 13 ml tube et remettre en suspension le culot nucléaire fraction (P1) dans 500 ul de 0,32 M saccharose tamponné à l'HEPES. NOTE: Le (P1) la fraction peut être conservé à -80 ° C et utilisé pour l'analyse western blot de la fraction nucléaire.
5. enrichissement de la fraction brute Synaptosomal (rendements Pellet P2)
- Centrifuger le surnageant (S1) à 10 000 g pendant 15 min à 4 ° C. Eliminer le surnageant (S2) et réserve de 500 pl dans un tube à centrifuger de stocker à -80 ° C pour la suite quant protéinefication et l'analyse western blot de l'/ fraction membranaire lumière cytosolique. Remettre en suspension le reste de la fraction synaptosomale brute pastille (P2) dans 1 ml de solution de saccharose 0,32 M tamponnée par HEPES, puis ajouter une autre solution de 3 ml de saccharose 0,32 M tamponné à l'HEPES.
- Centrifugeuse à 10.000 x g pendant 15 min à 4 ° C. Eliminer le surnageant (S2 ') et de la réserve de 500 pl dans un tube à centrifuger pour stocker à -80 ° C pour la quantification de protéines et d'une analyse western blot de l'/ fraction membranaire lumière cytosolique. Enregistrez le synaptosomale brut culot lavé (P2 ') dans le tube en polypropylène.
6. de lyse (hypoosmotiques choc) de la Fraction brut Synaptosomal
- Lyser les synaptosomes bruts pastille (P2 ') dans le tube en polypropylène par remise en suspension dans 1 ml de trou DDH 2 O. Ajouter un autre 3 ml de ddH 2 O, transférer à une homogénéisation des tissus de verre Téflon, et homogénéiser à la main avec 3 coups. NOTE: Il est importantd'effectuer cette étape aussi rapidement que possible et de procéder rapidement à l'étape 6.2.
- échantillons de transfert de l'homogénéisation de nouveau dans le même 13 ml tube en polypropylène et rapidement ajuster l'échantillon revenir à 4 mM HEPES avec 16 pi de 1 M solution HEPES, renverser pour mélanger.
- Faire tourner les échantillons à 4 ° C pendant 30 min pour assurer la lyse complète.
7. enrichissement de la fraction Synaptosomal membrane (P3)
- Centrifugeuse à 25 000 x g pendant 20 min à 4 ° C. Retirer le surnageant de la fraction vésiculaire brut (S3) et réserver dans un tube de 5 ml pour stocker à -80 ° C, pour la quantification de protéines et analyse subséquente western blot. Remettre en suspension de la fraction membranaire de synaptosomes (P3) dans 1 ml de solution de saccharose à 0,32 M tamponné à l'HEPES.
8 Préparation du gradient de saccharose discontinu
- Pipeter exactement 3,5 ml de solution de saccharose 1,2 M tamponné à l'HEPES et 3,0 ml chacune exactement de 1,0 M et 0,8 M HEPESolution de saccharose à S-tampon dans séparées 6 ml accrochage des tubes à bouchon. NOTE: Ceci est fait pour pré-mesurer les volumes des tampons qui sont utilisés pour faire le gradient de saccharose. Mesure exacte du volume est important de veiller à ce que les gradients résultants seront équilibrées par ultracentrifugation.
- En utilisant une pipette Pasteur en verre et ampoule, transférer 1,2 M solution de tampon HEPES saccharose à 12 ml polyallomère tube d'ultracentrifugation. Superposer soigneusement la solution de saccharose 1,0 M HEPES tamponné au-dessus de la solution de saccharose 1,2 M tamponné à l'HEPES. Enfin, la couche de la solution de saccharose 0,8 M HEPES tamponné au-dessus de la solution de saccharose 1,0 M tamponné à l'HEPES. Utilisez une pipette Pasteur frais pour chaque solution de saccharose et de prendre soin de ne pas perturber le gradient de saccharose. Vibrations d'un tourbillon de banc ou centrifuger viendra troubler l'intégrité du gradient.
- En utilisant une pipette Pasteur, la couche de la fraction membranaire de synaptosomes remis en suspension (P3) sur le dessus du gradient discontinu de saccharose préparé.Veiller à ce que les gradients sont équilibrés en les pesant à l'intérieur du seau du rotor à godets oscillants. Si les compartiments ne sont pas équilibrées, utiliser une pipette P200 à ajouter soigneusement saccharose 0,32 M tamponnée par HEPES à la partie supérieure du gradient et d'équilibrer les godets de rotor.
9 Le fractionnement de la membrane plasmique synaptique (SPM)
- Ultracentrifugation dans un seau rotor oscillant à 150 000 g pendant 2 h à 4 ° C. Retirez délicatement les gradients de saccharose des seaux d'ultracentrifugation. En utilisant une aiguille de 18 G et une seringue de 1 ml, la perforation du tube au fond de la solution de saccharose 1,0 M interphase / 1,2 M de tampon HEPES et retirer la couche de la membrane plasmique synaptique (SPM).
- Prenez note du volume que chaque échantillon de SPM occupe dans la seringue de 1 ml. Passer la couche de SPM recueillies dans 3,5 ml d'épaisseur de paroi des tubes d'ultracentrifugation, ajouter exactement 2,5 volumes de 4 mM de HEPES à ajuster la concentration en saccharose de 1,2 M à 0,32 M. Une fois que chaque échantillon a été ajustered à 0,32 M de saccharose, équilibrer les tubes avec une solution de saccharose 0,32 M tampon HEPES.
- Ultracentrifugation dans un rotor à angle fixe à 200 000 g pendant 30 min à 4 ° C. Retirer et jeter le surnageant. Remettre en suspension le culot de membranes synaptiques de plasma (SPM) dans 300 pi de solution de HEPES 50 mM / EDTA 2 mM. Conserver les échantillons à -80 ° C jusqu'à ce que le transfert de Western.
10 Préparation de la fraction de la densité post-synaptique (PSD)
- Décongeler les échantillons SPM sur la glace.
- Ajouter une solution de 0,54% de Triton X-100 dans une solution de HEPES 50 mM / EDTA 2 mM.
- Dans un tube de 5 ml en polystyrène, mélanger 2,7 ml de Triton X-100 / solution HEPES / EDTA et 300 pi de la fraction de SPM et faire tourner l'échantillon pendant 15 min à 4 ° C
- échantillons de transfert à 3,5 ml tubes d'ultracentrifugation à paroi épaisse et centrifuger les échantillons à 32 000 g pendant 20 min à 4 ° C.
- Réservez le surnageant (Triton X-100 fraction soluble [TS]) et conserver à -80; ° C. NOTE: A ce stade, le culot représente le "PSD-1T" fraction. Un second traitement avec un détergent va produire un "PSD-2T" fraction. Si une fraction PSD-1T est souhaité, passez à l'étape 10.6.
- Pour produire une fraction PSD-2T, remettre en suspension le culot dans 3 ml de 0,5% de Triton X-100 dans 50 mM de HEPES / 2 mM d'EDTA solution. Tournez échantillons pendant 15 min à 4 ° C. Centrifuger les échantillons à 32 000 g pendant 20 min à 4 ° C et passez à l'étape 10.6.
- Jeter le surnageant et remettre en suspension le post-synaptique (PSD) culot dans une solution à 50 mM HEPES / EDTA 2. REMARQUE: Le volume de remise en suspension peut dépendre de la taille de la pastille; un volume de 50-75 ul est recommandé. Étant donné que la fraction est une fraction PSD détergent insoluble, il est souvent nécessaire d'ajouter de 1 à 2 pi de SDS à 0,5% pour permettre la remise en suspension de la protéine complète. Conserver les échantillons à -80 ° C jusqu'à ce que le transfert de Western.
Résultats
La préparation du gradient de densité de saccharose devrait se traduire par une séparation claire des trois solutions molaires de saccharose (0,8, 1,0, et 1,2 M de saccharose). Voir la figure 3A un exemple de la pente avant de l'échantillon de protéine est ajoutée. Si le gradient est préparé trop à l'avance, ou si elle est préparée sur une surface de banc avec la vibration d'un autre appareil, le gradient sera compromise et la séparation adéquate ne sera pas atteint. Si une séparation claire des trois solutions n'est pas visible, il est conseillé de faire un nouveau dégradé avant d'ajouter l'échantillon de protéine. Voir la figure 3B un exemple de gradient de saccharose où l'échantillon de protéine est ajouté (flèche noire).
Après la centrifugation, il devrait y avoir des bandes claires de fractions de protéines à chaque interphase (0,32 / 0,8, 0,8 / 1,0, 1,0 / 1,2). En outre, une pastille doit être visible dans le bas du tube. Voir la figure 3C pour un exempledes bandes de fractions après ultracentrifugation. Si les fractions sont présentes seulement de manière diffuse à l'interphase, il est probable que le gradient a été compromise et le traitement n'est pas conseillé.
Western blot de l'ensemble, SPM et protéines PSD1T échantillons de striatum de souris est démontrée sur la figure 2. L'enrichissement de protéines synaptiques comme GluR1, PSD95, et CaMKII, peut être visualisé par le chargement d'une quantité constante de protéine (10 ug) à partir totale, SPM , et des fractions PSD. Protéines périsynaptiques comme le transporteur de la dopamine (DAT) sont enrichis dans la fraction de SPM, mais sont éliminés dans les étapes de détergent ultérieures du processus d'enrichissement PSD.
Pour assurer le chargement équivalent, les taux de protéine peuvent être visualisées sur la membrane western blot par coloration au rouge Ponceau 26. «Contrôles de chargement» à base d'anticorps sont souvent rapportée dans la littérature, mais cela peut être un abus de langage car les protéines synaptiques peuvent être differentially réglementée dans les groupes de traitement expérimental. Si un «témoin de charge" à base d'anticorps est souhaité, il est conseillé de d'abord déterminer chargement de protéines équivalent par Ponceau coloration, puis tester plusieurs protéines de référence afin d'identifier ceux qui ne changent pas dans les différents groupes expérimentaux.
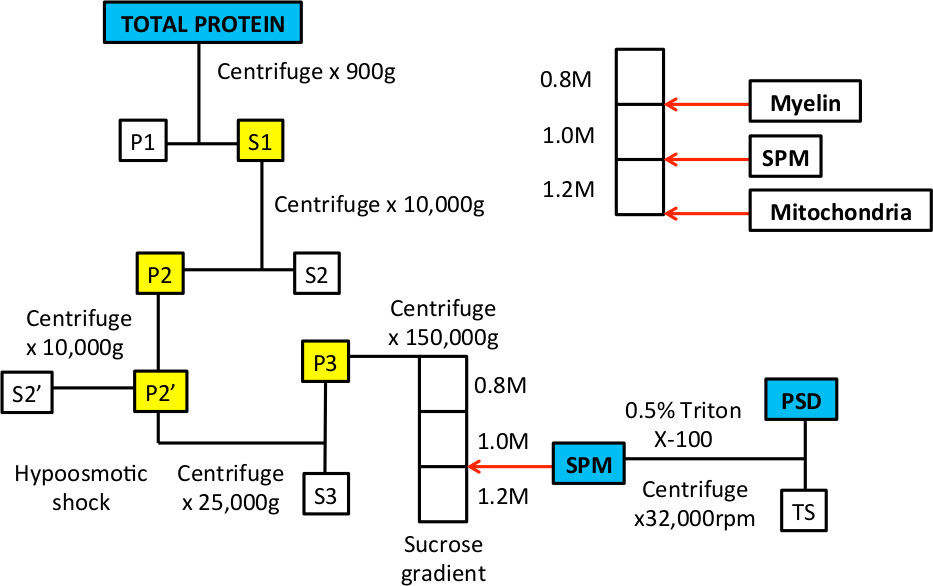
Figure 1: Flux de fractionnement subcellulaire d'enrichir SPM et fractions protéiques PSD.

Figure 2: Western blot représentatif du total, SPM, et la protéine de PSD1T de striatum de souris. 10 pg d'extrait de protéine ont été séparés sur SDS-dénaturation, 10% acryldes gels d'amide, et transférés sur des membranes de PVDF. Par la suite ces transferts ont été incubées avec des anticorps primaires pour αCaMKII, GluR1, PSD-93, et PSD-95, qui sont toutes les composantes de la densité post-synaptique. En conséquence, ces protéines sont enrichies dans le SPM et les fractions PSD. En variante, des transferts ont été incubés avec un anticorps primaire de DAT, qui se trouve dans les membranes pré-synaptiques dans le striatum. Bien DAT est enrichi dans la fraction de SPM, il ne fait pas partie du complexe de PSD, et une immunoréactivité n'a pas été observée dans la fraction PSD. Les anticorps dirigés contre l'actine ou de sodium / potassium ATPase (pompe Na / K) peuvent être utilisés comme témoins de chargement, bien que certaines conditions expérimentales peuvent affecter les niveaux de ces protéines ainsi et si le contrôle de chargement approprié doivent être déterminées de manière empirique.

Figure 3. Des exemples représentatifs de gradient de saccharose avant et après ultracentrifugation. A. Après le gradient est préparé, il devrait y avoir trois phases qui sont visibles lorsque le tube est maintenu en place à la lumière. Les flèches blanches indiquent l'interphase entre 0,8 / 1,0 M de solutions de saccharose et 1,0 / 1,2 M de solutions de saccharose. B. Lorsque l'échantillon est chargé sur le dessus de la pente, il se trouve dans une solution 0,32 M de saccharose et reposer sur le dessus de la 0,8 M couche saccharose. C. Après centrifugation, le produit d'homogénéisation se séparer en plusieurs fractions. La fraction flottante à l'interphase de 0,8 / 1,0 M de solutions de saccharose sera enrichie en membranes de la myéline. La fraction de l'interphase de 1,0 / 1,2 M de solutions de saccharose représente la fraction de GPS qui sont collectées avec une aiguille et une seringue. Le culot au fond du tube est enrichie en protéines mitochondriales.
| Solutions | Saccharose tamponnée par HEPES | Les inhibiteurs de protéase | * inhibiteurs de la phosphatase |
| 1 M de HEPES pH 7,4 | 0,32 M de saccharose à 4 mM de HEPES (pH 7,4) | 0,25 mM de PMSF (actions 250 mM dans l'éthanol, 1,000x) | 10 mM de fluorure de sodium (500 mM actions, 50x) |
| 4 mM de HEPES pH 7,4 | 0,8 M de saccharose à 4 mM de HEPES (pH 7,4) | 1,5 pg / ml d'aprotinine (actions de 1,5 mg / ml, 1,000x) | 2,5 mM de pyrophosphate (actions 250 mM, 100x) |
| ddH 2 O | 1,0 M de saccharose à 4 mM de HEPES (pH 7,4) | 10 pg / ml Leupeptine (stock 10 mg / ml, 1,000x) | 1,0 mM b-glycérophosphate (actions 200 mM, 200x) |
| HEPES 50 mM (pH 7,4), EDTA 2 mM | 1,2 M de saccharose à 4 mM de HEPES (pH 7,4) | 0,1 mg / ml Benzamidine (stock 100 mg / ml, 1,000x) | 5.0mM sodium orthovanadate (actions 500 mM, 100x) |
| 10 pg / ml Pepstatine (stock 5 mg / ml dans de l'éthanol, 500x) |
Tableau 1 réactifs nécessaires
| Fraction | la fraction de protéine | marqueur de protéine |
| P1 | nucléaire | histone H1 27 |
| S1 | cytosol / membranes | calnexine 28 (de réticulum endoplasmique), une tubuline 29 (cytosquelette), GAPDH 30 (cytosol), 58K Golgi proprotéine 31 (de l'appareil de Golgi) |
| P2 et P2 ' | synaptosomes bruts | AMPA et NMDA sous-unités des récepteurs 32 |
| S2 et S2 ' | cytosol / membranes légères | nNOS1 29 (cytosol), GAPDH (cytosol), LAMP1 33 (lysosome), PEX14 34 (peroxysomes) |
| P3 | synaptosome / mitochondries | VDAC 35 (mitochondries), AMPA et NMDA sous-unités des récepteurs (synaptosomes) |
| S3 | vésicule synaptique | SV2 8, synaptophysine 8 |
| 0,8 M / 1,0 M | m yelin | protéine basique de la myéline 36 |
| 1,0 M / 1,2 M | SPM | AMPA et NMDA unités des récepteurs, marqueur présynaptique (SNAP25 8), neurexine 32, 32 neuroligine |
| 1.2 MP | mitochondries | VDAC 35 |
| PSD (1T) | PSD | PSD93 32, PSD95 32, AMPA et NMDA unités des récepteurs, neuroligin, PICK1 32, 32 CaMKII |
| TS | membranes présynaptiques | SNAP25, Munc18 37, Basson 38, neurexine |
| enrichi PSD | PSD95, AMPA et NMDA sous-unités des récepteurs, PICK1, CaMKII |
Tableau 2 Liste des marqueurs protéiques de distinguer les fractions subcellulaires
Discussion
Il ya plusieurs étapes de la procédure qui sont essentiels pour le succès. A l'étape 3, il est important qu'un certain degré de cohérence homogénéisation est obtenue pour chaque échantillon. Lorsque le tissu avec le moteur entraîné homogénéisateur homogénéisation, une vitesse constante est utilisée non seulement pour la rotation du pilon, mais également avec le nombre de coups. Le temps d'incubation au cours du choc osmotique doit être précise, car homogénéisation prolongée ou incubation dans la solution hypotonique se lyser les mitochondries et contaminer l'échantillon de SPM.
Une autre étape est critique dans la préparation des réactifs, en particulier les solutions de saccharose; si la molarité de la solution de saccharose est incorrect, le mode opératoire ne fonctionne pas. Par conséquent, les solutions de saccharose doivent être préparées en pesant le saccharose, le dissolvant dans une solution 4 mM d'HEPES, puis l'ajout de 4 mM de HEPES à un volume final précis. Conseil de dépannage: construire un gradient de test avec les solutions de saccharose préparés à envous que le gradient est correctement assemblé. Ajouter des concentrations variables de bleu de bromophénol (par exemple, la concentration finale de 0,005% -0,02% p / v) pour les deux premières des trois solutions de saccharose pour aider à la visualisation de trois couches distinctes.
Il est important de limiter la quantité de temps entre le moment où le gradient est monté et lorsque les tubes sont centrifugés. Diffusion normale va détruire le gradient dans le temps, ce qui est accéléré en cas de vibration sur le banc où le gradient est stocké. Pré-pipetage de solutions dans des aliquotes individuelles permet de volumes précis à la pipette avec une pipette Pasteur en verre. Ceci diminue également le temps entre l'assemblage et l'ultracentrifugation à gradient. Conseil de dépannage: construire un «gradient d'essai» avec un colorant bleu de bromophénol comme décrit ci-dessus en même temps que les gradients de saccharose pour l'expérience. L'intégrité de la pente peut donc être suivie au cours du temps. Le gradient de test servira d'indicateur de diffusion si les gradients sont assemblés trop à l'avance ou sont exposés à des vibrations.
Enfin, il est important pour collecter l'échantillon de SPM dans un volume aussi petit que possible, car il est ensuite nécessaire de diluer l'échantillon avec 2,5 volumes d'eau. Idéalement, l'échantillon doit être prélevé dans un volume de 0,4-0,7 ml en utilisant une seringue de 1 cc. Il est conseillé de construire les gradients discontinus pendant 20 min essorage final à l'étape 7 de limiter le temps entre l'ensemble gradient et ultracentrifugation.
Le protocole comprend la recommandation de réserver toutes les différentes fractions et les stocker à -80 ° C pour analyse ultérieure. Nous avons démontré l'enrichissement de protéines post-synaptiques de la figure 2 en seulement quelques uns de ces fractions. Cependant, il est souhaitable de mesurer les niveaux d'une protéine d'intérêt dans chacune des fractions de comprendre sa distribution. En comparant la distribution d'une protéine dans les fractions avec d'autres protéines marqueurs subcellulaires permettra également de vérifier que les conditions expérimentales ont donné le fractionnement souhaité. tableau 2 résume les marqueurs protéiques couramment utilisés qui peuvent être utilisés comme indicateurs pour les étapes de fractionnement 8,27- 38.
Utilisation du gradient de saccharose discontinu est largement utilisé pour enrichir les membranes plasmiques synaptiques. Cette méthode a l'avantage sur gradients de Percoll continu en ce gradient de saccharose discontinues sont plus faciles à faire et ne nécessite pas d'équipement spécialisé. Cependant, cette méthode peut ne pas être suffisante pour localiser précisément une protéine d'intérêt, et pour ces applications, un gradient de Percoll peut être préféré.
Déclarations de divulgation
The authors have no conflicts of interest to disclose.
Remerciements
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
matériels
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
Références
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon