Method Article
Preparación de sináptica Membrana plasmática y proteínas postsináptica densidad utilizando un gradiente discontinuo de sacarosa
* Estos autores han contribuido por igual
En este artículo
Resumen
Este artículo detalla el enriquecimiento de las proteínas asociadas con la membrana plasmática sináptica por ultracentrifugación en un gradiente discontinuo de sacarosa. También se describe la preparación posterior de las proteínas de densidad post-sináptica. Preparaciones de proteínas son adecuados para el Western Blot o análisis DIGE 2D.
Resumen
Técnicas de fraccionamiento subcelular neuronales permiten la cuantificación de proteínas que son objeto de trata hacia y desde la sinapsis. Como se describió originalmente en la década de 1960, las proteínas asociadas con la membrana plasmática sináptica se pueden aislar mediante ultracentrifugación en un gradiente de densidad de sacarosa. Una vez que se aislaron las membranas sinápticas, el complejo macromolecular conocido como la densidad post-sináptica puede ser posteriormente aislado debido a su insolubilidad detergente. Las técnicas usadas para aislar las membranas plasmáticas sinápticas y proteínas de densidad post-sinápticas siguen siendo esencialmente la misma después de 40 años, y se utilizan ampliamente en la investigación neurocientífica actual. Este artículo detalla el fraccionamiento de las proteínas asociadas con la membrana plasmática sináptica y post-sináptica densidad utilizando un gradiente discontinuo de sacarosa. Preparaciones de proteínas resultantes son adecuadas para el Western Blot o análisis DIGE 2D.
Introducción
Las neuronas se comunican a través de las sinapsis, y la calidad de esta comunicación está regulada en gran medida por las alteraciones en la composición de las proteínas en la sinapsis. En particular, las proteínas localizadas en la densidad post-sináptica participan en la comunicación neuronal por receptores de neurotransmisores íntimamente andamiaje con sus sistemas de transducción de señales 1. Además, los cambios duraderos en la fuerza de la eficacia sináptica son controlados por la adición o eliminación de los receptores a la densidad post-sináptica 1-6. Por lo tanto, el aislamiento y la cuantificación de las proteínas sinápticas es una técnica necesaria y útil para comprender mejor la forma en que las neuronas responden a estímulos y alterar la eficacia sináptica 7. Este artículo describe una técnica común para aislar proteínas sinápticas de tejido cerebral de roedor por ultracentrifugación en gradientes de sacarosa discontinuos. La fracción de membrana plasmática sináptica puede ser enriquecido y aislado basándose en elsu densidad en sacarosa, que ha sido determinado empíricamente para ser similar a 1.2 M de sacarosa.
Dependiendo de la pregunta biológica, fracciones subcelulares se pueden separar por gradientes continuos o discontinuos de Percoll, ya sea sacarosa o. Gradientes continuos permiten la separación de las proteínas en fracciones múltiples; esto puede ser particularmente útil para demostrar la co-localización de las proteínas dentro de una fracción dada 8. Sin embargo, la preparación de gradientes continuos es más laborioso y no es necesaria para muchas aplicaciones. Gradientes discontinuos son comparativamente más fáciles de preparar y se pueden utilizar para separar proteínas en unas pocas fracciones, definidos en general-. Gradientes discontinuos que están compuestos de tres capas de sacarosa de molaridad creciente han sido ampliamente utilizados para aislar proteínas asociadas con la membrana plasmática sináptica (SPM). Esta fracción de membrana plasmática sináptica se puede procesar adicionalmente a la fractio densidad post-sináptican (PSD) por tratamiento con detergente y el aislamiento de la fracción insoluble en detergente.
Cuando este proceso fue descrito por primera vez en el 1960 de 9,10, se utilizó microscopía electrónica para demostrar los orgánulos y membranas que definen aproximadamente la membrana plasmática sináptica y fracciones de densidad post-sináptica 9-14. Estos estudios demostraron la inclusión de membranas pre y post-sinápticas y vesículas sinápticas en la fracción SPM; después de tratamiento con detergente principalmente el electrón-densos, las densidades de post-sinápticas eran visibles. En el procedimiento, un choque hipotónico se utiliza para evitar el paso de los procesos sinápticos desde el cuerpo celular 10. Este paso se aprovecha del hecho de que las mitocondrias son más resistentes a choque osmótico y permanecen intactos, y por lo que se sedimentan en la parte inferior del gradiente de sacarosa (Figura 1).
Utilizando esta misma técnica de enriquecimiento, las fracciones de SPM y PSD fueron primero bioquímicamentedefinido por electroforesis en gel de poliacrilamida y la secuenciación de los principales componentes de la proteína de 15-17. El análisis de transferencia Western Posteriormente se ha utilizado para detectar y cuantificar los niveles de proteínas sinápticas y definir estas fracciones (Figura 2). Hemos utilizado esta técnica en nuestros laboratorios para cuantificar los cambios en los niveles sinápticos de transportador de dopamina que se producen cuando el locus SLC6A3 se duplica en ratones 18. También hemos utilizado esta técnica en ratones deficientes del receptor NMDA para descubrir reducciones sinápticos específicos en las proteínas que forman parte de la interactome DISC1 19.
Es evidente a partir de análisis de transferencia Western que las fracciones SPM contienen proteínas sinápticas membrana de la vesícula, marcadores endosoma, proteínas asociadas a la membrana mitocondrial, enzimas sintéticas y moléculas de transducción de señales, así como componentes integrales de la densidad post-sináptica y las membranas plasmáticas sinápticas 20-23. Efracciones PSD VEN pueden tener contaminación con abundantes proteínas mitocondriales y puede ser necesario realizar una segunda sedimentación gradiente o etapas de purificación adicionales para eliminarlos 13. Recientemente, la espectrometría de masas cuantitativa ha proporcionado una lista de más de 100 proteínas en la densidad post-sináptica solo, así como una indicación de la abundancia relativa de estos componentes 24,25.
Protocolo
El siguiente protocolo se ajusta a las directrices del Consejo Canadiense de Cuidado Animal y ha sido aprobado por la Facultad de Medicina y del Comité de Cuidado de Animales de Farmacia de la Universidad de Toronto.
1. Preparar Obligatorio reactivos como se indica en la Tabla 1
- Añadir proteasa y fosfatasa (si es necesario) inhibidores a todas las soluciones de sacarosa, tampones y ddH2O a concentraciones descritas en la Tabla 1. IMPORTANTE: Realice todos los pasos a 4 ° C y pre-cool todos los reactivos y equipos antes del inicio del experimento. Etiquetar todos los tubos, incluyendo tubos de ultracentrífuga, con marcador permanente.
2. Disección de la región cerebral adecuada
- Sacrificar el animal por dislocación cervical o decapitación. Casa y eutanasia de animales de acuerdo con las políticas institucionales y gubernamentales en el cuidado de animales.
- Eliminar rápidamente ªe cerebro del cráneo y el lugar en un bloque de disección fría.
- Diseccionar la región cerebral correspondiente de tejido fresco y vaya al paso 3.
3. homogeneización de tejido con accionado por motor de vidrio-teflón Homogeneizador
- Coloque 50-100 mg (por SPM), o 100-200 mg (por PSD) del tejido diseccionado en un tubo de polipropileno de 13 ml marcado que contiene 4 ml de solución de sacarosa 0,32 tamponada con HEPES M. Transferir la muestra a un 15 ml cónico tejido de vidrio-teflón grinder / homogeneizador, establezca la unidad de motor a 900 rpm (posición 7) y homogeneizar la muestra con 12 golpes en un período de 30 segundos. Utilice un homogeneizador de vidrio-teflón diferente entre las muestras, o enjuagar el homogeneizador con agua destilada fría entre las muestras y seque con un Kimwipe. NOTA: Hasta 4 g de tejido se puede homogeneizar en 4 ml de solución de sacarosa 0,32 tamponada con HEPES M, sin embargo, es aconsejable usar menos tejido para asegurar fraccionamiento adecuado.
- Transferir la muestra homogeneizada espalda to el mismo tubo de polipropileno de 13 ml. Reserva 100 l de homogeneizado y almacenar a -80 ° C para la cuantificación de proteínas y posterior análisis de Western blot de la fracción de proteína total.
4. baja velocidad de centrifugación para eliminar la fracción nuclear (rendimientos sobrenadante S1)
- Centrifugar el homogeneizado en un rotor de ángulo fijo a 900 xg durante 10 min a 4 ° C. Transferir el sobrenadante (S1) a una nueva, etiquetado tubo de 13 ml y resuspender el precipitado fracción nuclear (P1) en 500 l de sacarosa 0,32 M tamponada con HEPES. NOTA: El (P1) fracción puede ser almacenado a -80 ° C y se utiliza para el análisis de transferencia de Western de la fracción nuclear.
5. enriquecimiento de la fracción bruta sinaptosomal (rendimientos Pellet P2)
- Centrifugar el sobrenadante (S1) a 10.000 xg durante 15 min a 4 ° C. Eliminar el sobrenadante (S2) y de reserva 500 l en un tubo de microcentrífuga para almacenar a -80 ° C para su posterior quant proteínaficación y análisis de Western blot de la fracción de membrana citosólica / luz. Resuspender el restante sinaptosomal crudo fracción de sedimento (P2) en 1 ml de solución de sacarosa tamponada con HEPES 0,32 M y luego agregar otra solución de sacarosa tamponada con HEPES 3 ml de 0,32 M.
- Se centrifuga a 10.000 x g durante 15 min a 4 ° C. Eliminar el sobrenadante (S2 ') y de reserva 500 l en un tubo de microcentrífuga para almacenar a -80 ° C para la cuantificación de proteínas y posterior análisis de Western blot de la fracción de membrana citosólica / luz. Guarde el lavado de pellets sinaptosomal crudo (P2 ') en el tubo de polipropileno.
6. lisis (Hipoosmótico Choque) de la Fracción crudo sinaptosomal
- Lyse el pellet sinaptosomal crudo (P2 ') en el tubo de polipropileno mediante resuspensión en 1 ml de ddH 2 O. Añadir otro 3 ml de ddH2O, transfiera a un homogeneizador de tejidos de vidrio-teflón, y homogeneizar a mano con 3 golpes. NOTA: Es importantepara llevar a cabo este paso lo más rápidamente posible y rápidamente vaya al paso 6.2.
- Muestras de traslado desde el homogeneizador de nuevo en el mismo tubo de polipropileno de 13 ml y ajustar rápidamente la muestra de nuevo a 4 mM HEPES con 16 l de una solución 1 M HEPES, invierten para mezclar.
- Girar las muestras a 4 ° C durante 30 minutos para asegurar la lisis completa.
7. Enriquecimiento de la Fracción sinaptosomal Membrana (P3)
- Centrifugar a 25.000 x g durante 20 min a 4 ° C. Retire el crudo vesicular fracción sobrenadante (S3) y reservar en un tubo de 5 ml para almacenar a -80 ° C para la posterior cuantificación de proteínas y análisis de transferencia Western. Resuspender la fracción de membrana de sinaptosomas (P3) en 1 ml de solución de sacarosa 0,32 tamponada con HEPES M.
8 Preparación del gradiente de sacarosa discontinuo
- Pipetear exactamente 3,5 ml de solución de sacarosa tamponada con HEPES 1,2 M y exactamente 3,0 ml de cada uno de 1,0 M y 0,8 M HEPESolución de sacarosa S-guardado en separadas 6 ml complemento de tubos con cierre. NOTA: Esto se hace para medir la validez de los volúmenes de las memorias intermedias que se utilizan para hacer que el gradiente de sacarosa. La medición exacta de los volúmenes es importante asegurarse de que los gradientes resultantes serán equilibradas para ultracentrifugación.
- Utilizando una pipeta Pasteur de vidrio y el bulbo, transferir solución de sacarosa 1,2 M tamponada con HEPES a los 12 ml tubo ultracentrifugadora polialómero. Capa cuidadosamente la solución de sacarosa tamponada con HEPES 1,0 M en la parte superior de la solución de sacarosa tamponada con HEPES 1,2 M. Finalmente, la capa de la solución de sacarosa tamponada con HEPES 0,8 M en la parte superior de la solución de sacarosa tamponada con HEPES 1,0 M. Utilice una pipeta Pasteur nueva para cada solución de sacarosa y tener cuidado de no alterar el gradiente de sacarosa. Las vibraciones de un vórtice banco o microcentrífuga esperar perturbaciones de la integridad de la gradiente.
- Utilizando una pipeta Pasteur, la capa de la fracción de membrana sinaptosomal se resuspendió (P3) en la parte superior del gradiente discontinuo de sacarosa preparada.Asegúrese de que los gradientes se equilibran con un peso en el interior del cubo de rotor basculante. Si los cubos no están equilibradas, utilizar una pipeta P200 para agregar cuidadosamente sacarosa 0,32 M tamponada con HEPES a la parte superior del gradiente y el equilibrio de los cubos del rotor.
9. El fraccionamiento de la membrana plasmática sináptica (SPM)
- Ultracentrífuga en un rotor basculante a 150.000 xg durante 2 horas a 4 ° C. Retire con cuidado los gradientes de sacarosa de los cubos de ultracentrífuga. Uso de un 18 G aguja y una jeringa de 1 ml, perforar el tubo en la parte inferior de la solución de sacarosa tamponada con HEPES interfase 1,0 M / 1,2 M y retirar la capa de membrana plasmática sináptica (SPM).
- Anote el volumen que cada muestra de SPM ocupa en la jeringa de 1 ml. Coloque la capa de SPM recogido en 3,5 ml tubos de ultracentrífuga de pared gruesa, añadir exactamente 2,5 volúmenes de 4 mM HEPES para ajustar la concentración de sacarosa de 1,2 M a 0,32 M. Una vez cada muestra ha sido ajustared a 0,32 M de sacarosa, equilibrar los tubos con 0,32 solución de sacarosa tamponada con HEPES M.
- Ultracentrífuga en un rotor de ángulo fijo a 200.000 xg durante 30 min a 4 ° C. Retire y deseche el sobrenadante. Resuspender el pellet sináptica membrana plasmática (SPM) en 300 l de 50 mM EDTA solución HEPES / 2 mM. Guardar las muestras a -80 ° C hasta su utilización para el Western Blot.
10 Preparación de la Fracción de densidad postsináptica (PSD)
- Descongele las muestras de SPM en hielo.
- Hacer una solución de 0,54% de Triton X-100 en 50 mM de solución EDTA HEPES / 2 mM.
- En un tubo de poliestireno de 5 ml, se combinan 2,7 ml de Triton X-100 / / solución de EDTA y 300 l fracción SPM HEPES y rotar la muestra durante 15 min a 4 ° C
- Muestras de traslado hasta 3,5 ml tubos de ultracentrífuga de pared gruesa y Centrifugar las muestras a 32.000 xg durante 20 min a 4 ° C.
- Reservar el sobrenadante (Triton X-100 fracción soluble [TS]) y se almacena a -80; ° C. NOTA: En esta etapa, el sedimento representa el "PSD-1T" fracción. Un segundo tratamiento con detergente producirá una "PSD-2T" fracción. Si se desea una fracción PSD-1T, continúe en el paso 10.6.
- Para producir una fracción PSD-2T, resuspender el sedimento en 3 ml de 0,5% de Triton X-100 en 50 mM HEPES / EDTA 2 mM solución. Gire las muestras durante 15 minutos a 4 ° C. Centrifugar las muestras a 32.000 xg durante 20 min a 4 ° C y continuar con el paso 10.6.
- Descartar el sobrenadante y resuspender el postsináptica (PSD) pellet en solución de 50 mM de HEPES / EDTA 2 mM. NOTA: El volumen de resuspensión puede depender del tamaño de la pastilla; Se recomienda un volumen de 50-75 l. Debido a que el PSD fracción es una fracción insoluble en detergente, a menudo es necesario añadir 1-2 l de 0,5% de SDS para permitir la resuspensión completa de proteínas. Guardar las muestras a -80 ° C hasta su utilización para el Western Blot.
Resultados
La preparación del gradiente de densidad de sacarosa debe dar lugar a una clara separación de las tres soluciones molares de sacarosa (0,8, 1,0, y 1,2 M de sacarosa). Véase la Figura 3A para un ejemplo del gradiente antes de añadir la muestra de proteína. Si el gradiente se prepara con demasiada antelación, o si se prepara en una superficie de la mesa con la vibración de otro equipo, el gradiente se verá comprometida y no se logra una separación adecuada. Si una clara separación de las tres soluciones no es visible, es recomendable hacer un nuevo gradiente antes de añadir la muestra de proteína. Véase la Figura 3B para un ejemplo del gradiente de sacarosa cuando se añade la muestra de proteína (flecha negro).
Después de la centrifugación, debe haber bandas claras de fracciones de proteína en cada interfase (0,32 / 0,8, 0,8 / 1,0, 1,0 / 1,2). Además un pellet debe ser visible en la parte inferior del tubo. Ver Figura 3C para un ejemplode las bandas de fracción después de la ultracentrifugación. Si fracciones son sólo difusamente presente en la interfase, es probable que el gradiente se ve comprometida y posterior procesamiento no se aconseja.
Western Blot del total, SPM y proteínas PSD1T muestras de cuerpo estriado del ratón se muestra en la Figura 2. El enriquecimiento de las proteínas sinápticas como GluR1, PSD95 y CaMKII, se puede visualizar mediante la carga de una cantidad constante de proteína (10 g) de total, SPM y fracciones PSD. Proteínas Perisynaptic como el transportador de dopamina (DAT) se enriquecen en la fracción SPM, pero se eliminan en los pasos de detergente posteriores del proceso de enriquecimiento de PSD.
Para asegurar una carga equivalente, los niveles de proteína se pueden visualizar en la membrana de transferencia de western por tinción con Ponceau Red 26. "Controles de carga" a base de anticuerpos con frecuencia se reporta en la literatura, pero esto puede ser un nombre inapropiado ya que las proteínas sinápticas pueden ser diferentially regulada en grupos de tratamiento experimentales. Si se desea un "control de carga" a base de anticuerpos, es aconsejable determinar primero la carga de proteínas equivalente por tinción con Ponceau y pruebe varias proteínas de referencia para identificar aquellos que no cambian en los diferentes grupos experimentales.
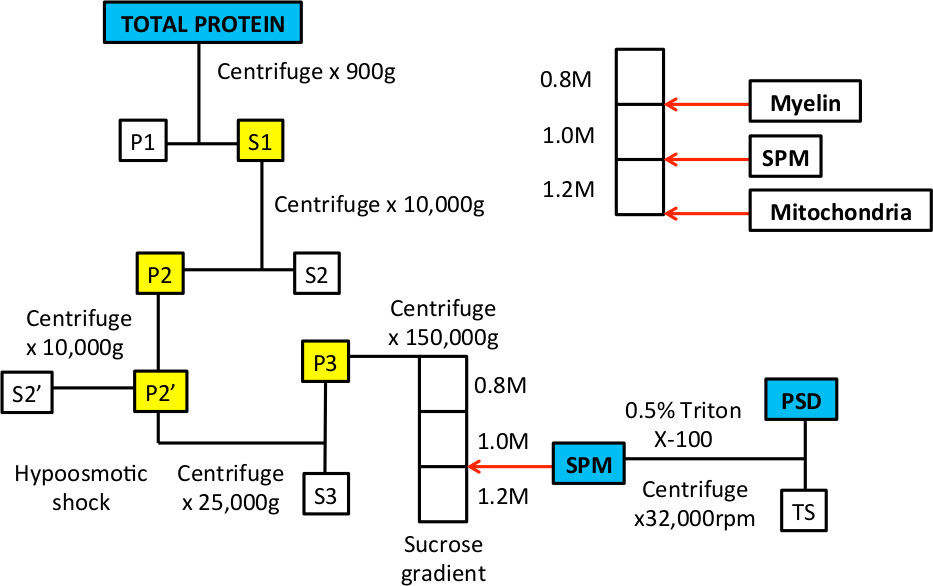
Figura 1 Flujo de trabajo de fraccionamiento subcelular para enriquecer SPM y fracciones de proteína PSD.

Figura 2. Representante western blot del total, SPM, y la proteína PSD1T del cuerpo estriado del ratón. 10 g de extracto de proteínas se resolvieron en SDS-desnaturalización, 10% acrílicogeles de amida, y se transfirieron a membranas de PVDF. Posteriormente estas transferencias fueron incubadas con anticuerpos primarios para αCaMKII, GluR1, PSD-93, y el PSD-95, que son todos los componentes de la densidad post-sináptica. En consecuencia, estas proteínas se enriquecen en el SPM y las fracciones PSD. Alternativamente, blots se incubaron con un anticuerpo primario para DAT, que se encuentra en las membranas presinápticas en el cuerpo estriado. Mientras DAT se enriquece en la fracción SPM, no es parte del complejo de PSD, y la inmunorreactividad no se observa en la fracción PSD. Los anticuerpos contra la actina o de sodio / potasio ATPasa (bomba de Na / K) se pueden usar como controles de carga, aunque algunas condiciones experimentales pueden afectar los niveles de estas proteínas, así y por lo que el control de carga apropiada deben determinarse empíricamente.

Figura 3. Ejemplos representativos de gradiente de sacarosa antes y después de la ultracentrifugación. A. Después se prepara el gradiente, debe haber tres fases que son visibles cuando el tubo se mantiene hasta la luz. Las flechas blancas indican la interfase entre 0,8 / 1,0 M soluciones de sacarosa y 1,0 / 1,2 M soluciones de sacarosa. B. Cuando la muestra se carga en la parte superior del gradiente, es en una solución de sacarosa 0,32 M y se apoyará sobre la parte superior de la 0,8 capa de sacarosa M. C. Después de la centrifugación, el homogeneizado se separará en varias fracciones. La fracción flotante en la interfase de 0,8 / 1,0 M soluciones de sacarosa se verá enriquecida en membranas de mielina. La fracción en la interfase de 1,0 / 1,2 M soluciones de sacarosa representa la fracción SPM que se recoge con una aguja y una jeringa. El sedimento en la parte inferior del tubo está enriquecida para las proteínas mitocondriales.
| Soluciones | Sacarosa tamponada con HEPES | Inhibidores de la proteasa | * inhibidores de la fosfatasa |
| 1 M de HEPES pH 7,4 | 0,32 M de sacarosa en mM HEPES 4 (pH 7,4) | 0,25 mM PMSF (de stock 250 mM en etanol, 1,000x) | 10 mM de fluoruro de sodio (500 mM de stock, 50x) |
| 4 mM de HEPES pH 7,4 | 0,8 M de sacarosa en mM HEPES 4 (pH 7,4) | 1,5 mg / ml de aprotinina (acción 1.5 mg / ml, 1,000x) | 2,5 mM pirofosfato de sodio (250 mM de stock, 100x) |
| ddH2O | 1,0 M de sacarosa en mM HEPES 4 (pH 7,4) | 10 mg / ml leupeptina (madre 10 mg / ml, 1,000x) | 1.0 mm B-glicerofosfato (de stock 200 mM, 200x) |
| HEPES 50 mM (pH 7,4) EDTA 2 mM | 1,2 M de sacarosa en mM HEPES 4 (pH 7,4) | 0,1 mg / ml de benzamidina (Stock 100 mg / ml, 1,000x) | 5.0mM de sodio Ortovanadato (de stock 500 mM, 100x) |
| 10 mg / ml Pepstatina (almacén 5 mg / ml en etanol, 500x) |
Cuadro 1 Requeridos Reactivos
| Fracción | Fracción proteica | Marcador de proteína |
| P1 | nuclear | la histona H1 27 |
| S1 | citosol / membranas | 28 calnexina (retículo endoplasmático), un 29-tubulina (citoesqueleto), GAPDH 30 (citosol), 58K golgi Protein 31 (aparato de Golgi) |
| P2 y P2 ' | sinaptosomas crudo | AMPA y NMDA subunidades del receptor 32 |
| S2 y S2 ' | citosol / membranas ligeras | nNOS1 29 (citosol), GAPDH (citosol), LAMP1 33 (lisosoma), PEX14 34 (peroxisoma) |
| P3 | sinaptosoma / mitocondria | VDAC 35 (mitocondrias), AMPA y NMDA receptor subunidades (sinaptosoma) |
| S3 | vesícula sináptica | SV2 8, sinaptofisina 8 |
| 0,8 M / 1,0 M | m yelin | proteína básica de mielina 36 |
| 1,0 M / 1,2 M | SPM | Subunidades del receptor de AMPA y NMDA, marcador presináptica (SNAP25 8), neurexin 32, neuroligin 32 |
| 1.2 MP | mitocondrias | VDAC 35 |
| PSD (1T) | PSD | PSD93 32, PSD95 32, subunidades del receptor de AMPA y NMDA, neuroligin, PICK1 32, CaMKII 32 |
| TS | membranas presinápticas | SNAP25, Munc18 37, Fagot 38, neurexin |
| enriquecido PSD | Subunidades del receptor PSD95, AMPA y NMDA, PICK1, CaMKII |
Cuadro 2 Lista de marcadores de proteínas distinguir fracciones subcelulares
Discusión
Hay varios pasos en el proceso que son críticos para un resultado exitoso. En el paso 3, es importante que un grado consistente de homogeneización se logra para cada muestra. Cuando la homogeneización de tejido con el homogeneizador accionado por motor, una velocidad constante se utiliza no sólo para la rotación de la mano del mortero, pero también con el número de golpes. El tiempo de incubación durante el choque osmótico debe ser preciso, ya que la homogeneización ampliada o de la incubación en la solución hipotónica se lisarán mitocondrias y contaminar la muestra de SPM.
Otro paso es crítico en la preparación de los reactivos, especialmente las soluciones de sacarosa; si la molaridad de la solución de sacarosa es incorrecto el procedimiento no funcionará. Por lo tanto, las soluciones de sacarosa deben ser preparados por un peso de sacarosa, disolviendo en solución 4 mM de HEPES a continuación, añadir 4 mM HEPES hasta el volumen final precisa. Punta Solución de problemas: construir un gradiente de ensayo con las soluciones de sacarosa preparados para enAsegúrese de que el gradiente está armada correctamente. Añadir concentraciones variables de azul de bromofenol (por ejemplo, concentración final de 0,005% -0,02% w / v) a la dos de las tres soluciones de sacarosa para ayudar en la visualización de tres capas distintas.
Es importante limitar la cantidad de tiempo entre cuando el gradiente se ensambla y cuando se centrifugan los tubos. Difusión normal destruirá el gradiente en el tiempo, y esto se acelera si hay vibración en el banco donde se almacena el gradiente. Pre-pipeteo de soluciones en partes alícuotas individuales permite volúmenes precisos que se debe verter con una pipeta Pasteur de vidrio. Esto también disminuye el tiempo entre el conjunto de gradiente y ultracentrifugación. Solución de problemas punta: construir un "gradiente de prueba" con colorante azul de bromofenol como se describió anteriormente, al mismo tiempo que los gradientes de sacarosa para el experimento. La integridad del gradiente por lo tanto se puede controlar a través del tiempo. El gradiente de prueba servirá como unindicador de difusión si los gradientes se ensamblan con demasiada anticipación o están expuestos a vibraciones.
Finalmente, es importante para recoger la muestra SPM en un volumen tan pequeño como sea posible, ya que es necesario para diluir posteriormente la muestra con 2,5 volúmenes de agua. Idealmente, la muestra se debe recoger en un volumen de 0,4 a 0,7 ml usando una jeringa de 1 cc. Es aconsejable para construir los gradientes discontinuos durante el centrifugado final 20 min en el paso 7 para limitar el tiempo entre el conjunto de gradiente y ultracentrifugación.
El protocolo incluye la recomendación de reservar todas las diferentes fracciones y almacenarlos a -80 ° C para su posterior análisis. Hemos demostrado el enriquecimiento de proteínas post-sinápticas en la Figura 2 en sólo unas pocas de estas fracciones. Sin embargo, es aconsejable para medir los niveles de una proteína de interés en cada una de las fracciones de entender su distribución. Comparando el distriblución de una proteína en las fracciones con otras proteínas marcadoras subcelulares también ayudará a confirmar que las condiciones experimentales han alcanzado el fraccionamiento deseado. Tabla 2 resume los marcadores de proteínas de uso común que se pueden utilizar como indicadores para las etapas de fraccionamiento 8,27- 38.
Utilización del gradiente discontinuo de sacarosa se utiliza ampliamente para enriquecer las membranas plasmáticas sinápticas. Este método tiene la ventaja sobre gradientes de Percoll continuas en gradientes de sacarosa discontinuos que son más fáciles de hacer y no requieren equipo especializado. Sin embargo, este método puede no ser suficiente para localizar con precisión una proteína de interés, y para estas aplicaciones puede preferirse un gradiente de Percoll.
Divulgaciones
The authors have no conflicts of interest to disclose.
Agradecimientos
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
Referencias
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados