Method Article
불연속 자당 구배를 사용 시냅틱 세포막과 시냅스 밀도 단백질의 제조
요약
이 문서에서는 불연속 자당 기울기에 초 원심 분리에 의해 시냅스 세포막과 관련된 단백질의 농축을 자세히 설명합니다. 시냅스 밀도 단백질의 준비 과정도 설명한다. 단백질 제제는 서쪽 블로 팅 또는 2D DIGE 분석에 적합하다.
초록
신경 세포 내 분획 기술과 시냅스에서 인신 매매 단백질의 정량화 할 수 있습니다. 원래는 1960 년대 후반에 설명한 바와 같이, 시냅스 세포막과 연관된 단백질 자당 밀도 구배 초 원심 분리에 의해 단리 될 수있다. 시냅스 막 단리되면 시냅스 후 밀도로 알려진 고분자 복합체이어서 인해 세제 불용성으로 분리 될 수있다. 시냅스 세포막과 시냅스 후 밀도 단백질을 분리하는 데 사용되는 기술들은 본질적으로 사십년 후 동일하게 유지하고, 현재 널리 신경 과학 연구에 사용된다. 이 문서에서는 시냅스 세포막과 시냅스 밀도가 불연속 자당 기울기 사용과 관련된 단백질의 분별에 대해 자세히 설명합니다. 그 결과 단백질 제제는 서쪽 블로 팅 또는 2D DIGE 분석에 적합하다.
서문
뉴런은 시냅스를 통해 통신하고,이 통신 품질이 시냅스에서 단백질 조성물의 변화가 큰 범위로 조절된다. 특히, 시냅스 후 밀도에있는 단백질은 신호 전달 체계 1 속속들이 비계 신경 전달 물질 수용체의 연결에 의해 통신에 참여한다. 또한 시냅스 효능의 강도 변화는 지속 시냅스 후 밀도 1-6에서 추가 또는 수용체의 제거에 의해 제어된다. 따라서 시냅스 단백질의 분리 및 정량은 신경 자극과 시냅스 효능 7을 변경하는 대응 방법에 대한 통찰력을 얻을 수있는 필요하고 유용한 기술이다. 이 문서에서는 불연속 자당 그라디언트에 초 원심 분리에 의해 쥐 뇌 조직에서 시냅스 단백질을 분리하는 일반적인 방법에 대해 설명합니다. 시냅스 세포막 분획을 농축 할 수 있고 기반 절연경험적 1.2 M 수크로오스 유사한 것으로 판정 된 수크로오스의 밀도.
생물학적 질문에 따라 세포 내 분획 자당 또는 퍼콜 하나의 연속 또는 불연속 그라디언트에 의해 분리 될 수있다. 연속 그라디언트 여러 분획으로 단백질의 분리를 허용; 이 주어진 분수 8 내에서 단백질의 공동 현지화을 설명하기 위해 특히 유용 할 수 있습니다. 그러나, 연속 그라디언트의 준비는 더 힘든이며 많은 응용 프로그램에 필요하지 않습니다. 불연속 구배가 비교적 쉽게 제조 할 수 있으며, 몇 일반적으로 정의 된 단백질 분획을 분리하는 데 사용될 수있다. 증가 몰 농도의 수크로오스 세 층으로 구성되는 불연속 구배 널리 시냅스 원형질막 (SPM)과 연관된 단백질을 분리하는데 사용되어왔다. 이 시냅스 세포막 분획을 상기 시냅스 후 밀도 fractio로 처리 될 수있다세제 불용성 부분의 세제 처리 및 분리에 의해 N (PSD).
이 프로세스가 첫번째 1960 9,10에서 설명 될 때, 전자 현미경은 대략 시냅스 세포막과 시냅스 후 밀도 분획 9-14을 정의하는 소기관 및 세포막을 입증하기 위해 사용되었다. 이러한 연구들은 전후 시냅스 막 및 SPM 분획 시냅스 소포의 포함을 증명; 세제 치료를 주로 전자 조밀 한 후, 시냅스 밀도를 볼 수 있었다. 절차에서, 저장성 충격 전지 본체 (10)로부터 시냅스 핀치 오프 공정을 위해 사용된다. 이 단계는 미토콘드리아는 삼투압 충격에 더 저항성을 그대로 유지하고, 그래서 그들은 자당 구배 (도 1)의 바닥에 침강한다는 사실을 이용한다.
이 같은 농축 기술을 사용하여, SPM 및 PSD 분수 생화학 첫번째이었다폴리 아크릴 아미드 겔 전기 영동 및 주요 단백질 성분 15-17의 서열에 의해 정의. 그 후 서양 얼룩 분석 (그림 2)이 분수를 정의 더 감지하고 시냅스 단백질의 수준을 정량화하는 데 사용되었습니다. 우리는 Slc6a3 궤적 쥐 18에서 중복 될 때 발생하는 도파민 수송의 시냅스 수준의 변화를 정량화하기 위해 실험실에서이 기술을 사용하고 있습니다. 우리는 또한 DISC1의 interactome 19의 일부 단백질이 시냅스 별 감축을 발견하는 NMDA 수용체 결핍 생쥐에서이 기술을 사용하고 있습니다.
또한 SPM 획분 시냅스 소포 막 단백질, 엔도 좀 마커, 미토콘드리아 단백질, 막 관련된 합성 효소 및 신호 전달 분자뿐만 아니라, 시냅스 후 밀도의 적분 요소 및 시냅스 세포막 (20-23)를 포함하는 웨스턴 블롯 분석으로부터 명백하다. E하지마 PSD 풍부한 분획 미토콘드리아 단백질 오염을 가질 수 있으며이를 제거하기 위해 13 초 구배 침강 또는 추가적인 정제 단계를 수행 할 필요가있다. 최근 정량적 질량 분석은 단독 시냅스 후 밀도의 100 위에 단백질의리스트뿐만 아니라, 이들 구성 요소 (24, 25)의 상대적인 풍요의 표시를 제공하고있다.
프로토콜
다음 프로토콜은 동물 관리의 캐나다 협의회의 가이드 라인을 준수하고 토론토 대학에서 의학 및 약학 동물 관리위원회의 교수진에 의해 승인되었습니다.
표 1에서 설명한 것과 같이 필요한 시약을 준비
- 표 1에 설명 된 농도에서 모두 자당 솔루션, 버퍼에 단백질 분해 효소와 포스 파타 아제 (필요한 경우) 억제제를 추가하고 DDH 2 O. 중요 : 실험의 시작하기 전에 시약 및 장비를 모두 4 ° C에서 모든 단계를 수행하고 사전 멋진. 영구 마커 초 원심 분리기 튜브를 포함한 모든 튜브 레이블.
적절한 두뇌 지역의 2 해부
- 자궁 경부 전위 또는 잘린 동물을 제물로 바친다. 하우스와는 동물 보호에 대한 제도 및 정부 정책에 따라 동물을 안락사.
- 신속하게 일을 제거냉장 해부 블록에 두개골과 장소에서 전자 두뇌입니다.
- 신선한 조직에서 해당 뇌 영역을 해부하고 3 단계로 진행합니다.
모터 구동 유리 테플론 균질와 3 조직의 균질화
- 0.32 M HEPES 버퍼 자당 용액 4ml를 포함하는 레이블 13 ㎖의 폴리 프로필렌 튜브에 해부 조직 (SPM 용) 50 ~ 100 ㎎, 또는 (PSD 용) 100 ~ 200 mg의 놓습니다. 15 ㎖의 테이퍼 유리 - 테플론 조직 그라인더 / 균질화에 샘플을 이동시켜, 900 RPM (7 설정) 모터 드라이브를 설정하고 30 초에 걸쳐 12 스트로크 샘플을 균질화. 샘플 사이에 다른 유리 테플론 균질화를 사용하거나 샘플 사이의 차가운 증류수로 균질화를 씻어 킴으로 물기를 닦아냅니다. NOTE : 조직 4g 최대 그러나 그것은 적절한 분획을 확인하기 위해 이하의 조직을 사용하는 것이 바람직하다, 0.32 M 수크로오스 HEPES 완충 용액 4 ㎖에 균질화 될 수있다.
- t 다시 균질화 샘플을 전송같은 13 ㎖의 폴리 프로필렌 튜브 오. 이사회 이후의 단백질 정량 및 총 단백질 분획의 서양 얼룩 분석을 위해 -80 ° C에서 파쇄 및 저장 100 ㎕.
4 저속 원심 분리가 핵 분획을 제거하는 (금리 뜨는 S1)
- 원심 분리기 4 ° C에서 10 분 동안 900 XG에 고정 각 회 전자의 균질. 새에 뜨는 (S1)을 전송, 13 ML 튜브를 표시하고 0.32 M HEPES 버퍼 자당의 500 μL에 핵 분수 펠렛 (P1)을 재현 탁. NOTE : (P1) 분획은 -80 ° C에 보관과 핵 분획의 웨스턴 블롯 분석을 위해 사용될 수있다.
원유 Synaptosomal 분수의 5 농축 (수익률 펠렛 P2)
- 4 ° C에서 15 분 동안 10,000 XG에 뜨는 (S1)을 원심 분리기. microcentrifuge 관에 500 ㎕의 후속 단백질 정량을위한 -80 ° C에서 저장하는 상층 액 (S2)와 예약을 제거동북 아시아의 평화와 번영과 세포질 / 라이트 막 분획의 서양 얼룩 분석. 0.32 M HEPES 버퍼 자당 용액 1 ㎖에 남아있는 원유 synaptosomal 분율 펠렛 (P2)을 재현 탁하고 또 다른 3 ㎖의 0.32의 M HEPES 버퍼 자당 솔루션을 추가합니다.
- 4 ° C에서 15 분 동안 10,000 × g으로 원심 분리기. 이후 단백질 정량 및 세포질 / 라이트 막 분획의 서양 얼룩 분석을 위해 -80 ° C에서 저장하는 microcentrifuge 관에 뜨는 (S2 ') 및 예비 500 μl를 제거합니다. 폴리 프로필렌 튜브에 세척 조 synaptosomal 펠렛 (P2 ')을 저장합니다.
원유 Synaptosomal 분수의 6 용균 (Hypoosmotic 충격)
- DDH 2 O. 1 ㎖에 재현 탁을하여 폴리 프로필렌 튜브를 Lyse 조질 synaptosomal 펠렛 (P2 ') DDH 2 O의 또 다른 3 ㎖를, 3 선을 손으로 유리 테플론 조직 균질로 전송하고, 균질화 추가합니다. 참고 : 그것은 중요빨리 가능한 빨리이 단계를 수행하고 6.2 단계로 진행합니다.
- 다시 동일한 13 ml의 폴리 프로필렌 튜브에 빠르게 균질로부터 전송 샘플을, 1 M HEPES 용액 16 μL로 다시 4 mM의 HEPES으로 샘플을 조정 혼합 반전.
- 30 분 완료 용균을 보장하기 위해 4 ° C에서 샘플을 돌립니다.
Synaptosomal 막 분수의 7 농축 (P3)
- 4 ° C에서 20 분 동안 25,000 × g으로 원심 분리기. 조 기공 분수 상층 액 (S3)를 제거하고 이후의 단백질 정량 및 서양 얼룩 분석을 위해 -80 ° C에서 저장하는 5 ML 튜브에를 보유합니다. 0.32 M 수크로오스 HEPES 완충 용액 1 ㎖에 synaptosomal 세포막 분획 (P3)에 재현 탁.
불연속 자당 그라데이션의 8 준비
- 피펫 정확히 3.5 ml의 1.2 M HEPES 버퍼 자당 용액 정확히 3.0 ㎖의 각 1.0 M 0.8 M HEPE의별도의 6 ML에 S-버퍼 자당 솔루션은 캡 튜브 웁니다. 참고 :이이 자당 기울기를 확인하는 데 사용되는 버퍼의 양을 미리 측정하기 위해 수행됩니다. 볼륨의 정확한 측정 결과 그라데이션 초 원심 분리에 대한 균형 될 수 있도록하는 것이 중요합니다.
- 유리 파스퇴르 피펫 및 전구를 사용하여 12 ㎖의 polyallomer 초 원심 분리기 튜브에 1.2 M HEPES 완충 수크로오스 용액을 전송. 조심스럽게 1.2 M HEPES 버퍼 자당 솔루션의 상단에 1.0 M HEPES 버퍼 자당 솔루션을 층. 마지막으로, 1.0 M HEPES 버퍼 자당 솔루션의 상단에 0.8 M HEPES 버퍼 자당 솔루션을 층. 각 자당 솔루션에 대한 신선한 파스퇴르 피펫을 사용하고 자당 기울기를 방해하지 않도록주의. 벤치 소용돌이 또는 마이크로 원심에서 진동은 그라데이션의 무결성을 방해 할 것이다.
- 파스퇴르 피펫을 이용하여 제조 된 불연속 자당 구배 상단에 재현 탁 synaptosomal 세포막 분획 (P3)를 층.그라디언트가 스윙 버킷 로터의 버킷 내부를 무게로 균형되어 있는지 확인합니다. 버킷 균형을하지 않은 경우, 조심스럽게 로터 버킷 그라데이션의 상단에 0.32 M HEPES 버퍼 자당을 추가하고 균형 P200 피펫을 사용합니다.
시냅틱 플라즈마 멤브레인의 9 분별 (SPM)
- 4 ° C에서 2 시간 동안 150,000 XG에 스윙 버킷 로터에서 초 원심 분리기. 조심스럽게 초 원심 분리기의 버킷에서 자당 구배를 제거합니다. 18 G 바늘과 1 ㎖의 주사기를 사용하여, 1.0 M / 1.2 M HEPES 완충 자당 용액의 계면의 하단에 튜브를 천공하고 시냅스 세포막 층 (SPM)을 철회.
- 각 SPM 샘플 1 ML의 주사기에서 차지하는 부피를 기록합니다. 각 샘플이 조정되면 정확히 4 mM의 HEPES의 2.5 볼륨이 0.32 M.에 1.2 M의 자당 농도를 조정 추가, 3.5 ml의 두꺼운 벽 초 원심 분리기 튜브에 수집 된 SPM 층을 배치에드는 0.32 M 자당에, 0.32 M HEPES 버퍼 자당 용액으로 튜브를 균형.
- 4 ° C에서 30 분 동안 200,000 XG에 고정 각 회 전자의 초 원심 분리기. 제거하고 상층 액을 버린다. 50 mM의 HEPES / 2 mM의 EDTA 용액 300 μL에 시냅스 세포막 펠릿 (SPM)을 재현 탁. -80 ° C에서 보관 샘플 서부 블로 팅에 사용되는 때까지.
시냅스 밀도 분획 (10) 제조 (PSD)
- 얼음에 SPM 샘플을 해동.
- 50 mM의 HEPES / 2 mM의 EDTA 용액 0.54 % 트리톤 X-100 용액을 확인.
- 5 ㎖의 폴리스티렌 관에서 트리톤 X-100 / HEPES / EDTA 용액 300 ㎕의 SPM 분율 2.7 ML을 결합하고 4 ° C에서 15 분 동안 샘플을 회전
- 4 ° C에서 20 분 동안 32,000 XG에 3.5 ㎖의 두꺼운 벽 초 원심 분리기 튜브와 원심 분리기 샘플로 전송 샘플.
- -80에서 뜨는 (트리톤 X-100, 가용 분 [TS]) 및 저장을 예약; C를 °. 주 :이 단계에서는, 펠릿 "PSD-1T"분획을 나타낸다. 세제 초 처리는 "PSD-2T"부분을 생성합니다. PSD-1T 분율을 원하는 경우, 10.6 단계로 진행합니다.
- PSD-2T 분획을 생산하기 위해, 50 mM의 HEPES / 2 mM의 EDTA 용액 3 ㎖의 0.5 %의 트리톤 X에 펠릿을 재현 탁-100. 4 ° C에서 15 분 동안 샘플을 돌립니다. 4 ° C에서 20 분 동안 32,000 XG에 원심 분리기 샘플 및 10.6 단계로 진행합니다.
- 뜨는을 취소하고 50 mM의 HEPES / 2 mM의 EDTA 용액에 시냅스 (PSD) 펠렛을 재현 탁. NOTE : 재 부유 볼륨 펠릿의 크기에 의존 할 수있다; 50 ~ 75 μL의 볼륨을 권장합니다. PSD 분획 세제 불용 분획이기 때문에, 단백질의 완전한 재 부유 있도록 0.5 % SDS 1-2 μL를 추가하는 것이 필요하다. -80 ° C에서 보관 샘플 서부 블로 팅에 사용되는 때까지.
결과
자당 밀도 구배의 제제는 수 크로스 (0.8, 1.0 및 1.2 M 수크로오스)의 세 몰 솔루션이 완전히 분리 될 것이다. 단백질 샘플이 추가되기 전에 그라데이션의 예는도 3a를 참조하십시오. 구배 미리 너무 제조하거나, 다른 기기로부터 진동 벤치 표면에 제조 된 경우, 구배는 손상 될 것이며, 적절한 분리가 달성 될 수없는 경우. 세 용액의 명확한 분리가 보이지 않는 경우, 단백질 시료를 추가하기 전에 새로운 구배를 만드는 것이 바람직하다. 자당 기울기 단백질 샘플이 추가됩니다 (검은 색 화살표)의 예제는 그림 (b)를 참조하십시오.
원심 분리 후, 각 계면에서의 단백질 분획을 맑은 밴드가 있어야한다 (0.32 / 0.8 / 1.0 0.8 1.0 / 1.2). 또한 펠릿은 관의 하단에 표시해야한다. 예를 들어 그림 3C를 참조초 원심 분리 후 분획 밴드. 분획 만 계면 확산에 존재하는 경우에는 경사가 손상시키고, 상기 처리를 의뢰하지 않은 것 같다.
마우스 선조체 (striatum)에서 총 SPM 및 PSD1T 단백질 시료의 웨스턴 블로 팅은 그림 2에서 설명된다.하는 GluR1, PSD95 및 CaMKII 같은 시냅스 단백질의 농축, 총, SPM에서 단백질 (10 μg)의 일정 금액을로드하여 시각화 할 수 있습니다 및 PSD 분수. 도파민 수송 체 (DAT) 등 Perisynaptic 단백질 분획 SPM 농축되지만, PSD 농축 공정의 후속 단계에서 세제 제거된다.
해당로드를 보장하기 위해, 단백질 수준은 개양귀비 빛 레드 (26) 염색하여 서양 얼룩 막에 시각화 할 수 있습니다. 항체 기반 "로드 컨트롤은"종종 문헌에보고되어 있지만, 시냅스 단백질이 차이가 될 수 있기 때문에 이것은 잘못된 일 수있다erentially 실험적인 치료 그룹에 규제. 항체 - 기반 "로드 제어"를 원하는 경우, 먼저 개양귀비 빛 염색함으로써 등가 단백질 로딩을 결정하고 다른 실험 그룹이 변경되지 않는 사람들을 식별하는 여러 기준 단백질을 테스트하는 것이 바람직하다.
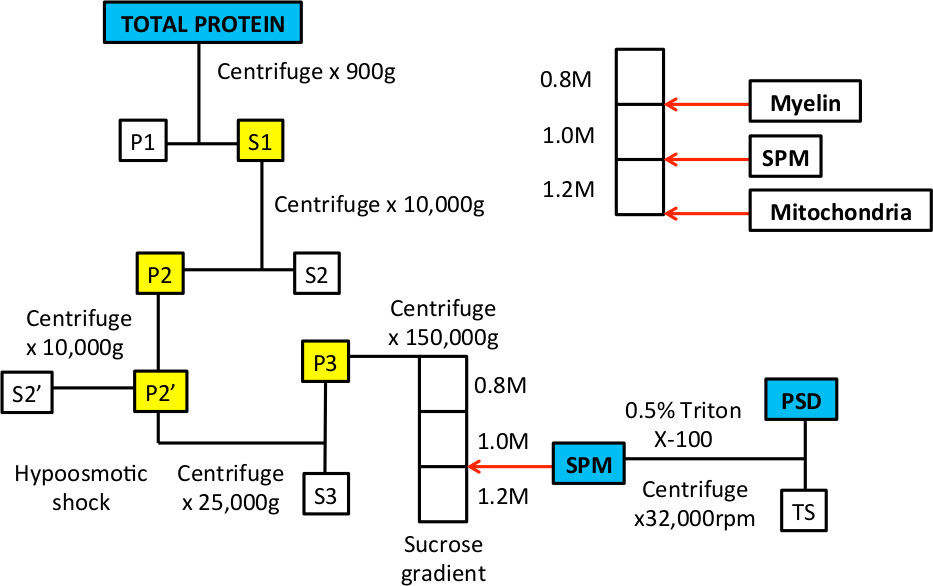
세포 내 분획의 그림 1 워크 플로 SPM 및 PSD 단백질 분획을 풍부하게합니다.

마우스 선조체 (striatum)에서 그림 2 대표 서부 총 SPM의 오점 및 PSD1T 단백질. 단백질 추출물 ㎍의이 SDS-변성에 해결이되었습니다 10, 10 %의 아크릴아미드 젤, 그리고 PVDF 멤브레인에 옮겼다. 그 후이 말은 시냅스 밀도의 모든 구성 요소 αCaMKII,하는 GluR1, PSD-93, 및 PSD-95 차 항체와 함께 배양 하였다. 따라서,이 단백질은 SPM 및 PSD 분수에 충실. 다른 방법으로, 말은 선조체 (striatum)에서 시냅스 막에있는 DAT에 대한 일차 항체와 함께 배양 하였다. DAT는 SPM 분획에서 농축되는 반면, PSD 복합체의 일부가 아닌, 그리고 면역 반응은 PSD 분획에서 관찰되지 않는다. 일부 실험 조건뿐만 아니라 이들 단백질의 수준에 영향을 미칠 수 있지만 액틴 또는 나트륨 / 칼륨 ATPase를 (나트륨 / K 펌프)에 대한 항체는, 로딩 대조군으로 사용할 수있는 등 적절한 부하 제어를 경험적으로 결정되어야한다.

그림 3. 자당 기울기의 대표적인 예 전 초 원심 분리 후. 그라데이션이 준비 A. 후, 튜브가 빛을 개최 할 때 볼 수 있습니다 세 가지 단계가 있어야한다. 흰색 화살표는 0.8 / 1.0 M 수크로오스 용액 1.0 / 1.2 M 수크로오스 용액 사이의 계면을 나타낸다. B. 샘플 구배의 상단에 장착되면, 그것이 0.32 M 수크로오스 용액에 있고 0.8 위에 닿 M 수크로오스 층. C. 원심 분리 후에, 균질 물은 여러 분획으로 분리된다. 0.8 / 1.0 M 자당 용액의 계면에 떠있는 부분은 수초 막에 농축 될 것이다. 1.0 / 1.2 M 수크로오스 용액의 계면에서 분획 바늘 및 주사기로 수집 SPM 분율을 나타낸다. 튜브의 아래쪽 펠렛 미토콘드리아 단백질 농축된다.
| 솔루tions | HEPES 버퍼 자당 | 단백질 분해 효소 억제제 | * 포스 파타 아제 억제제 |
| 한 M HEPES pH를 7.4 | 0.32 M 자당 4 mM의 HEPES (산도 7.4)에서 | 0.25 mM의 PMSF (주 에탄올 250 밀리미터, 1,000 배) | 10 mM의 나트륨 불소 (주식 500 mm의 50 배) |
| 4 mM의 HEPES pH를 7.4 | 0.8 M 자당 4 mM의 HEPES (산도 7.4)에서 | 1.5 μg / ㎖ 아프로 티닌 (주 1.5 ㎎ / ㎖, 1,000 배) | 2.5 mM의 나트륨 피로 인산 (주식 250 밀리미터, 100 배) |
| DDH 2 O | 1.0 M 자당 4 mM의 HEPES (산도 7.4)에서 | 10 μg / ㎖ 류 펩틴 (주 10 ㎎ / ㎖, 1,000 배) | 1.0 MM의 β-글리세로 포스페이트 (주식 200 밀리미터, 200 배) |
| 50 mM의 HEPES (산도 7.4) 2 mM의 EDTA | 1.2 M 자당 4 mM의 HEPES (산도 7.4)에서 | 0.1 ㎎ / ㎖ 벤즈 아미 딘 (주 100 ㎎ / ㎖, 1,000 배) | 5.0mM의 나트륨 오르토 바나 데이트 (주식 500 밀리미터, 100 배) |
| 10 μg / ml의 펩 스타틴 (주 5 밀리그램 / 에탄올 ML, 500X) |
표 1에 필요한 시약
| 분수 | 단백질 분획 | 단백질 마커 |
| P1 | 핵 | 히스톤 H1 27 |
| S1 | 세포질은 / 막 | calnexin 28 (소포체) - 튜 불린 29 (골격), GAPDH 30 (세포질), 58K 골지 프로TEIN 31 (골지체) |
| P2와 P2 ' | 원유 synaptosomes | AMPA 및 NMDA 수용체의 서브 유닛 (32) |
| S2 및 S2 ' | 세포질 / 라이트 막 | nNOS1 29 (세포질), GAPDH (세포질), 램프 1 33 (리소좀), PEX14 34 (퍼 옥시) |
| P3 | synaptosome / 미토콘드리아 | VDAC 35 (미토콘드리아), AMPA 및 NMDA 수용체의 서브 유닛 (synaptosome) |
| S3 | 시냅스 소포 | SV2 8, 시납 8 |
| 0.8 M / 1.0 M | m yelin | 미엘린 염기성 단백질 36 |
| 1.0 M / 1.2 M | SPM | AMPA 및 NMDA 수용체 서브 유닛, 연접 마커 (SNAP25 8) neurexin 32, 32 neuroligin |
| 1.2 MP | 미토콘드리아 | VDAC 35 |
| PSD (1T) | PSD | PSD93 32, PSD95 32, AMPA 및 NMDA 수용체의 서브 유닛, neuroligin, PICK1 32, CaMKII 32 |
| TS | 시냅스 막 | SNAP25, Munc18 37, 바순 38, neurexin |
| 풍부한 PSD | PSD95, AMPA 및 NMDA 수용체의 서브 유닛, PICK1, CaMKII |
단백질 마커의 표 2 목록 세포 내 분수를 구별
토론
성공적인 결과를위한 중요한 절차의 몇 가지 단계가 있습니다. 단계 3에서는, 균질화의 일관성 정도가 각각의 샘플에 대해 달성되는 것이 중요하다. 구동 모터와 균질 조직을 균질화 할 때 일정한 속도 유봉의 회전뿐만 아니라, 스트로크의 수뿐만 아니라 사용된다. 저장성 용액 확장 균질화 또는 배양이 미토콘드리아를 용해하고 SPM 샘플을 오염 때문에 삼투압 충격 동안 배양 시간은 정확해야한다.
또 다른 중요한 단계는 시약, 특히 자당 용액의 제조에있다; 자당 용액의 몰 농도가 잘못된 경우 절차가 작동하지 않습니다. 따라서, 자당 용액이어서 정확한 최종 부피로 4 mM의 HEPES를 추가 4 mM의 HEPES 용액에 용해, 수 크로스 칭량함으로써 제조한다. 문제 해결 팁 : 욕실에 준비된 자당 솔루션을 테스트 그라데이션을 구축그라데이션이 제대로 조립되어 있는지 확인합니다. 브로 모 페놀 블루의 다양한 농도의 세 자당 솔루션이이 세 가지 층의 시각화를 지원하는에 (0.005 % V / w -0.02 %의 예를 들어, 최종 농도)를 추가합니다.
이것은 그라데이션 조립 될 때 원심 분리 튜브 때 사이의 시간의 양을 제한하는 것이 중요하다. 보통 확산 시간이 지남에 구배를 파괴하고, 구배가 저장된 벤치에 진동이있는 경우에는이 가속된다. 정확한 볼륨이 유리 파스퇴르 피펫으로 피펫 팅하는 개별 분주로 솔루션의 사전 피펫은 할 수 있습니다. 이것은 또한 구배 초 원심 조립체 사이의 시간을 감소시킨다. 문제 해결 팁 : 실험 자당 구배 동시에 전술 한 바와 같은 브로 모 페놀 블루 염료 "테스트 구배"를 만든다. 구배의 무결성은 시간이 지남에 따라서, 모니터링 할 수있다. 테스트 그라데이션이 될 것입니다확산의 표시 그라디언트 사전에 너무 멀리 조립이나 진동에 노출되는 경우.
마지막으로, 그 이후에 물 2.5 권으로 샘플을 희석 할 필요가 있기 때문에, 가능한 한 작은 체적에서 SPM 샘플을 수집하는 것이 중요하다. 이상적으로는 시료 1 공통 주사기를 사용하여 0.4-0.7 ㎖를 수집한다. 그것은 그라데이션 조립 및 초 원심 사이의 시간을 제한하는 7 단계의 마지막 20 분 동안 스핀 불연속 그라디언트를 구축하는 것이 좋습니다.
프로토콜은 서로 다른 분수의 모든 예약 및 후속 분석을 위해 -80 ° C에서 다음을 저장할 수있는 권고 사항을 포함한다. 우리는이 분수의 몇에 그림 2의 시냅스 단백질의 농축을 증명하고있다. 그러나, 그것의 분포를 이해할 분획 각각 단백질의 관심의 수준을 측정하는 것이 바람직하다. distrib에 비교다른 세포 내 마커 단백질과 분획에서의 단백질의 ution 또한 실험 조건은 원하는 분획을 획득했음을 확인하는 데 도움이된다. 표 2 분획의 단계에 대한 지표로 이용 될 수있는 일반적으로 사용되는 단백질 마커를 요약 8,27- 38.
불연속 자당 기울기의 이용은 널리 시냅스 세포막을 풍부하게하는 데 사용됩니다. 이 방법은 확인하기 쉽게하고 특수 장비를 필요로하지 않는 불연속 자당 그라디언트 연속 퍼콜 구배를 통해 장점이 있습니다. 그러나,이 방법은 정확하게 관심 단백질을 지역화하기에 충분하지 않을 수 있으며, 따라서 이러한 애플리케이션에 퍼콜 구배가 바람직 할 수있다.
공개
The authors have no conflicts of interest to disclose.
감사의 말
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
자료
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
참고문헌
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유