Method Article
Preparazione di Synaptic membrana plasmatica e Proteine densità postsinaptica Utilizzo di un gradiente di saccarosio discontinuo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo descrive l'arricchimento di proteine associate con la membrana plasmatica sinaptica da ultracentrifugazione su gradiente di saccarosio discontinuo. La successiva preparazione di proteine di densità post-sinaptica è anche descritto. Preparati proteici sono adatti per western blotting o l'analisi 2D DIGE.
Abstract
Neuronali tecniche di frazionamento subcellulare consentono la quantificazione di proteine che sono vittime della tratta da e per la sinapsi. Come originariamente descritto nel tardo 1960, proteine associate alla membrana plasmatica sinaptica possono essere isolati da ultracentrifugazione su gradiente di densità di saccarosio. Una volta membrane sinaptiche sono isolati, il complesso macromolecolare nota come la densità post-sinaptica può essere successivamente isolato per la sua insolubilità detersivo. Le tecniche utilizzate per isolare le membrane plasmatiche sinaptiche e proteine densità post-sinaptica rimane essenzialmente la stessa dopo 40 anni, e sono ampiamente utilizzati nella ricerca neuroscientifica attuale. Questo articolo descrive il frazionamento delle proteine associate alla membrana plasmatica sinaptica e la densità post-sinaptica utilizzando un gradiente di saccarosio discontinuo. Risultanti preparati proteici sono adatti per western blotting o l'analisi 2D DIGE.
Introduzione
I neuroni comunicano attraverso le sinapsi, e la qualità di questa comunicazione è regolata in gran parte da alterazioni nella composizione delle proteine alla sinapsi. In particolare, le proteine ubicata nella densità postsinaptica partecipa nella comunicazione neuronale recettori dei neurotrasmettitori intimamente ponteggi con i loro sistemi di trasduzione del segnale 1. Inoltre, durevoli cambiamenti nella forza di efficacia sinaptica sono controllate mediante l'aggiunta o la rimozione di recettori alla densità post-sinaptica 1-6. Pertanto, l'isolamento e la quantificazione delle proteine sinaptiche è una tecnica necessaria ed utile al fine di conoscere i modi in cui i neuroni rispondono a stimoli e alterare l'efficacia sinaptica 7. Questo articolo descrive una tecnica comune per isolare le proteine sinaptiche da tessuto cerebrale dei roditori da ultracentrifugazione su gradiente discontinuo di saccarosio. La frazione di membrana plasmatica sinaptica può essere arricchita e isolato basa susua densità di saccarosio, che è stato determinato empiricamente essere simile a 1,2 M saccarosio.
A seconda della domanda biologica, frazioni subcellulari possono essere separati da gradienti continui o discontinui di entrambi saccarosio o Percoll. Gradienti continui consentono la separazione di proteine in più frazioni; questo può essere particolarmente utile per dimostrare la co-localizzazione delle proteine all'interno di una data frazione 8. Tuttavia, la preparazione di gradienti continui è più laborioso e non è necessaria per molte applicazioni. Gradienti discontinui sono relativamente facili da preparare e possono essere usate per separare le proteine in poche frazioni, generalmente definiti. Gradienti discontinui che sono costituiti da tre strati di saccarosio degli crescente molarità sono stati ampiamente utilizzati per isolare le proteine associate alla membrana plasmatica sinaptica (SPM). Questa frazione membrana plasmatica sinaptica può essere ulteriormente elaborato per la fractio densità post-sinaptican (PSD) per trattamento detergente e l'isolamento della frazione detergente-insolubili.
Quando questo processo è stato descritto nel 1960 del 9,10, microscopia elettronica è stato utilizzato per dimostrare gli organelli e membrane che circa definiscono la membrana plasmatica sinaptica e frazioni di densità post-sinaptici 9-14. Questi studi hanno dimostrato l'inclusione delle membrane pre e post-sinaptici e vescicole sinaptiche nella frazione SPM; dopo il trattamento detergente principalmente l'elettrone-densi, densità post-sinaptica erano visibili. Nella procedura, uno shock ipotonico viene utilizzato per pizzicare fuori i processi sinaptici dal corpo cellulare 10. Questo passaggio sfrutta il fatto che i mitocondri sono più resistenti agli shock osmotico e rimangono intatte, e quindi sedimentare sul fondo del gradiente di saccarosio (Figura 1).
Usando la stessa tecnica di arricchimento, le frazioni SPM e PSD erano di prima biochimicamentedefinito mediante elettroforesi su gel di poliacrilammide e sequenziamento dei principali componenti proteiche 15-17. Blot Successivamente occidentale è stato utilizzato per rilevare e quantificare i livelli di proteine sinaptiche e definire ulteriormente queste frazioni (Figura 2). Abbiamo utilizzato questa tecnica nei nostri laboratori di quantificare i cambiamenti nei livelli sinaptici del trasportatore della dopamina che si verificano quando il locus Slc6a3 viene duplicato nei topi 18. Abbiamo anche usato questa tecnica in recettori NMDA topi deficienti per scoprire riduzioni specifiche per sinapsi in proteine che fanno parte della DISC1 interattoma 19.
E 'evidente da analisi western blot che le frazioni SPM contengono proteine di membrana delle vescicole sinaptiche, marcatori degli endosomi, proteine mitocondriali, membrana associata enzimi sintetici e molecole di trasduzione del segnale, così come componenti integrali della densità post-sinaptica e membrane plasmatiche sinaptiche 20-23. Efrazioni PSD Ven possono avere contaminazione con abbondanti proteine mitocondriali e può essere necessario eseguire una seconda sedimentazione sfumatura o fasi di purificazione aggiuntivi per rimuoverli 13. Recentemente, spettrometria di massa quantitativa ha fornito un elenco di oltre 100 proteine nei soli densità post-sinaptica, così come un'indicazione della relativa abbondanza di questi componenti 24,25.
Protocollo
Il seguente protocollo è conforme alle linee guida del Consiglio canadese della cura degli animali ed è stato approvato dalla Facoltà di Medicina e Farmacia Comitato cura degli animali presso l'Università di Toronto.
1 Preparare Obbligatorio reagenti come descritto nella Tabella 1
- Aggiungi proteasi e fosfatasi (se necessario) inibitori a tutte le soluzioni di saccarosio, tamponi e DDH 2 O a concentrazioni indicate nella tabella 1. Importante: eseguire tutte le operazioni a 4 ° C e pre-raffreddare tutti i reagenti e apparecchiature prima dell'inizio dell'esperimento. Etichettare tutte le provette, compresi i tubi ultracentrifuga, con pennarello indelebile.
2 Dissezione della regione del cervello appropriata
- Sacrifica l'animale da dislocazione cervicale o decapitazione. Casa e eutanasia degli animali in conformità con le politiche istituzionali e governativi sulla cura degli animali.
- Rapidamente rimuovere the cervello dal cranio e posto su un blocco dissezione refrigerata.
- Sezionare la regione del cervello appropriata dal tessuto fresco e procedere al passaggio 3.
3 Tissue omogeneizzazione con Motor Driven vetro-teflon Omogeneizzatore
- Posizionare 50-100 mg (per SPM), o 100-200 mg (per PSD) del tessuto sezionato in una etichetta 13 ml tubo di polipropilene contenente 4 ml di soluzione di saccarosio 0.32 M HEPES-buffered. Trasferire il campione in un 15 ml conica fibra di vetro-teflon smerigliatrice / omogeneizzatore, impostare l'unità motore a 900 giri (impostazione 7) e omogeneizzare il campione con 12 colpi in un periodo di 30 sec. Utilizzare un diverso omogeneizzatore vetro-teflon tra i campioni, o sciacquare la omogeneizzatore con acqua distillata fredda tra i campioni e asciugare con un Kimwipe. NOTA: Fino a 4 g di tessuto può essere omogeneizzato in 4 ml di soluzione di saccarosio 0.32 M HEPES-buffered, tuttavia è consigliabile utilizzare meno tessuto per garantire il corretto frazionamento.
- Trasferire il campione omogeneizzato posteriore to lo stesso tubo di polipropilene 13 ml. Riserva 100 ml di omogenato e conservare a -80 ° C per la successiva quantificazione di proteine e analisi western blot della frazione totale di proteine.
4. bassa velocità di centrifugazione per eliminare completamente le frazioni nucleare (rendimenti supernatante S1)
- Centrifugare l'omogeneizzato in un rotore ad angolo fisso a 900 xg per 10 min a 4 ° C. Trasferire il surnatante (S1) per un nuovo, marcato 13 ml di tubo e risospendere il pellet frazione nucleare (P1) in 500 ml di saccarosio 0,32 M HEPES-buffered. NOTA: La (P1) frazione può essere conservato a -80 ° C ed utilizzato per l'analisi western blot della frazione nucleare.
5. arricchimento della Frazione Crude sinaptosomale (rendimenti a pellet P2)
- Centrifugare il surnatante (S1) a 10.000 xg per 15 min a 4 ° C. Rimuovere il surnatante (S2) e riserva 500 ml in una provetta per conservare a -80 ° C per la successiva proteina quantificazione e analisi western blot della frazione citosolica membrana / luce. Risospendere il pellet rimanente frazione sinaptosomale greggio (P2) in 1 ml di soluzione di saccarosio 0.32 M HEPES-buffered e poi aggiungere un'altra soluzione di saccarosio 3 ml di 0,32 M HEPES-buffered.
- Centrifugare a 10.000 x g per 15 min a 4 ° C. Rimuovere il surnatante (S2 ') e riserva 500 ml in una provetta per conservare a -80 ° C per la successiva quantificazione di proteine e analisi western blot della frazione citosolica membrana / luce. Salvare il lavato sinaptosomale greggio pellet (P2 ') nel tubo di polipropilene.
6. lisi (ipoosmotico Shock) della Frazione Crude sinaptosomale
- Lyse il pellet sinaptosomale grezzo (P2 ') nel tubo di polipropilene da risospendere in 1 ml di DDH 2 O. Aggiungi un altro 3 ml di DDH 2 O, trasferimento in un omogeneizzatore tessuto di vetro-teflon, e omogeneizzare a mano con 3 colpi. NOTA: E 'importanteper eseguire questo passaggio il più rapidamente possibile e rapidamente passare al punto 6.2.
- Campioni di trasferimento dalla omogeneizzatore nuovamente dentro lo stesso tubo di polipropilene 13 ml e regolare rapidamente il campione torna a HEPES 4 mm con 16 ml di soluzione 1 M HEPES, miscelarlo.
- Ruotare i campioni a 4 ° C per 30 minuti per garantire la completa lisi.
7 Arricchimento della Frazione sinaptosomale membrana (P3)
- Centrifugare a 25.000 x g per 20 minuti a 4 ° C. Rimuovere il surnatante grezzo frazione vescicolare (S3) e prenotare in una provetta 5 ml di conservare a -80 ° C per la successiva quantificazione delle proteine e western blot. Risospendere la frazione di membrana sinaptosomale (P3) in 1 ml di soluzione di saccarosio 0.32 M HEPES-buffered.
8 Preparazione del Discontinuo gradiente di saccarosio
- Dispensare esattamente 3.5 ml di soluzione di saccarosio 1,2 M HEPES-buffered ed esattamente 3.0 ml di 1,0 M e 0,8 M HEPESoluzione di saccarosio S-buffered in separati 6 ml provette con tappo a scatto. NOTA: Questo viene fatto per pre-misurare i volumi dei buffer che vengono utilizzati per rendere il gradiente di saccarosio. Misurazione esatta dei volumi è importante per garantire che i gradienti risultanti saranno bilanciati per ultracentrifugazione.
- Usando una pipetta Pasteur e bulbo di vetro, trasferire 1,2 M HEPES-buffered soluzione di saccarosio a 12 ml tubo ultracentrifuge polyallomer. Strato con attenzione la soluzione di saccarosio 1.0 M HEPES-tampone sulla parte superiore della soluzione di saccarosio 1.2 M HEPES-buffered. Infine, lo strato di soluzione di saccarosio 0,8 M HEPES-tampone sulla parte superiore della soluzione di saccarosio 1.0 M HEPES-buffered. Utilizzare una pipetta Pasteur fresco per ogni soluzione di saccarosio e fare attenzione a non disturbare il gradiente di saccarosio. Vibrazioni da un vortice panchina o microcentrifuga disturberà l'integrità del gradiente.
- Usando una pipetta Pasteur, sovrapporre la frazione di membrana sinaptosomale risospeso (P3) sulla parte superiore del preparato discontinuo gradiente di saccarosio.Assicurarsi che i gradienti sono bilanciate tramite pesatura all'interno del secchio del rotore oscillante. Se i secchi non sono equilibrati, utilizzare una pipetta P200 aggiungere attentamente saccarosio 0,32 M HEPES-buffered all'inizio della sfumatura e bilanciare i secchi rotore.
9 Frazionamento del Synaptic membrana plasmatica (SPM)
- Ultracentrifuge in un rotore oscillante secchio a 150.000 xg per 2 ore a 4 ° C. Rimuovere con attenzione i gradienti di saccarosio dai secchi ultracentrifuga. Utilizzando un ago da 18 G e una siringa da 1 ml, forare il tubo sul fondo della soluzione 1,0 M / 1,2 M HEPES-buffered saccarosio interfase e ritirare lo strato di membrana plasmatica sinaptica (SPM).
- Prendere nota del volume che ogni campione SPM occupa nella siringa da 1 ml. Posizionare lo strato SPM raccolti in 3,5 ml tubi ultracentrifuga spessa parete, aggiungere esattamente 2,5 volumi di HEPES 4 mM per regolare la concentrazione di saccarosio da 1,2 M a 0.32 M. Dopo ogni campione è stato regolareed al 0,32 M saccarosio, bilanciare i tubi con soluzione di saccarosio 0,32 M HEPES-buffered.
- Ultracentrifuga in un rotore ad angolo fisso a 200.000 xg per 30 min a 4 ° C. Rimuovere e scartare il surnatante. Risospendere il pellet sinaptica membrana plasmatica (SPM) in 300 ml di soluzione di 50 mM EDTA HEPES / 2 mm. Conservare i campioni a -80 ° C fino a quando utilizzati per western blotting.
10 Preparazione della Frazione Postsynaptic Density (PSD)
- Scongelare i campioni SPM sul ghiaccio.
- Fare una soluzione di 0,54% di Triton X-100 in 50 mM EDTA soluzione HEPES / 2 mM.
- In una provetta da 5 ml polistirene, combinare 2,7 ml di Triton X-100 / soluzione / EDTA e 300 microlitri frazione SPM HEPES e ruotare il campione per 15 minuti a 4 ° C
- Campioni Trasferire 3,5 ml tubi ultracentrifuga spessore-parete e Centrifugare i campioni a 32.000 xg per 20 min a 4 ° C.
- Prenotate il surnatante (Triton X-100 frazione solubile [TS]) e conservare a -80; ° C. NOTA: In questa fase, il pellet rappresenta la frazione "PSD-1T". Un secondo trattamento con detergente produrrà una frazione "PSD-2T". Se una frazione PSD-1T si desidera, passare al punto 10.6.
- Per produrre una frazione PSD-2T, risospendere il pellet in 3 ml di 0,5% Triton X-100 in 50 mM HEPES / 2 soluzione mM EDTA. Ruotare i campioni per 15 minuti a 4 ° C. Centrifugare i campioni a 32.000 xg per 20 min a 4 ° C e passare al punto 10.6.
- Eliminare il supernatante e risospendere il pellet postsinaptica (PSD) in 50 / soluzione EDTA mM mM HEPES 2. NOTA: Il volume risospensione può dipendere dalle dimensioni del pellet; Si raccomanda un volume di 50-75 ml. Poiché la frazione PSD è una frazione detergente-insolubili, è spesso necessario aggiungere 1-2 ml di 0,5% SDS per consentire completa risospensione delle proteine. Conservare i campioni a -80 ° C fino a quando utilizzati per western blotting.
Risultati
La preparazione del gradiente di densità di saccarosio dovrebbe tradursi in una netta separazione delle tre soluzioni molari di saccarosio (0.8, 1.0, e 1.2 M saccarosio). Vedere Figura 3A per un esempio del gradiente prima di aggiungere il campione di proteine. Se il gradiente è preparato troppo in anticipo, o se è disposta su una superficie panchina con vibrazioni da altri apparecchi, il gradiente sarà compromessa e separazione corretta non sarà raggiunto. Se una netta separazione delle tre soluzioni non è visibile, è consigliabile fare una nuova sfumatura prima di aggiungere il campione di proteine. Vedere la Figura 3B per un esempio del gradiente di saccarosio quando viene aggiunto il campione di proteine (freccia nera).
Dopo la centrifugazione, ci dovrebbero essere evidenti bande di frazioni proteiche ad ogni interfase (0,32 / 0,8, 0,8 / 1,0, 1,0 / 1,2). Inoltre un pellet deve essere visibile nella parte inferiore del tubo. Vedere la Figura 3C per un esempiodelle bande frazione dopo ultracentrifugazione. Se frazioni sono solo diffusamente presenti alla interfase, è probabile che il gradiente è stata compromessa e ulteriore trasformazione e non è consigliato.
Western blotting del totale, SPM e di proteine PSD1T campioni di topo striato è dimostrato in Figura 2. L'arricchimento di proteine sinaptiche come GluR1, PSD95, e CaMKII, può essere visualizzato caricando una quantità costante di proteine (10 mg) dal totale, SPM , e frazioni PSD. Proteine Perisynaptic come il trasportatore della dopamina (DAT) sono arricchite nella frazione SPM, ma vengono eliminate in fasi successive detergenti del processo di arricchimento PSD.
Per assicurare il carico equivalente, i livelli di proteina possono essere visualizzati sulla membrana Western Blot dalla colorazione con Ponceau Rosso 26. "Controlli di caricamento" a base di anticorpi sono spesso riportati in letteratura, ma questo può essere un termine improprio in quanto le proteine sinaptiche possono essere diffpreferenzialmente regolato in gruppi di trattamento sperimentali. Se si desidera un "controllo di carico" a base di anticorpi, si consiglia di determinare prima proteina di carico equivalente da Ponceau colorazione, e poi testare diverse proteine di riferimento per identificare quelli che non cambiano nei diversi gruppi sperimentali.
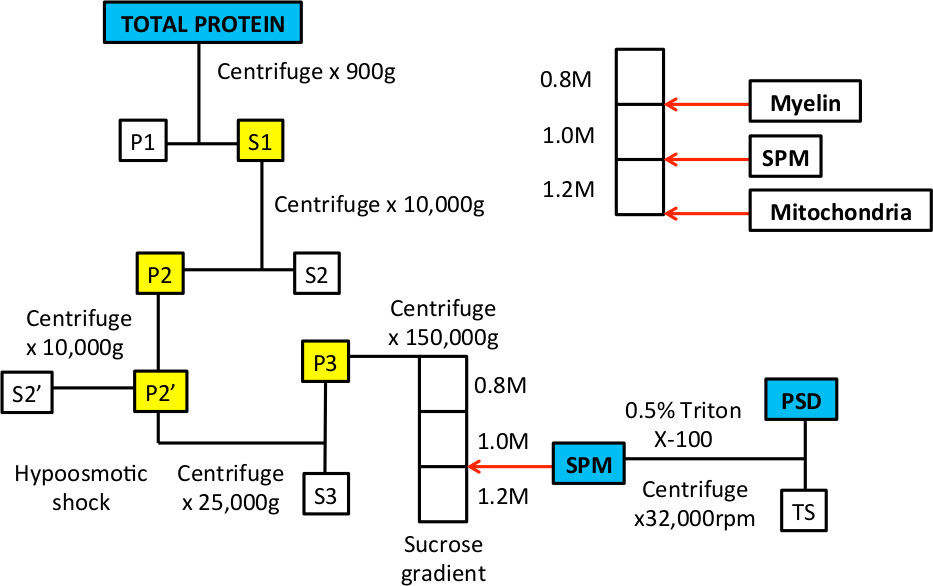
Figura 1 Flusso di lavoro di frazionamento subcellulare per arricchire SPM e frazioni proteiche PSD.

Figura 2 Rappresentante western blot del totale, SPM, e proteine PSD1T da topo striato. 10 mg di estratto proteico sono stati risolti su SDS-denaturazione, 10% acrilicogel ammide, e trasferite su membrane di PVDF. Successivamente queste macchie sono state incubate con anticorpi primari per αCaMKII, GluR1, PSD-93, e PSD-95, che sono tutti i componenti della densità post-sinaptica. Di conseguenza, queste proteine sono arricchite nel SPM e frazioni PSD. In alternativa, le macchie sono state incubate con un anticorpo primario per DAT, che si trova a membrane presinaptiche nello striato. Mentre DAT è arricchito nella frazione SPM, non è parte del complesso PSD, e immunoreattività non si osserva nella frazione PSD. Anticorpi contro l'actina o sodio / potassio ATPasi (pompa Na / K) possono essere utilizzati come controlli di carico, anche se alcune condizioni sperimentali possono influenzare i livelli di queste proteine come bene e quindi il controllo di carico appropriata devono essere determinati empiricamente.

Figura 3. Esempi rappresentativi di gradiente di saccarosio prima e dopo ultracentrifugazione. R. Dopo la pendenza è preparato, ci dovrebbero essere tre fasi che sono visibili quando il tubo viene mantenuto fino alla luce. Le frecce bianche indicano l'interfase tra 0,8 / 1,0 M soluzioni di saccarosio e 1,0 / 1,2 M soluzioni di saccarosio. B. Quando viene caricato il campione sulla parte superiore del gradiente, si trova in una soluzione di saccarosio 0,32 M e poggerà sulla parte superiore del 0,8 M strato di saccarosio. C. Dopo la centrifugazione, l'omogeneizzato si separerà in diverse frazioni. La frazione di galleggiamento al interfase di 0,8 / 1,0 M soluzioni di saccarosio sarà arricchita in membrane mieliniche. La frazione all'interfase di 1,0 / 1,2 M soluzioni di saccarosio rappresenta la frazione SPM che vengono raccolte con un ago e la siringa. Il pellet sul fondo del tubo è arricchito di proteine mitocondriali.
| Soluzioni | Saccarosio HEPES-buffered | Inibitori della proteasi | * inibitori di fosfatasi |
| 1 M HEPES pH 7.4 | 0.32 M saccarosio a 4 mM HEPES (pH 7,4) | 0.25 mM PMSF (magazzino 250 mM in etanolo, 1,000x) | 10 mM fluoruro di sodio (magazzino 500 mm, 50x) |
| 4 mM HEPES pH 7,4 | 0.8 M saccarosio in 4 HEPES mM (pH 7.4) | 1.5 mcg / ml aprotinina (stock 1.5 mg / ml, 1,000x) | 2.5 mM sodio pirofosfato (magazzino 250 mm, 100x) |
| DDH 2 O | 1.0 M saccarosio in 4 HEPES mM (pH 7.4) | 10 mg / ml leupeptina (magazzino 10 mg / ml, 1,000x) | 1.0 mm B-glicerofosfato (magazzino 200 mm, 200x) |
| HEPES 50 mM (pH 7,4) 2 mM EDTA | 1.2 M saccarosio in 4 HEPES mM (pH 7.4) | 0,1 mg / ml di Benzamidine (magazzino 100 mg / ml, 1,000x) | 5.0mM sodio orthovanadate (magazzino 500 mm, 100x) |
| 10 mg / ml Pepstatin (magazzino 5 mg / ml in etanolo, 500x) |
Tabella 1. richiesti Reagenti
| Frazione | Frazione proteica | Marcatore di proteine |
| P1 | nucleare | istone H1 27 |
| S1 | citosol / membrane | calnexina 28 (reticolo endoplasmatico), a-tubulina 29 (citoscheletro), GAPDH 30 (citosol), 58K Golgi proproteina 31 (apparato di Golgi) |
| P2 e P2 ' | sinaptosomi grezzi | AMPA e NMDA subunità del recettore 32 |
| S2 e S2 ' | citosol / membrane di luce | nNOS1 29 (citosol), GAPDH (citosol), LAMP1 33 (lisosomi), PEX14 34 (perossisomi) |
| P3 | sinaptosomi / mitocondri | VDAC 35 (mitocondri), AMPA e NMDA subunità del recettore (sinaptosomi) |
| S3 | vescicole sinaptiche | SV2 8, synaptophysin 8 |
| 0,8 M / 1,0 M | m Yelin | proteina basica della mielina 36 |
| 1.0 M / 1,2 M | SPM | AMPA e NMDA subunità del recettore, marcatore presinaptico (SNAP25 8), neurexin 32, neuroligin 32 |
| 1.2 MP | mitocondri | VDAC 35 |
| PSD (1T) | PSD | PSD93 32, PSD95 32, AMPA e NMDA subunità del recettore, neuroligin, PICK1 32, CaMKII 32 |
| TS | membrane presinaptiche | SNAP25, Munc18 37, Fagotto 38, neurexin |
| arricchito PSD | PSD95, AMPA e NMDA subunità del recettore, PICK1, CaMKII |
Tabella 2 Elenco dei marcatori proteici di distinguere frazioni subcellulari
Discussione
Ci sono diversi passaggi della procedura che sono fondamentali per un esito positivo. Nel passaggio 3, è importante che un grado costante di omogeneizzazione è ottenuta per ogni campione. Quando omogeneizzando tessuto con l'omogeneizzatore a motore, una velocità costante viene utilizzata non solo per la rotazione del pestello, ma anche con il numero di colpi. Il tempo di incubazione durante lo shock osmotico deve essere preciso, dal momento omogeneizzazione estesa o incubazione nella soluzione ipotonica si lisare mitocondri e contaminare il campione SPM.
Un altro punto critico è nella preparazione dei reagenti, in particolare le soluzioni di saccarosio; se la molarità della soluzione di saccarosio è corretta la procedura non funziona. Pertanto, soluzioni di saccarosio dovrebbero essere preparate mediante pesatura saccarosio, sciogliere in 4 soluzione HEPES mM quindi aggiungendo HEPES 4 mM al volume finale preciso. Punta Risoluzione dei problemi: costruire un gradiente test con le soluzioni di saccarosio preparate per enAssicurarsi che il gradiente sia correttamente montato. Aggiungi concentrazioni variabili di blu di bromofenolo (per esempio, concentrazione finale del 0,005% -0.02% w / v) ai due dei tre soluzioni di saccarosio per assistere nella visualizzazione di tre strati distinti.
È importante limitare la quantità di tempo tra quando il gradiente è assemblato e quando i tubi vengono centrifugati. Diffusione normale distruggerà il gradiente nel tempo, e questo viene accelerato se c'è vibrazione sul banco in cui è memorizzato il gradiente. Pre-pipettaggio di soluzioni in singole aliquote permette di volumi precisi da pipettati con una pipetta Pasteur di vetro. Questo diminuisce anche il tempo tra montaggio e ultracentrifugazione gradiente. Punta Risoluzione dei problemi: costruire una "sfumatura di prova" con colorante blu di bromofenolo come descritto sopra, allo stesso tempo, come i gradienti di saccarosio per l'esperimento. L'integrità del gradiente può quindi essere monitorata nel tempo. Il gradiente di prova servirà comeindicatore di diffusione se i gradienti vengono assemblati troppo in anticipo o sono esposti a vibrazioni.
Infine, è importante raccogliere il campione SPM in piccolo volume possibile, in quanto è necessario diluire successivamente il campione con 2,5 volumi di acqua. Idealmente il campione deve essere raccolto in un volume di 0,4-0,7 ml con una siringa da 1 cc. Si consiglia di costruire i gradienti discontinui durante la finale 20 minuti di spin nel passaggio 7 per limitare il tempo tra montaggio e ultracentrifugazione gradiente.
Il protocollo comprende la raccomandazione di riservare tutte le diverse frazioni e conservare questi a -80 ° C per la successiva analisi. Abbiamo dimostrato l'arricchimento di proteine post-sinaptiche in figura 2 in solo pochi di queste frazioni. Tuttavia, si consiglia di misurare i livelli di una proteina di interesse in ciascuna delle frazioni per capire la sua distribuzione. Confrontando la distribution di una proteina nelle frazioni con altre proteine marker subcellulari aiuterà anche a confermare che le condizioni sperimentali hanno raggiunto il frazionamento desiderato. Tabella 2 riassume marcatori proteici di uso comune che possono essere utilizzati come indicatori per le fasi di frazionamento 8,27- 38.
Utilizzo del gradiente discontinuo di saccarosio è ampiamente usato per arricchire membrane plasmatiche sinaptiche. Questo metodo ha il vantaggio rispetto continui gradienti Percoll che in gradiente discontinuo di saccarosio sono più facili da fare e non richiedono attrezzature specializzate. Tuttavia, questo metodo potrebbe non essere sufficiente a localizzare con precisione una proteina di interesse, e per queste applicazioni un gradiente Percoll può essere preferito.
Divulgazioni
The authors have no conflicts of interest to disclose.
Riconoscimenti
The authors thank Dr. Mike Ehlers and his laboratory members for originally demonstrating the protocol for subcellular fractionation of synaptic plasma membranes. We also thank Wendy Horsfall for management of the mouse colonies. This work was supported by operating grants from CIHR (AJR and AS).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 M HEPES, pH 7.4 | BioShop | HEP003.100 | |
| HEPES | BioShop | HEP001.500 | |
| Sucrose | BioShop | SUC507.1 | |
| EDTA | BioBasic | EB0185 | |
| PMSF | BioShop | PMS123.5 | |
| Aprotinin | BioShop | APR600.1 | |
| Leupeptin | BioShop | LEU001.1 | |
| Pepstatin | BioShop | PEP605.5 | |
| Benzamidine | BioShop | BEN601.25 | |
| Sodium fluoride | BioShop | SFL001.100 | |
| Sodium pyrophosphate | BioShop | SPP310.100 | |
| Sodium orthovanadate | BioShop | SOV664.10 | |
| β-glycerophosphate | BioShop | GYP001.10 | |
| Triton X-100 | BioShop | TRX506.500 | |
| 18 G x 1 ½” needle | BD | 305196 | |
| 1 cc syringe | BD | 309659 | |
| Glass Teflon homogenizer Kontes Duall 23 | VWR | KT885450-0023 | |
| IKA Model RW 16 basic stirrer | IKA Works | 2572100 | |
| Sorvall SM-24 fixed angle rotor | ThermoScientific | 29017 | |
| Sorvall RC 6 Plus centrifuge | ThermoScientific | 46910 | |
| Thinwall polyallomer tubes (13.2 ml) | Beckman Coulter | 331372 | |
| SW 41 Ti rotor swinging bucket | Beckman Coulter | 331362 | |
| Beckman L-80 floor ultracentrifuge | Beckman Coulter | ||
| Thickwall polycarbonate tubes (3.5 ml) | Beckman Coulter | 349622 | |
| TLA-100.3 fixed angle rotor | Beckman Coulter | 349481 | |
| Beckman TL-100 tabletop ultracentrifuge | Beckman Coulter |
Riferimenti
- Delint-Ramirez, I., et al. In vivo composition of NMDA receptor signaling complexes differs between membrane subdomains and is modulated by PSD-95 and PSD-93. The Journal of Neuroscience : the Official Journal of the Society for Neuroscience. 30, 8162-8170 (2010).
- Wang, Q., et al. The psychiatric disease risk factors DISC1 and TNIK interact to regulate synapse composition and function. Mol Psychiatry. 16, (2010).
- Ehlers, M. D. Reinsertion or degradation of AMPA receptors determined by activity-dependent endocytic sorting. Neuron. 28, 511-525 (2000).
- Tomita, S., Fukata, M., Nicoll, R. A., Bredt, D. S. Dynamic interaction of stargazin-like TARPs with cycling AMPA receptors at synapses. Science. 303, 1508-1511 (2004).
- Ehlers, M. D., Heine, M., Groc, L., Lee, M. C., Choquet, D. Diffusional trapping of GluR1 AMPA receptors by input-specific synaptic activity. Neuron. 54, 447-460 (2007).
- Bats, C., Groc, L., Choquet, D. The interaction between Stargazin and PSD-95 regulates AMPA receptor surface trafficking. Neuron. 53, 719-734 (2007).
- Ehlers, M. D. Activity level controls postsynaptic composition and signaling via the ubiquitin-proteasome system. Nat Neurosci. 6, 231-242 (2003).
- Cartier, E. A., et al. A biochemical and functional protein complex involving dopamine synthesis and transport into synaptic vesicles. J Biol Chem. 285, 1957-1966 (2010).
- Rodriguez de Lores, A., Alberici, M., De Robertis, E. Ultrastructural and enzymic studies of cholinergic and non-cholinergic synaptic membranes isolated from brain cortex. Journal of Neurochemistry. 14, 215-225 (1967).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: an electron-microscopic study of cell fragments derived by homogenization and centrifugation. J Anat. 96, 79-88 (1962).
- Cotman, C. W., Taylor, D. Isolation and structural studies on synaptic complexes from rat brain. J Cell Biol. 55, 696-711 (1972).
- Cotman, C. W., Banker, G., Churchill, L., Taylor, D. Isolation of postsynaptic densities from rat brain. The Journal of Cell Biology. 63, 441-455 (1974).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. The Journal of Cell Biology. 86, 831-845 (1980).
- Jones, D. H., Matus, A. I. Isolation of synaptic plasma membrane from brain by combined flotation-sedimentation density gradient centrifugation. Biochim Biophys Acta. 356, 276-287 (1974).
- Kennedy, M. B., Bennett, M. K., Erondu, N. E. Biochemical and immunochemical evidence that the "major postsynaptic density protein" is a subunit of a calmodulin-dependent protein kinase. Proceedings of the National Academy of Sciences of the United States of America. 80, 7357-7361 (1983).
- Moon, I. S., Apperson, M. L., Kennedy, M. B. The major tyrosine-phosphorylated protein in the postsynaptic density fraction is N-methyl-D-aspartate receptor subunit 2B. Proceedings of the National Academy of Sciences of the United States of America. 91, 3954-3958 (1994).
- Cho, K. O., Hunt, C. A., Kennedy, M. B. The rat brain postsynaptic density fraction contains a homolog of the Drosophila discs-large tumor suppressor protein. Neuron. 9, 929-942 (1992).
- Salahpour, A., et al. Increased amphetamine-induced hyperactivity and reward in mice overexpressing the dopamine transporter. Proc Natl Acad Sci U S A. 105, 4405-4410 (2008).
- Ma, D. K., et al. Neuronal activity-induced Gadd45b promotes epigenetic DNA demethylation and adult neurogenesis. Science. 323, 1074-1077 (2009).
- Budreck, E. C., Scheiffele, P. Neuroligin-3 is a neuronal adhesion protein at GABAergic and glutamatergic synapses. The European Journal of Neuroscience. 26, 1738-1748 (2007).
- Wu, J., et al. Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent beta-amyloid generation. Cell. 147, 615-628 (2011).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. J Cell Biol. 96, 1374-1388 (1983).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Res. 109, 285-309 (1976).
- Cheng, D., et al. Relative and absolute quantification of postsynaptic density proteome isolated from rat forebrain and cerebellum. Molecular & Cellular Proteomics : MCP. 5, 1158-1170 (2006).
- Sheng, M., Hoogenraad, C. C. The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu Rev Biochem. 76, 823-847 (2007).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Molecular cloning : a Laboratory Manual. , 2nd ed, Cold Spring Harbor Laboratory Press. (1989).
- Eggena, M., et al. Identification of histone H1 as a cognate antigen of the ulcerative colitis-associated marker antibody pANCA. J Autoimmun. 14, 83-97 (2000).
- Salahpour, A., et al. Homodimerization of the beta2-adrenergic receptor as a prerequisite for cell surface targeting. J Biol Chem. 279, 33390-33397 (2004).
- Bernocco, S., et al. Sequential detergent fractionation of primary neurons for proteomics studies. Proteomics. 8, 930-938 (2008).
- Grunewald, T. G., et al. Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma. BMC Cancer. 7, 198(2007).
- Heimann, K., Percival, J. M., Weinberger, R., Gunning, P., Stow, J. L. Specific isoforms of actin-binding proteins on distinct populations of Golgi-derived vesicles. J Biol Chem. 274, 10743-10750 (1999).
- Neff, R. A. 3rd, Gomez-Varela, D., Fernandes, C. C., Berg, D. K. Postsynaptic scaffolds for nicotinic receptors on neurons. Acta Pharmacol Sin. 30, 694-701 (2009).
- Cella, N., Cornejo-Uribe, R. R., Montes, G. S., Hynes, N. E., Chammas, R. The lysosomal-associated membrane protein LAMP-1 is a novel differentiation marker for HC11 mouse mammary epithelial cells. Differentiation. 61, 113-120 (1996).
- Otera, H., et al. Peroxisomal targeting signal receptor Pex5p interacts with cargoes and import machinery components in a spatiotemporally differentiated manner: conserved Pex5p WXXXF/Y motifs are critical for matrix protein import. Mol Cell Biol. 22, 1639-1655 (2002).
- Goubaeva, F., et al. Cardiac mitochondrial connexin 43 regulates apoptosis. Biochem Biophys Res Commun. 352, 97-103 (2007).
- Lamers, K. J., et al. Protein S-100B, neuron-specific enolase (NSE), myelin basic protein (MBP) and glial fibrillary acidic protein (GFAP) in cerebrospinal fluid (CSF) and blood of neurological patients. Brain Res Bull. 61, 261-264 (2003).
- Arunachalam, L., et al. Munc18-1 is critical for plasma membrane localization of syntaxin1 but not of SNAP-25 in PC12 cells. Mol Biol Cell. 19, 722-734 (2008).
- Brandstatter, J. H., Fletcher, E. L., Garner, C. C., Gundelfinger, E. D., Wassle, H. Differential expression of the presynaptic cytomatrix protein bassoon among ribbon synapses in the mammalian retina. Eur J Neurosci. 11, 3683-3693 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon