Method Article
Флуоресцентная матричная лазерная десорбция/ионизация с лазерно-индуцированной постионизационной масс-спектрометрией отдельных нервных клеток крыс
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом протоколе описывается использование микроМС для флуоресцентной масс-спектрометрии одиночных клеток MALDI-2, что позволяет улучшить молекулярное профилирование первичных нейрональных клеток крысы.
Аннотация
Измерения отдельных клеток имеют решающее значение для понимания богатой пространственно-химической гетерогенности мозга. Масс-спектрометрия (МС) с помощью матричного лазера/десорбционной ионизации (MALDI) способна безметочно и с высокой пропускной способностью характеризовать эндогенные молекулы в отдельных клетках. Последние достижения в разработке масс-спектрометров MALDI с лазерно-индуцированной постионизацией (MALDI-2) обеспечивают значительно повышенную чувствительность детектирования различных липидов и других малых молекул. Тем не менее, МС-визуализация больших образцов с помощью MALDI-2 с клеточным разрешением является непомерно медленной для большинства приложений. В этом протоколе первичные клетки изолируются и диспергируются на проводящих предметных стеклах. Относительное расположение клеток определяется с помощью цельностековой флуоресцентной микроскопии с последующей точной совместной регистрацией координат микроскопии с координатами рабочей области масс-спектрометра MALDI-2. Целевой МС-анализ только местоположений клеток обеспечивает высокопроизводительные измерения отдельных клеток с высоким покрытием аналита и уменьшенным размером данных по сравнению с МС-визуализацией всего образца. Мы описываем важнейшие этапы, необходимые для получения одиночных клеток, визуализации цельного предметного стекла, применения матрицы и масс-спектрометрии MALDI-2.
Введение
Липиды и метаболиты имеют основополагающее значение для клеточной функции и служат важными компонентами мембран, источников энергии и сигнальных молекул 1,2. Тем не менее, их состав и распространенность могут значительно варьироваться между отдельными клетками, отражая различия в типах клеток и их развитии и функциональных состояниях 3,4,5. Анализ этих различий имеет решающее значение для понимания биологической изменчивости и идентификации отдельных клеточных субпопуляций. Методы измерения отдельных клеток, такие как секвенирование РНК, позволяют получить полезные профили транскриптов для конкретных клеток6. Тем не менее, эти измерения на уровне транскриптов не отражают непосредственно фактическое количество липидов и метаболитов в клетках, поскольку экспрессия генов не всегда коррелирует с фактическим содержанием этих аналитов. Поэтому для всестороннего анализа химического состава отдельных клеток и их популяций требуются специализированные методы прямых измерений липидов и метаболитов.
Матричная лазерная десорбция/ионизация (MALDI) масс-спектрометрической визуализации (MSI) является предпочтительным инструментом для пространственного картирования эндогенных биомолекул in situ 7,8 без меток. Как правило, при использовании MALDI УФ-лазер используется для абляции материала из тонкого слоя образца, сокристаллизованного с органической матрицей, образуя шлейф ионов и нейтральных молекул. Затем образовавшиеся ионы разделяются с помощью МС-анализатора и детектируются в масс-спектрометре. Учитывая точное расположение современных столиков масс-спектрометра, лазер может быть позиционирован так, чтобы он был нацелен на определенные области образца или растрирован по областям для создания молекулярных изображений с помощью MSI. MSI с клеточным или субклеточным пространственным разрешением (< 10 мкм), достигаемым с помощью сфокусированного лазерного луча и точного движения рабочей области, может быть использована для получения химической информации об отдельных клетках 9,10. Однако измерения MSI в таком масштабе неэффективны, особенно в случае образцов с низкой плотностью целевых клеток, из-за количества времени, затрачиваемого на визуализацию пустых областей между клетками. Кроме того, обнаруживаемость многих аналитов ограничена из-за небольшого объема выборки. Чтобы преодолеть эти проблемы, мы разработали подход MALDI MS под визуальным контролем для высокопроизводительного анализа одиночных клеток11,12. В этом подходе местоположения дисперсных ячеек программно определяются по флуоресцентным изображениям всего предметного стекла и используются для направления столика масс-спектрометра к местам, где расположены отдельные клетки с определенными параметрами (например, размером и формой), а затем анализируются с помощью облучения лазером MALDI. Предыдущая работа с использованием этого таргетного подхода была использована для характеристики липидов, пептидов и других биомолекул в гетерогенных клеточных популяциях 5,13.
Учитывая ограниченную по массе природу одиночных клеток, количество аналитов, обнаруженных в таких образцах, как правило, меньше, чем при непосредственном исследовании из ткани. Таким образом, для увеличения охвата аналита при анализе РС одиночных клеток решающее значение имеет повышение чувствительности обнаружения аналита. Одним из недавно разработанных подходов, который помогает преодолеть эту проблему обнаружения, является MALDI с лазерной постионизацией (MALDI-2), который, как было показано, повышает чувствительность к широкому спектру аналитов 9,14,15,16. В результате MALDI-2 генерирует более полные наборы данных об отдельных клетках и обеспечивает более глубокий молекулярный охват в образцах с ограниченной массой, таких как изолированные клетки.
Цель этого метода — получить измерения липидов от тысяч отдельных клеток. С этой целью мы описываем рабочий процесс, который позволяет проводить высокопроизводительную масс-спектрометрию MALDI-2 с одной ячейкой и, как правило, может быть расширен до любого подхода к масс-спектрометрии на основе зондов с точным управлением столиком17. В этом рабочем процессе ткань из интересующей области (областей) мозга рассекается, и отдельные клетки получают из ткани после процедуры диссоциации папаина. Затем клетки помечаются ядерным красителем и диспергируются на проводящих стеклянных предметных стеклах, вытравленных реперными маркерами, где им разрешается прилипать. Затем с помощью флуоресцентной микроскопии делаются снимки всего предметного стекла. Матрица осаждается путем сублимации, что создает повторяемый однородный кристаллический слой и высокое соотношение сигнал/шум для анализа МС одиночных клеток. С помощью программного обеспечения с открытым исходным кодом microMS11 относительные координаты расположения клеток из микроскопического изображения картируются и выравниваются с координатами столика масс-спектрометра путем точечной регистрации с использованием реперных маркеров, выгравированных на предметных стеклах, где были нанесены клетки. Наконец, используя эту информацию, от каждой отдельной клетки получают точные, целевые спектры МС, что позволяет профилировать тысячи клеток за один прогон (<1 ч)12,13.
протокол
Все эксперименты на животных в этом исследовании проводились в соответствии с протоколом использования животных, утвержденным Комитетом по уходу за животными и их использованию в учреждениях штата Иллинойс (23228), со строгим соблюдением как национальных, так и ARRIVE-стандартов этичного обращения и ухода за животными.
1. Подготовка материалов и растворов
- Приготовьте модифицированный сбалансированный раствор соли Гея (mGBSS) с 1,5 мМ CaCl2, 4,9 мМ KCl, 0,2 мМ KH2PO4, 11 мМ MgCl2, 0,3 мМ MgSO4, 138 мМ NaCl, 27,7 мМ NaHCO3, 0,8 мМ Na2HPO4 и 25 мМ HEPES. Отрегулируйте pH до 7,2 с помощью 3 М NaOH. Рекомендуется приготовить 1 л mGBSS и хранить при температуре 4 °C до использования.
- Приготовьте шприцы объемом 50 мл, наполнив их приготовленным раствором mGBSS, и положите их на лед для транскардиальной перфузии. Приготовьте по 1 шприцу на каждую вскрытую крысу.
- Приготовьте аликвоты раствора папаина в соответствии с протоколом системы диссоциации папаина Уортингтона. Эта система содержит четыре флакона, как описано ниже, при этом флакон 4 не используется для этого протокола:
Флакон 1: стерильный сбалансированный солевой раствор Эрла (EBSS) с бикарбонатом и феноловым красным
Флакон 2: папаин с L-цистеином и ЭДТА
Флакон 3: дезоксирибонуклеаза I (ДНКаза)
Флакон 4: ингибитор овомукоидной протеазы с бычьим сывороточным альбумином- Добавьте 5 мл EBSS (флакон 1) во флакон с папаином (флакон 2) и поместите его на водяную баню при температуре 37 °C на 10 минут, чтобы папаин растворился.
- Добавьте 500 мкл EBSS (флакон 1) во флакон с ДНКазой (флакон 3) и аккуратно перемешайте. Добавьте 250 мкл разведенного флакона с ДНКазой (флакон 3) в флакон с папаином (флакон 2). Этот препарат содержит конечную концентрацию 20 ЕД/мл папаина, 0,005% ДНКазы, 0,5 мМ ЭДТА и 1 мМ L-цистеина.
- Заморозьте 250 мкл аликвот этого приготовленного раствора папаина для последующих диссоциаций (составляет ~20 аликвот). Дополните этот раствор следующими антибиотиками: 100 ЕД/мл пенициллина G, 100 мкг/мл стрептомицина и 100 мкг/мл гентамицина. Это может быть изменено для приложения пользователя.
- Приготовьте раствор ацетата аммония 150 мМ и храните его при температуре 4 °C. Приготовьте 33% раствор глицерина, разбавив глицерин в приготовленном растворе mGBSS.
- Травлейте реперные точки на предметных стеклах микроскопии с покрытием из оксида индия и олова (ITO) с помощью гравировального пера с наконечником из карбида вольфрама или алмазного наконечника или лазерного гравера CO2 . На проводящей стороне предметного стекла ITO вытравите 20-40 Х-образных реперных маркеров по периферии предметного стекла, чтобы обеспечить кроссплатформенную (например, микроскоп и масс-спектрометр) пространственную регистрацию.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не травить одну соединенную линию, окружающую образец или его участки, так как это нарушает поверхностную проводимость между областью и адаптером для предметного стекла.
2. Подготовка первичных нервных клеток
Примечание: Ткань гиппокампа крысы препарируют, диссоциируют на отдельные клетки с папаином и наносят на проводящие стеклянные стекла с низкой плотностью. Выделение клеток таким образом позволяет проводить высокопроизводительную масс-спектрометрию эндогенных липидов для отдельных клеток.
- Перед вскрытием животного разморозьте аликвоту приготовленного раствора папаина и поместите его в контейнер с входной и выходной трубкой, позволяющейCO2 вытеснять воздух внутри контейнера. Поместите эту систему в водяную баню, установленную на 37 °C, и продолжайте потокCO2 до тех пор, пока раствор не достигнет нужного pH, как указано цветом, используя цветовую таблицу pH, входящую в комплект системы диссоциации Papain Worthington. Целевой уровень pH находится в диапазоне от 7,2 до 7,4.
ПРИМЕЧАНИЕ: Не вводитеСО2 в ферментативный раствор, так как это приведет к денатурации ДНКазы и потере биологической активности. Используйте центрифужную пробирку объемом 50 мл с двумя пробирками, вклеенными в крышку, позволяя CO2 заполнять пробирку снизу и выходить из верхней выпускной трубки. - Усыпляйте крыс в соответствии с протоколами IACUC в соответствии с институциональными, местными и федеральными рекомендациями. Здесь используются 2-3-месячные самцы крыс Sprague-Dawley и приносятся в жертву путем удушения CO2 .
- Транскардинально перфузируйте крысу ледяным (4 °С) раствором mGBSS для удаления крови из сосудистой системы и быстрого охлаждения организма животного. Один из примеров этой процедуры можно найти в протоколе We et al.18.
- Хирургическим путем изолируйте мозг от крысы, следя за тем, чтобы не повредить интересующую область мозга. Ранее опубликованный обзор этой изоляции содержит более подробную информацию о некоторых отдельных шагах19.
- Используйте измельчитель ткани или тканевый куб, чтобы вырезать поперечное сечение (толщиной ~ 2 мм) мозга, чтобы подвергнуть эту область (гиппокамп, кору или стриатум) образцу.
- С помощью биопсийного перфоратора диаметром 2 мм возьмите образец интересующей области мозга и поместите кусочек ткани во флакон с раствором папаина.
- Инкубируйте эту ткань и раствор папаина при температуре 37 °C при постоянном перемешивании (например, с помощью электрической качалки) в течение 30-90 минут.
ПРИМЕЧАНИЕ: Продолжительность ферментативного лечения должна быть оптимизирована в зависимости от области мозга, штамма животного, возраста и желаемого выхода клеток (например, нейроны и астроциты с окончаниями по сравнению с максимальным выходом клеток без терминалей). Для тканей гиппокампа крысы характерно 60-90 мин. Более короткие обработки могут сохранить некоторые терминали, но оставить много клеток в недиссоциированных кластерах, в то время как более длительные обработки могут повысить урожайность, но увеличить повреждение клеток, требуя оценки с помощью анализов живых/мертвых (например, набор жизнеспособности/цитотоксичности LIVE/DEAD). Для сравнительных исследований лечение должно быть одинаковым для всех типов выборок. - Поместите пузырек с салфеткой и папаином на лед, чтобы охладить и подавить ферментативную активность. Растирайте ткань с помощью отрезанного наконечника для дозатора, прикрепленного к пипетке с регулируемым объемом P100, пока большая часть ткани не будет визуально разбита. Не образуйте пузырьков воздуха во время диссоциации, чтобы избежать чрезмерного повреждения клеток.
ПРИМЕЧАНИЕ: Энергичное растирание приводит к высокому выходу клеток; Однако они не сохраняют большую часть своих процессов. Щадящая растирание обеспечивает больше процессов на клетках, но приводит к большему количеству недиссоциированных клеток. Наконечники для пипеток разного размера и другие методы также могут быть оптимизированы для достижения идеальных результатов диссоциации20. - Центрифугируйте диссоциированные клетки при 300 x g в течение 5 минут при комнатной температуре, чтобы гранулировать клетки. Удалите надосадочную жидкость и повторно суспендируйте гранулу в 1 мл mGBSS. Добавьте в ядерный краситель Hoechst 33342 до конечной концентрации 1 г/мл.
- Нанесите 100-500 μл клеточной суспензии на травленое стекло ITO и оставьте на предметное стекло примерно на 5 минут или дольше, чтобы клетки могли оседать и прилипнуть к предметному стеклу.
- Разведение клеточной суспензии нужно будет определить опытным путем. Используя оптический микроскоп, добавьте каплю клеток на предметное стекло, чтобы определить приблизительную плотность, и разбавьте оттуда, чтобы убедиться, что расстояние между клетками достаточное (т.е. значительно больше, чем размер луча MALDI). Это разбавление может быть выполнено на первом слайде, а затем разбавление может быть скорректировано по мере необходимости для последующих слайдов.
- Осторожно отсадите суспензию элемента от предметного стекла с помощью вакуумной системы, содержащей (расположенных в порядке, начиная с вакуумной линии): 1) трубку со встроенным газовым фильтром HEPA, 2) трубку, установленную на фильтрующую колбу объемом 50 мл, 3) трубку, соединенную со вторым входным отверстием фильтрующей колбы с прикрепленным наконечником для пипетки (например, 100 мкл). Если вы храните покрытые клетки впрок, замените аспирированную суспензию 33% раствором глицерина на 1-2 минуты и удалите ее.
ПРИМЕЧАНИЕ: Этот шаг обеспечит стабильность клетки. Дозирование раствора глицерина с одной стороны и мягкое аспирирование с другой стороны работает оптимально для поддержания клеточной структуры. Всегда визуально контролируйте все описанные здесь этапы с помощью инвертированного микроскопа во время подготовки первого образца. - Нанесите 100-500 мкл ацетата аммония на осажденные участки, оставьте на 1 минуту, затем аспирируйте для очистки стекол. При необходимости повторите эти действия, чтобы убедиться, что на предметных стеклах нет соли или глицерина.
3. Микроскопия
ПРИМЕЧАНИЕ: Чтобы определить местоположение отложенных клеток, каждое стекло визуализируется с помощью светлопольной/флуоресцентной микроскопии. Флуоресцентный канал позволяет точно определить местоположение клеток, окрашенных по методу Хёхста, в то время как визуализация в светлом поле предоставляет морфологическую информацию. Для этого процесса подходит любой микроскоп, способный получать мозаичное изображение.
- Если это не было сделано ранее, промойте предметные стекла 2-3 мл 150 мл ацетата аммония. Этот шаг имеет решающее значение для удаления кристаллов глицерина и солей, которые могут мешать наблюдению под микроскопией и применению матрицы MALDI. Высушите горки под слабой струей N2 или дайте высохнуть на воздухе.
- Загрузите предметное стекло в предметный столик микроскопа. Сфокусируйте микроскоп, используя не менее 10 опорных точек, равномерно распределенных по предметному стеклу.
- Используя фильтры, подходящие для DAPI (возбуждение: 335-383 нм, излучение: 420-470 нм) и светлопольной визуализации, получите мозаичное флуоресцентное изображение с 5-10-кратным увеличением по всему слайду, гарантируя, что реперные маркеры (созданные на шаге 1.5) будут захвачены.
ПРИМЕЧАНИЕ: 5-кратного увеличения обычно достаточно, особенно когда необходимо сфотографировать много слайдов. Для определения более тонкой клеточной морфологии можно использовать 10-кратные или 20-кратные объективы за счет квадратично более длительного времени визуализации и увеличения размера файла. - Сшейте мозаичное изображение с помощью программного обеспечения для микроскопии, такого как ZEN (Zeiss). Точное сшивание имеет решающее значение, так как любые ошибки на этом этапе будут распространяться на последний этап регистрации, что приведет к неточному нацеливанию. Чтобы проверить, убедитесь, что вертикально расположенные рядом плитки не смещены. Кроме того, рассмотрите возможность получения мозаичных изображений с большим перекрытием плиток (20%-30%).
- Обрабатывайте и экспортируйте каждое изображение в виде файла bigTIFF в программном обеспечении для микроскопии. Если отображаемая область относительно мала и итоговый размер изображения составляет менее 2 ГБ, используйте стандартный формат файла TIFF.
4. Матричное приложение
ПРИМЕЧАНИЕ: Последовательное и правильное применение матрицы MALDI имеет решающее значение для получения качественных данных по отдельным ячейкам. В то время как здесь используется сублимация с помощью коммерческого аппарата, нанесение матрицы также может быть выполнено с помощью роботизированного распылителя12, аэрографа21 или самодельного сублимационного аппарата22. Мы обнаружили, что препараты одиночных клеток требуют меньше матрицы, чем тонкие срезы тканей, обычно используемые для масс-спектрометрической визуализации. Чтобы уменьшить пакетные эффекты, рекомендуется применять матрицу ко всем исследуемым предметным стеклам в течение одного сеанса и по возможности помещать клетки из разных групп (например, из области мозга или из контрольной группы) на одно и то же предметное стекло. Выбор матрицы имеет решающее значение как для традиционных рабочих процессов MALDI, так и для MALDI-2 с одиночными ячейками. Для одноклеточных MALDI успешно используются DHB23, 9-AA24 и CHCA25 . В MALDI-2 мы и другие наблюдали значительное усиление сигнала с помощью DHAP9, в то время как такие матрицы, как NEDC16 и CHCA26 , также были эффективно применены.
- Растворите 20 мг 2,5-дигидроксиацетофенона (ДХАП) в 1,5 мл ацетона. Поместите предметные стекла в держатель сублимационной камеры и поместите их в сублимационный аппарат.
- Нанесите растворенный матричный раствор на керамическую пластину и дайте ацетону испариться. Закройте сублимационную камеру, чтобы закрыть ее.
- Заполните камеру охлаждающей жидкости ледяной водой и поместите ее поверх камеры.
- Включите вакуум и дайте системе уравновеситься в течение 5 минут. Давление в системе должно быть менее 40 мбар.
- Начните сублимацию с нагрева камеры до 200 °C в течение 5 минут.
- Снимите баню с ледяной водой, увеличьте температуру до 25 °C и установите радиатор на верхнюю часть камеры. Дайте системе прогреться до комнатной температуры в течение 5 минут, чтобы избежать образования конденсата.
ПРИМЕЧАНИЕ: Контейнер с ледяной водой можно опорожнить и наполнить горячей водой, которая будет служить радиатором. - Медленно проветрите систему, откройте камеру и снимите предметные стекла.
5. Одноклеточный MALDI MS
ПРИМЕЧАНИЕ: Данные МС одиночных клеток получены на приборе MALDI-2 timsTOF (timsTOF flex) с использованием пакета microMS с открытым исходным кодом для обнаружения клеток и управления масс-спектрометром. Для этого необходимо, чтобы расположение пикселей оптического изображения целевых клеток было преобразовано в физические координаты столика масс-спектрометра.
- Откройте микроМС и уменьшите микроскопические изображения bigTIFF с помощью опции «Группа изображений», так как есть как светлопольные, так и флуоресцентные каналы.
- С помощью инструмента "Параметры большого двоичного объекта" определите оптимальные параметры для выбора целевых ячеек. Настройте следующие параметры: максимальный и минимальный размер большого двоичного объекта, чтобы выбрать размер большого или большого размера больших двоичных объектов, которые следует найти; настройка порогового значения, определяющая, как установить пороговое значение флуоресцентного канала для обнаружения больших двоичных объектов; и круговость, которая определяет, насколько круглыми должны быть идентифицированные клетки для рассмотрения. Для представленных здесь данных мы использовали следующие значения параметров: максимальная круговость: нет; минимальная круговая величина: 0,6; порог: 75; минимальный размер: 20; Максимальный размер: нет.
- Используйте параметр Поиск BLOB-объектов для поиска BLOB-объектов и всплывающее окно, чтобы сохранить список BLOB-объектов под нужным именем.
- С помощью инструмента Фильтр расстояний выберите конкретное расстояние, на котором каждая ячейка должна находиться друг от друга (для этих данных с помощью 5-кратной флуоресцентной микроскопии мы использовали фильтр расстояний в 35 пикселей). Это необходимо для того, чтобы клетки находились достаточно далеко друг от друга для проведения анализа отдельных клеток. Это число выражается в пиксельных единицах, поэтому знайте преобразование пикселей в μм для микроскопа, чтобы определить идеальное число. Используйте размер диаметра лазерного щупа плюс около 20-30 мкм для учета ошибок в регистрации.
- Загрузите слайды в прибор с помощью адаптера MTP Slide Adapter II. Вернитесь к компьютеру с помощью microMS и с помощью приложения удаленного рабочего стола получите доступ к компьютеру масс-спектрометра.
- Если прибор используется впервые, проверьте его положение по осям X-Y. Для этого перейдите в раздел «Инструменты и настройки инструментов». Во всплывающем окне отобразится набор координат с их позициями по осям X и Y. Выберите каждую из этих конкретных точек на геометрии адаптера Slide Adapter II на приборе и обновите положения X и Y в окне microMS.
- Используя элементы управления камерой и столиком масс-спектрометра, перейдите к легко идентифицируемому месту на слайде и скопируйте координаты прибора. В microMS найдите соответствующее место на изображении микроскопа, щелкните правой кнопкой мыши по этому положению и введите координаты в текстовое положение всплывающего окна. Округлите все координаты до ближайшего целого числа, а координаты X и Y разделите пробелом (т.е. 39595 -23232).
- Повторите шаг 5.7. зарегистрировать не менее 12 реперных маркеров по всему слайду. После того, как будут добавлены три точки регистрации, один из кругов станет красным, указывая на то, что это наиболее невыгодная позиция от регистрации. Если это произошло, удалите текущую точку регистрации с помощью Shift + щелчок правой кнопкой мыши и повторите попытку.
- В разделе Файл перейдите в раздел Сохранить, а затем в раздел Регистрация, чтобы сохранить файл регистрации (.msreg).
- Когда большие двоичные объекты отображаются на слайде, сохраните файл положения инструмента (.xeo), перейдя в раздел «Файл», затем «Сохранить», а затем «Положения приборов». Используя программное обеспечение для удаленного рабочего стола, перенесите этот файл .xeo на компьютер прибора.
- Скопируйте текст из пользовательского файла .xeo, созданного в файл .xeo MTP Slide Adapter II на приборе и сохраните его. Это обновит файл геометрии с указанием местоположения ячеек.
- Перейдите на вкладку Автоматизация и выберите Создать..., чтобы запустить автоматический запуск. Перетащите курсор через отображаемую область выборки, чтобы выбрать ячейки, и щелкните правой кнопкой мыши, чтобы добавить их в список анализа. Сохраните прогон автоматизации и нажмите кнопку Начать автоматический запуск , чтобы начать сбор. Продолжительность прогона зависит от множества факторов, включая количество ячеек, лазерные выстрелы и частоту лазера, но в целом, примерно 5-10 ячеек могут быть проанализированы в режиме MALDI (частота повторения лазера 10 кГц), а 1-5 ячеек могут быть проанализированы в режиме MALDI-2 (частота повторения лазера 1 кГц) каждую секунду.
6. Обработка данных
Примечание: Существующие коммерческие пакеты программного обеспечения не очень хорошо подходят для анализа высокопроизводительных данных масс-спектрометрии с использованием одиночных клеток. В то время как отдельные спектры можно визуализировать, для извлечения значимых биологических знаний требуются специализированные инструменты. Чтобы решить эту проблему, мы предоставляем бесплатное программное обеспечение, которое облегчает анализ данных MALDI-2 MS для отдельных клеток. Наш обновленный рабочий процесс упрощает прямое преобразование данных из одной ячейки в формат imzML с открытым исходным кодом27, обеспечивая совместимость с SCiLS MVS и другим программным обеспечением поставщиков. Для более сложного анализа данных полный скрипт также включает функции аннотирования липидов, кластеризации и другие инструменты визуализации, доступные в Matplotlib (версия 3.7.3). Парсинг и чтение необработанных данных облегчаются библиотекой pyTDFSDK, набором функций, включенных в рабочий процесс TIMSCONVERT28.
- Инициализируйте пользовательскую библиотеку Python SC_MALDI2_Analysis, скопировав файл, предоставленный в дополнительном файле 1 , в тот же рабочий путь, что и Jupyter Notebook, а затем нажмите Shift + Enter на клавиатуре в первой ячейке кода. Это позволит нам в дальнейшем вызывать эти функции и использовать их для обработки данных.
- Скопируйте путь к собранным данным (файлы Bruker .d). Мы рекомендуем называть папки и имена каждого файла описательно, чтобы мы могли проанализировать эти пути к файлам позже, чтобы установить метаданные для каждого образца. Запустите команду Импорт файлов Bruker .d и сохраните их в ячейку с кодом списка. Это выведет общее количество загруженных файлов .d.
- Запустите ячейку кода под названием Обработка необработанных данных и сохранение в imzML. Он прочитает каждый предоставленный файл Bruker .d, выполнит выбор пиковых значений данных, а затем сохранит 20 ppm данных вокруг каждого пика в файл .imzML, записанный внутри файла .d.
- Чтобы найти сохраненные данные, откройте местоположение первого файла .d, и imzML и другие метаданные будут сохранены в этом пути. На этом этапе сохраненный файл imzML может быть импортирован в программное обеспечение вендора, такое как SCiLS Lab MVS. Для более сложного анализа данных продолжайте следовать сценарию.
- Загрузите сохраненные данные imzML, выполнив команду Загрузка в ранее сохраненной ячейке с кодом файла imzML. При этом сохраненные данные загружаются в переменные data.
- Запустите команду Группировка данных и сохранение ячейки матрицы данных, чтобы объединить все данные по общей оси m/z , удалить объекты, присутствующие в низкой плотности (<0,1%), и удалить значения меньше шума (относительная интенсивность 100). Затем эта функция повторно связывает данные путем усреднения каждого пикового значения m/z в каждой ячейке. Результирующая матрица данных сохраняется как datacube_array, ячейки m/z , связанные с матрицей, сохраняются как valid_mz_bins, а количество каждой ячейки сохраняется как количество.
- Чтобы аннотировать данные, запустите ячейку аннотации Экспорт пиков для LIPID MAPS . Это приведет к копированию всех m/z пиков в вашей матрице данных в буфер обмена. Вставьте это в пустой текстовый файл и сохраните его, чтобы загрузить на LIPID MAPS.
- Откройте lipidmaps.org, затем выберите MS Data Bulk Search и Search LMSD для поиска биологически значимых видов липидов. Загрузите список пиков, выбрав текстовый файл и выбрав соответствующие аддукты (например, [M+H]+, [M+Na]+ и [M+K]+). Выберите допустимое отклонение по массе, подходящее для вашего масс-спектрометра (мы выбрали +/- 0,01 м/з), выберите все интересующие классы липидов и нажмите «Поиск». Скачайте файл .tsv.
- Загрузите метаданные спектров, выполнив команду Загрузка в пути к отдельным ячейкам для ячеек метаданных. Измените здесь разделенный код на основе структур пути к файлу.
- Выполните предварительную обработку данных, запустив ячейку Предварительная обработка данных и аннотация липидов . При этом будет использоваться tsv-файл lipidMAPS для аннотирования набора данных с точностью до 10 ppm, исключения нечетных цепных липидов из результатов lipidMAPS, нормализации оставшихся данных и удаления объектов или ячеек, которые не превышают определенного порога. При этом новый обработанный набор данных будет сохранен как data2, а обновленные метаданные спектров — как updated_cell_types.
- Анализ данных выполняется методом сканирования. Запустите ячейку UMAP и Clustering Analysis for Single Cells , чтобы выбрать интересующие нас данные (здесь мы выбрали только данные MALDI-2, M2), масштабировать набор данных и загрузить его в сканпы объект AnnData для упрощения анализа.
ПРИМЕЧАНИЕ: Здесь на наборе данных была выполнена Лейденская кластеризация и уменьшение размерности (UMAP), визуализированы как исходные классы данных, так и кластеры на UMAP, а некоторые из наиболее статистически значимых признаков среди кластеров были суммированы с помощью функции rank_genes_groups_dotplot из scanpy.
Результаты
Обзор рабочего процесса для одноклеточного MALDI-2 MS с флуоресцентным управлением показан на рисунке 1. Во-первых, ткань, рассекаемая из целевых областей мозга (рис. 1A), диссоциируется на отдельные клетки и наносится на проводящие микроскопические стекла с покрытием ITO (рис. 1B). Расположение клеток определяется с помощью флуоресцентной визуализации всего предметного стекла (рисунок 1C), за которым следует применение матрицы MALDI (рисунок 1D), анализ MALDI-2 MS с помощью микроМС (рисунок 1E) и анализ данных (рисунок 1F). Используя этот рабочий процесс, можно предположительно идентифицировать от десятков до сотен липидов в отдельных клетках с точностью массы менее 10 ppm (с помощью MALDI-2 timsTOF).
Масс-спектрометрическая визуализация может быть выполнена на небольшой области интереса для оценки качества клеточного препарата и нанесения матрицы. Репрезентативный результат визуализации дисперсных клеток с помощью MALDI-2 показан на рисунке 2A. По этому изображению пользователь может оценить степень распространения аналита по сравнению с микрофотографией того же региона. В зависимости от величины распространения аналитик может настроить размер поля лазерного луча и фильтр расстояний, чтобы обеспечить истинное получение данных об отдельных ячейках. В одноклеточном MSI для получения клеточного разрешения (1-5 мкм) будет использоваться малый размер лазера и ширина растра (1-5 мкм), в то время как для микроMS можно использовать лазер большего размера, увеличивая интенсивность сигнала и количество обнаруживаемых липидов относительно визуализации. Репрезентативные результаты усиления сигнала, полученные с помощью MALDI-2, показаны на рисунке 2B. Повышение уровня холестерина, ПЭ и ПК наблюдается в соответствии с предшествующей литературой14. Как правило, наилучшее усиление сигнала MALDI-2 достигается при использовании относительно высокой мощности лазера (>50%) и меньшего количества снимков (от 10 до 200). Необходима некоторая оптимизация, так как слишком низкая мощность лазера не обеспечит усиления, в то время как слишком большая энергия лазера вызовет чрезмерную фрагментацию аналита29. Для анализа отдельных клеток пространственная регистрация является критически важным шагом для обеспечения точного нацеливания на отдельные клетки. Для проверки регистрации вокруг слайда может быть сгенерирован небольшой набор контрольных точек (~5) путем создания пятен в известных точках и экспорта координат прибора через микроMS. Проверка правильности расположения измерительного столика в этих тестовых точках при выборе гарантирует, что последующее нацеливание на ячейку будет точным.
MALDI MS позволяет профилировать клеточную гетерогенность как между отдельными областями мозга, так и внутри них (рис. 3). Анализируя вариации липидных профилей, методы уменьшения размерности эффективно разделяют клетки на отдельные кластеры, подчеркивая разнообразие липидных составов в наборе данных (рис. 3A). Кроме того, применение методов кластеризации, таких как Лейденская кластеризация, показывает наличие уникальных субпопуляций клеток в определенных областях мозга, включая стриатум и кору головного мозга (рис. 3B). Кроме того, сравнивая липидные профили каждого кластера друг с другом (рис. 3C), можно использовать конкретные липиды в качестве маркеров для определения идентичности, специфичной для кластера. Некоторые виды липидов значительно повышаются или понижаются в определенных кластерах, что предполагает различные функциональные роли или состояния, в то время как другие являются общими для всех кластеров, но различаются по своей относительной интенсивности сигнала. Чтобы обеспечить надежный анализ данных на последующих этапах, важно обеспечить надежное обнаружение липидов в большинстве клеток и оценить потенциальные эффекты партии. На рисунке 3D представлены репрезентативные спектры шести отдельных корковых клеток, распределенных по отдельным предметным стеклам, покрытым ITO. В то время как отдельные липидные профили демонстрируют гетерогенность, липиды последовательно обнаруживаются во всех полученных данных. На рисунке 3E показана UMAP корковых клеток из разных слайдов, подготовленных и проанализированных в идентичных условиях. Существенное перекрытие клеток между предметными стеклами указывает на то, что пакетные эффекты существенно не искажают биологические интерпретации. При необходимости могут быть применены алгоритмы периодической коррекции, такие как ComBat30 , для смягчения любых остаточных эффектов. Таким образом, одноклеточный MALDI-2 является передовым методом идентификации липидных биомаркеров, предлагающим критически важное понимание клеточных субпопуляций и улучшающим наше понимание регионального и функционального разнообразия в мозге.
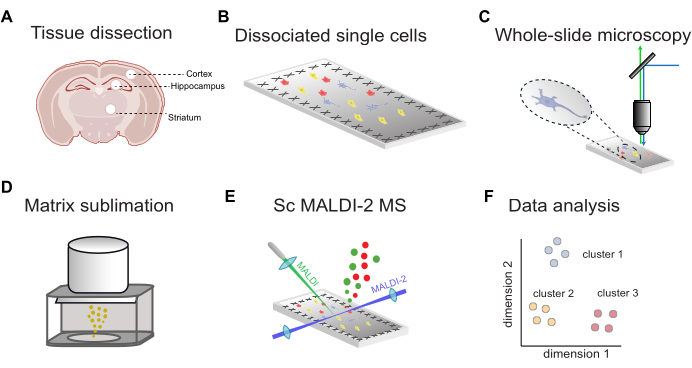
Рисунок 1: Общий рабочий процесс для scMALDI-2 MS. (A) Ручное рассечение тканей и изоляция областей мозга. (B) Папаинская диссоциация ткани на одиночные клетки и осаждение клеток на проводящие предметные стекла с покрытием ITO. (C) Цельностекольная флуоресцентная микроскопия с помощью ядерного окрашивания (DAPI/Hoechst). (D) Сублимация матрицы MALDI (DHAP) на предметные стекла. (E) Измерения MALDI-2 MS с помощью одного элемента под визуальным контролем. (F) Всесторонний анализ данных, включая уменьшение размерности, кластеризацию и статистический анализ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
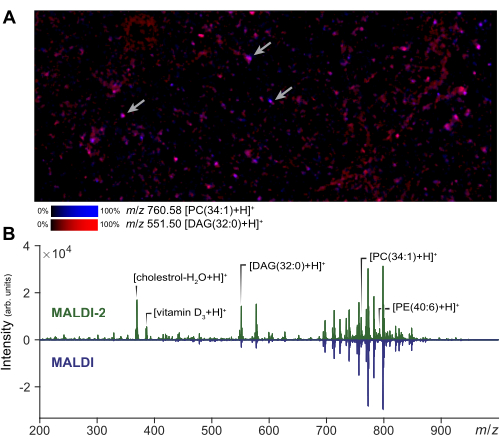
Рисунок 2: Оптимизация и визуализация MALDI-2 MSI для анализа одиночных клеток. (A) Визуализация MALDI-2 MSI дисперсных популяций первичных клеток. Стрелками обозначены несколько отдельных ячеек. Выполнение MSI и небольшой области позволяет аналитику оптимизировать параметры метода и оценить качество выборки. (B) Сравнение результатов, полученных с использованием MALDI-2 и MALDI MS. Усиление сигнала (MALDI 2 против MALDI) различных липидов, включая холестерин, DAG (диацилглицерины), PC (фосфатидилхолин) и PE (фосфатидилэтаноламин), подчеркивается путем отображения спектра MALDI-2 (вверху) и спектра MALDI (внизу). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
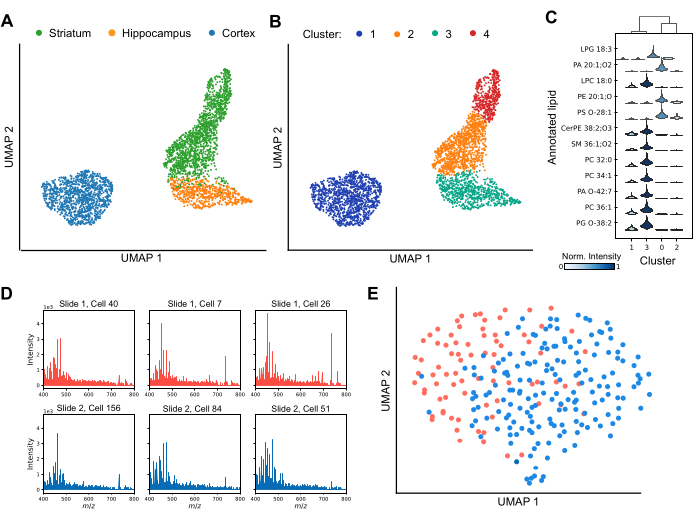
Рисунок 3: Профилирование липидов одиночных клеток в трех областях мозга грызунов с помощью MALDI-2 MS. (A) анализа равномерной аппроксимации и проекции многообразия (UMAP) анализируемых клеток, окрашенных по области происхождения мозга. (B) UMAP анализ тех же клеток после прохождения Лейденской кластеризации, где кластеры соответствуют субпопуляциям клеток со сходным липидным составом. Цветами здесь показаны различные кластеры данных Лейдена. (C) График Скрипки, показывающий разницу в распределениях интенсивности для различных липидов между кластерами. (D) Спектры шести репрезентативных отдельных клеток коры головного мозга были проанализированы с двух отдельных слайдов. (E) UMAP анализ клеток коры головного мозга, проанализированный на двух отдельных предметных стеклах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный файл 1: SC-MALDI2_Analysis.py. Этот файл содержит набор функций, разработанных для обработки данных масс-спектрометрии MALDI-2 с одной ячейкой. Он включает в себя методы чтения необработанных данных масс-спектрометрии, выполнения биннинга, а также проведения аннотаций и последующего анализа. Набор ячеек для загрузки и выполнения всей предварительной обработки и анализа данных представлен в дополнительном файле 2. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: JOVE Analysis.ipynb. Этот файл содержит записную книжку Jupyter, которая содержит набор ячеек для загрузки пользовательских функций Python из SC-MALDI2_Analysis.py и выполнения всей упомянутой предварительной обработки и анализа данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Высокопроизводительный одноклеточный MALDI MS с визуальным контролем является ценным инструментом для понимания химической гетерогенности в масштабе одной клетки. Добавление лазерно-индуцированной постионизации (MALDI-2) обеспечивает более глубокое покрытие аналита, что имеет решающее значение для образцов с ограниченной массой и объемом, таких как изолированные клетки млекопитающих.
В то время как в подавляющем большинстве опубликованных рабочих процессов с липидами и метаболитами одиночных клеток РС используются культивируемые клетки, наш подход применяется к относительно быстро выделенным первичным клеткам. Это различие имеет решающее значение, так как культивируемые клетки демонстрируют заметные изменения в содержании метаболитов и липидов всего за несколько дней культивирования23,31. Ферментативная изоляция клеток, в большинстве случаев, приводит к потере тонких клеточных структур, таких как аксоны, дендриты и астроцитарные процессы. Таким образом, наблюдаемые сигналы аналита получаются в первую очередь от клеточной сомы. Несмотря на это, достигнута успешная классификация по типу клеток4 и области мозга12. Это говорит о том, что многие липиды, которые являются уникальными для отдельных клеток, расположены в соме.
Небольшие различия в методе нанесения матрицы MALDI могут оказывать глубокое влияние на результирующий сигнал аналита. Мы представили рабочий процесс, основанный на воспроизводимой сублимации матрицы с помощью коммерческого аппарата, который генерирует однородный матричный слой, высокое соотношение сигнал/шум и ограниченное распространение аналита. Тем не менее, можно использовать матричное нанесение с помощью роботизированного распылителя или аэрографа художника, среди прочих подходов. Независимо от подхода, для достижения оптического соотношения матрицы и аналита к одноклеточным препаратам следует применять более низкую плотность матрицы по сравнению с той, которая используется в стандартных тканевых MSI. Плотность матрицы, применяемая здесь, составляет примерно половину от плотности, используемой для тканевого MSI. Конечно, это означает, что количество матрицы на клетку выше, чем в MSI, что способствует усиленному извлечению и обнаружению аналита в подходе с изолированными клетками, используемом здесь.
Для образцов, требующих значительной оптимизации, выполнение MSI с небольшим ROI диссоциатов отдельных клеток, как показано на рисунке 2A, может быть выполнено как часть процесса оптимизации. Этот шаг также может позволить аналитику оценить степень распространения аналита при применении матриц на основе растворителей.
Для успешной MALDI отдельных клеток под визуальным контролем требуется высококачественное флуоресцентное изображение, воспроизводимое матричное нанесение и точное управление столиком. Эти эксперименты более требовательны, чем стандартные рабочие процессы MSI, которые допускают незначительные ошибки регистрации и изменчивость условий матрицы и образца из-за больших областей визуализации и большего количества аналитов. Несмотря на эти проблемы, мы успешно нацелились на отдельные органеллы с помощью традиционной MALDI.
Точное сшивание мозаичных флуоресцентных изображений имеет важное значение, так как небольшие ошибки могут усугубить и повлиять на управление сценой, что делает точность регистрации критически важной. Пакетные эффекты также представляют собой серьезную проблему, поскольку различия сигнала наблюдаются на одном и том же слайде, между слайдами и при подготовке. Надлежащие стратегии нормализации, включая использование внутренних стандартов и межквартильной нормализации, помогают смягчить эти проблемы. Кроме того, алгоритмы периодической коррекции, такие как ComBat30 , могут использоваться для снижения технической изменчивости и усиления истинных биологических различий.
Получение достоверных молекулярных аннотаций из отдельных клеток остается сложной задачей. Часто количество материала и чувствительность обнаружения недостаточны для тандемных МС от всех, кроме наиболее распространенных видов. Для тех из них, которые недостаточно обнаруживаемы для тандемного МС непосредственно из отдельных клеток, могут быть применены альтернативные подходы к созданию библиотеки аналитов. Например, данные о тандемном РС на тканях могут быть получены из тонких криоссечений из той же области мозга и животных, используемых для создания клеточных популяций. Также может быть использована экстракция липидов из ткани с последующим ЖХ-МС. По мере того, как стратегии подготовки образцов и технология МС продолжают совершенствоваться, все больше и больше актуальной структурной информации можно получить непосредственно из отдельных клеток. В будущем мы ожидаем, что этот рабочий процесс будет расширен для получения тандемных данных МС из отдельных клеток, что устранит необходимость во вспомогательных экспериментах ЖХ-МС/МС. Мы также предполагаем, что этот подход может быть распространен на многочисленные образцы в микромасштабе в биологии и за ее пределами, включая уникальные типы клеток, органеллы млекопитающих, порошки и микропластик.
Раскрытие информации
Авторы не имеют конкурирующих интересов для раскрытия информации.
Благодарности
S.W.C выражает признательность за поддержку, оказанную стипендией Peixin He and Xiaoming Chen PhD4 Fellowship и стипендией Университета Иллинойса Block Grant. Эта работа также была поддержана Национальным институтом по борьбе со злоупотреблением наркотиками в рамках премии No. P30DA018310, Национальный институт по проблемам старения в рамках премии No. R01AG078797, а также Канцелярией Директора Национальных институтов здравоохранения под Грантом No S10OD032242.
Материалы
| Name | Company | Catalog Number | Comments |
| 2',5'-dihydroxyacetophenone | Sigma Aldrich | D107603 | DHAP, 97% purity |
| Ammonium acetate | Sigma Aldrich | 238074 | ACS reagent, ≥97% |
| Axio M2 Imager | Zeiss | N/A | N/A |
| Biopsy punch, 2 mm | Fisher Scientific | 12-460-399 | integra miltex standard biopsy punch, 2mm |
| Calcium chloride | Sigma Aldrich | C4901 | anhydrous, powder ≥97% |
| Eppendorf Centrifuge | Sigma Aldrich | EP5405000441 | centrifuge 5425 with rotor FA-24x2 |
| Gentamicin | Sigma Aldrich | G1272 | liquid, BioReagent |
| Glass etching pen | Sigma Aldrich | Z225568 | carbide time, pkg of 1 |
| Glycerol | Sigma Aldrich | G7893 | ACS reagent, ≥99.5% |
| HEPES buffer | Sigma Aldrich | H3375 | ≥99.5% (titration) |
| Hoechst 33258 Solution | Sigma Aldrich | 94403 | 1 mg/mL in H2O, ≥98.0% (HPLC) |
| In line HEPA Filter | Sigma Aldrich | WHA67225001 | VACU-GUARD 60 mm disc, 0.45 PFTE housing |
| ITO-Coated Microscopy Slides | Delta Technologies | CG-90IN-S115 | 70-100Ω resistance |
| Magnesium chloride | Sigma Aldrich | M8266 | anhydrous, ≥98% |
| Magnesium sulfate | Sigma Aldrich | 208094 | anhydrous, ≥97% |
| Microcentrifuge tubes | Sigma Aldrich | HS4323K | tube capacity 1.5 mL, pack of 500 |
| Papain dissociation system | Worthington Biochemical | LK003150 | one box, 5 single use vials |
| Penicillin-Streptomycin | Sigma Aldrich | P4458 | liquid, BioReagent |
| Potassium chloride | Sigma Aldrich | 529552 | Molecular biology grade |
| Potassium phosphate monobasic | Sigma Aldrich | P5379 | Reagent Plus |
| Sodium biocarbonate | Sigma Aldrich | S6014 | ACS reagent, ≥99.7% |
| Sodium chloride | Sigma Aldrich | S9888 | ACS reagent, ≥99% |
| Sodium hydroxide | Sigma Aldrich | 221465 | ACS reagent, ≥97%, pellets |
| Sodium phosphate dibasic | Sigma Aldrich | S9763 | ACS reagent, ≥99% |
| Sublimate | HTX | N/A | N/A |
| timsTOF FleX MALDI-2 | Bruker | N/A | microGRID enabled |
| Vacuum tubing | Thermo Scientific | 8701-0080 | Nalgene Non-phthalate PVC Tubing |
Ссылки
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены