Method Article
レーザー誘起位置イオン化質量分析によるラット神経細胞の蛍光ガイド下マトリックス支援レーザー脱離イオン化
* これらの著者は同等に貢献しました
要約
このプロトコールでは、蛍光ガイド下シングルセルMALDI-2質量分析にmicroMSを使用することを概説し、初代ラット神経細胞の分子プロファイリングを強化します。
要約
シングルセル測定は、脳の豊かな時空間化学的不均一性を理解するために重要です。マトリックス支援レーザー/脱離イオン化(MALDI)質量分析(MS)は、個々の細胞の内因性分子のラベルフリーでハイスループットな特性評価が可能です。レーザー誘起ポストイオン化(MALDI-2)を備えたMALDI質量分析計の開発における最近の進歩により、さまざまな脂質やその他の低分子の検出感度が大幅に向上しています。しかし、MALDI-2を用いた大きなサンプルの細胞分解能でのMSイメージングは、ほとんどのアプリケーションにおいて非常に遅くなります。このプロトコルでは、初代細胞を単離し、導電性スライド上に分散させます。相対的な細胞位置は、ホールスライド蛍光顕微鏡法によって決定され、続いて顕微鏡座標とMALDI-2質量分析計のステージ座標との正確な同時レジストレーションが行われます。細胞位置のみのターゲットMS分析により、サンプル全体のMSイメージングと比較して、高い分析種カバレッジとデータサイズの縮小により、ハイスループットのシングルセル測定が可能になります。シングルセル調製、ホールスライド蛍光イメージング、マトリックスアプリケーション、およびMALDI-2質量分析に必要な重要なステップについて説明します。
概要
脂質と代謝物は細胞機能の基本であり、膜、エネルギー源、およびシグナル伝達分子の必須成分として機能します1,2。しかし、それらの組成と存在量は、細胞の種類と発生および機能状態の違いを反映して、個々の細胞間で大きく異なる可能性があります3,4,5。これらの違いを解析することは、生物学的多様性を理解し、異なる細胞亜集団を同定するために非常に重要です。RNAシーケンシングなどのシングルセル測定技術は、有用な細胞特異的な転写産物プロファイルを提供します6。しかし、遺伝子発現は必ずしもこれらの分析物の実際の存在量と相関するわけではないため、これらの転写産物レベルの測定値は、脂質や代謝物の実際の細胞量を直接反映するものではありません。したがって、脂質と代謝物を直接測定するための特殊な方法は、単一細胞とその集団の化学組成を包括的に分析するために必要です。
マトリックス支援レーザー脱離イオン化(MALDI)質量分析イメージング(MSI)は、in situ7,8の内因性生体分子のラベルフリー空間マッピングに最適なツールです。通常、MALDIでは、UVレーザーを使用して、有機マトリックスと共結晶化した薄いサンプル層から材料をアブレーションし、イオンと中性分子のプルームを形成します。次に、形成されたイオンをMSアナライザーで分離し、質量分析計内で検出します。最新の質量分析計ステージの正確な位置決めを考えると、レーザーは特定のサンプル領域を対象とするように配置したり、MSIによって領域間でラスター化して分子画像を生成したりできます。細胞内または細胞内の空間分解能(< 10μm)でのMSIは、集束レーザービームと正確なステージ移動によって達成され、個々の細胞に関する化学情報を得るために使用され得る9,10。しかし、このスケールでのMSI測定は、特に標的細胞密度の低いサンプルの場合、細胞間の空領域のイメージングに時間がかかるため、非効率的です。さらに、多くの分析種は、サンプリングされた量が少ないため、検出可能性が制限されます。これらの課題を克服するために、私たちはハイスループットシングルセル解析のための画像誘導MALDI MSアプローチを開発しました11,12。このアプローチでは、全スライド蛍光画像から分散細胞の位置をプログラムで決定し、質量分析計のステージを特定のパラメータ(サイズや形状など)を持つ個々の細胞が位置する位置に誘導し、MALDIレーザーの照射によって分析します。このターゲットアプローチを用いた以前の研究は、不均一な細胞集団5,13における脂質、ペプチド、およびその他の生体分子の特性評価に使用されてきました。
単一細胞の質量が限られているため、このようなサンプルで検出される分析物の数は、一般に組織から直接観察されるものよりも少なくなります。したがって、シングルセルMS分析で分析種の適用範囲を増やすには、分析種検出感度を向上させることが重要です。この検出課題を克服するのに役立つ最近開発されたアプローチの1つは、レーザーポストイオン化(MALDI-2)によるMALDIであり、これは広範囲の分析物9,14,15,16の感度を向上させることが示されています。その結果、MALDI-2はより包括的なシングルセルデータセットを生成し、単離された細胞などの質量が限られているサンプルでより深い分子カバレッジを提供します。
この方法の目標は、数千の個々の細胞から脂質測定値を取得することです。この目的のために、ハイスループットのシングルセルMALDI-2質量分析を可能にし、一般的に正確なステージ制御を備えた任意のプローブベースの質量分析アプローチに拡張可能なワークフローについて説明します17。このワークフローでは、目的の脳領域の組織を解剖し、パパイン解離法後の組織から個々の細胞を採取します。次に、細胞を核染色で標識し、基準マーカーでエッチングされた導電性スライドガラス上に分散させ、そこで接着させます。次に、蛍光顕微鏡を用いてホールスライド画像を撮影します。マトリックスは昇華によって堆積され、再現性のある均質な結晶層とシングルセルMS分析のための高いS/N比を生成します。オープンソースソフトウェアであるmicroMS11を使用して、顕微鏡画像からの細胞位置の相対座標を、細胞が堆積したスライドガラスにエッチングされた基準マーカーを使用したポイントセットレジストレーションにより、質量分析計のステージ座標にマッピングおよび整列されます。最後に、この情報を使用して、個々の細胞から精密で標的を絞ったMSスペクトルが取得され、1回のラン(<1時間)で数千の細胞をプロファイリングすることができます12,13。
プロトコル
この研究におけるすべての動物実験は、イリノイ州施設動物管理および使用委員会(23228)によって承認された動物使用プロトコルに従って行われ、動物の倫理的治療とケアに関する国内基準とARRIVE基準の両方を厳守しています。
1. 材料と溶液の調製
- 1.5 mM CaCl2、4.9 mM KCl、0.2 mM KH2PO4、11 mM MgCl2、0.3 mM MgSO4、138 mM NaCl、27.7 mM NaHCO3、0.8 mM Na2HPO4、および25 mM HEPESで改質Gey平衡塩溶液(mGBSS)を調製します。3 M NaOHを使用してpHを7.2に調整します。mGBSSを1L調製し、使用するまで4°Cで保存することをお勧めします。
- 調製したmGBSS溶液で50mLのシリンジを調製し、経心灌流のために氷の上に置きます。解剖したラットごとに1本の注射器を準備します。
- Worthington Papain Dissociation Systemプロトコルに従ってパパイン溶液のアリコートを調製します。.このシステムには、以下に説明する4つのバイアルが含まれており、バイアル4はこのプロトコルには使用されません。
バイアル1:重炭酸塩とフェノールレッドを含む滅菌アール平衡塩溶液(EBSS)
バイアル2:パパインとL-システインとEDTAの併用
バイアル3:デオキシリボヌクレアーゼI(DNase)
バイアル4:ウシ血清アルブミンを含むオボムコイドプロテアーゼ阻害剤- 5 mLのEBSS(バイアル1)をパパインバイアル(バイアル2)に加え、37°Cの水浴に10分間入れてパパインを溶解します。
- DNaseバイアル(バイアル3)に500μLのEBSS(バイアル1)を加え、穏やかに混合します。希釈したDNaseバイアル(バイアル3)250μLをパパインバイアル(バイアル2)に加えます。この調製物には、最終濃度20ユニット/mLのパパイン、0.005%DNase、0.5 mM EDTA、および1 mM L-システインが含まれています。
- この調製したパパイン溶液の250μLアリコートをその後の解離のために凍結します(~20アリコートになります)。この溶液に次の抗生物質を補給します:100ユニット/ mLペニシリンG、100μg/ mLストレプトマイシン、および100μg / mLゲンタマイシン。.これは、ユーザーのアプリケーションに合わせて変更できます。
- 150 mMの酢酸アンモニウム溶液を調製し、4°Cで保存します。 調製したmGBSS溶液にグリセロールを希釈することにより、33%グリセロール溶液を調製します。
- タングステンカーバイドまたはダイヤモンドチップの彫刻ペンまたはCO2 レーザー彫刻機を使用して、酸化インジウムスズ(ITO)コーティング顕微鏡スライドにフィデューシャルをエッチングします。ITOスライドガラスの導電面では、スライドの周囲に沿って20-40個のX字型フィデューシャルマーカーをエッチングして、クロスプラットフォーム(顕微鏡や質量分析計など)の空間レジストレーションを可能にします。
注:サンプルまたはその領域を囲む1本の接続された線にエッチングを加えないように注意してください。これにより、その領域とガラススライドアダプターとの間の表面導電率が乱れます。
2. 初代神経細胞の作製
注:ラット海馬組織を解剖し、パパインで個々の細胞に解離し、低密度で導電性スライドガラス上に堆積させます。この方法で細胞を単離することで、内因性脂質のハイスループットなシングルセル質量分析が可能になります。
- 動物解剖の前に、調製したパパイン溶液のアリコートを解凍し、CO2 が容器内の空気を置換できるように、入口と出口のチューブを備えた容器に入れます。このシステムを37°Cに設定されたウォーターバスに入れ、Worthington Papain Dissociation Systemパッケージに含まれているpHカラーチャートを使用して、溶液が色で示されている適切なpHになるまでCO2 の流れを続けます。目標pHは7.2〜7.4です。
注:CO2 を酵素溶液に泡立てないでください、これはDNaseの変性と生物学的活性の損失をもたらすからです。蓋に2本のチューブを接着した50mLの遠心分離チューブを使用して、CO2 がチューブを下から満たし、上部の出口チューブから逃げるようにします。 - 機関、地方、および連邦のガイドラインに従って、IACUCプロトコルに従ってラットを安楽死させます。ここでは、生後2〜3か月のオスのSprague-Dawleyラットが使用され、CO2 窒息によって犠牲になります。
- ラットに氷冷(4°C)mGBSS溶液を経心灌流して血管系から血液を取り出し、動物の体を迅速に冷やします。この手順の一例は、We et al.18によるプロトコルで見つけることができます。
- ラットから脳を外科的に分離し、関心のある脳領域を損傷しないようにします。この分離の以前に公開された概要では、個々のステップ19 の一部について詳しく説明します。
- ティッシュチョッパーまたはティッシュキューブを使用して、脳の断面(厚さ~2 mm)を切断し、サンプリングする領域(海馬、皮質、または線条体)を露出させます。
- 2 mmの生検パンチを使用して、関心のある脳領域をサンプリングし、組織チャンクをパパイン溶液のバイアルに沈着させます。
- この組織とパパイン溶液を37°Cで、一定の攪拌(電気ロッカーなど)で30〜90分間インキュベートします。
注:酵素治療期間は、脳領域、動物系統、年齢、および所望の細胞出力(例えば、末端を有するニューロンおよびアストロサイトと末端を有する細胞の最大収量)に基づいて最適化されるべきである。ラットの海馬組織の場合、60〜90分が一般的です。短期間で処理すると、一部の末端は保持されますが、多くの細胞が未解離クラスターに残る可能性がありますが、長時間の処理では収量は向上しますが、細胞損傷が増加する可能性があるため、生/死アッセイ(LIVE/DEAD生存率/細胞毒性キットなど)を使用した評価が必要です。比較研究では、サンプルタイプ間で処理が一貫していなければなりません。 - ティッシュとパパインのバイアルを氷の上に置き、酵素活性を冷却して抑制します。P100調整可能な容量ピペットに取り付けられたカットピペットチップを使用して、組織のほとんどが視覚的に分解されるまで組織を粉砕します。細胞の過度の損傷を避けるために、解離中に気泡を形成しないでください。
注:激しいトリチュレーションにより、細胞の収量が高くなります。ただし、ほとんどのプロセスを保持していません。穏やかなトリチュレーションは、細胞に対してより多くのプロセスを提供しますが、より多くの未解離細胞をもたらします。異なるサイズのピペットチップやその他の方法も使用し、理想的な解離結果を得るために最適化することができます20。 - 解離した細胞を300 x g で室温で5分間遠心分離し、細胞をペレット化します。上清を取り除き、ペレットを1 mLのmGBSSに再懸濁します。Hoechst 33342核染色液を最終濃度1 μg/mLまで添加します。
- 細胞懸濁液100〜500μLをエッチングしたITOスライドガラスにピペットで移し、約5分以上放置して細胞が沈殿してスライドに付着するのを待ちます。
- 細胞懸濁液の希釈は、経験的に決定する必要があります。光学顕微鏡を使用して、スライド上に細胞の液滴を添加して粗い密度を決定し、そこから希釈して細胞間に十分な距離がある(つまり、MALDIビームサイズよりも十分に大きい)ことを確認します。この希釈は最初のスライドで行うことができ、その後のスライドで必要に応じて希釈を調整することができます。
- 1)インラインガスHEPAフィルター付きチューブ、2)50 mLフィルターフラスコに取り付けられたチューブ、3)ピペットチップが取り付けられた2番目のフィルターフラスコインレットに接続されたチューブ(100 μLなど)を含む真空システムを使用して、細胞懸濁液をスライドから穏やかに吸引します(真空ラインから順番に配置されています)。将来の使用のためにプレーティングされた細胞を保存する場合は、吸引した懸濁液を33%グリセロール溶液と1〜2分間交換し、それを取り除きます。
注:この手順により、セルの安定性が確保されます。グリセロール溶液を片側から分注し、反対側から穏やかに吸引することが、細胞構造の維持に最適です。最初のサンプルの調製中は、ここに説明するすべてのステップを常に倒立顕微鏡を使用して目視で監視してください。 - 100〜500μLの酢酸アンモニウムを堆積した領域に塗布し、約1分間放置してから、吸引してスライドを清掃します。必要に応じて繰り返して、スライドに塩分やグリセロールが含まれていないことを確認します。
3. 顕微鏡検査
注:沈着した細胞の位置を決定するために、各スライドを明視野/蛍光顕微鏡で画像化します。蛍光チャンネルにより、ヘキスト染色された細胞を正確に位置特定でき、明視野イメージングにより形態学的情報が得られます。タイル画像取得が可能な顕微鏡は、このプロセスに適しています。
- 以前に行っていない場合は、スライドを2〜3mLの150 mM酢酸アンモニウムですすいでください。このステップは、顕微鏡観察やMALDIマトリックスの適用を妨げる可能性のあるグリセロールと塩の結晶を除去するために重要です。N2 の穏やかな流れの下でスライドを乾燥させるか、または風乾させます。
- スライドを顕微鏡ステージにロードします。スライド全体に均等に分散した少なくとも10個のサポートポイントを使用して顕微鏡の焦点を合わせます。
- DAPI(励起:335-383 nm、発光:420-470 nm)および明視野イメージングに適したフィルターを使用して、スライド全体にわたって5倍から10倍の倍率でタイル状の蛍光画像を取得し、ステップ1.5で作成したフィデューシャルマーカーが確実に捕捉されるようにします。
注:通常、5倍の倍率で十分です、特に多くのスライドを画像化する必要がある場合は。より微細な細胞形態を解像するために、10倍または20倍の対物レンズを使用できますが、イメージング時間が二次関数的に長くなり、ファイルサイズが大きくなります。 - タイル張りの画像を、ZEN(Zeiss)などの顕微鏡ソフトウェアを使用してステッチします。このステップでエラーが発生すると、最終的な登録ステップに伝播し、ターゲティングが不正確になるため、正確なスティッチングが重要です。確認するには、垂直に隣接するタイルがオフセットされていないことを確認します。さらに、タイルの重なりが大きい (20%-30%) タイル画像の取得を検討してください。
- 顕微鏡ソフトウェアで各画像をbigTIFFファイルとして処理し、エクスポートします。画像化された領域が比較的小さく、最終的な画像サイズが 2 GB 未満の場合は、代わりに標準の TIFF ファイル形式を使用します。
4.マトリックスアプリケーション
注:一貫性のある適切なMALDIマトリックスの適用は、高品質のシングルセルデータを取得するために重要です。ここでは商用装置を用いた昇華が用いられるが、マトリックス塗布は、ロボット噴霧器12、エアブラシ21、または自家製昇華装置22を用いて行うこともできる。シングルセル調製物は、質量分析イメージングに一般的に使用される薄い組織切片よりもマトリックスが少なくて済むことがわかりました。バッチ効果を低減するために、1回のセッション中に研究中のすべてのスライドにマトリックスを適用し、可能な限り異なるグループ(脳領域や治療対コントロールなど)の細胞を同じスライドに沈着させることをお勧めします。マトリックスの選択は、従来のMALDIとMALDI-2の両方のシングルセルワークフローにとって重要です。シングルセルMALDIでは、DHB23、9-AA24、およびCHCA25 が成功裏に使用されています。MALDI-2では、DHAP9による有意なシグナル増強が観察され、NEDC16 やCHCA26 などのマトリックスも効果的に適用されています。
- 20 mgの2,5-ジヒドロキシアセトフェノン(DHAP)を1.5 mLのアセトンに溶解します。.スライドを昇華チャンバーのホルダーに入れ、昇華装置に入れます。
- 溶解したマトリックス溶液をセラミックウェーハにピペットで移し、アセトンを蒸発させます。昇華チャンバーを閉じて密封します。
- クーラントチャンバーに氷水スラッシュを入れ、チャンバーの上に置きます。
- バキュームをオンにし、システムを5分間平衡化させます。システム内の圧力は 40 mbar 未満である必要があります。
- チャンバーを200°Cに5分間加熱することにより、昇華を開始します。
- 氷水浴を取り外し、温度を25°Cに回し、チャンバーの上部にヒートシンクを置きます。結露を避けるために、システムを室温まで5分間温めます。
注意: 氷水浴を保持している容器は、空にしてお湯で満たしてヒートシンクとして機能させることができます。 - システムをゆっくりとベントし、チャンバーを開き、スライドを取り外します。
5. シングルセルMALDI MS
注:シングルセルMSデータは、オープンソースのmicroMSパッケージを使用してMALDI-2 timsTOF装置(timsTOF flex)で取得され、細胞を検出し、質量分析計をガイドします。これには、標的細胞の光学画像ピクセル位置を質量分析計ステージの物理座標に変換する必要があります。
- microMSを開き、明視野チャンネルと蛍光チャンネルの両方が存在するため、Image Groupオプションを使用してbigTIFF顕微鏡画像をデシメーションします。
- [BLOB オプション] ツールを使用して、ターゲット セルに対して選択する最適なパラメーターを特定します。次のパラメータを調整します:最大および最小ブロブサイズを使用して、検出するブロブの小ささまたは大きさを選択します。ブロブ検出のために蛍光チャネルをしきい値にする方法を決定するしきい値設定。そして、真円度は、同定された細胞がどの程度循環している必要があるかを決定します。ここに示すデータでは、次のパラメータ値を使用しました: max circularity: none;最小真円度:0.6;しきい値:75;最小サイズ:20;最大サイズ:なし。
- [ブロブ検索]オプションを使用してブロブを検索し、ポップアップウィンドウを使用してブロブリストを目的の名前で保存します。
- 距離フィルターツールを使用して、各細胞が互いに離れる必要がある特定の距離を選択します(このデータでは、5倍蛍光顕微鏡を使用して、35ピクセルの距離フィルターを使用しました)。これは、細胞が互いに十分に離れてシングルセル解析を行うためです。この数値はピクセル単位で表されるため、顕微鏡で理想的な数値を決定するためのピクセルからμmへの変換を知っておく必要があります。レーザープローブの直径に約20〜30μmを加えたサイズを使用して、レジストレーションのエラーを考慮します。
- MTPスライドアダプターIIを使用してスライドを装置にロードします。microMSを使用してコンピューターに戻り、リモートデスクトップアプリケーションを使用して、質量分析計コンピューターにアクセスします。
- 装置を初めて使用する場合は、装置のX-Y位置を確認します。これを行うには、[ツールとインストゥルメント設定]に移動します。ポップアップウィンドウには、X位置とY位置を含む一連の座標が表示されます。装置のスライドアダプターIIジオメトリで これらの特定のポイントをそれぞれ 選択し、microMSウィンドウでX位置とY位置を更新します。
- 質量分析計のカメラとステージコントロールを使用して、スライド上の簡単に識別できる場所に移動し、機器の座標をコピーします。microMSで、顕微鏡画像内の対応する位置を見つけて、その位置を右クリックし、ポップアップウィンドウのテキスト位置に座標を入力します。すべての座標を最も近い整数に丸め、X 座標と Y 座標をスペースで区切ります (つまり、39595 -23232)。
- 手順5.7を繰り返します。をクリックして、スライド全体に少なくとも 12 個の基準マーカーを登録します。レジストレーションポイントを3つ追加すると、円の1つが赤に変わり、レジストレーションから最もオフの位置であることを示します。これが発生した場合は、Shift + 右クリックを使用して現在のレジストレーションポイントを削除し、再試行してください。
- [ファイル] で、[保存] に移動し、[登録] に移動して登録 (.msreg) ファイルを保存します。
- スライドにブロブを表示した状態で、[File]、[Save]、[Instrument Positions]の順に選択して、機器の位置(.xeo)ファイルを保存します。リモートデスクトップソフトウェアを使用して、この.xeoファイルを装置コンピューターに転送します。
- 生成されたカスタム.xeoファイルから、装置上のMTP Slide Adapter II .xeoファイルにテキストをコピーして保存します。これにより、このジオメトリファイルがセルの位置で更新されます。
- [ オートメーション ] タブをクリックし、[ 新規] を選択して自動実行を開始します。表示されたサンプル領域をドラッグしてセルを選択し、右クリックして分析リストに追加します。自動化実行を保存し、[ 自動実行の開始 ] をクリックして取得を開始します。ランの長さは、細胞数、レーザーショット、レーザー周波数など、さまざまな要因によって異なりますが、一般的には、MALDIモード(10kHzのレーザー繰り返し周波数)で約5〜10個の細胞を解析でき、MALDI-2モード(1k Hzのレーザー繰り返し周波数)で1〜5個の細胞を毎秒解析できます。
6. データ処理
注:既存の商用ソフトウェアパッケージは、ハイスループットのシングルセル質量分析データの分析にはあまり適していません。個々のスペクトルを視覚化することは可能ですが、意味のある生物学的洞察を抽出するには、専用のツールが必要です。これに対処するために、シングルセルMALDI-2 MSデータ解析を容易にするソフトウェアを無料で提供しています。更新されたワークフローにより、シングルセルデータをオープンソースのimzMLフォーマット27に直接変換できるため、SCiLS MVSやその他のベンダーソフトウェアとの互換性が確保されます。より高度なデータ解析のために、完全なスクリプトには、Matplotlib(バージョン3.7.3)によって可能になる脂質アノテーション、クラスタリング、およびその他の視覚化ツールの機能も含まれています。生データの解析および読取りは、TIMSCONVERTワークフロー28に含まれる一連の関数であるpyTDFSDKライブラリによって容易になる。
- カスタム Python ライブラリ SC_MALDI2_Analysis を初期化するには、 補足ファイル 1 で提供されているファイルを Jupyter Notebook と同じ作業パスにコピーし、キーボードの最初のコード セルで Shift + Enter キーを押します。これにより、後でこれらの関数を呼び出し、それらを使用してデータを処理できるようになります。
- 収集したデータ(Bruker .dファイル)へのパスをコピーします。各ファイルのフォルダーと名前には、後でこれらのファイル パスを解析して各サンプルのメタデータを確立できるように、わかりやすい名前を付けることをお勧めします。 Bruker .d ファイルのインポート を実行し、リスト コード セルに保存します。これにより、ロードされた.dファイルの総数が出力されます。
- 「Processing the raw data and saving to imzML」というタイトルのコードセルを実行します。これにより、提供された各Bruker .dファイルが読み取られ、データに対してピークピッキングが実行され、各ピークの周りの20ppmのデータが.dファイル内に書き込まれた.imzMLファイルに保存されます。
- 保存されたデータを見つけるには、最初の .d ファイルの場所を開くと、imzML とその他のメタデータがこのパスに保存されます。この段階で、保存されたimzMLファイルをSCiLS Lab MVSなどのベンダーソフトウェアにインポートできます。より高度なデータ分析を行うには、スクリプトの手順に従ってください。
- 以前に保存したimzMLファイルコードセルでの読み込みを実行して、保存したimzMLデータを読み込みます。これにより、保存されたデータが変数データにロードされます。
- [データのビン分割とデータ マトリックスの保存] セルを実行して、共通の m/z 軸に沿ってすべてのデータをビン化し、存在量が少ない (<0.1%) 特徴を削除し、ノイズ未満の値 (相対強度 100) を削除します。次に、この関数は、各ビン内の各ピーク m/z 値を平均化してデータを再ビン化します。結果のデータ マトリックスは [datacube_array] として保存され、マトリックスに関連付けられた m/z ビンは valid_mz_bins として保存され、各ビンのカウントは [カウント] として保存されます。
- データにアノテーションを付けるには、 Exporting peaks for LIPID MAPS アノテーション セルを実行します。これにより、データマトリックス内のすべての m/z ピークがクリップボードにコピーされます。これを空のテキストファイルに貼り付けて保存し、LIPID MAPSにアップロードします。
- lipidmaps.org を開き、[ MS Data Bulk Search ]および[ Search LMSD ]を選択して、生物学的に関連性のある脂質種を検索します。テキストファイルを選択してピークリストをアップロードし、適切な付加付加物([M+H]+、[M+Na]+、M+K]+など)を選択します。お客様の質量分析計に適した質量許容誤差を選択し(ここでは+/- 0.01 m/zを選択しました)、関心のある脂質クラスをすべて選択して、 Searchをクリックします。.tsv ファイルをダウンロードします。
- スペクトルメタデータをロードするには、 メタデータセルの単一セルパスでの読み込み を実行します。ここで分割コードをファイルパス構造に基づいて変更します。
- データの前処理と脂質 アノテーション のセルを実行して、データを前処理します。これにより、lipidMAPS tsv ファイルを使用してデータセットに 10 ppm エラーのアノテーションを付加し、lipidMAPS の結果から奇数鎖脂質を排除し、残りのデータを正規化し、特定のしきい値を満たさない特徴または細胞を削除します。これにより、新しく処理されたデータセットが data2 として保存され、更新されたスペクトル メタデータが updated_cell_types として保存されます。
- データの分析はscanpyによって行われます。 UMAP and Clustering Analysis for Single Cells セルを実行して、関心のあるデータを選択し(ここではMALDI-2、M2、データのみを選択しました)、データセットをスケーリングし、簡単に分析できるようにスキャン可能なAnnDataオブジェクトにロードします。
注:ここでは、データセットに対してライデンクラスタリングと次元削減(UMAP)が実行され、元のデータクラスとUMAP上のクラスターの両方が視覚化され、クラスターの中で最も統計的に有意な特徴のいくつかがscanpyのrank_genes_groups_dotplot関数を使用して要約されました。
結果
蛍光ガイド下シングルセルMALDI-2 MSのワークフローの概要を 図1に示します。まず、標的脳領域から解剖した組織(図1A)を単一細胞に解離し、導電性ITOコーティング顕微鏡スライド(図1B)に堆積させます。細胞の位置は、ホールスライド蛍光イメージング(図1C)によって決定され、続いてMALDIマトリックスアプリケーション(図1D)、microMS支援MALDI-2 MS分析(図1E)、およびデータ解析(図1F)によって決定されます。このワークフローを使用すると、個々の細胞内で数十から数百の脂質を10 ppm未満の質量精度で推定的に同定できます(MALDI-2 timsTOFを使用)。
質量分析イメージングは、関心のある小さな領域に対して実行して、細胞調製とマトリックスアプリケーションの品質を評価できます。分散細胞のMALDI-2イメージングの代表的な結果を 図2Aに示します。この画像から、ユーザーは同じ領域の顕微鏡写真と比較することで、分析物の拡散範囲を評価できます。拡散量に基づいて、分析者はレーザービームフィールドサイズのサイズと距離フィルターを調整して、真のシングルセル取得を確保できます。シングルセルMSIでは、小さなレーザーサイズとラスター幅を使用して細胞分解能(1〜5 μm)を得ることができますが、より大きなレーザーサイズをmicroMSに使用することで、イメージングに比べてシグナル強度と検出可能な脂質の数を増やすことができます。MALDI-2で得られたシグナル増強の代表的な結果を 図2Bに示します。コレステロール、PE、およびPC種の増強は、以前の文献14と一致して観察されます。一般に、比較的高いレーザー出力(>50%)とより少ないショット数(約10〜200)を使用すると、最高のMALDI-2信号増強が得られます。レーザー出力が低すぎると強化が得られず、レーザーエネルギーが多すぎると分析物が過剰に断片化するため、ある程度の最適化が必要です29。シングルセル解析では、空間レジストレーションが個々の細胞の正確なターゲティングを確保するための重要なステップです。レジストレーションを検証するために、既知のスポットにブロブを作成し、マイクロMSを介して機器の座標をエクスポートすることにより、スライドの周囲に小さなテストポイント(~5)のセットを生成できます。これらのテストスポットが選択されたときに装置ステージが正しく配置されていることを確認することで、その後の細胞ターゲティングが正確になります。
MALDI MSは、個々の脳領域間および個々の脳領域内の細胞の不均一性をプロファイリングすることができます(図3)。脂質プロファイルのばらつきを解析することにより、次元削減技術により、細胞を異なるクラスターに効果的に分離し、データセット全体の脂質組成の多様性を強調します(図3A)。さらに、ライデンクラスタリングなどのクラスタリング技術の適用は、線条体や皮質などの特定の脳領域内に細胞のユニークな亜集団が存在することを示しています(図3B)。さらに、各クラスターの脂質プロファイルを相互に比較することにより(図3C)、特定の脂質をマーカーとして使用して、クラスター固有のアイデンティティを定義できます。いくつかの脂質種は、特定のクラスターで有意にアップレギュレーションまたはダウンレギュレーションされており、これは異なる機能的役割または状態を示唆していますが、他のものはクラスター間で共有されていますが、相対的なシグナル強度が異なります。堅牢なダウンストリームデータ解析を確実に行うには、大多数の細胞で信頼性の高い脂質検出を達成し、潜在的なバッチ効果を評価することが不可欠です。 Figure 3D は、別々のITOコーティングスライドに分散した6つの個々の皮質細胞からの代表的なスペクトルを示しています。個々の脂質プロファイルは不均一性を示しますが、脂質はすべての取り込みで一貫して検出されます。 図3E は、異なるスライドからの皮質細胞のUMAPを示し、同一の条件下で調製および分析した。スライド間の細胞の実質的なオーバーラップは、バッチ効果が生物学的解釈を大きく混乱させないことを示しています。必要に応じて、ComBat30 などのバッチ補正アルゴリズムを適用して、残留効果を軽減できます。要約すると、シングルセルMALDI-2は脂質バイオマーカー同定のための先進的な技術であり、細胞亜集団に関する重要な洞察を提供し、脳内の地域的および機能的多様性の理解を深めます。
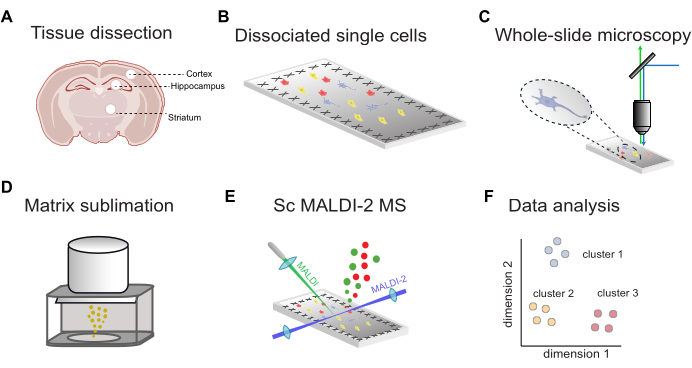
図1:scMALDI-2 MSの一般的なワークフロー (A) 脳領域の手動組織解剖と分離。 (B) 組織の単一細胞へのパパイン解離および導電性ITOコーティングスライドへの細胞沈着。 (C) 核染色によるホールスライド蛍光顕微鏡(DAPI/Hoechst)。 (D) サンプルスライドへのMALDIマトリックス(DHAP)昇華。 (E) 画像誘導シングルセルMALDI-2 MS測定。 (F) 次元削減、クラスタリング、統計分析を含む包括的なデータ分析。 この図の拡大版を表示するには、ここをクリックしてください。
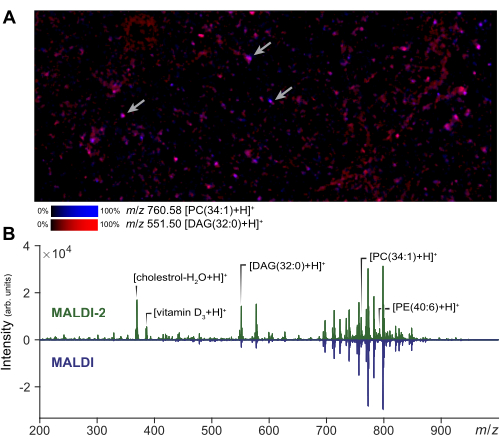
図2:シングルセル解析のためのMALDI-2 MSの最適化とイメージング (A)初代細胞の分散集団のMALDI-2 MSIイメージング。矢印は、いくつかの個々のセルを示しています。MSIと小さな領域を実行することで、分析者はメソッドパラメーターを最適化し、サンプルの品質を評価できます。(B)MALDI-2とMALDI MSの取り込みを用いて得られた結果の比較。コレステロール、DAG(ジアシルグリセロール)、PC(ホスファチジルコリン)、PE(ホスファチジルエタノールアミン)など、さまざまな脂質のシグナル増強(MALDI 2 vs MALDI)は、MALDI-2スペクトル(上)とMALDIスペクトル(下)を示すことで強調されています。 この図の拡大版を表示するには、ここをクリックしてください。
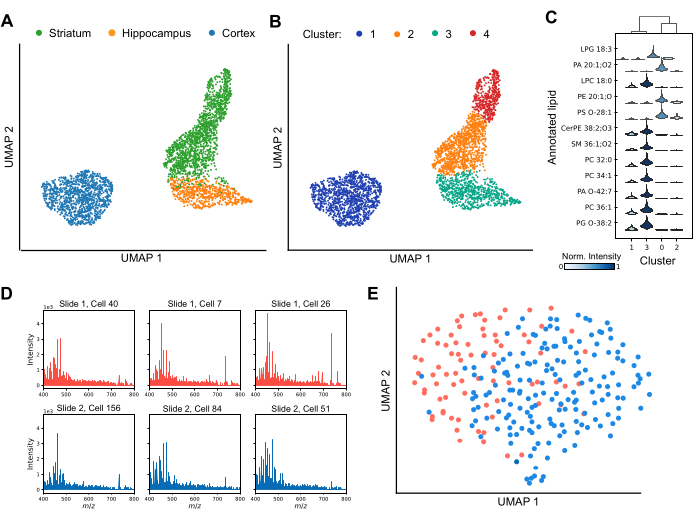
図3:MALDI-2 MS.(A)脳の起源領域によって色付けされた分析された細胞の均一多様体近似および投影(UMAP)分析による、げっ歯類の脳領域内の3つのげっ歯類脳領域内での単一細胞脂質プロファイリング。(B)ライデンクラスタリングを受けた後の同じ細胞のUMAP分析(クラスターは、同様の脂質組成を持つ細胞の亜集団に対応します)。この色は、データのさまざまなライデン クラスターを示しています。(C)クラスター間の異なる脂質の強度分布の違いを示すバイオリンプロット。(D)6つの代表的な個々の皮質細胞からのスペクトルを、2つの別々のスライドから分析した。(E)2つの別々のスライドから分析された皮質細胞のUMAP分析。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:SC-MALDI2_Analysis.py。 このファイルには、シングルセルMALDI-2質量分析データを処理するために開発された一連の関数が含まれています。これには、生の質量分析データの読み取り、ビニングの実行、アノテーション分析とダウンストリーム分析の実施方法が含まれます。ロードしてすべてのデータの前処理と解析を実行するセルのセットは、 補足ファイル2に記載されています。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:JOVE分析.ipynb。 このファイルには、SC-MALDI2_Analysis.py のカスタム Python 関数にロードし、前述のすべてのデータの前処理と分析を実行するためのセルのセットを含む Jupyter ノートブックが含まれています。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ハイスループットの画像誘導シングルセルMALDI MSは、シングルセルスケールでの化学的不均一性を理解するための貴重なツールです。レーザー誘起ポストイオン化(MALDI-2)の追加により、単離された哺乳類細胞などの質量と体積に制限のあるサンプルにとって重要な、より深い分析種カバレッジが得られます。
発表されているシングルセル脂質および代謝物MSワークフローの圧倒的多数は培養細胞を使用していますが、当社のアプローチは比較的迅速に単離された初代細胞に適用されています。培養細胞は、わずか数日の培養で代謝物と脂質含有量に明らかな変化を示すため、この区別は重要です23,31。酵素による細胞の単離は、ほとんどの場合、軸索、樹状突起、アストロサイトプロセスなどの微細な細胞構造の喪失につながります。したがって、観察される分析物シグナルは、主に細胞体細胞から得られます。それにもかかわらず、細胞型4と脳領域による分類が成功裏に達成されています12。これは、異なる細胞に特有の脂質の多くが体細胞に位置していることを示唆しています。
MALDIマトリックスの適用方法のわずかな違いが、結果として得られる分析種のシグナルに大きな影響を与える可能性があります。市販の装置を使用した再現性のあるマトリックス昇華に基づくワークフローを提示し、均一なマトリックス層を生成し、高いシグナル対ノイズ比、および分析物の拡散を制限します。ただし、ロボット噴霧器やアーティストのエアブラシを使用したマトリックス塗布など、さまざまなアプローチを使用できます。いずれのアプローチであっても、光学マトリックスと分析種の比率を達成するためには、標準的な組織MSIで使用されるものと比較して、シングルセル調製物に低いマトリックス密度を適用する必要があります。ここで適用されるマトリックス密度は、組織MSIに使用される密度の約半分です。もちろん、これは細胞あたりのマトリックスの量がMSIよりも多いことを意味し、ここで使用した単離細胞アプローチにおける分析物の抽出と検出の向上に貢献しています。
大幅な最適化が必要なサンプルの場合、 図2Aに示すように、単一細胞解離の小さなROIでMSIを実行することを最適化プロセスの一部として実行できます。このステップにより、分析者は、溶媒ベースのマトリックスアプリケーションアプローチにおける分析種の拡散の程度を評価することもできます。
単一細胞の画像誘導MALDIを成功させるには、高品質の蛍光画像、再現性のあるマトリックスアプリケーション、および正確なステージ制御が必要です。これらの実験は、イメージング領域が広く、分析種数が多いため、マトリックスやサンプル条件のわずかなレジストレーションエラーや変動を許容する標準的なMSIワークフローよりも要求が厳しいです。これらの課題にもかかわらず、私たちは従来のMALDIを使用して単一の細胞小器官を標的にすることに成功しました。
タイル状の蛍光画像の正確なスティッチングは、小さな誤差が重なり、ステージ制御に影響を与える可能性があるため、レジストレーションの精度が重要になります。バッチ効果も大きな課題であり、同じスライド全体、スライド間、および調製間でシグナルのばらつきが観察されます。内部標準の使用や四分位間正規化など、適切な正規化戦略は、これらの問題を軽減するのに役立ちます。さらに、ComBat30 などのバッチ補正アルゴリズムを使用して、技術的なばらつきを減らし、真の生物学的差異を強化することができます。
単一細胞から信頼性の高い分子アノテーションを得ることは依然として課題です。多くの場合、物質の量と検出感度は、最も豊富な分子種を除くすべてのタンデムMSには不十分です。個々の細胞から直接タンデムMSを検出できないものには、分析物ライブラリーを作成するための代替アプローチを適用できます。例えば、組織上のタンデムMSデータは、細胞集団の生成に使用された同じ脳領域および動物からの薄い凍結切片から取得できます。組織からの脂質抽出とそれに続くLC-MSも使用できます。サンプル調製戦略と MS テクノロジーが向上するにつれて、シングルセルから直接取得できる構造情報はますます増えています。将来的には、このワークフローが拡張され、シングルセルからタンデムMSデータを取得できるようになると予想しており、補助的なLC-MS/MS実験が不要になると考えています。さらに、このアプローチは、ユニークな細胞タイプ、哺乳類のオルガネラ、粉末、マイクロプラスチックなど、生物学およびそれ以外のミクロスケールの多数のサンプルに拡張できると想定しています。
開示事項
著者らには、開示すべき競合する利害関係はありません。
謝辞
S.W.C.は、Peixin He and Xiaoming Chen PhD4 FellowshipおよびUniversity of Illinois Block Grant Fellowshipによる支援に感謝しています。この研究は、国立薬物乱用研究所(National Institute on Drug Abuse)の支援も受けました。P30DA018310年、国立老化研究所賞第号R01AG078797、および国立衛生研究所の所長室による賞番号S10OD032242。
資料
| Name | Company | Catalog Number | Comments |
| 2',5'-dihydroxyacetophenone | Sigma Aldrich | D107603 | DHAP, 97% purity |
| Ammonium acetate | Sigma Aldrich | 238074 | ACS reagent, ≥97% |
| Axio M2 Imager | Zeiss | N/A | N/A |
| Biopsy punch, 2 mm | Fisher Scientific | 12-460-399 | integra miltex standard biopsy punch, 2mm |
| Calcium chloride | Sigma Aldrich | C4901 | anhydrous, powder ≥97% |
| Eppendorf Centrifuge | Sigma Aldrich | EP5405000441 | centrifuge 5425 with rotor FA-24x2 |
| Gentamicin | Sigma Aldrich | G1272 | liquid, BioReagent |
| Glass etching pen | Sigma Aldrich | Z225568 | carbide time, pkg of 1 |
| Glycerol | Sigma Aldrich | G7893 | ACS reagent, ≥99.5% |
| HEPES buffer | Sigma Aldrich | H3375 | ≥99.5% (titration) |
| Hoechst 33258 Solution | Sigma Aldrich | 94403 | 1 mg/mL in H2O, ≥98.0% (HPLC) |
| In line HEPA Filter | Sigma Aldrich | WHA67225001 | VACU-GUARD 60 mm disc, 0.45 PFTE housing |
| ITO-Coated Microscopy Slides | Delta Technologies | CG-90IN-S115 | 70-100Ω resistance |
| Magnesium chloride | Sigma Aldrich | M8266 | anhydrous, ≥98% |
| Magnesium sulfate | Sigma Aldrich | 208094 | anhydrous, ≥97% |
| Microcentrifuge tubes | Sigma Aldrich | HS4323K | tube capacity 1.5 mL, pack of 500 |
| Papain dissociation system | Worthington Biochemical | LK003150 | one box, 5 single use vials |
| Penicillin-Streptomycin | Sigma Aldrich | P4458 | liquid, BioReagent |
| Potassium chloride | Sigma Aldrich | 529552 | Molecular biology grade |
| Potassium phosphate monobasic | Sigma Aldrich | P5379 | Reagent Plus |
| Sodium biocarbonate | Sigma Aldrich | S6014 | ACS reagent, ≥99.7% |
| Sodium chloride | Sigma Aldrich | S9888 | ACS reagent, ≥99% |
| Sodium hydroxide | Sigma Aldrich | 221465 | ACS reagent, ≥97%, pellets |
| Sodium phosphate dibasic | Sigma Aldrich | S9763 | ACS reagent, ≥99% |
| Sublimate | HTX | N/A | N/A |
| timsTOF FleX MALDI-2 | Bruker | N/A | microGRID enabled |
| Vacuum tubing | Thermo Scientific | 8701-0080 | Nalgene Non-phthalate PVC Tubing |
参考文献
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved