Method Article
荧光引导基质辅助激光解吸/电离与激光诱导位置电离质谱法对单个大鼠神经细胞进行检测
* 这些作者具有相同的贡献
摘要
该方案概述了使用 microMS 进行荧光引导的单细胞 MALDI-2 质谱分析,从而能够增强原代大鼠神经元细胞的分子分析。
摘要
单细胞测量对于理解大脑丰富的时空异质性至关重要。基质辅助激光/解吸电离 (MALDI) 质谱 (MS) 能够对单个细胞中的内源性分子进行无标记、高通量表征。具有激光诱导后电离 (MALDI-2) 的 MALDI 质谱仪的最新开发进展大大提高了对各种脂质和其他小分子的检测灵敏度。然而,对于大多数应用来说,在细胞分辨率下使用 MALDI-2 对大样品进行 MS 成像的速度非常慢。在该协议中,原代细胞被分离并分散到导电载玻片上。通过全玻片荧光显微镜确定相对细胞位置,然后将显微镜坐标准确配准到 MALDI-2 质谱仪的载物台坐标。与整个样品的 MS 成像相比,仅对细胞位置进行靶向 MS 分析可提供高通量、单细胞测量,分析物覆盖率高,数据量更小。我们描述了单细胞制备、全玻片荧光成像、基质应用和 MALDI-2 质谱分析所需的关键步骤。
引言
脂质和代谢物是细胞功能的基础,是细胞膜、能量来源和信号分子的重要组成部分 1,2。然而,它们的组成和丰度在单个细胞之间可能有很大差异,这反映了细胞类型以及发育和功能状态的差异 3,4,5。分析这些差异对于了解生物变异性和识别不同的细胞亚群至关重要。单细胞测量技术(如 RNA 测序)提供了有用的细胞特异性转录谱6。然而,这些转录水平的测量值并不直接反映脂质和代谢物的实际细胞量,因为基因表达并不总是与这些分析物的实际丰度相关。因此,需要用于直接测量脂质和代谢物的专用方法,以全面分析单个细胞及其细胞群的化学成分。
基质辅助激光解吸/电离 (MALDI) 质谱成像 (MSI) 是内源性生物分子原位无标记空间映射的首选工具 7,8。通常,使用 MALDI 时,紫外激光用于从与有机基质共结晶的薄样品层中烧蚀材料,形成离子和中性分子羽流。然后通过 MS 分析仪分离形成的离子,并在质谱仪中检测。鉴于现代质谱仪载物台的精确定位,激光器可以定位到特定样品区域或跨区域光栅化,以通过 MSI 生成分子图像。通过聚焦激光束和精确的载物台移动实现细胞或亚细胞空间分辨率 (< 10 μm) 的 MSI 可用于获取有关单个细胞的化学信息 9,10。然而,这种规模的 MSI 测量效率低下,尤其是在目标细胞密度低的样品的情况下,因为对细胞之间的空白区域进行成像所花费的时间很多。此外,由于采样体积小,许多分析物的检测能力受到限制。为了克服这些挑战,我们开发了一种用于高通量单细胞分析的图像引导 MALDI MS 方法11,12。在这种方法中,分散细胞的位置是从全玻片荧光图像中以编程方式确定的,并用于将质谱仪载物台引导到具有特定参数(例如大小和形状)的单个细胞所在的位置,然后通过 MALDI 激光器照射进行分析。以前使用这种靶向方法的工作已用于表征异质细胞群中的脂质、肽和其他生物分子 5,13。
鉴于单细胞的质量有限性,在此类样品中检测到的分析物数量通常少于直接从组织中观察到的分析物数量。因此,为了提高单细胞 MS 分析中的分析物覆盖率,提高分析物检测灵敏度至关重要。最近开发的一种有助于克服这一检测挑战的方法是激光后电离 MALDI (MALDI-2),该方法已被证明可以提高对多种分析物的灵敏度 9,14,15,16。因此,MALDI-2 可生成更全面的单细胞数据集,并在质量受限的样品(如分离细胞)中提供更深入的分子覆盖。
该方法的目标是从数千个单个细胞中获得脂质测量值。为此,我们描述了一种能够实现高通量单细胞 MALDI-2 质谱分析的工作流程,并且通常可扩展到任何具有精确载物台控制的基于探针的质谱方法17。在此工作流程中,解剖来自感兴趣大脑区域的组织,并在木瓜蛋白酶解离程序后从组织中获得单个细胞。然后用细胞核染色剂标记细胞,并将其分散到蚀刻有基准标记物的导电载玻片上,让它们粘附在那里。接下来,使用荧光显微镜拍摄全玻片图像。基质通过升华沉积,产生可重复的均质晶体层和高信噪比,用于单池 MS 分析。使用开源软件 microMS11,使用蚀刻在细胞沉积的载玻片上的基准标记,通过点集配准,绘制显微镜图像中细胞位置的相对坐标并与质谱仪载物台坐标对齐。最后,利用这些信息,从每个单独的细胞中获取精确、靶向的 MS 谱图,从而可以在一次运行 (<1 h) 中分析数千个细胞12,13。
研究方案
本研究中的所有动物实验均按照伊利诺伊州机构动物护理和使用委员会 (23228) 批准的动物使用方案进行,并严格遵守动物道德治疗和护理的国家和 ARRIVE 标准。
1. 材料和溶液的制备
- 用 1.5 mM CaCl2、4.9 mM KCl、0.2 mM KH2PO4、11 mM MgCl2、0.3 mM MgSO4、138 mM NaCl、27.7 mM NaHCO3、0.8 mM Na2、HPO4 和 25 mM HEPES 制备改良的 Gey 平衡盐溶液 (mGBSS)。使用 3 M NaOH 将 pH 调节至 7.2。建议制备 1 L mGBSS 并在 4 °C 下储存直至使用。
- 准备 50 mL 注射器,用准备好的 mGBSS 溶液填充,并将它们放在冰上进行经心灌注。为每只解剖的大鼠准备 1 个注射器。
- 按照 Worthington 木瓜蛋白酶解离系统方案制备等分试样的木瓜蛋白酶溶液。该系统包含四个样品瓶,如下所述,其中样品瓶 4 不用于此方案:
样品瓶 1:含碳酸氢盐和酚红的无菌 Earle 平衡盐溶液 (EBSS)
小瓶 2:含 L-半胱氨酸和 EDTA 的木瓜蛋白酶
样品瓶 3:脱氧核糖核酸酶 I (DNase)
样品瓶 4:含牛血清白蛋白的卵类粘蛋白蛋白酶抑制剂- 向木瓜蛋白酶小瓶(小瓶 2)中加入 5 mL EBSS(小瓶 1),并将其置于 37 °C 水浴中 10 分钟以溶解木瓜蛋白酶。
- 将 500 μL EBSS(样品瓶 1)添加到 DNase 样品瓶(样品瓶 3)中并轻轻混合。将 250 μL 稀释的 DNase 样品瓶(样品瓶 3)添加到木瓜蛋白酶样品瓶(样品瓶 2)中。该制剂包含终浓度为 20 单位/mL 木瓜蛋白酶、0.005% DNase、0.5 mM EDTA 和 1 mM L-半胱氨酸。
- 冷冻 250 μL 制备好的木瓜蛋白酶溶液等分试样,用于后续解离(制成 ~20 个等分试样)。用以下抗生素补充该溶液:100 单位/mL 青霉素 G、100 μg/mL 链霉素和 100 μg/mL 庆大霉素。可以针对用户的应用程序进行修改。
- 制备 150 mM 乙酸铵溶液并将其储存在 4 °C。 通过将甘油稀释到制备的 mGBSS 溶液中来制备 33% 甘油溶液。
- 使用带有碳化钨或金刚石尖端的雕刻笔或 CO2 激光雕刻机,将基准点蚀刻到氧化铟锡 (ITO) 涂层的显微镜载玻片上。在 ITO 载玻片的导电侧,沿载玻片的外围蚀刻 20-40 个 X 形基准标记,以实现跨平台(例如,显微镜和质谱仪)空间配准。
注意:注意不要在样品或其区域周围的一条连接线上蚀刻,因为这会破坏该区域与载玻片适配器之间的表面导电性。
2. 原代神经细胞的制备
注:解剖大鼠海马组织,用木瓜蛋白酶解离成单个细胞,并以低密度沉积在导电载玻片上。以这种方式分离细胞可实现内源性脂质的高通量单细胞质谱分析。
- 在动物解剖之前,解冻一份准备好的木瓜蛋白酶溶液,并将其放入一个带有入口和出口管的容器中,以便 CO2 置换容器内的空气。将该系统置于设置为 37 °C 的水浴中,并使用 Worthington 木瓜蛋白酶解离系统套装中包含的 pH 颜色图表继续 CO2 流动,直到溶液达到适当的 pH 值,如颜色所示。目标 pH 值在 7.2 到 7.4 之间。
注意:不要将 CO2 泡入酶溶液中,因为这会导致 DNase 变性和生物活性丧失。使用 50 mL 离心管,并在盖子上粘上两根试管,让 CO2 从底部填充试管并从顶部出口管中逸出。 - 按照机构、地方和联邦指南的 IACUC 协议对大鼠实施安乐死。在这里,使用 2 至 3 个月大的雄性 Sprague-Dawley 大鼠并通过 CO2 窒息处死。
- 用冰冷的 (4 °C) mGBSS 溶液经心脏灌注大鼠,以从血管系统中去除血液并迅速冷却动物的身体。该程序的一个例子可以在 We et al.18 的协议中找到。
- 通过手术将大脑与大鼠隔离,确保不会损害感兴趣的大脑区域。之前发布的这种隔离概述提供了有关一些各个步骤19 的更多详细信息。
- 使用组织切片机或组织立方体切割大脑的横截面(~2 毫米厚),以将该区域(海马体、皮层或纹状体)暴露于样本中。
- 使用 2 mm 活检打孔器对感兴趣的大脑区域进行采样,并将组织块沉积到木瓜蛋白酶溶液小瓶中。
- 将该组织和木瓜蛋白酶溶液在 37 °C 下在不断搅拌(例如,通过电动摇杆)孵育 30-90 分钟。
注意:应根据大脑区域、动物品系、年龄和所需的细胞输出(例如,具有末端的神经元和星形胶质细胞与没有末端的细胞的最大产量)优化酶处理持续时间。对于大鼠海马组织,通常为 60-90 分钟。较短的处理可能会保留一些末端,但将许多细胞留在未解离的簇中,而较长的处理可以提高产量但会增加细胞损伤,需要使用 LIVE/DEAD 检测试剂盒(例如,LIVE/DEAD 活力/细胞毒性试剂盒)进行评估。对于比较研究,不同样本类型的处理必须一致。 - 将一小瓶组织和木瓜蛋白酶放在冰上以冷却并抑制酶活性。使用连接到 P100 可调容量移液器的切割移液器吸头研磨组织,直到大部分组织在视觉上被打碎。解离过程中不要形成气泡,以免过度损伤细胞。
注:剧烈研磨可产生高产量的细胞;但是,他们不会保留大部分流程。温和研磨对细胞进行了更多的处理,但会产生更多未解离的细胞。也可以使用不同尺寸的移液器吸头和其他方法,并对其进行优化,以获得理想的解离结果20。 - 在室温下以 300 x g 离心解离的细胞 5 分钟以沉淀细胞。去除上清液并将沉淀重悬于 1 mL mGBSS 中。加入 Hoechst 33342 细胞核染色剂,使终浓度为 1 μg/mL。
- 将 100-500 μL 细胞悬液移液到蚀刻的 ITO 载玻片上,静置约 5 分钟或更长时间,让细胞沉淀并粘附在载玻片上。
- 细胞悬液的稀释度需要根据经验确定。使用光学显微镜,将细胞液滴添加到载玻片上以确定粗略密度并从那里稀释以确保细胞之间有足够的距离(即,足够大于 MALDI 光束尺寸)。这种稀释可以在第一张玻片上进行,然后可以根据需要调整后续玻片的稀释。
- 使用真空系统轻轻地从载玻片上吸出细胞悬液,该系统包含(按从真空管路开始的顺序放置):1) 带有在线气体 HEPA 过滤器的管道,2) 安装在 50 mL 过滤瓶上的管道,3) 连接到第二个过滤瓶入口的管道,并附有移液器吸头(例如 100 μL)。如果储存铺板的细胞以备将来使用,请用 33% 甘油溶液替换吸出的悬浮液 1-2 分钟,然后将其取出。
注意:此步骤将确保细胞稳定性。从一侧分配甘油溶液,同时从另一侧轻轻吸出,这是维持细胞结构的最佳选择。在制备第一个样品期间,始终使用倒置显微镜目视监测此处描述的所有步骤。 - 将 100-500 μL 乙酸铵涂抹在沉积区域,静置约 1 分钟,然后吸出以清洁载玻片。根据需要重复以确保载玻片不含任何盐或甘油。
3. 显微镜
注意:为了确定沉积细胞的位置,每张载玻片都通过明场/荧光显微镜成像。荧光通道可以准确定位 Hoechst 染色的细胞,而明场成像可提供形态学信息。任何能够进行平铺图像采集的显微镜都适用于此过程。
- 如果之前没有这样做,请用 2-3 mL 的 150 mM 乙酸铵冲洗玻片。此步骤对于去除甘油和盐晶体至关重要,它们会干扰显微镜观察和 MALDI 基质应用。在 N2 的轻柔气流下干燥载玻片或风干。
- 将载玻片加载到显微镜载物台中。使用至少 10 个均匀分布在载玻片上的支撑点聚焦显微镜。
- 使用适用于 DAPI 的滤光片(激发:335-383 nm,发射:420-470 nm)和明场成像,在整个载玻片上以 5x-10x 放大倍率获得平铺荧光图像,确保捕获基准标记(在步骤 1.5 中创建)。
注意:5 倍放大倍率通常就足够了,尤其是当需要对许多载玻片进行成像时。为了分辨更精细的细胞形态,可以使用 10 倍或 20 倍物镜,但代价是成像时间呈二次方延长,文件大小增加。 - 使用显微镜软件拼接平铺图像,例如 ZEN (Zeiss)。准确的拼接至关重要,因为此步骤中的任何错误都会传播到最终的配准步骤,从而导致定位不准确。要进行检查,请确保垂直相邻的切片没有偏移。此外,考虑获取具有较大平铺重叠 (20%-30%) 的平铺图像。
- 在显微镜软件中将每个图像处理并导出为 bigTIFF 文件。如果成像的区域相对较小,并且导致最终图像大小小于 2 GB,请改用标准 TIFF 文件格式。
4. 矩阵应用
注:一致且适当的 MALDI 基质应用对于获得高质量的单细胞数据至关重要。虽然这里使用商业设备的升华,但也可以使用机器人喷雾器12、喷枪21 或自制的升华设备22 进行基质应用。我们发现,与通常用于质谱成像的薄组织切片相比,单细胞制备需要更少的基质。为了减少批量效应,建议在一个会话期间将基质应用于所有正在研究的载玻片,并尽可能将来自不同组(例如,大脑区域或治疗与对照)的细胞沉积到同一张载玻片上。基质选择对于传统的 MALDI 和 MALDI-2 单细胞工作流程都至关重要。对于单细胞 MALDI,已成功使用 DHB23、9-AA24 和 CHCA25 。在 MALDI-2 中,我们和其他人观察到 DHAP9 的信号显著增强,而 NEDC16 和 CHCA26 等基质也得到了有效应用。
- 将 20 mg 2,5-二羟基苯乙酮 (DHAP) 溶解在 1.5 mL 丙酮中。将玻片放入升华室的支架中,然后放入升华装置中。
- 将溶解的基质溶液移液到陶瓷晶片上,让丙酮蒸发。关闭升华室以将其密封。
- 用冰水泥填充冷却液室,然后将其放在腔室顶部。
- 打开真空并让系统平衡 5 分钟。系统中的压力应小于 40 mbar。
- 通过将腔室加热至 200 °C 5 分钟开始升华。
- 取下冰水浴,将温度调至 25 °C,并在腔室顶部放置一个散热器。让系统预热至室温 5 分钟以避免冷凝。
注意: 可以清空装有冰水浴的容器并装满热水以用作散热器。 - 缓慢地对系统进行排气,打开腔室,然后取出载玻片。
5. 单细胞 MALDI MS
注:单细胞 MS 数据是在 MALDI-2 timsTOF 仪器 (timsTOF flex) 上使用开源 microMS 软件包获取的,用于检测细胞并引导质谱仪。这需要将目标细胞的光学图像像素位置转换为质谱仪载物台的物理坐标。
- 打开 microMS 并使用“图像组”选项抽取 bigTIFF 显微镜图像,因为同时存在明场和荧光通道。
- 使用 Blob Options 工具,确定要为目标单元格选择的最佳参数。调整以下参数:最大和最小 blob 大小以选择要查找的 blob 的大小;阈值设置,用于确定如何对 blob 检测的荧光通道进行阈值设置;以及圆度,它决定了需要考虑识别的像元的圆度。对于此处显示的数据,我们使用以下参数值:最大圆度:无;最小圆度:0.6;阈值:75;最小尺寸: 20;最大尺寸:无。
- 使用 Blob 查找选项查找 blob,并使用弹出窗口将 blob 列表保存在所需名称下。
- 使用距离过滤器工具选择每个细胞需要彼此保持距离的特定距离(对于此数据,使用 5 倍荧光显微镜,我们使用了 35 像素的距离过滤器)。这是为了确保细胞彼此之间足够远以进行单细胞分析。该数字以像素为单位,因此请了解显微镜的像素到 μm 的转换以确定理想的数字。使用激光探针直径加上大约 20-30 μm 的尺寸来考虑套准中的误差。
- 使用 MTP 玻片适配器 II 将玻片加载到仪器中。返回装有 microMS 的计算机,并使用远程桌面应用程序访问质谱仪计算机。
- 如果这是第一次使用仪器,请验证仪器的 X-Y 位置。为此,请转到 Tools and Instrument Settings。弹出窗口将显示一组坐标及其 X 和 Y 位置。在仪器的 Slide Adapter II 几何结构上选择 每个特定点 ,并在 microMS 窗口中更新 X 和 Y 位置。
- 使用质谱仪的摄像头和载物台控件,导航到载玻片上易于识别的位置并复制仪器坐标。在 microMS 中,在显微镜图像中找到相应的位置,右键单击该位置,然后在弹出窗口文本位置中输入坐标。将所有坐标舍入到最接近的整数,并用空格分隔 X 和 Y 坐标(即 39595 -23232)。
- 重复步骤 5.7。在整个载玻片上注册至少 12 个基准标记。添加三个注册点后,其中一个圆圈将变为红色,表示它是注册中距离最大的位置。如果发生这种情况,请使用 Shift + 右键单击删除当前注册点,然后重试。
- 在 File (文件) 下,转到 Save (保存),然后转到 Registration (注册) 以保存注册 (.msreg) 文件。
- 在幻灯片上显示斑点后,转到 File(文件),然后 Save(保存),然后转到 Instrument Positions(仪器位置)来保存仪器位置 (.xeo) 文件。使用远程桌面软件将此 .xeo 文件传输到仪器计算机。
- 将生成的自定义 .xeo 文件中的文本复制到仪器上的 MTP Slide Adapter II .xeo 文件中并保存。这将使用单元格的位置更新此几何文件。
- 单击 Automation 选项卡,然后选择 New... 以启动自动运行。在显示的样品区域上拖动以选择单元格,然后右键单击以将其添加到分析列表中。保存自动化运行,然后单击 Start Automatic Run 开始采集。运行时间长短取决于多种因素,包括细胞数量、激光发射次数和激光频率,但一般来说,在 MALDI 模式(10 kHz 激光重复率)下可以分析大约 5-10 个细胞,在 MALDI-2 模式下每秒可以分析 1-5 个细胞(1k Hz 激光重复率)。
6. 数据处理
注:现有的商业软件包不太适合分析高通量单细胞质谱数据。虽然单个光谱可以可视化,但提取有意义的生物学见解需要专门的工具。为了解决这个问题,我们免费提供软件来促进单细胞 MALDI-2 MS 数据分析。我们更新的工作流程有助于将单细胞数据直接转换为开源 imzML 格式27,从而与 SCiLS MVS 和其他供应商软件兼容。对于更高级的数据分析,完整的脚本还包括脂质注释、聚类和 Matplotlib(版本 3.7.3)启用的其他可视化工具的功能。pyTDFSDK 库有助于解析和读取原始数据,该库是 TIMSCONVERT 工作流28 中包含的一组函数。
- 通过将 补充文件 1 中提供的文件复制到与 Jupyter Notebook 相同的工作路径中,然后在第一个代码单元上按 Shift + Enter,SC_MALDI2_Analysis 自定义 Python 库。这将允许我们稍后调用这些函数并使用它们来处理数据。
- 复制所收集数据的路径(Bruker .d 文件)。我们建议以描述性方式命名每个文件的文件夹和名称,以便我们稍后可以解析这些文件路径,以建立每个样本的元数据。运行 Importing the Bruker .d Files 并保存到列表代码单元格。这将输出加载的 .d 文件的总数。
- 运行标题为 Processing the raw data and saving to imzML 的代码单元。这将读取提供的每个布鲁克 .d 文件,对数据执行峰挑选,然后将每个峰周围的 20 ppm 数据保存到写入 .d 文件中的 .imzML 文件中。
- 要查找保存的数据,请打开第一个 .d 文件的位置,imzML 和其他元数据将保存到此路径中。在此阶段,可以将保存的 imzML 文件导入到供应商软件中,例如 SCiLS Lab MVS。要进行更高级的数据分析,请继续按照脚本进行作。
- 通过在以前保存的 imzML 文件代码单元格中运行 Loading 来加载保存的 imzML 数据。这会将保存的数据加载到变量数据中。
- 运行分箱数据并保存数据矩阵单元格,以沿公共 m/z 轴对所有数据进行分箱,移除低丰度 (<0.1%) 的特征,并移除小于噪声的值(100 相对强度)。然后,此函数通过平均每个 bin 中的每个峰值 m/z 值来重新分组数据。生成的数据矩阵将保存为 datacube_array,与矩阵关联的 m/z 条柱保存为 valid_mz_bins,每个条柱的计数保存为 count。
- 为了注释数据,请运行 Exporting peaks for LIPID MAPS 注释 单元格。这会将数据矩阵中的所有 m/z 峰复制到剪贴板。将其粘贴到一个空文本文件中并保存以将其上传到 LIPID MAPS。
- 打开 lipidmaps.org,然后选择 MS Data Bulk Search 和 Search LMSD 以搜索生物学相关的脂质种类。通过选择文本文件并选择合适的加合物(例如,[M+H]+、[M+Na]+ 和 [M+K]+)来上传峰列表。选择适合您的质谱仪的质量容差(我们选择了 +/- 0.01 m/z),选择所有感兴趣的脂质类别,然后点击 搜索。下载 .tsv 文件。
- 通过在元数据单元格的 单个单元格路径中运行 Loading in the single cell (加载) 来 加载光谱元数据。根据文件路径结构在此处更改拆分代码。
- 通过运行 Data Preprocessing and Lipid Annotation 单元格对数据进行预处理。这将使用 lipidMAPS tsv 文件将数据集注释为 10 ppm 误差,从 lipidMAPS 结果中消除奇数链脂质,对剩余数据进行归一化,并删除未通过特定阈值的特征或细胞。这会将新处理的数据集保存为 data2,并将更新的光谱元数据保存为 updated_cell_types。
- 数据分析由 scanpy 执行。运行 UMAP 和 Clustering Analysis for Single Cells 单元格以选择感兴趣的数据(这里我们只选择了 MALDI-2、M2 数据),缩放数据集,并将其加载到一个 scanpy AnnData 对象中以便于分析。
注意:在这里,对数据集执行了莱顿聚类和降维 (UMAP),原始数据类和 UMAP 上的聚类都被可视化,并且使用 scanpy 的 rank_genes_groups_dotplot 函数总结了聚类中一些最具统计意义的特征。
结果
荧光引导单细胞 MALDI-2 MS 的工作流程概述如图 1 所示。首先,从目标大脑区域解剖的组织(图 1A)解离成单个细胞并沉积在导电 ITO 涂层的显微镜载玻片上(图 1B)。通过全玻片荧光成像(图 1C)确定细胞的位置,然后进行 MALDI 矩阵应用(图 1D)、microMS 辅助 MALDI-2 MS 分析(图 1E)和数据分析(图 1F)。使用此工作流程,可以推定地鉴定单个细胞中的数十至数百种脂质,质量精度小于 10 ppm(使用 MALDI-2 timsTOF)。
可以在感兴趣的小区域进行质谱成像,以评估细胞制备和基质应用的质量。分散细胞的 MALDI-2 成像的代表性结果如图 2A 所示。从该图像中,用户可以通过与同一区域的显微照片进行比较来评估分析物扩散的程度。根据扩散量,分析人员可以调整激光束场大小和距离滤光片的大小,以确保真正的单细胞采集。在单细胞 MSI 中,将使用较小的激光尺寸和光栅宽度来获得细胞分辨率 (1-5 μm),而较大的激光尺寸可用于 microMS,相对于成像增加信号强度和可检测脂质的数量。使用 MALDI-2 获得的信号增强的代表性结果如图 2B 所示。观察到胆固醇、 PE 和 PC 种类的增加与先前的文献一致14。通常,当使用相对较高的激光功率 (>50%) 和较少的拍摄次数(约 10 到 200 次)时,我们可以获得最佳的 MALDI-2 信号增强。一些优化是必要的,因为激光功率过低不会提供增强,而激光能量过高会导致分析物碎裂过多29。对于单细胞分析,空间配准是确保准确靶向单个细胞的关键步骤。为了验证配准,可以通过在已知点创建斑点并通过 microMS 导出仪器坐标,在载玻片周围生成一小组测试点 (~5)。验证这些测试点在选择时是否正确定位仪器载物台,可确保后续的细胞靶向准确。
MALDI MS 能够分析单个大脑区域之间和内部的细胞异质性(图 3)。通过分析脂质谱的变化,降维技术有效地将细胞分离成不同的簇,突出了整个数据集中脂质组成的多样性(图 3A)。此外,聚类技术(例如 Leiden 聚类)的应用表明,在特定大脑区域(包括纹状体和皮层)内存在独特的细胞亚群(图 3B)。此外,通过比较每个簇的脂质谱(图 3C),可以使用特定脂质作为标记物来定义簇特异性身份。几种脂质在特定簇中显著上调或下调,表明不同的功能作用或状态,而其他脂质在簇中共享,但其相对信号强度不同。为了确保稳健的下游数据分析,必须在大多数细胞中实现可靠的脂质检测并评估潜在的批次效应。 图 3D 显示了分散在单独的 ITO 涂层载玻片上的六个单独皮质细胞的代表性光谱。虽然单个脂质谱图表现出异质性,但在所有采集中都能一致地检测到脂质。 图 3E 显示了在相同条件下制备和分析的不同载玻片的皮质细胞的 UMAP。载玻片之间细胞的大量重叠表明,批次效应不会显着混淆生物学解释。如有必要,可以应用 ComBat30 等批量校正算法来减轻任何残余影响。总之,单细胞 MALDI-2 是一种先进的脂质生物标志物鉴定技术,为细胞亚群提供了重要见解,并增强了我们对大脑区域和功能多样性的理解。
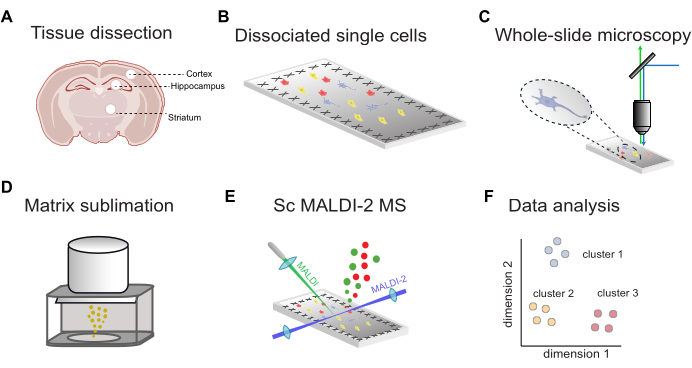
图 1:scMALDI-2 MS 的一般工作流程。(A) 手动组织解剖和脑区分离。(B) 木瓜蛋白酶将组织解离成单细胞,并将细胞沉积到导电 ITO 包被的载玻片上。(C) 通过核染色 (DAPI/Hoechst) 进行全玻片荧光显微镜检查。(D) MALDI 基质 (DHAP) 升华到样品玻片上。(E) 图像引导的单细胞 MALDI-2 MS 测量。(F) 全面的数据分析,包括降维、聚类和统计分析。请单击此处查看此图的较大版本。
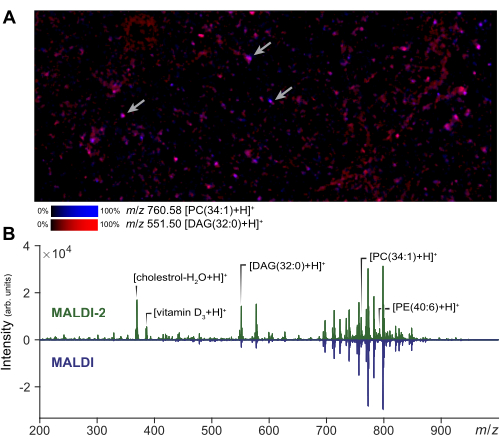
图 2:用于单细胞分析的 MALDI-2 MS 优化和成像。 (A) 分散的原代细胞群的 MALDI-2 MSI 成像。箭头表示几个单独的单元格。执行 MSI 和小区域使分析人员能够优化方法参数并评估样品质量。(B) 使用 MALDI-2 和 MALDI MS 采集获得的结果比较。通过显示 MALDI-2 光谱(上图)和 MALDI 光谱(下图),突出显示了各种脂质的信号增强(MALDI 2 与 MALDI),包括胆固醇、DAG(甘油二酯)、PC(磷脂酰胆碱)和 PE(磷脂酰乙醇胺)。 请单击此处查看此图的较大版本。
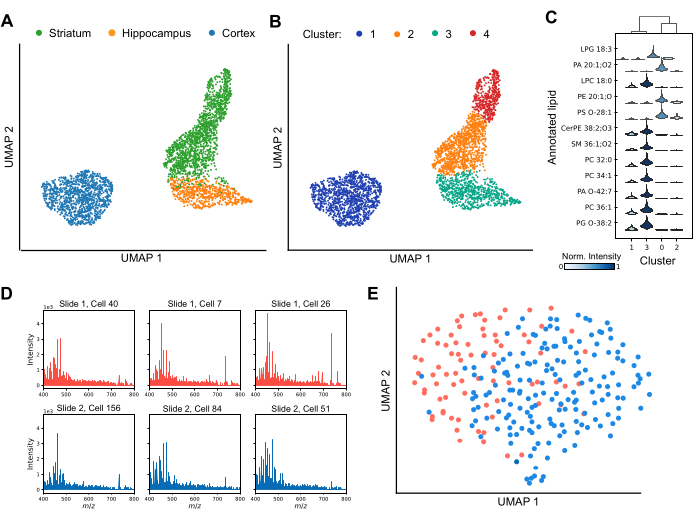
图 3:使用 MALDI-2 MS 在三个啮齿动物脑区内的单细胞脂质分析。 (A) 按脑起源区域着色的分析细胞的均匀流形近似和投影 (UMAP) 分析。(B) 进行 Leiden 聚类后对相同细胞进行的 UMAP 分析,其中聚类对应于具有相似脂质组成的细胞亚群。此处的颜色显示不同的 Leiden 数据集群。(C) 小提琴图显示了簇之间不同脂质的强度分布差异。(D) 从两张单独的载玻片中分析来自 6 个代表性单个皮质细胞的光谱。(E) 从两张单独的载玻片分析的皮质细胞的 UMAP 分析。 请单击此处查看此图的较大版本。
补充文件 1:SC-MALDI2_Analysis.py。 此文件包含一组为处理单池 MALDI-2 质谱数据而开发的函数。它包括读取原始质谱数据、执行分箱以及进行注释和下游分析的方法。 补充文件 2 中提供了用于加载和执行所有数据预处理和分析的单元格集。 请点击此处下载此文件。
补充文件 2:JOVE Analysis.ipynb。 此文件包含一个 Jupyter 笔记本,其中包含一组单元格,这些单元格要从 SC-MALDI2_Analysis.py 加载到自定义 Python 函数中,并执行上述所有数据预处理和分析。 请点击此处下载此文件。
讨论
高通量、图像引导的单细胞 MALDI MS 是了解单细胞规模化学异质性的宝贵工具。激光诱导后电离 (MALDI-2) 的加入提供了更深的分析物覆盖,这对于质量和体积受限的样品(如分离的哺乳动物细胞)至关重要。
虽然绝大多数已发表的单细胞脂质和代谢物 MS 工作流程使用培养细胞,但我们的方法适用于相对快速分离的原代细胞。这种区别至关重要,因为培养的细胞在培养的短短几天内就显示出其代谢物和脂质含量的明显变化23,31。在大多数情况下,酶细胞分离会导致精细细胞结构的丢失,例如轴突、树突和星形胶质细胞突。因此,观察到的分析物信号主要来自细胞胞体。尽管如此,还是实现了按细胞类型4 和大脑区域的成功分类12。这表明许多不同细胞特有的脂质位于体细胞中。
MALDI 基质应用方法的微小差异会对所得分析物信号产生深远影响。我们提出了一种基于商用设备进行可重现基质升华的工作流程,该工作流程可产生均匀的基质层、高信噪比和有限的分析物扩散。但是,可以使用使用机器人喷雾器或艺术家喷枪的矩阵应用等方法。无论采用哪种方法,与标准组织 MSI 中使用的基质相比,单细胞制备物的基质密度应较低,以实现光学基质与分析物的比例。此处应用的基质密度大约是组织 MSI 使用的基质密度的一半。当然,这确实意味着每个细胞的基质量高于 MSI,这有助于在此处使用的分离细胞方法中增强分析物的提取和检测。
对于需要显著优化的样品,可以作为优化过程的一部分,对单细胞解离物的小 ROI 进行 MSI,如图 2A 所示。此步骤还可以让分析人员评估溶剂型基质应用方法中分析物的扩散程度。
成功的单细胞图像引导 MALDI 需要高质量的荧光图像、可重现的基质应用和精确的载物台控制。这些实验比标准 MSI 工作流程要求更高,因为标准 MSI 工作流程由于成像区域更大、分析物数量更高,可以容忍基质和样品条件的微小配准错误和变化。尽管存在这些挑战,我们还是成功地使用传统 MALDI 靶向了单个细胞器。
平铺荧光图像的准确拼接至关重要,因为微小的误差会加剧并影响载物台控制,因此配准精度至关重要。批次效应也带来了重大挑战,在同一张玻片上、玻片之间和不同制备中观察到信号变化。适当的归一化策略,包括使用内标和四分位数归一化,有助于缓解这些问题。此外,批量校正算法(如 ComBat30 )可用于减少技术差异并增强真正的生物学差异。
从单个细胞中获得可靠的分子注释仍然是一个挑战。通常,材料量和检测灵敏度不足以对除最丰富的物种外的所有物种进行串联 MS。对于那些不能直接从单个细胞进行串联 MS 检测的细胞,可以采用其他方法来创建分析物库。例如,可以从来自同一大脑区域和用于生成细胞群的动物的薄冷冻切片中获得组织上串联 MS 数据。也可以采用从组织中提取脂质,然后进行 LC-MS。随着样品制备策略和 MS 技术的不断改进,可以直接从单细胞中获得越来越多的相关结构信息。未来,我们预计该工作流程将得到扩展,以从单个细胞中获取串联 MS 数据,无需辅助 LC-MS/MS 实验。我们进一步设想,这种方法可以扩展到生物学及其他领域的微量样品,包括独特的细胞类型、哺乳动物细胞器、粉末和微塑料。
披露声明
作者没有需要披露的竞争利益。
致谢
S.W.C 感谢 Peixin He 和 Xiaoming Chen PhD4 奖学金以及伊利诺伊大学 Block Grant 奖学金提供的支持。这项工作也得到了国家药物滥用研究所的支持,奖励号为P30DA018310,国家老龄化研究所 (National Institute on Aging) 授予第R01AG078797,并由美国国立卫生研究院院长办公室授予 S10OD032242。
材料
| Name | Company | Catalog Number | Comments |
| 2',5'-dihydroxyacetophenone | Sigma Aldrich | D107603 | DHAP, 97% purity |
| Ammonium acetate | Sigma Aldrich | 238074 | ACS reagent, ≥97% |
| Axio M2 Imager | Zeiss | N/A | N/A |
| Biopsy punch, 2 mm | Fisher Scientific | 12-460-399 | integra miltex standard biopsy punch, 2mm |
| Calcium chloride | Sigma Aldrich | C4901 | anhydrous, powder ≥97% |
| Eppendorf Centrifuge | Sigma Aldrich | EP5405000441 | centrifuge 5425 with rotor FA-24x2 |
| Gentamicin | Sigma Aldrich | G1272 | liquid, BioReagent |
| Glass etching pen | Sigma Aldrich | Z225568 | carbide time, pkg of 1 |
| Glycerol | Sigma Aldrich | G7893 | ACS reagent, ≥99.5% |
| HEPES buffer | Sigma Aldrich | H3375 | ≥99.5% (titration) |
| Hoechst 33258 Solution | Sigma Aldrich | 94403 | 1 mg/mL in H2O, ≥98.0% (HPLC) |
| In line HEPA Filter | Sigma Aldrich | WHA67225001 | VACU-GUARD 60 mm disc, 0.45 PFTE housing |
| ITO-Coated Microscopy Slides | Delta Technologies | CG-90IN-S115 | 70-100Ω resistance |
| Magnesium chloride | Sigma Aldrich | M8266 | anhydrous, ≥98% |
| Magnesium sulfate | Sigma Aldrich | 208094 | anhydrous, ≥97% |
| Microcentrifuge tubes | Sigma Aldrich | HS4323K | tube capacity 1.5 mL, pack of 500 |
| Papain dissociation system | Worthington Biochemical | LK003150 | one box, 5 single use vials |
| Penicillin-Streptomycin | Sigma Aldrich | P4458 | liquid, BioReagent |
| Potassium chloride | Sigma Aldrich | 529552 | Molecular biology grade |
| Potassium phosphate monobasic | Sigma Aldrich | P5379 | Reagent Plus |
| Sodium biocarbonate | Sigma Aldrich | S6014 | ACS reagent, ≥99.7% |
| Sodium chloride | Sigma Aldrich | S9888 | ACS reagent, ≥99% |
| Sodium hydroxide | Sigma Aldrich | 221465 | ACS reagent, ≥97%, pellets |
| Sodium phosphate dibasic | Sigma Aldrich | S9763 | ACS reagent, ≥99% |
| Sublimate | HTX | N/A | N/A |
| timsTOF FleX MALDI-2 | Bruker | N/A | microGRID enabled |
| Vacuum tubing | Thermo Scientific | 8701-0080 | Nalgene Non-phthalate PVC Tubing |
参考文献
- Sunshine, H., Iruela-Arispe, M. L. Membrane lipids and cell signaling. Curr Opin Lipidol. 28 (5), 408-413 (2017).
- Van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nat Rev Mol Cell Biol. 9 (2), 112-124 (2008).
- Cheng, K. W., Su, P. R., Feller, K. J. A., Chien, M. P., Hsu, C. C. Investigating the Metabolic Heterogeneity of Cancer Cells Using Functional Single-Cell Selection and nLC Combined with Multinozzle Emitter Mass Spectrometry. Anal Chem. 96 (2), 624-629 (2024).
- Neumann, E. K., Comi, T. J., Rubakhin, S. S., Sweedler, J. V. Lipid Heterogeneity between Astrocytes and Neurons Revealed by Single-Cell MALDI-MS Combined with Immunocytochemical Classification. Ange Chem. 131 (18), 5971-5975 (2019).
- Bhaduri, A., Neumann, E. K., Kriegstein, A. R., Sweedler, J. V. Identification of Lipid Heterogeneity and Diversity in the Developing Human Brain. JACS Au. 1 (12), 2261-2270 (2021).
- Saliba, A. E., Westermann, A. J., Gorski, S. A., Vogel, J. Single-cell RNA-seq: advances and future challenges. Nuc Acid Res. 42 (14), 8845-8860 (2014).
- Karas, M., Hillenkamp, F. Laser desorption ionization of proteins with molecular masses exceeding 10,000 daltons. Anal Chem. 60 (20), 2299-2301 (1988).
- Croslow, S. W., Trinklein, T. J., Sweedler, J. V. Advances in multimodal mass spectrometry for single-cell analysis and imaging enhancement. FEBS Lett. 598 (6), 591-601 (2024).
- Bien, T., Bessler, S., Dreisewerd, K., Soltwisch, J. Transmission-Mode MALDI Mass Spectrometry Imaging of Single Cells: Optimizing Sample Preparation Protocols. Anal Chem. 93 (10), 4513-4520 (2021).
- Rappez, L., et al. SpaceM reveals metabolic states of single cells. Nat Methods. 18 (7), 799-805 (2021).
- Comi, T. J., Neumann, E. K., Do, T. D., Sweedler, J. V. microMS: A Python Platform for Image-Guided Mass Spectrometry Profiling. J Am Soc Mass Spec. 28 (9), 1919-1928 (2017).
- Xie, Y. R., et al. Multiscale biochemical mapping of the brain through deep-learning-enhanced high-throughput mass spectrometry. Nat Methods. 21 (3), 521-530 (2024).
- Neumann, E. K., Ellis, J. F., Triplett, A. E., Rubakhin, S. S., Sweedler, J. V. Lipid Analysis of 30 000 Individual Rodent Cerebellar Cells Using High-Resolution Mass Spectrometry. Anal Chem. 91 (12), 7871-7878 (2019).
- Soltwisch, J., et al. Mass spectrometry imaging with laser-induced postionization. Science. 348 (6231), 211-215 (2015).
- Barré, F. P. Y., et al. Enhanced Sensitivity Using MALDI Imaging Coupled with Laser Postionization (MALDI-2) for Pharmaceutical Research. Anal Chem. 91 (16), 10840-10848 (2019).
- McKinnon, J. C., et al. MALDI-2-Enabled Oversampling for the Mass Spectrometry Imaging of Metabolites at Single-Cell Resolution. J Am Soc Mass Spec. 35 (11), 2729-2742 (2024).
- Comi, T. J., Makurath, M. A., Philip, M. C., Rubakhin, S. S., Sweedler, J. V. MALDI MS Guided Liquid Microjunction Extraction for Capillary Electrophoresis-Electrospray Ionization MS Analysis of Single Pancreatic Islet Cells. Anal Chem. 89 (14), 7765-7772 (2017).
- Wu, J., et al. Transcardiac Perfusion of the Mouse for Brain Tissue Dissection and Fixation. Bio Protoc. 11 (5), e3988(2021).
- Aboghazleh, R., et al. Rodent brain extraction and dissection: A comprehensive approach. MethodsX. 12, 102516(2024).
- Jager, L. D., et al. Effect of enzymatic and mechanical methods of dissociation on neural progenitor cells derived from induced pluripotent stem cells. Adv Med Sci. 61 (1), 78-84 (2016).
- Chan-Andersen, P. C., Romanova, E. V., Rubakhin, S. S., Sweedler, J. V. Profiling 26,000 Aplysia californica neurons by single cell mass spectrometry reveals neuronal populations with distinct neuropeptide profiles. J Biol Chem. 298 (8), 102254(2022).
- Castro, D. C., Xie, Y. R., Rubakhin, S. S., Romanova, E. V., Sweedler, J. V. Image-guided MALDI mass spectrometry for high-throughput single-organelle characterization. Nat Methods. 18 (10), 1233-1238 (2021).
- Castro, D. C., et al. Single-Cell and Subcellular Analysis Using Ultrahigh Resolution 21 T MALDI FTICR Mass Spectrometry. Anal Chem. 95 (17), 6980-6988 (2023).
- Ibáñez, A. J., et al. Mass spectrometry-based metabolomics of single yeast cells. Proc Natl Acad Sci. 110 (22), 8790-8794 (2013).
- Krestensen, K. K., et al. Molecular Profiling of Glioblastoma Patient-Derived Single Cells Using Combined MALDI-MSI and MALDI-IHC. Anal Chem. 97 (7), 3846-3854 (2025).
- Niehaus, M., Soltwisch, J., Belov, M. E., Dreisewerd, K. Transmission-mode MALDI-2 mass spectrometry imaging of cells and tissues at subcellular resolution. Nat Methods. 16 (9), 925-931 (2019).
- Xie, Y. R., et al. Data-Driven and Machine Learning-Based Framework for Image-Guided Single-Cell Mass Spectrometry. J Proteome Res. 22 (2), 491-500 (2023).
- Luu, G. T., et al. TIMSCONVERT: a workflow to convert trapped ion mobility data to open data formats. Bioinformatics. 38 (16), 4046-4047 (2022).
- Vandergrift, G. W., et al. Experimental and Computational Evaluation of Lipidomic In-Source Fragmentation as a Result of Postionization with Matrix-Assisted Laser Desorption/Ionization. Anal Chem. 96 (41), 16127-16133 (2024).
- Zhang, Y., Parmigiani, G., Johnson, W. E. ComBat-seq: batch effect adjustment for RNA-seq count data. NAR Genom Bioinfo. 2 (3), lqaa078(2020).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Single-Cell Metabolomics: Changes in the Metabolome of Freshly Isolated and Cultured Neurons. ACS Chem Neurosci. 3 (10), 782-792 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。