Method Article
ספיגה/יינון לייזר בסיוע מטריצה פלואורסצנטית עם ספקטרומטריית מסה פוסטיוניזציה המושרה בלייזר של תאים עצביים בודדים של חולדה
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר את השימוש במיקרוMS לספקטרומטריית מסה MALDI-2 חד-תאית מונחית פלואורסצנטית, המאפשרת פרופיל מולקולרי משופר של תאי עצב ראשוניים של חולדות.
Abstract
מדידות של תא בודד הן קריטיות להבנת ההטרוגניות המרחבית העשירה של המוח. ספקטרומטריית מסה (MS) בסיוע לייזר/יינון ספיגה (MALDI) מסוגלת לאפיין ללא תוויות ותפוקה גבוהה של מולקולות אנדוגניות בתאים בודדים. ההתקדמות האחרונה בפיתוח ספקטרומטר מסה MALDI עם פוסט-יינון המושרה על ידי לייזר (MALDI-2) מספקת רגישות משופרת מאוד לזיהוי עבור מגוון שומנים ומולקולות קטנות אחרות. עם זאת, הדמיית טרשת נפוצה של דגימות גדולות עם MALDI-2 ברזולוציה תאית היא איטית מאוד עבור רוב היישומים. בפרוטוקול זה, תאים ראשוניים מבודדים ומפוזרים על גבי שקופיות מוליכות. מיקומי התאים היחסיים נקבעים על ידי מיקרוסקופיה פלואורסצנטית של שקופית שלמה, ואחריה רישום מדויק של קואורדינטות המיקרוסקופיה לקואורדינטות השלב של ספקטרומטר המסה MALDI-2. ניתוח MS ממוקד של מיקומי תאים בלבד מספק מדידות תא בודד בתפוקה גבוהה עם כיסוי אנליטי גבוה וגודל נתונים מופחת בהשוואה להדמיית MS של הדגימה כולה. אנו מתארים את השלבים הקריטיים הדרושים להכנת תא בודד, הדמיית פלואורסצנטיות של שקופית שלמה, יישום מטריצה וספקטרומטריית מסה MALDI-2.
Introduction
ליפידים ומטבוליטים הם בסיסיים לתפקוד התא ומשמשים כמרכיבים חיוניים של ממברנות, מקורות אנרגיה ומולקולות איתות 1,2. עם זאת, הרכבם ושכיחותם יכולים להשתנות באופן משמעותי בין תאים בודדים, מה שמשקף את ההבדלים בסוגי התאים ובמצבים התפתחותיים ותפקודיים 3,4,5. ניתוח הבדלים אלה חיוני להבנת השונות הביולוגית ולזיהוי תת-אוכלוסיות תאים מובחנות. טכניקות מדידה של תא בודד, כגון ריצוף RNA, מספקות פרופילי תעתיק שימושיים ספציפיים לתא6. עם זאת, מדידות אלה ברמת התעתיק אינן משקפות ישירות את הכמויות התאיות בפועל של שומנים ומטבוליטים, מכיוון שביטוי גנים לא תמיד מתואם עם השפע האמיתי של אנליטים אלה. לכן נדרשות שיטות מיוחדות למדידות ישירות של שומנים ומטבוליטים לניתוח מקיף של ההרכב הכימי של תאים בודדים ואוכלוסיותיהם.
הדמיית ספקטרומטריית מסה בסיוע מטריצה (MALDI) היא כלי בחירה למיפוי מרחבי ללא תווית של ביומולקולות אנדוגניות באתרן 7,8. בדרך כלל, עם MALDI, לייזר UV משמש להסרת חומר משכבת דגימה דקה שהתגבשה יחד עם מטריצה אורגנית, ויוצרת פלומה של יונים ומולקולות ניטרליות. היונים שנוצרו מופרדים לאחר מכן על ידי מנתח MS ומתגלים בתוך ספקטרומטר מסה. בהתחשב במיקום המדויק של שלבי ספקטרומטר מסה מודרניים, ניתן למקם את הלייזר כדי למקד לאזורי דגימה ספציפיים או להוסיף רסטר על פני אזורים כדי ליצור תמונות מולקולריות על ידי MSI. MSI ברזולוציה מרחבית תאית או תת-תאית (< 10 מיקרומטר), המושגת עם קרן לייזר ממוקדת ותנועת במה מדויקת, יכולה לשמש להשגת מידע כימי על תאים בודדים 9,10. עם זאת, מדידות MSI בקנה מידה זה אינן יעילות, במיוחד במקרה של דגימות עם צפיפות תאים ממוקדת נמוכה, בשל משך הזמן המושקע בהדמיית אזורים ריקים בין תאים. יתר על כן, יכולת הזיהוי של אנליטים רבים מוגבלת בשל הנפח הקטן שנדגם. כדי להתגבר על אתגרים אלה, פיתחנו גישת MALDI MS מונחית תמונה לניתוח תאים בודדים בתפוקה גבוהה11,12. בגישה זו, מיקומם של תאים מפוזרים נקבעים באופן פרוגרמטי מתמונות פלואורסצנטיות של שקופיות שלמות ומשמשים להנחיית שלב ספקטרומטר המסה למיקומים שבהם ממוקמים תאים בודדים עם פרמטרים ספציפיים (למשל, גודל וצורה) ולאחר מכן מנותחים באמצעות הקרנה עם לייזר MALDI. עבודות קודמות שהשתמשו בגישה ממוקדת זו שימשו לאפיון שומנים, פפטידים וביו-מולקולות אחרות באוכלוסיות תאים הטרוגניות 5,13.
בהתחשב באופי המוגבל במסה של תאים בודדים, מספר האנליטים שזוהו בדגימות כאלה הוא בדרך כלל קטן מזה שנצפה ישירות מרקמה. לכן, כדי להגדיל את הכיסוי האנליטי בניתוח MS של תא בודד, הגדלת הרגישות לזיהוי האנליטים היא קריטית. גישה אחת שפותחה לאחרונה המסייעת להתגבר על אתגר זיהוי זה היא MALDI עם יינון לייזר (MALDI-2), שהוכח כמשפר את הרגישות למגוון רחב של אנליטים 9,14,15,16. כתוצאה מכך, MALDI-2 מייצר מערכי נתונים מקיפים יותר של תא בודד ומספק כיסוי מולקולרי עמוק יותר בדגימות מוגבלות מסה, כגון תאים מבודדים.
מטרת שיטה זו היא להשיג מדידות שומנים מאלפי תאים בודדים. לשם כך, אנו מתארים זרימת עבודה המאפשרת ספקטרומטריית מסה של תא יחיד MALDI-2 בתפוקה גבוהה ובדרך כלל ניתנת להרחבה לכל גישת ספקטרומטריית מסה מבוססת בדיקה עם בקרת שלב מדויקת17. בזרימת עבודה זו מנותחים רקמה מאזור המוח המבוקש, ותאים בודדים מתקבלים מהרקמה לאחר הליך דיסוציאציה של פפאין. לאחר מכן התאים מסומנים בכתם גרעיני ומפוזרים על שקופיות זכוכית מוליכות החרוטות בסמנים נאמנים, שם מותר להם להידבק. לאחר מכן, תמונות שקופיות שלמות מצולמות באמצעות מיקרוסקופ פלואורסצנטי. המטריצה מופקדת על ידי סובלימציה, ויוצרת שכבת גביש הומוגנית הניתנת לחזרה ואות לרעש גבוה לניתוח MS של תא יחיד. באמצעות תוכנת הקוד הפתוח microMS11, הקואורדינטות היחסיות של מיקומי התאים מתמונת המיקרוסקופיה ממופות ומיושרות עם קואורדינטות שלב ספקטרומטר המסה על ידי רישום מוגדר באמצעות סמנים נקודתיים החרוטים על שקופיות הזכוכית שבהן הופקדו התאים. לבסוף, באמצעות מידע זה, ספקטרום טרשת נפוצה מדויק וממוקד נרכש מכל תא בודד, מה שמאפשר פרופיל של אלפי תאים בריצה אחת (<1 שעות)12,13.
Protocol
כל הניסויים בבעלי חיים במחקר זה נעשו בהתאם לפרוטוקול השימוש בבעלי חיים שאושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אילינוי (23228) תוך הקפדה על תקנים לאומיים וסטנדרטים של ARRIVE לטיפול אתי וטיפול בבעלי חיים.
1. הכנת חומרים ופתרונות
- הכן תמיסת מלח מאוזנת של גיי שונה (mGBSS) עם 1.5 מ"מ CaCl2, 4.9 מ"מ KCl, 0.2 מ"מ KH2PO4, 11 מ"מ MgCl2, 0.3 מ"מ MgSO4, 138 מ"מ NaCl, 27.7 מ"מ NaHCO3, 0.8 מ"מ Na2HPO4 ו-25 מ"מ HEPES. התאם את ה-pH ל-7.2 באמצעות 3 M NaOH. מומלץ להכין 1 ליטר mGBSS ולאחסן בטמפרטורה של 4 מעלות צלזיוס עד לשימוש.
- הכינו מזרקים של 50 מ"ל על ידי מילויים בתמיסת mGBSS המוכנה והניחו אותם על קרח לזלוף דרך הלב. הכן מזרק אחד לכל חולדה שנותחה.
- הכן כמויות של תמיסת פפאין בהתאם לפרוטוקול מערכת דיסוציאציה פפאין של וורת'ינגטון. מערכת זו מכילה ארבעה בקבוקונים כמתואר להלן, כאשר בקבוקון 4 אינו משמש לפרוטוקול זה:
בקבוקון 1: תמיסת מלח מאוזנת סטרילית של ארל (EBSS) עם ביקרבונט ופנול אדום
בקבוקון 2: פפאין עם L-ציסטאין ו-EDTA
בקבוקון 3: דאוקסיריבונוקלאז I (DNase)
בקבוקון 4: מעכב פרוטאז אובומוקואיד עם אלבומין בסרום בקר- הוסף 5 מ"ל של EBSS (בקבוקון 1) לבקבוקון הפפאין (בקבוקון 2) והנח אותו באמבט מים של 37 מעלות צלזיוס למשך 10 דקות כדי להמיס את הפפאין.
- הוסף 500 מיקרוליטר של EBSS (בקבוקון 1) לבקבוקון DNase (בקבוקון 3) וערבב בעדינות. הוסף 250 מיקרוליטר מבקבוקון ה-DNase המדולל (בקבוקון 3) לבקבוקון הפפאין (בקבוקון 2). תכשיר זה מכיל ריכוז סופי של 20 יחידות/מ"ל פפאין, 0.005% DNase, 0.5 מ"מ EDTA ו-1 מ"מ L-ציסטאין.
- הקפיא 250 מיקרוליטר של תמיסת פפאין מוכנה זו לדיסוציאציות הבאות (עושה ~ 20 אליקוטים). השלם תמיסה זו עם האנטיביוטיקה הבאה: 100 יחידות/מ"ל פניצילין G, 100 מיקרוגרם/מ"ל סטרפטומיצין ו-100 מיקרוגרם/מ"ל גנטמיצין. ניתן לשנות זאת עבור היישום של המשתמש.
- הכן תמיסת אמוניום אצטט של 150 מ"מ ואחסן אותה בטמפרטורה של 4 מעלות צלזיוס. הכן תמיסת גליצרול 33% על ידי דילול גליצרול לתמיסת mGBSS המוכנה.
- חרוט נאמנים על שקופיות מיקרוסקופיה מצופות תחמוצת פח אינדיום (ITO) באמצעות עט חריטה עם טונגסטן קרביד או קצה יהלום או חרט לייזר CO2 . בצד המוליך של מגלשת הזכוכית של ITO, חרטו 20-40 סמנים פידוציאליים בצורת X לאורך היקף המגלשה כדי לאפשר רישום מרחבי חוצה פלטפורמות (למשל, מיקרוסקופ וספקטרומטר מסה).
הערה: הקפד לא לחרוט בקו מחובר אחד המקיף את הדגימה או את אזוריה, מכיוון שהדבר משבש את מוליכות פני השטח בין האזור למתאם שקופיות זכוכית.
2. הכנת תאים עצביים ראשוניים
הערה: רקמת ההיפוקמפוס של חולדה מנותחת, מפורקת לתאים בודדים עם פפאין, ומופקדת על מגלשות זכוכית מוליכות בצפיפות נמוכה. בידוד התאים באופן זה מאפשר ספקטרומטריית מסה של תא בודד בתפוקה גבוהה של ליפידים אנדוגניים.
- לפני נתיחת בעלי חיים, יש להפשיר כמות של תמיסת הפפאין המוכנה ולהניח אותה במיכל עם צינור כניסה ויציאה המאפשר ל-CO2 להזיז את האוויר בתוך המיכל. הנח מערכת זו באמבט מים המוגדר ל-37 מעלות צלזיוס והמשך בזרימת CO2 עד שהתמיסה תהיה ה-pH המתאים, כפי שמצוין על ידי הצבע, באמצעות טבלת צבעי ה-pH הכלולה בחבילת מערכת הדיסוציאציה של וורת'ינגטון פפאין. ה-pH היעד הוא בין 7.2 ל-7.4.
הערה: אין לבעבע CO2 לתמיסה האנזימטית, מכיוון שהדבר יגרום לדנטורציה של ה-DNase ולאובדן הפעילות הביולוגית. השתמש בצינור צנטריפוגה של 50 מ"ל עם שני צינורות המודבקים במכסה, מה שמאפשר ל-CO2 למלא את הצינור מלמטה ולברוח מצינור היציאה העליון. - המתת חסד של חולדות בהתאם לפרוטוקולי IACUC בהתאם להנחיות מוסדיות, מקומיות ופדרליות. כאן, חולדות ספראג-דולי זכרות בנות 2 עד 3 חודשים משמשות ומוקרבות על ידי חנק CO2 .
- יש להחדיר את החולדה בתמיסת mGBSS קרה כקרח (4 מעלות צלזיוס) כדי להוציא דם ממערכת כלי הדם ולצנן במהירות את גוף החיה. דוגמה אחת להליך זה ניתן למצוא בפרוטוקול של We et al.18.
- בודדו את המוח מהחולדה בניתוח, והקפידו לא לפגוע באזור המוח המבוקש. סקירה כללית שפורסמה בעבר של בידוד זה מספקת פרטים נוספים על חלק מהשלבים הבודדים19.
- השתמש בקוצץ רקמות או בקוביית רקמות כדי לחתוך חתך רוחב (בעובי ~2 מ"מ) של המוח כדי לחשוף את האזור (היפוקמפוס, קליפת המוח או סטריאטום) לדגימה.
- השתמש באגרוף ביופסיה של 2 מ"מ כדי לדגום את האזור המעניין במוח ולהפקיד את גוש הרקמה בבקבוקון של תמיסת פפאין.
- דגרו על תמיסת רקמה ופפאין זו בטמפרטורה של 37 מעלות צלזיוס תחת תסיסה מתמדת (למשל, על ידי נדנדה חשמלית) למשך 30-90 דקות.
הערה: משך הטיפול האנזימטי צריך להיות אופטימלי על סמך אזור המוח, זן בעלי החיים, הגיל ותפוקת התאים הרצויה (למשל, נוירונים ואסטרוציטים עם טרמינלים לעומת תפוקה מקסימלית של תאים ללא טרמינלים). עבור רקמת היפוקמפוס של חולדות, 60-90 דקות אופייניות. טיפולים קצרים יותר עשויים לשמר חלק מהטרמינלים אך להשאיר תאים רבים באשכולות לא מנותקים, בעוד שטיפולים ארוכים יותר יכולים לשפר את התפוקה אך להגביר את הנזק לתאים, ודורשים הערכה באמצעות מבחנים חיים/מתים (למשל, ערכת כדאיות/ציטוטוקסיות חיה/מתה). עבור מחקרים השוואתיים, הטיפולים חייבים להיות עקביים בין סוגי המדגם. - יש להניח בקבוקון של טישו ופפאין על קרח כדי לקרר ולדכא את הפעילות האנזימטית. שלש את הרקמה באמצעות קצה פיפטה חתוך המחובר לפיפטה בנפח מתכוונן P100 עד שרוב הרקמה מתפרקת חזותית. אין ליצור בועות אוויר במהלך דיסוציאציה כדי למנוע נזק מוגזם לתאים.
הערה: טריטורציה נמרצת מביאה לתפוקה גבוהה של תאים; עם זאת, הם אינם שומרים על רוב התהליכים שלהם. טריטורציה עדינה מספקת יותר תהליכים על התאים אך מביאה ליותר תאים לא מפורקים. ניתן להשתמש גם בקצות פיפטות בגדלים שונים ובשיטות אחרות ולבצע אופטימיזציה לתוצאות דיסוציאציה אידיאליות20. - צנטריפוגה של התאים המנותקים ב-300 x g למשך 5 דקות בטמפרטורת החדר כדי לגלול את התאים. הסר את הסופרנטנט והשהה מחדש את הגלולה ב-1 מ"ל של mGBSS. הוסף כתם גרעיני Hoechst 33342 לריכוז סופי של 1 מיקרוגרם/מ"ל.
- פיפטה 100-500 מיקרוליטר של מתלה התא על שקופיות זכוכית ITO חרוטות ומניחה לשבת כ-5 דקות או יותר כדי לאפשר לתאים לשקוע ולהיצמד למגלשה.
- יהיה צורך לקבוע אמפירית את דילול תרחיף התאים. בעזרת מיקרוסקופ אופטי, הוסף טיפה של התאים על השקופית כדי לקבוע צפיפות גסה ודלל משם כדי להבטיח שיש מספיק מרחק בין התאים (כלומר, גדול מספיק מגודל קרן MALDI). ניתן לבצע דילול זה בשקופית הראשונה, ולאחר מכן ניתן לכוונן את הדילול לפי הצורך עבור השקופיות הבאות.
- שאב בעדינות את מתלה התא מהמגלשה באמצעות מערכת ואקום המכילה (ממוקמת לפי הסדר החל מקו הוואקום): 1) צינורות עם מסנן HEPA גז בשורה, 2) צינורות המותקנים על בקבוק סינון של 50 מ"ל, 3) צינורות המחוברים לכניסת בקבוק סינון שנייה עם קצה פיפטה מחובר (למשל, 100 מיקרוליטר). אם מאחסנים את התאים המצופים לשימוש עתידי, החלף את התרחיף הנשאף בתמיסת גליצרול 33% למשך 1-2 דקות והסר אותו.
הערה: שלב זה יבטיח את יציבות התא. הוצאת תמיסת גליצרול מצד אחד תוך שאיבה עדינה מהצד השני פועלת בצורה אופטימלית לשמירה על מבנה התא. עקוב תמיד חזותית אחר כל השלבים המתוארים כאן באמצעות מיקרוסקופ הפוך במהלך הכנת הדגימה הראשונה. - מרחו 100-500 מיקרוליטר אמוניום אצטט על האזורים המופקדים, הניחו לשבת כדקה ואז שאפו לניקוי המגלשות. חזור על הפעולה לפי הצורך כדי להבטיח שהשקופיות נקיות מכל מלח או גליצרול.
3. מיקרוסקופיה
הערה: כדי לקבוע את מיקום התאים המופקדים, כל שקופית מצולמת על ידי מיקרוסקופ שדה בהיר/פלואורסצנטי. תעלת הקרינה מאפשרת לאתר במדויק תאים מוכתמים ב-Hoechst, בעוד שהדמיית שדה בהיר מספקת מידע מורפולוגי. כל מיקרוסקופ המסוגל לרכוש תמונה מרוצפת מתאים לתהליך זה.
- אם לא נעשה בעבר, יש לשטוף את השקופיות עם 2-3 מ"ל של 150 מ"מ אמוניום אצטט. שלב זה הוא קריטי להסרת גבישי גליצרול ומלח, שעלולים להפריע לתצפית מיקרוסקופיה וליישום מטריצת MALDI. יש להחליק מתחת לזרם עדין של N2 או להניח לייבוש באוויר.
- טען החלקה לתוך שלב המיקרוסקופ. מקד את המיקרוסקופ באמצעות לפחות 10 נקודות תמיכה המפוזרות באופן שווה על פני השקופית.
- באמצעות מסננים המתאימים ל-DAPI (עירור: 335-383 ננומטר, פליטה: 420-470 ננומטר) והדמיית שדה בהיר, השג תמונת פלואורסצנטיות מרוצפת בהגדלה של פי 5x-10x על פני כל השקופית, מה שמבטיח שהסמנים הפידוציאליים (שנוצרו בשלב 1.5) נלכדים.
הערה: הגדלה פי 5 מספיקה בדרך כלל, במיוחד כאשר יש צורך לצלם שקופיות רבות. כדי לפתור מורפולוגיה תאית עדינה יותר, ניתן להשתמש ביעדים פי 10 או פי 20 במחיר של זמן הדמיה ארוך יותר פי ארבעה והגדלת גודל הקבצים. - תפר את התמונה המרוצפת באמצעות תוכנת מיקרוסקופיה, כגון ZEN (Zeiss). תפירה מדויקת היא קריטית, מכיוון שכל שגיאה בשלב זה תתפשט לשלב הרישום הסופי, וכתוצאה מכך מיקוד לא מדויק. כדי לבדוק, ודא שאריחים סמוכים אנכית אינם מתקזזים. בנוסף, שקול לרכוש תמונות באריחים עם חפיפה גדולה של אריחים (20%-30%).
- עבדו וייצאו כל תמונה כקובץ bigTIFF בתוכנת המיקרוסקופיה. אם האזור המוצג בתמונה קטן יחסית וגודל התמונה הסופי קטן מ- 2 GB, השתמשו במקום זאת בתבנית קובץ TIFF רגילה.
4. יישום מטריקס
הערה: יישום מטריצת MALDI עקבי ונכון הוא קריטי להשגת נתונים איכותיים של תא בודד. בעוד שסובלימציה באמצעות מכשיר מסחרי משמשת כאן, ניתן לבצע יישום מטריצה גם באמצעות מרסס רובוטי12, מברשת אוויר21 או מכשיר סובלימציה ביתי22. מצאנו שתכשירים חד-תאיים דורשים פחות מטריצה מאשר קטעי רקמה דקים המשמשים בדרך כלל להדמיית ספקטרומטריית מסה. כדי להפחית את השפעות האצווה, מומלץ ליישם את המטריצה על כל השקופיות הנחקרות במהלך מפגש אחד ולהפקיד תאים מקבוצות שונות (למשל, אזור מוח או טיפול לעומת ביקורת) על אותה שקופית במידת האפשר. בחירת מטריצה היא חיונית הן עבור זרימות עבודה מסורתיות של MALDI והן עבור MALDI-2 חד-תאיים. עבור MALDI חד-תאיים, נעשה שימוש מוצלח ב-DHB23, 9-AA24 ו-CHCA25 . ב-MALDI-2, אנו ואחרים ראינו שיפור משמעותי באות עם DHAP9, בעוד שמטריצות כמו NEDC16 ו-CHCA26 יושמו גם הן ביעילות.
- יש להמיס 20 מ"ג של 2,5-דיהידרוקסיאצטופנון (DHAP) ב-1.5 מ"ל אצטון. הנח שקופיות במחזיק תא הסובלימציה והנח אותן במנגנון הסובלימציה.
- הניחו את תמיסת המטריצה המומסת על פרוסת הקרמיקה ואפשרו לאצטון להתאדות. סגור את תא הסובלימציה כדי לאטום אותו.
- מלאו את תא נוזל הקירור ברפש מי קרח והניחו אותו על גבי החדר.
- הפעל את הוואקום ואפשר למערכת להתאזן למשך 5 דקות. הלחץ במערכת צריך להיות פחות מ -40 מבר.
- התחל סובלימציה על ידי חימום החדר ל -200 מעלות צלזיוס למשך 5 דקות.
- הסר את אמבט מי הקרח, העלה את הטמפרטורה ל-25 מעלות צלזיוס והנח גוף קירור על גבי החדר. אפשר למערכת להתחמם לטמפרטורת החדר למשך 5 דקות כדי למנוע עיבוי.
הערה: ניתן לרוקן את המיכל המכיל את אמבט מי הקרח ולמלא אותו במים חמים כדי לשמש כגוף הקירור. - אוורור לאט את המערכת, פתח את החדר והסר את השקופיות.
5. תא יחיד MALDI MS
הערה: נתוני MS של תא יחיד מתקבלים במכשיר MALDI-2 timsTOF (timsTOF flex) באמצעות חבילת microMS בקוד פתוח כדי לזהות תאים ולהנחות את ספקטרומטר המסה. זה דורש שמיקומי הפיקסלים של התמונה האופטית של התאים הממוקדים יתורגמו לקואורדינטות הפיזיקליות של שלב ספקטרומטר המסה.
- פתח את microMS והשמיד את תמונות המיקרוסקופיה bigTIFF באמצעות האפשרות Image Group, מכיוון שיש גם ערוצי שדה בהיר וגם ערוצי פלואורסצנטיות.
- באמצעות הכלי Blob Options, זהה את הפרמטרים האופטימליים לבחירה עבור התאים הממוקדים. התאם את הפרמטרים הבאים: גודל הכתמים המרבי והמינימלי כדי לבחור כמה קטן או גדול של כתמים למצוא; הגדרת הסף, הקובעת כיצד לסף את ערוץ הקרינה לזיהוי כתמים; והמעגליות, שקובעת עד כמה התאים המזוהים צריכים להיות מעגליים לשיקול. עבור הנתונים המוצגים כאן, השתמשנו בערכי הפרמטרים הבאים: מעגליות מקסימלית: ללא; מעגליות מינימלית: 0.6; סף: 75; גודל מינימלי: 20; גודל מקסימלי: אין.
- השתמש באפשרות חיפוש Blob כדי למצוא Blobs ובחלון המוקפץ כדי לשמור את רשימת ה- Blob תחת שם רצוי.
- השתמש בכלי המסנן מרחק כדי לבחור מרחק ספציפי שכל תא צריך להיות רחוק זה מזה (עבור נתונים אלה, באמצעות מיקרוסקופ פלואורסצנטי פי 5, השתמשנו במסנן מרחק של 35 פיקסלים). זאת כדי להבטיח שהתאים רחוקים מספיק זה מזה כדי לבצע ניתוח של תא בודד. מספר זה הוא ביחידות פיקסלים, אז דע את המרת הפיקסל למיקרומטר עבור המיקרוסקופ כדי לקבוע את המספר האידיאלי. השתמש בגודל קוטר בדיקת הלייזר בתוספת בסביבות 20-30 מיקרומטר כדי להסביר שגיאות ברישום.
- טען את השקופיות לתוך המכשיר באמצעות MTP Slide Adapter II. חזור למחשב עם microMS, ובאמצעות יישום שולחן עבודה מרוחק, גש למחשב ספקטרומטר המסה.
- אם זו הפעם הראשונה שנעשה שימוש במכשיר, ודא את מיקום ה-XY של המכשיר. לשם כך, עבור אל כלים והגדרות מכשירים. החלון המוקפץ יציג קבוצה של קואורדינטות עם מיקומי X ו-Y שלהן. בחר כל אחת מהנקודות הספציפיות הללו בגיאומטריית Slide Adapter II במכשיר ועדכן את מיקומי X ו-Y בחלון ה-microMS.
- באמצעות פקדי המצלמה והבמה של ספקטרומטר המסה, נווט למיקום הניתן לזיהוי בקלות בשקופית והעתק את קואורדינטות המכשיר. ב-microMS, מצא את המיקום המתאים בתמונת המיקרוסקופ, לחץ באמצעות לחצן העכבר הימני על מיקום זה והקלד את הקואורדינטות במיקום הטקסט בחלון המוקפץ. עיגול כל הקואורדינטות למספר השלם הקרוב ביותר, והפרדת קואורדינטות X ו-Y עם רווח (כלומר, 39595 -23232).
- חזור על שלב 5.7. כדי לרשום לפחות 12 סמני אמון לאורך כל השקף. לאחר הוספת שלוש נקודות רישום, אחד העיגולים יהפוך לאדום, מה שמצביע על כך שהוא הכי רחוק מההרשמה. אם זה קורה, מחק את נקודת הרישום הנוכחית באמצעות shift + לחיצה ימנית ונסה שוב.
- תחת קובץ, עבור אל שמור ולאחר מכן אל רישום כדי לשמור את קובץ הרישום ( .msreg).
- כאשר הכתמים מוצגים בשקופית, שמור את קובץ מיקום המכשיר ( .xeo) על-ידי מעבר אל קובץ, לאחר מכן שמור ולאחר מכן מיקומי מכשירים. באמצעות תוכנת שולחן עבודה מרוחק, העבר קובץ .xeo זה למחשב המכשיר.
- העתק את הטקסט מקובץ ה-.xeo המותאם אישית שנוצר לקובץ ה-.xeo של MTP Slide Adapter II במכשיר ושמור אותו. פעולה זו תעדכן קובץ גיאומטריה זה במיקומי התאים.
- לחץ על הכרטיסיה אוטומציה ובחר חדש... כדי להתחיל הפעלה אוטומטית. גרור על-פני אזור הדגימה המוצג כדי לבחור את התאים ולחץ באמצעות לחצן העכבר הימני כדי להוסיף אותם לרשימת הניתוח. שמור את הפעלת האוטומציה ולחץ על התחל הפעלה אוטומטית כדי להתחיל ברכישה. אורך הריצה תלוי במגוון גורמים, כולל מספר התאים, זריקות לייזר ותדירות הלייזר, אך באופן כללי, ניתן לנתח בערך 5-10 תאים במצב MALDI (קצב חזרות לייזר של 10 קילו-הרץ), וניתן לנתח 1-5 תאים במצב MALDI-2 (קצב חזרת לייזר של 1k הרץ) בכל שנייה.
6. עיבוד נתונים
הערה: חבילות תוכנה מסחריות קיימות אינן מתאימות היטב לניתוח נתוני ספקטרומטריית מסה של תא יחיד בתפוקה גבוהה. בעוד שניתן להמחיש ספקטרום אינדיבידואלי, חילוץ תובנות ביולוגיות משמעותיות דורש כלים מיוחדים. כדי לטפל בכך, אנו מספקים תוכנה זמינה בחינם המאפשרת ניתוח נתוני MALDI-2 MS חד-תאיים. זרימת העבודה המעודכנת שלנו מאפשרת המרה ישירה של נתוני תא בודד לפורמט imzML בקוד פתוח27, מה שמאפשר תאימות עם SCiLS MVS ותוכנות ספקים אחרות. לניתוח נתונים מתקדם יותר, הסקריפט המלא כולל גם פונקציונליות להערות שומנים, אשכולות וכלי הדמיה אחרים המופעלים על ידי Matplotlib (גרסה 3.7.3). ניתוח וקריאה של הנתונים הגולמיים מתאפשרים על ידי ספריית pyTDFSDK, קבוצה של פונקציות הכלולות בזרימת העבודה TIMSCONVERT28.
- אתחל את SC_MALDI2_Analysis ספריית Python המותאמת אישית על ידי העתקת הקובץ המסופק בקובץ משלים 1 לאותו נתיב עבודה כמו Jupyter Notebook ולאחר מכן הקש Shift + Enter במקלדת בתא הקוד הראשון. זה יאפשר לנו לקרוא לפונקציות אלה מאוחר יותר ולהשתמש בהן כדי לעבד את הנתונים.
- העתק את הנתיב לנתונים שנאספו (קבצי Bruker .d). אנו ממליצים לתת שמות לתיקיות ולשמות של כל קובץ באופן תיאורי כך שנוכל לנתח את נתיבי הקבצים הללו מאוחר יותר כדי ליצור מטא נתונים עבור כל דגימה. הפעל את ייבוא קבצי ה-.d של Bruker ושמור בתא קוד רשימה. פעולה זו תוציא את המספר הכולל של קבצי .d שנטענו.
- הפעל את תא הקוד שכותרתו עיבוד הנתונים הגולמיים ושמירה ב-imzML. פעולה זו תקרא כל קובץ Bruker .d שסופק, תבצע איסוף שיא של הנתונים, ולאחר מכן תשמור 20 עמודים לדקה של נתונים סביב כל שיא בקובץ .imzML שנכתב בתוך קובץ ה-.d.
- כדי למצוא את הנתונים השמורים, פתח את המיקום של קובץ ה- .d הראשון וה- imzML ומטא נתונים אחרים יישמרו בנתיב זה. בשלב זה, ניתן לייבא את קובץ ה-imzML שנשמר לתוכנת ספק, כגון SCiLS Lab MVS. לניתוח נתונים מתקדם יותר, המשך לעקוב אחר קובץ ה- Script.
- טען את נתוני imzML השמורים על ידי הפעלת הטעינה בתא קוד הקובץ imzML שנשמר בעבר. פעולה זו טוענת את הנתונים השמורים לנתוני המשתנה.
- הפעל את תא מטריצת ה-Binning של הנתונים ושמירת הנתונים כדי לאחסן את כל הנתונים לאורך ציר m/z משותף, להסיר תכונות הקיימות בשפע נמוך (<0.1%), ולהסיר ערכים נמוכים מרעש (100 עוצמה יחסית). לאחר מכן, פונקציה זו מחדשת את הנתונים על ידי חישוב ממוצע של כל ערך שיא m/z בתוך כל סל. מטריצת הנתונים המתקבלת נשמרת כ-datacube_array, סלי ה-m/z המשויכים למטריצה נשמרים valid_mz_bins, וספירה של כל סל נשמרת כספינה.
- כדי להוסיף ביאורים לנתונים, הפעל את תא הביאור שיאי ייצוא עבור LIPID MAPS . פעולה זו תעתיק את כל שיאי ה- m/z בתוך מטריצת הנתונים שלך ללוח שלך. הדבק את זה בקובץ טקסט ריק ושמור אותו כדי להעלות אותו במפות LIPID.
- פתח את lipidmaps.org ולאחר מכן בחר MS Data Bulk Search ו-Search LMSD כדי לחפש מיני ליפידים רלוונטיים מבחינה ביולוגית. העלה את רשימת השיא על ידי בחירת קובץ הטקסט ובחר את התוספות המתאימות (למשל, [M+H]+, [M+Na]+ ו-[M+K]+). בחר את סובלנות המסה המתאימה לספקטרומטר המסה שלך (בחרנו +/- 0.01 m/z), בחר את כל מחלקות השומנים המעניינות ולחץ על חיפוש. הורד את קובץ ה- .tsv.
- טען את המטא נתונים של הספקטרום על ידי הפעלת הטעינה בנתיבי התא הבודד עבור תאי מטא נתונים . שנה את הקוד המפוצל כאן בהתבסס על מבני נתיב הקובץ.
- עבד מראש את הנתונים על ידי הפעלת התא עיבוד מקדים של נתונים וביאור שומנים . פעולה זו תשתמש בקובץ lipidMAPS tsv כדי להוסיף הערות למערך הנתונים לשגיאה של 10 עמודים לדקה, לחסל שומני שרשרת מוזרים מתוצאות lipidMAPS, לנרמל את הנתונים הנותרים ולהסיר תכונות או תאים שאינם עוברים סף ספציפי. פעולה זו תשמור את מערך הנתונים המעובד החדש כנתונים2 ואת המטא נתונים המעודכנים של הספקטרום updated_cell_types.
- ניתוח הנתונים מתבצע על ידי scanpy. הפעל את UMAP וניתוח אשכולות עבור תא תאים בודדים כדי לבחור נתונים מעניינים (כאן בחרנו רק נתונים של MALDI-2, M2), קנה מידה של מערך הנתונים וטען אותו לאובייקט AnnData סריקתי לניתוחים קלים.
הערה: כאן, אשכולות ליידן והפחתת מימדים (UMAP) בוצעו על מערך הנתונים, הן מחלקות הנתונים המקוריות והן האשכולות ב-UMAP הודגמו, וכמה מהתכונות המובהקות ביותר מבחינה סטטיסטית מבין האשכולות סוכמו באמצעות פונקציית rank_genes_groups_dotplot מ-scanpy.
תוצאות
סקירה כללית של זרימת העבודה עבור MALDI-2 MS חד-תא מונחה פלואורסצנטי מוצגת באיור 1. ראשית, הרקמה שנותחה מאזורי מוח ממוקדים (איור 1A) מפורקת לתאים בודדים ומופקדת על שקופיות מיקרוסקופיה מוליכות מצופות ITO (איור 1B). מיקומי התאים נקבעים על ידי הדמיה פלואורסצנטית של שקופית שלמה (איור 1C), ואחריה יישום מטריצת MALDI (איור 1D), ניתוח MALDI-2 MS בסיוע microMS (איור 1E) וניתוח נתונים (איור 1F). באמצעות זרימת עבודה זו, ניתן לזהות כביכול עשרות עד מאות ליפידים בתוך תאים בודדים עם דיוק מסה של פחות מ-10 ppm (באמצעות MALDI-2 timsTOF).
ניתן לבצע הדמיית ספקטרומטריית מסה באזור עניין קטן כדי להעריך את איכות הכנת התא ויישום המטריצה. תוצאה מייצגת של הדמיית MALDI-2 של תאים מפוזרים מוצגת באיור 2A. מתמונה זו, המשתמש יכול להעריך את מידת התפשטות האנליט על ידי השוואה לפוטומיקרוגרף של אותו אזור. בהתבסס על כמות ההתפשטות, האנליסט יכול להתאים את גודל גודל שדה קרן הלייזר ואת מסנן המרחק כדי להבטיח רכישות אמיתיות של תא בודד. ב-MSI של תא יחיד, גודל לייזר קטן ורוחב רסטר ישמשו להשגת רזולוציה תאית (1-5 מיקרומטר), בעוד שגודל לייזר גדול יותר יכול לשמש עבור microMS, מה שמגדיל את עוצמת האות ומספר השומנים הניתנים לזיהוי ביחס להדמיה. תוצאות מייצגות של שיפור האות שהושגו עם MALDI-2 מוצגות באיור 2B. שיפור של מיני כולסטרול, PE ו-PC נצפה בהסכמה עם ספרות קודמת14. בדרך כלל, אנו משיגים את שיפור האות הטוב ביותר של MALDI-2 בעת שימוש בעוצמת לייזר גבוהה יחסית (>50%) ומספר קטן יותר של יריות (בסביבות 10 עד 200). יש צורך באופטימיזציה מסוימת, מכיוון שעוצמת לייזר נמוכה מדי לא תספק שיפור, בעוד שיותר מדי אנרגיית לייזר תגרום לפיצול אנליטי מוגזם29. עבור ניתוח תא בודד, רישום מרחבי הוא צעד קריטי להבטחת מיקוד מדויק של תאים בודדים. כדי לאמת את הרישום, ניתן ליצור קבוצה קטנה של נקודות בדיקה (~5) סביב השקופית על ידי יצירת כתמים בנקודות ידועות וייצוא קואורדינטות המכשיר באמצעות microMS. אימות שנקודות הבדיקה הללו ממקמות נכון את שלב המכשיר כאשר הוא נבחר מבטיח שמיקוד התאים הבא יהיה מדויק.
MALDI MS מאפשר אפיון הטרוגניות תאית הן בין אזורי מוח בודדים והן בתוך אזורים בודדים במוח (איור 3). על ידי ניתוח וריאציות בפרופילי השומנים, טכניקות הפחתת מימדים מפרידות ביעילות תאים לאשכולות נפרדים, ומדגישות את מגוון הרכבי השומנים על פני מערך הנתונים (איור 3A). יתר על כן, היישום של שיטות אשכולות, כמו למשל אשכולות ליידן, מראה נוכחות של תת-אוכלוסיות ייחודיות של תאים בתוך אזורים מסוימים במוח, כולל הסטריאטום וקליפת המוח (איור 3B). נוסף על כך, על ידי השוואת פרופילי השומנים של כל אשכול זה לזה (איור 3C), ליפידים ספציפיים יכולים לשמש כסמנים להגדרת זהויות ספציפיות לאשכול. מספר מיני ליפידים מווסתים באופן משמעותי למעלה או למטה באשכולות ספציפיים, מה שמרמז על תפקידים או מצבים פונקציונליים מובחנים, בעוד שאחרים משותפים בין אשכולות אך משתנים בעוצמת האות היחסית שלהם. כדי להבטיח ניתוח נתונים חזק במורד הזרם, חיוני להשיג זיהוי שומנים אמין ברוב התאים ולהעריך את השפעות האצווה הפוטנציאליות. איור 3D מציג ספקטרום מייצג משישה תאים קליפת המוח המפוזרים על פני שקופיות נפרדות מצופות ITO. בעוד שפרופילי שומנים בודדים מציגים הטרוגניות, שומנים מזוהים באופן עקבי בכל הרכישות. איור 3E מציג UMAP של תאים בקליפת המוח משקופיות שונות, שהוכנו ונותחו בתנאים זהים. החפיפה המשמעותית של תאים בין שקופיות מצביעה על כך שהשפעות אצווה אינן מבלבלות באופן משמעותי את הפרשנויות הביולוגיות. במידת הצורך, ניתן ליישם אלגוריתמים לתיקון אצווה כגון ComBat30 כדי להפחית את כל ההשפעות השיוריות. לסיכום, MALDI-2 חד-תאית היא טכניקה מתקדמת לזיהוי סמנים ביולוגיים של שומנים, המציעה תובנות קריטיות לגבי תת-אוכלוסיות תאיות ומשפרת את ההבנה שלנו לגבי מגוון אזורי ותפקודי במוח.
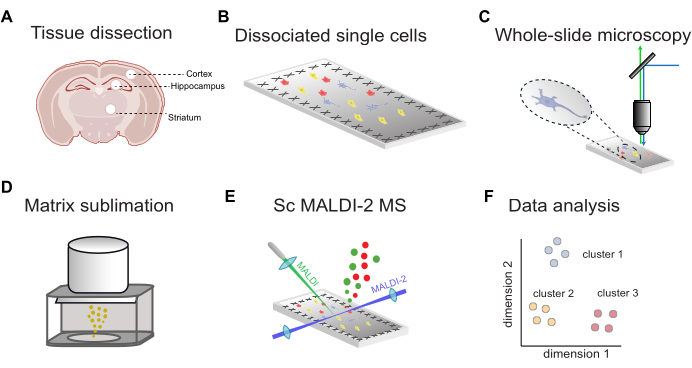
איור 1: זרימת עבודה כללית עבור scMALDI-2 MS. (A) דיסקציה ידנית של רקמות ובידוד של אזורי מוח. (B) דיסוציאציה פפאין של רקמה לתאים בודדים ותצהיר תאים על גבי שקופיות מוליכות מצופות ITO. (C) מיקרוסקופ פלואורסצנטי של שקופית שלמה באמצעות צביעה גרעינית (DAPI/Hoechst). (D) סובלימציה של מטריצת MALDI (DHAP) על גבי שקופיות לדוגמה. (E) מדידות MALDI-2 MS חד-תאיות מונחות תמונה. (ו) ניתוח נתונים מקיף, כולל הפחתת מימדיות, אשכולות וניתוח סטטיסטי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
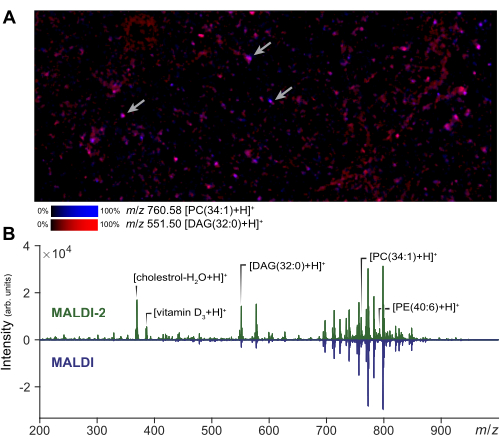
איור 2: אופטימיזציה והדמיה של MALDI-2 MS לניתוח תאים בודדים. (A) הדמיית MALDI-2 MSI של אוכלוסיות מפוזרות של תאים ראשוניים. החצים מציינים כמה תאים בודדים. ביצוע MSI ואזור קטן מאפשר לאנליסט לייעל את פרמטרי השיטה ולהעריך את איכות המדגם. (B) השוואה בין תוצאות שהושגו באמצעות רכישות MALDI-2 ו-MALDI MS. שיפור האות (MALDI 2 לעומת MALDI) של ליפידים שונים, כולל כולסטרול, DAG (דיאצילגליצרולין), PC (פוספטידילכולין) ו-PE (פוספטידיל-אתנולמין), מדגיש על ידי הצגת ספקטרום MALDI-2 (למעלה) וספקטרום MALDI (למטה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
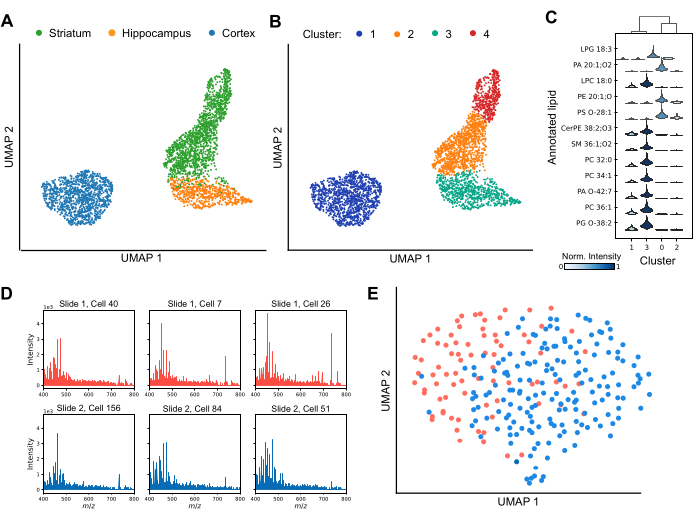
איור 3: פרופיל שומנים של תא בודד בתוך שלושה אזורי מוח של מכרסמים על ידי MALDI-2 MS. (A) ניתוח קירוב והקרנה אחידים של סעפת (UMAP) של התאים המנותחים שנצבעו לפי אזור המוצא במוח. (B) ניתוח UMAP של אותם תאים אחרי שעברו אשכולות ליידן, כאשר אשכולות מתאימים לתת-אוכלוסיות של תאים עם הרכבי שומנים דומים. הצבעים כאן מציגים אשכולות נתונים שונים של ליידן. (C) תרשים כינור שמראה את ההבדל בהתפלגות העוצמה של שומנים שונים בין אשכולות. (D) ספקטרום משישה תאים קליפת המוח המייצגים נותחו משתי שקופיות נפרדות. (E) ניתוח UMAP של תאים בקליפת המוח שנותחו משתי שקופיות נפרדות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תיק משלים 1: SC-MALDI2_Analysis.py. קובץ זה מכיל קבוצה של פונקציות שפותחו לעיבוד נתוני ספקטרומטריית מסה של תא יחיד MALDI-2. הוא כולל שיטות לקריאת נתוני ספקטרומטריית מסה גולמיים, ביצוע binning וביצוע הערות וניתוחים במורד הזרם. קבוצת התאים לטעינה וביצוע כל העיבוד המקדים והניתוחים של הנתונים מסופקת בקובץ משלים 2. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 2: JOVE Analysis.ipynb. קובץ זה מכיל מחברת Jupyter המכילה קבוצה של תאים לטעינה בפונקציות Python המותאמות אישית מ-SC-MALDI2_Analysis.py ולבצע את כל העיבוד המקדים והניתוחים של הנתונים שהוזכרו. אנא לחץ כאן להורדת קובץ זה.
Discussion
MALDI MS חד-תא מונחה תמונה בעל תפוקה גבוהה הוא כלי רב ערך להבנת הטרוגניות כימית בקנה מידה של תא בודד. התוספת של פוסט-יינון המושרה על ידי לייזר (MALDI-2) מספקת כיסוי אנליטי עמוק יותר, שהוא קריטי לדגימות מוגבלות במסה ובנפח כגון תאי יונקים מבודדים.
בעוד שהרוב המכריע של תהליכי העבודה של ליפידים ומטבוליטים של תאים בודדים שפורסמו משתמשים בתאים מתורבתים, הגישה שלנו מיושמת על תאים ראשוניים מבודדים במהירות יחסית. הבחנה זו היא קריטית, שכן תאים מתורבתים מראים שינוי ניכר בתכולת המטבוליטים והשומנים שלהם תוך ימים ספורים בלבד של תרבית23,31. בידוד תאים אנזימטי, ברוב המקרים, מוביל לאובדן מבנים תאיים עדינים כגון אקסונים, דנדריטים ותהליכים אסטרוציטיים. לכן, אותות האנליטים הנצפים מתקבלים בעיקר מסומת התא. למרות זאת, סיווג מוצלח לפי סוג תא4 ואזור מוח מושג12. זה מצביע על כך שרבים מהליפידים הייחודיים לתאים מובחנים ממוקמים בסומה.
להבדלים קטנים בשיטת היישום של מטריצת MALDI יכולות להיות השפעות עמוקות על אות האנליט שנוצר. הצגנו זרימת עבודה המבוססת על סובלימציה של מטריצה הניתנת לשחזור עם מכשיר מסחרי, המייצר שכבת מטריצה הומוגנית, אות לרעש גבוה והתפשטות אנליטית מוגבלת. עם זאת, ניתן להשתמש ביישום מטריצה באמצעות מרסס רובוטי או מברשת אוויר של אמן, בין היתר. ללא קשר לגישה, יש ליישם צפיפות מטריצה נמוכה יותר על תכשירים חד-תאיים בהשוואה לזו המשמשת ב-MSI רקמות סטנדרטיות על מנת להשיג את יחס המטריצה לאנליט האופטי. צפיפות המטריצה המיושמת כאן היא כמחצית מזו המשמשת ל-MSI רקמות. כמובן, זה מרמז שכמות המטריצה לתא גבוהה יותר מאשר ב-MSI, מה שעוזר לתרום למיצוי וזיהוי האנליטים המשופרים בגישת התא המבודד המשמשת כאן.
עבור דגימות הדורשות אופטימיזציה משמעותית, ביצוע MSI על החזר ROI קטן של דיסוציאטים של תאים בודדים, כפי שמודגם באיור 2A, יכול להתבצע כחלק מתהליך האופטימיזציה. שלב זה יכול גם לאפשר לאנליסט להעריך את מידת התפשטות האנליט בגישות יישום מטריצה מבוססות ממס.
MALDI מונחה תמונה מוצלח של תאים בודדים דורש תמונות פלואורסצנטיות באיכות גבוהה, יישום מטריצה הניתן לשחזור ובקרת במה מדויקת. ניסויים אלה תובעניים יותר מתהליכי עבודה סטנדרטיים של MSI, הסובלים שגיאות רישום קלות ושונות בתנאי המטריצה והדגימה עקב אזורי הדמיה גדולים יותר וספירת אנליטים גבוהה יותר. למרות האתגרים הללו, התמקדנו בהצלחה באברונים בודדים באמצעות MALDI מסורתי.
תפירה מדויקת של תמונות פלואורסצנטיות מרוצפות היא חיונית, מכיוון ששגיאות קטנות עלולות להחמיר ולהשפיע על בקרת השלב, מה שהופך את דיוק הרישום לקריטי. השפעות אצווה מהוות גם אתגר גדול, עם וריאציות אות שנצפו על פני אותה שקופית, בין שקופיות ובין הכנות. אסטרטגיות נורמליזציה נכונות, כולל שימוש בתקנים פנימיים ונורמליזציה בין-רבעונית, עוזרות להפחית את הבעיות הללו. בנוסף, ניתן להשתמש באלגוריתמים לתיקון אצווה כגון ComBat30 כדי להפחית את השונות הטכנית ולשפר את ההבדלים הביולוגיים האמיתיים.
השגת הערות מולקולריות בטוחות מתאים בודדים נותרה אתגר. לעתים קרובות, כמות החומר ורגישות הגילוי אינן מספיקות עבור טרשת נפוצה טנדם מכל המינים מלבד הנפוצים ביותר. עבור אלה שאינם ניתנים לזיהוי מספיק עבור טרשת נפוצה טנדם ישירות מתאים בודדים, ניתן ליישם גישות חלופיות ליצירת ספריית אנליטים. לדוגמה, ניתן לקבל נתוני טרשת נפוצה טנדם על רקמות מקריסקציות דקות מאותו אזור במוח ומבעלי חיים המשמשים ליצירת אוכלוסיות תאיות. ניתן להשתמש גם במיצוי שומנים מרקמה ואחריו LC-MS. ככל שאסטרטגיות הכנת הדגימות וטכנולוגיית הטרשת הנפוצה ממשיכות להשתפר, ניתן לקבל יותר ויותר מידע מבני רלוונטי ישירות מתאים בודדים. בעתיד, אנו צופים שזרימת עבודה זו תורחב להשגת נתוני טרשת נפוצה טנדם מתאים בודדים, מה שיבטל את הצורך בניסויי LC-MS/MS נלווים. אנו צופים עוד כי ניתן להרחיב גישה זו לדגימות רבות בקנה מידה מיקרו בביולוגיה ומחוצה לה, כולל סוגי תאים ייחודיים, אברונים של יונקים, אבקות ומיקרופלסטיק.
Disclosures
למחברים אין אינטרסים מתחרים לחשוף.
Acknowledgements
S.W.C מכיר בתמיכה הניתנת על ידי מלגת הדוקטורט Peixin He ו-Xiaoming Chen ומלגת מענק הבלוק של אוניברסיטת אילינוי. עבודה זו נתמכה גם על-ידי המכון הלאומי לשימוש בסמים תחת פרס מס'. P30DA018310, המכון הלאומי להזדקנות תחת פרס מס. R01AG078797, ועל ידי משרד המנהל, של המכונים הלאומיים לבריאות תחת פרס מספר S10OD032242.
Materials
| Name | Company | Catalog Number | Comments |
| 2',5'-dihydroxyacetophenone | Sigma Aldrich | D107603 | DHAP, 97% purity |
| Ammonium acetate | Sigma Aldrich | 238074 | ACS reagent, ≥97% |
| Axio M2 Imager | Zeiss | N/A | N/A |
| Biopsy punch, 2 mm | Fisher Scientific | 12-460-399 | integra miltex standard biopsy punch, 2mm |
| Calcium chloride | Sigma Aldrich | C4901 | anhydrous, powder ≥97% |
| Eppendorf Centrifuge | Sigma Aldrich | EP5405000441 | centrifuge 5425 with rotor FA-24x2 |
| Gentamicin | Sigma Aldrich | G1272 | liquid, BioReagent |
| Glass etching pen | Sigma Aldrich | Z225568 | carbide time, pkg of 1 |
| Glycerol | Sigma Aldrich | G7893 | ACS reagent, ≥99.5% |
| HEPES buffer | Sigma Aldrich | H3375 | ≥99.5% (titration) |
| Hoechst 33258 Solution | Sigma Aldrich | 94403 | 1 mg/mL in H2O, ≥98.0% (HPLC) |
| In line HEPA Filter | Sigma Aldrich | WHA67225001 | VACU-GUARD 60 mm disc, 0.45 PFTE housing |
| ITO-Coated Microscopy Slides | Delta Technologies | CG-90IN-S115 | 70-100Ω resistance |
| Magnesium chloride | Sigma Aldrich | M8266 | anhydrous, ≥98% |
| Magnesium sulfate | Sigma Aldrich | 208094 | anhydrous, ≥97% |
| Microcentrifuge tubes | Sigma Aldrich | HS4323K | tube capacity 1.5 mL, pack of 500 |
| Papain dissociation system | Worthington Biochemical | LK003150 | one box, 5 single use vials |
| Penicillin-Streptomycin | Sigma Aldrich | P4458 | liquid, BioReagent |
| Potassium chloride | Sigma Aldrich | 529552 | Molecular biology grade |
| Potassium phosphate monobasic | Sigma Aldrich | P5379 | Reagent Plus |
| Sodium biocarbonate | Sigma Aldrich | S6014 | ACS reagent, ≥99.7% |
| Sodium chloride | Sigma Aldrich | S9888 | ACS reagent, ≥99% |
| Sodium hydroxide | Sigma Aldrich | 221465 | ACS reagent, ≥97%, pellets |
| Sodium phosphate dibasic | Sigma Aldrich | S9763 | ACS reagent, ≥99% |
| Sublimate | HTX | N/A | N/A |
| timsTOF FleX MALDI-2 | Bruker | N/A | microGRID enabled |
| Vacuum tubing | Thermo Scientific | 8701-0080 | Nalgene Non-phthalate PVC Tubing |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved