Method Article
Создание мышиной модели с гиперчувствительностью к кашлю путем вдыхания лимонной кислоты
В этой статье
Резюме
Этот протокол описывает разработку мышиной модели с гиперчувствительностью к кашлю, которая может служить идеальной моделью для изучения механизмов хронического кашля.
Аннотация
Кашель является одним из наиболее распространенных симптомов многих респираторных заболеваний. Хронический кашель существенно влияет на качество жизни и налагает значительное экономическое бремя. Повышенная чувствительность к кашлю является патофизиологическим признаком хронического кашля. Было замечено, что гиперчувствительность к кашлю связана с воспалением дыхательных путей, ремоделированием сенсорных нервов дыхательных путей и изменениями в центральной нервной системе. Тем не менее, точные молекулярные механизмы остаются неясными и требуют дальнейшего разъяснения с использованием подходящих животных моделей. В предыдущих исследованиях в качестве моделей для изучения кашля использовались морские свинки, но эти модели имеют ряд экспериментальных ограничений, включая высокую стоимость, отсутствие трансгенных инструментов и нехватку коммерческих реагентов. Кроме того, морские свинки обычно демонстрируют плохую переносимость окружающей среды и высокую смертность при воздействии раздражителей. В отличие от них, мыши меньше, проще в уходе, более экономичны и поддаются генетическим манипуляциям, что делает их более подходящими для механистических исследований. В этом исследовании мы создали мышиную модель с гиперчувствительностью к кашлю за счет непрерывного вдыхания лимонной кислоты (КА). Эта модель проста в использовании и дает воспроизводимые результаты, что делает ее ценным инструментом для дальнейших исследований механизмов и потенциальных новых методов лечения хронического кашля.
Введение
Кашель является важнейшим защитным рефлексом, который помогает выводить дыхательные выделения или инородные вещества из дыхательных путей. Тем не менее, это также один из наиболее распространенных симптомов многих респираторных заболеваний, часто побуждающий пациентов обращатьсяза медицинской помощью. Хронический кашель, определяемый как постоянный кашель, продолжающийся более 8 недель у взрослых, значительно влияет на качество жизни, вызывая такие проблемы, как недержание, бессонница, рефлюкс и другие неприятные ощущения, а также значительное экономическое бремя 2,3,4. Широко распространено мнение, что повышенная чувствительность к кашлю является патофизиологическим признаком хронического кашля, при котором низкий уровень термических, механических и химических раздражителей может вызвать кашель. Гиперчувствительность к кашлю связана с воспалением дыхательных путей6, ремоделированием чувствительных нервов дыхательных путей 7 и изменениями в центральной нервной системе8, хотя точные молекулярные механизмы остаются неясными и требуют дальнейшего уточнения с помощью подходящих животных моделей.
Различные животные, в том числе морские свинки, кошки, кролики, собаки и свиньи, использовались для изучения механизмов кашля. Морские свинки традиционно признаны наиболее подходящей моделью для изучения механизмов кашля и эффективности противокашлевых препаратов 9,10,11,12. Тем не менее, эти модели имеют несколько экспериментальных ограничений, в том числе высокую стоимость, нехватку трансгенных инструментов и дефицит коммерческих реагентов. Кроме того, морские свинки часто демонстрируют плохую переносимость окружающей среды и высокую смертность при воздействии раздражителей. В отличие от них, мыши меньше, проще в уходе, более экономичны и поддаются генетическим манипуляциям, что делает их более подходящими для механистических исследований. Предыдущие исследования моделей кашля в основном были сосредоточены на кашле, вызванном воспалением дыхательных путей, в основном используемом для оценки эффективности противокашлевых препаратов и периферических механизмов13,14. В настоящее время не хватает животных моделей гиперчувствительности к кашлю.
В ответ на это мы представляем метод создания мышиной модели гиперчувствительности к кашлю путем непрерывного вдыхания лимонной кислоты (КА). Эта модель проще, легче в построении и более осуществима по сравнению с другими животными моделями.
протокол
Все процедуры экспериментов на животных были одобрены Комитетом по этике лабораторных животных Первой аффилированной больницы Медицинского университета Гуанчжоу (20230656). В данном исследовании использовались взрослые самцы мышей C57BL/6 в возрасте 8-10 недель и массой 20-25 г без специфических патогенов. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Приготовление химических реагентов
- Приготовление раствора лимонной кислоты (ЦА)
- Для оценки кашля приготовьте 0,4 М раствор, растворив 3,84 г порошка лимонной кислоты в обычном физиологическом растворе до конечного объема 50 мл.
- Для лечения животных готовят 0,1 М раствор, растворяя 9,6 г порошка лимонной кислоты в обычном физрастворе до конечного объема 500 мл.
- Приготовление раствора капсаицина
- Растворите 30,5 мг порошка капсаицина в PBS, содержащем 10% этанола и 10% Tween-80, чтобы получить 10 мМ исходный раствор.
- Разведите исходный раствор в соотношении 1:100 в обычном физрастворе до получения рабочего раствора с концентрацией 100 мкм.
- Приготовление раствора метахолина
- Растворите 100 мг порошка метахолина в PBS до конечного объема 2 мл до получения раствора 50 мг/мл.
- Разбавляют этот раствор PBS до получения концентраций 25 мг/мл, 12,5 мг/мл, 6,25 мг/мл и 3,125 мг/мл.
2. Подготовка животных
- Жилищные условия
- Домашние мыши в клетках со свободным доступом к пище и воде, содержании при температуре 22 ± 1 °C со стандартным 12-часовым циклом свет/темнота. Экспериментальные манипуляции проводили через 1 неделю после акклиматизации к кормовой среде.
- Акклиматизация
- Дайте мышам акклиматизироваться к кормовой среде за 1 неделю до проведения экспериментальных манипуляций.
3. Разработка модели
- Групповое назначение
- Случайным образом разделите мышей на модельную группу и контрольную группу, по 8 мышей в каждой группе.
- Настройка экспозиции
- Поместите мышей в две независимые камеры (как показано на рисунке 1), каждая из которых подключена к ультразвуковому небулайзеру.
- Подвергайте модельную группу воздействию аэрозоля 0,1 М лимонной кислоты (СА), а контрольную группу – 0,9% аэрозолю физиологического раствора (NS) со скоростью распыления 3 мл/мин в течение 2 ч в день в течение 2 недель (как показано на рисунке 2). Возвращайте мышей в клетки после каждого воздействия.
- Оценка чувствительности к кашлю
- После последнего контакта оцените чувствительность к кашлю путем оценки рефлекторного кашля (при использовании NS, CA (0,4 M) и капсаицина (100 μM)) и спонтанного кашля (без каких-либо проблем).
ПРИМЕЧАНИЕ: Для мониторинга динамических изменений чувствительности к кашлю во время разработки модели оценивайте чувствительность к кашлю в дни 0, 3, 7 и 10 с помощью провокации CA (0,4 M).
- После последнего контакта оцените чувствительность к кашлю путем оценки рефлекторного кашля (при использовании NS, CA (0,4 M) и капсаицина (100 μM)) и спонтанного кашля (без каких-либо проблем).
4. Оценка чувствительности к кашлю
- Подготовка инструмента
- Используйте неинвазивную систему плетизмографии всего тела (WBP) для измерения чувствительности к кашлю. Подключите камеры, преобразователи потока, смещение потока и другие компоненты в соответствии с инструкцией по применению (см. Таблицу материалов).
- Выполните процесс калибровки, чтобы обеспечить точность измерений, нажав кнопку «Калибровать ». На экране состояния отобразится ход выполнения, и как только строка состояния достигнет 100%, калибровка будет завершена.
- Обнаружение кашля
- Создайте исследование кашля для мышей и настройте параметры на 1 минуту акклиматизации, 10 минут времени ответа и 10 минут доставки химического раствора.
- Поместите находящихся в сознании мышей в отдельные камеры, убедившись, что в каждой камере будет только одна мышь.
ПРИМЕЧАНИЕ: Перед закрытием крышки убедитесь, что мышь полностью находится внутри камеры, чтобы не повредить ее хвост и пальцы. - Добавьте в небулайзер 1 мл химических растворов (NS, CA или капсаицина).
Примечание: Количество кашлевых событий, каждая из которых состоит из трех фаз: вдоха, компрессии и экспульсивной15 (как показано на рисунке 3), будет зарегистрировано после начала исследования. Через 10 минут записи обнаружение кашля будет завершено. Очистите камеру после обнаружения каждого животного, чтобы избежать перекрестного загрязнения.
5. Измерение гиперреактивности дыхательных путей (AHR)
- Подготовка инструмента
- Подготовьте инструменты, как описано в шаге 4.1.
- Измерение AHR
- Создание исследования «доза-реакция» для мышей, настроив типы измерений, параметры и последовательность задач: 1 мин на акклиматизацию, 30 с на доставку раствора метахолина, 3 мин на время реакции и 1 мин на восстановление.
- Поместите находящихся в сознании мышей в отдельные камеры, убедившись, что в каждой камере будет только одна мышь.
- Добавьте 50 μL химических растворов (PBS или метахолина) в небулайзер и начните исследование.
- Запишите значение Пеня, индикатора бронхоконстрикции, в ответ на различные концентрации метахолина (0 мг/мл, 3,125 мг/мл, 6,25 мг/мл, 12,5 мг/мл, 25 мг/мл, 50 мг/мл).
6. Сбор бронхоальвеолярного лаважа
- Жертва
- Умерните мышей с помощью гиперанестезии пентобарбиталом натрия (50 мг/кг) путем внутрибрюшинной инъекции (в соответствии с утвержденными в учреждении протоколами).
- Забор образцов
- Соберите кровь из орбитального синуса мыши в микроцентрифужную пробирку объемом 1,5 мл, затем поместите пробирку на лед. Центрифугируйте кровь при 3000 х г в течение 10 минут при 4°C. С помощью пипетки соберите надосадочную жидкость, выделите ее и храните при температуре -80 °C.
- Соберите жидкость бронхоальвеолярного лаважа (BALF), открыв грудную клетку, чтобы обнажить трахею, введя иглу 22 г в трахею, затем трижды промыв 0,5 мл предварительно охлажденного PBS и собрав жидкость.
- После сбора центрифугируйте BALF при 500 x g в течение 10 минут при 4 °C. Соберите надосадочную жидкость, накройте ее и храните при температуре -80 °C. Повторно суспендируйте гранулу в 100 мкл PBS и подготовьте мазки клеток для дальнейшего анализа.
- Соберите легочные ткани, открыв грудную клетку, чтобы обнажить легкие, удалив легочные ткани и поместив их в криогенные флаконы. Храните флаконы при температуре -80 °C для будущих исследований.
7. Количественная ОТ-ПЦР
- Извлечь общую РНК из легочной ткани с помощью реагента TRIzol. Выполняйте синтез кДНК с помощью набора для синтеза кДНК первой цепи, следуя инструкциям производителя (см. Таблицу материалов).
- Проводите ПЦР в системе количественного обнаружения ПЦР в режиме реального времени с использованием зеленой флуоресценции SYBR. Нормализовать количественную оценку относительной экспрессии мРНК SP и CGRP в соответствии с экспрессией β-актина9.
8. Статистический анализ
- Представьте данные в виде среднего ± SEM. Используйте t-критерий для сравнения данных между двумя группами, считая P < 0,05 статистически значимым. Проводите все статистические анализы с помощью статистического и графического программного обеспечения.
Результаты
Как показано на рисунке 4А, чувствительность к кашлю в модельной группе (группа КА) значительно увеличилась после 1 недели воздействия по сравнению с контрольной группой (группа НС), и эта повышенная чувствительность сохранялась в течение всего периода воздействия. Ни в контрольной, ни в модельной группе мышей не наблюдалось смертности в процессе моделирования (рисунок 4B). Рисунки 4C и 4D показывают, что количество спонтанных случаев кашля значительно увеличилось в модельной группе после контакта. Кроме того, чувствительность к кашлю, вызванная NS (рисунок 4E и рисунок 4F), CA (рисунок 4G и рисунок 4H) и капсаицином (рисунок 4I и рисунок 4J), была значительно выше в модельной группе после периода воздействия.
На рисунках 5A,B у двух групп не было существенной разницы в общем количестве воспалительных клеток и дифференциальном количестве клеток в жидкости бронхоальвеолярного лаважа (BALF). На рисунке 5C, D показаны клетки BALF с окрашиванием H&E. Как показано на рисунке 6, не было существенной разницы в гиперреактивности дыхательных путей между моделью и контрольной группой после моделирования. Кроме того, с помощью QPCR оценивали уровни экспрессии CGRP и SP, нейрогенных медиаторов воспаления, в легочной ткани. Результаты показали значительное увеличение экспрессии SP в модельной группе (рисунок 7A), в то время как существенной разницы в экспрессии CGRP между двумя группами не наблюдалось (рисунок 7B).

Рисунок 1: Экспозиционная камера для модели мыши. Экспонирование изготовлено из акрилового стекла и имеет размеры 36 см x 20 см x 25 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Схема модели мыши с гиперчувствительностью к кашлю. Схематическая иллюстрация создания мышиной модели с гиперчувствительностью к кашлю при вдыхании лимонной кислоты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Репрезентативные изображения кашля. Репрезентативные изображения кашля, записанные с помощью неинвазивной системы плетизмографии всего тела. Кашля состоит из трех фаз: (а) вдоха, (б) компрессионной и (в) экспульсивной. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Оценка кашля на мышиной модели. (А) Приступы кашля, вызванные 0,4 М лимонной кислотой в течение 14-дневного периода воздействия. Чувствительность к кашлю в группе лимонной кислоты (КА) была достоверно выше, чем в контрольной группе после 7 дней воздействия. (B) Кривые выживаемости контрольных и модельных групп в процессе моделирования. (К-Дж) Спонтанные приступы кашля (C,D) и кашля, вызванные нормальным физиологическим раствором (NS) (E,F), лимонной кислотой (G,H) и капсаицином (I,J) до и после моделирования. Данные представлены в виде среднего значения ± SEM, ***P < 0,001 по сравнению с группой NS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
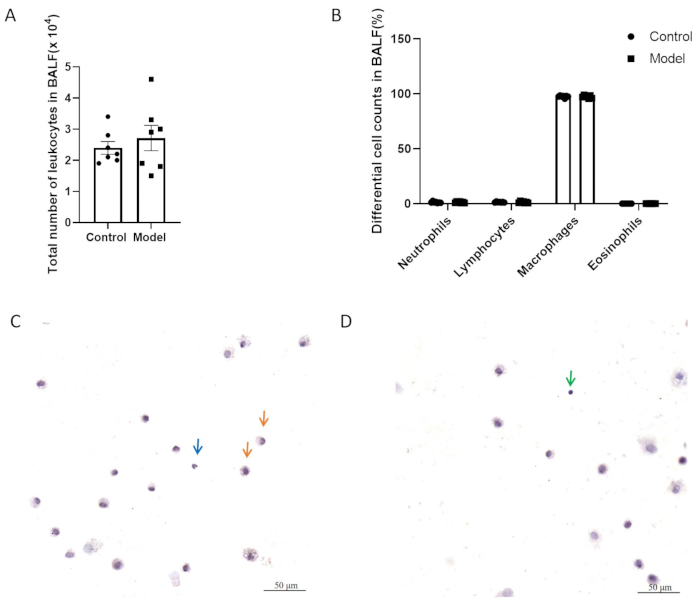
Рисунок 5: Количество лейкоцитов в жидкости бронхоальвеолярного лаважа (BALF). (А) Общее количество лейкоцитов в БАЛФ. (B) Дифференциальное количество клеток в BALF. Данные представлены в виде среднего значения ± SEM. (C, D) Репрезентативные изображения клеток BALF с окрашиванием H&E. Стрелками обозначены макрофаги (оранжевый), нейтрофилы (синий) и лимфоциты (зеленый). Масштабные линейки: 50 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Сопротивление дыхательных путей в группах СА и НС. Сопротивление дыхательных путей в группе лимонной кислоты (СА) по сравнению с группой с нормальным физиологическим раствором (NS). Данные представлены в виде среднего значения ± SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: уровни экспрессии мРНК SP и CGRP в легочной ткани. (A) Относительные уровни экспрессии мРНК вещества P (SP) в легочной ткани. (B) Относительные уровни экспрессии мРНК пептида, связанного с геном кальцитонина (CGRP) в легочной ткани. Данные представлены в виде среднего значения ± SEM, *P < 0,05 по сравнению с группой NS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этом исследовании была успешно создана мышиная модель с гиперчувствительностью к кашлю при непрерывном вдыхании лимонной кислоты (КА). Эта модель продемонстрировала достоверное повышение чувствительности к кашлю как при спонтанном кашле, так и при рефлекторном кашле, вызванном лимонной кислотой и капсаицином. Лимонная кислота и капсаицин широко используются для оценки чувствительности к кашлевому рефлексу16.
Несколько важных этапов в этом протоколе обеспечивают его эффективность. Во-первых, экспозиционная камера, используемая для экспериментов, не должна быть полностью герметичной. Чтобы обеспечить надлежащую вентиляцию, вентиляционные отверстия должны быть расположены в задней части камеры. Во-вторых, важно не допускать переполненности внутри камеры; Ограничение количества мышей до 10-12 предотвращает потенциальную панику. В-третьих, решающее значение имеет постконтактный уход: после каждого контакта мышей необходимо высушивать теплым воздухом, чтобы удалить остатки жидкости с их шерсти.
В то время как морские свинки традиционно используются для изучения механизмов кашля и оценки противокашлевых препаратов, модели мышей имеют ряд преимуществ. В предыдущих исследованиях были разработаны модели гиперчувствительности к кашлю у морских свинок, вызванной воздействием лимонной кислоты. Например, Nakaji et al. подвергали морских свинок воздействию 0,5 М лимонной кислоты в течение 10 минут, три раза в неделю в течение 2 недель (всего восемь контактов)17. Аналогичным образом, в другом исследовании, проведенном Xu et al., была создана модель с повышенной чувствительностью к кашлю путем вдыхания морскими свинками 0,4 М лимонной кислоты в течение 25 дней18. Тем не менее, эти модели морских свинок продемонстрировали менее выраженную чувствительность к кашлю по сравнению с текущей моделью мышей. Кроме того, модели морских свинок сталкиваются с ограничениями, такими как отсутствие трансгенных инструментов и коммерческих реагентов, что препятствует изучению молекулярных механизмов гиперчувствительности к кашлю.
Мыши, с другой стороны, проще в содержании, более экономичны и поддаются генетическим манипуляциям. Предыдущие исследования показали, что мыши также являются эффективными моделями для изучения кашля 15,19,20,21. Кроме того, мыши обычно используются в исследованиях в области нейробиологии, что дает преимущество для изучения центральных механизмов гиперчувствительности к кашлю. Таким образом, мыши считаются более подходящими для механистических исследований хронического кашля.
Несмотря на успешное создание модели, существуют некоторые ограничения, которые следует учитывать. Во-первых, лимонная кислота, хотя и широко используется в пищевой, фармацевтической, химической и металлургическойпромышленности, не очень точно имитирует реальные условия воздействия, которые приводят к гиперчувствительности к кашлю у людей. Во-вторых, точный механизм гиперчувствительности к кашлю в этой модели остается неясным. В то время как воспаление легких считается потенциальным медиатором повышенной чувствительности к кашлю6, оценка общего количества воспалительных клеток и дифференциального количества клеток в жидкости бронхоальвеолярного лаважа (BALF) не показала существенных изменений между двумя группами. Кроме того, гиперреактивность бронхов, известная как триггер хронического кашля24, не показала существенной разницы в сопротивлении дыхательных путей между модельной и контрольной группами после 14 дней воздействия.
В заключение следует отметить, что была создана мышиная модель с гиперчувствительностью к кашлю путем непрерывного вдыхания лимонной кислоты (КА). Эта модель проста в использовании и дает воспроизводимые результаты, что делает ее ценным инструментом для дальнейших исследований механизмов и потенциальных новых методов лечения хронического кашля.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Национальным фондом естественных наук Китая (NSFC 82100034), Проектом планирования науки и технологий в Гуанчжоу (202102010168).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% normal saline | Biosharp | BL158A | |
| Capsaicin | Cayman chemical | 92350 | |
| Citric Acid | Sigma-Aldrich | C2404 | |
| Ethanol | Guangzhou chemical reagent factory | GSHB15-AR-0.5L | |
| First-strand cDNA synthesis kit | TransGen Biotech | AT341 | |
| Methacholine | Sigma-Aldrich | A2251 | |
| Non-invasive whole-body plethysmography (WBP) system | DSI | 601-1400-001 | |
| Pentobarbital sodium | Merk | P3761 | |
| PerfectStart Green qPCR SuperMix | TransGen Biotech | AQ601 | |
| Phosphate Buffered Saline (PBS) | Meilunbio | MA0015 | |
| Real-time quantitative PCR detecting system | Bio-rad | CFX Connect | |
| TRIzol reagent | Invitrogen | 15596026CN | |
| Tween-80 | Solarbio | T8360-100 | |
| Ultrasonic nebulizer | Yuwell | 402AI |
Ссылки
- Morice, A. H. Epidemiology of cough. Pulm Pharmacol Ther. 15 (3), 253-259 (2002).
- Lai, K., Long, L. Current status and future directions of chronic cough in China. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional European survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Mazzone, S. B., Undem, B. J. Vagal afferent innervation of the airways in health and disease. Physiol Rev. 96 (3), 975-1024 (2016).
- Shapiro, C. O., et al. Airway sensory nerve density is increased in chronic cough. Am J Respir Crit Care Med. 203 (3), 348-355 (2021).
- Ando, A., et al. Neural correlates of cough hypersensitivity in humans: Evidence for central sensitization and dysfunctional inhibitory control. Thorax. 71 (4), 323-329 (2016).
- Plevkova, J., et al. Animal models of cough. Respir Physiol Neurobiol. 290, 103656 (2021).
- Smith, J. A., Hilton, E. C. Y., Saulsberry, L., Canning, B. J. Antitussive effects of memantine in guinea pigs. Chest. 141 (4), 996-1002 (2012).
- Hewitt, M. M., et al. Pharmacology of bradykinin-evoked coughing in guinea pigs. J Pharmacol Exp Ther. 357 (3), 620-628 (2016).
- Zhong, S., et al. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models. J Ethnopharmacol. 194, 378-385 (2016).
- Zhong, S., et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure. J Ethnopharmacol. 165, 73-82 (2015).
- Wei, L., et al. Effects of Shiwei longdanhua formula on LPS-induced airway mucus hypersecretion, cough hypersensitivity, oxidative stress and pulmonary inflammation. Biomed Pharmacother. 163, 114793 (2023).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Gibson, P., et al. Treatment of unexplained chronic cough: Chest guideline and expert panel report. Chest. 149 (1), 27-44 (2016).
- Nakaji, H., et al. Airway remodeling associated with cough hypersensitivity as a consequence of persistent cough: An experimental study. Respir Investig. 54 (6), 419-427 (2016).
- Xu, X., et al. Association of cough hypersensitivity with tracheal trpv1 activation and neurogenic inflammation in a novel guinea pig model of citric acid-induced chronic cough. J Int Med Res. 46 (7), 2913-2924 (2018).
- Iwata, T., et al. Mechanical stimulation by postnasal drip evokes cough. PLoS One. 10 (11), e0141823 (2015).
- Chen, L., et al. Establishment of a mouse model with all four clinical features of eosinophilic bronchitis. Sci Rep. 10 (1), 10557 (2020).
- Zhang, C., Lin, R. L., Hong, J., Khosravi, M., Lee, L. Y. Cough and expiration reflexes elicited by inhaled irritant gases are intensified in ovalbumin-sensitized mice. Am J Physiol Regul Integr Comp Physiol. 312 (5), R718-R726 (2017).
- Amato, A., Becci, A., Beolchini, F. Citric acid bioproduction: The technological innovation change. Crit Rev Biotechnol. 40 (2), 199-212 (2020).
- Hu, W., Li, W. J., Yang, H. Q., Chen, J. H. Current strategies and future prospects for enhancing microbial production of citric acid. Appl Microbiol Biotechnol. 103 (1), 201-209 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены