Method Article
Establecimiento de un modelo de ratón con hipersensibilidad a la tos por inhalación de ácido cítrico
En este artículo
Resumen
Este protocolo describe el desarrollo de un modelo de ratón con hipersensibilidad a la tos, que puede servir como modelo ideal para estudiar los mecanismos de la tos crónica.
Resumen
La tos es uno de los síntomas más comunes de muchas enfermedades respiratorias. La tos crónica tiene un impacto significativo en la calidad de vida e impone una carga económica considerable. El aumento de la sensibilidad a la tos es un sello fisiopatológico de la tos crónica. Se ha observado que la hipersensibilidad a la tos se relaciona con la inflamación de las vías respiratorias, la remodelación de los nervios sensoriales de las vías respiratorias y las alteraciones del sistema nervioso central. Sin embargo, los mecanismos moleculares precisos siguen sin estar claros y requieren una mayor elucidación utilizando modelos animales adecuados. Estudios previos han utilizado conejillos de indias como modelos para estudiar la tos, pero estos modelos presentan varias limitaciones experimentales, incluyendo altos costos, falta de herramientas transgénicas y escasez de reactivos comerciales. Además, los conejillos de indias suelen mostrar una mala tolerancia ambiental y una alta mortalidad cuando se exponen a estímulos. Por el contrario, los ratones son más pequeños, más fáciles de mantener, más rentables y susceptibles a la manipulación genética, lo que los hace más adecuados para las investigaciones mecánicas. En este estudio, establecimos un modelo de ratón con hipersensibilidad a la tos mediante inhalación continua de ácido cítrico (CA). Este modelo es fácil de operar y produce resultados reproducibles, lo que lo convierte en una herramienta valiosa para estudios posteriores sobre los mecanismos y posibles tratamientos novedosos para la tos crónica.
Introducción
La tos es un reflejo defensivo crucial que ayuda a eliminar las secreciones respiratorias o materiales extraños de las vías respiratorias. Sin embargo, también es uno de los síntomas más comunes de muchas enfermedades respiratorias, lo que a menudo lleva a los pacientes abuscar atención médica. La tos crónica, definida como una tos persistente que dura más de 8 semanas en adultos, impacta significativamente en la calidad de vida, causando problemas como incontinencia, insomnio, reflujo y otras experiencias desagradables, junto con una carga económica sustancial 2,3,4. Se cree ampliamente que el aumento de la sensibilidad a la tos es un sello fisiopatológico de la tos crónica, donde los niveles bajos de irritantes térmicos, mecánicos y químicos pueden desencadenarla tos. La hipersensibilidad a la tos se asocia con inflamación de las vías respiratorias6, remodelación de los nervios sensoriales de las vías respiratorias7 y alteraciones en el sistema nervioso central8, aunque los mecanismos moleculares precisos siguen sin estar claros y requieren una mayor elucidación a través de modelos animales adecuados.
Se han utilizado varios animales, incluyendo conejillos de indias, gatos, conejos, perros y cerdos, para estudiar los mecanismos de la tos9. Los cobayos han sido tradicionalmente reconocidos como el modelo más adecuado para estudiar los mecanismos de la tos y la eficacia de los fármacos antitusivos 9,10,11,12. Sin embargo, estos modelos tienen varias limitaciones experimentales, como los altos costos, la falta de herramientas transgénicas y la escasez de reactivos comerciales. Además, los conejillos de indias a menudo exhiben poca tolerancia ambiental y alta mortalidad cuando se exponen a estímulos. Por el contrario, los ratones son más pequeños, más fáciles de mantener, más rentables y susceptibles a la manipulación genética, lo que los hace más adecuados para las investigaciones mecánicas. Los estudios previos sobre modelos de tos se han centrado principalmente en la tos inducida por la inflamación de las vías respiratorias, utilizada principalmente para evaluar la eficacia de los fármacos antitusivos y los mecanismos periféricos13,14. Actualmente hay una falta de modelos animales para la hipersensibilidad a la tos.
En respuesta, presentamos un método para establecer un modelo de ratón de hipersensibilidad a la tos a través de la inhalación continua de ácido cítrico (CA). Este modelo es más simple, más fácil de construir y más factible en comparación con otros modelos animales.
Protocolo
Todos los procedimientos de experimentación con animales fueron aprobados por el Comité de Ética de Animales de Laboratorio del Primer Hospital Afiliado de la Universidad Médica de Guangzhou (20230656). En este estudio se utilizaron ratones machos C57BL/6 adultos libres de patógenos específicos, de 8 a 10 semanas de edad y con un peso de 20 a 25 g. Los detalles de los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
1. Preparación de reactivos químicos
- Preparación de la solución de ácido cítrico (CA)
- Para la evaluación de la tos, prepare una solución 0,4 M disolviendo 3,84 g de ácido cítrico en polvo en solución salina normal hasta un volumen final de 50 mL.
- Para el tratamiento animal, prepare una solución 0,1 M disolviendo 9,6 g de ácido cítrico en polvo en solución salina normal hasta un volumen final de 500 mL.
- Preparación de la solución de capsaicina
- Disuelva 30,5 mg de polvo de capsaicina en PBS que contenga 10% de etanol y 10% de Tween-80 para hacer una solución madre de 10 mM.
- Diluir la solución madre 1:100 en solución salina normal para hacer una solución de trabajo de 100 μM.
- Preparación de la solución de metacolina
- Disuelva 100 mg de polvo de metacolina en PBS hasta un volumen final de 2 mL para hacer una solución de 50 mg/mL.
- Diluya esta solución con PBS para obtener concentraciones de 25 mg/mL, 12,5 mg/mL, 6,25 mg/mL y 3,125 mg/mL.
2. Preparación animal
- Condiciones de la vivienda
- Ratones domésticos en jaulas con libre acceso a comida y agua, mantenidas a una temperatura de 22 ± 1 °C con un ciclo estándar de luz/oscuridad de 12 horas. Las manipulaciones experimentales se realizaron después de 1 semana de aclimatación al ambiente de alimentación.
- Aclimatación
- Permita que los ratones se aclimaten al entorno de alimentación durante 1 semana antes de realizar manipulaciones experimentales.
3. Desarrollo del modelo
- Asignación grupal
- Divida aleatoriamente los ratones en un grupo modelo y un grupo de control, con 8 ratones en cada grupo.
- Configuración de la exposición
- Coloque los ratones en dos cámaras independientes (como se muestra en la Figura 1), cada una conectada a un nebulizador ultrasónico.
- Exponga el grupo modelo a aerosol de ácido cítrico (CA) 0,1 M y el grupo control a aerosol de solución salina normal (NS) al 0,9% a una tasa de atomización de 3 mL/min durante 2 h por día durante 2 semanas (como se muestra en la Figura 2). Regrese los ratones a sus jaulas después de cada exposición.
- Evaluación de la sensibilidad a la tos
- Después de la última exposición, evalúe la sensibilidad a la tos mediante la evaluación de la tos refleja (desafiada con NS, CA (0,4 M) y capsaicina (100 μM)) y la tos espontánea (sin ninguna provocación).
NOTA: Para monitorear los cambios dinámicos en la sensibilidad a la tos durante el desarrollo del modelo, evalúe la sensibilidad a la tos en los días 0, 3, 7 y 10 utilizando un desafío CA (0.4 M).
- Después de la última exposición, evalúe la sensibilidad a la tos mediante la evaluación de la tos refleja (desafiada con NS, CA (0,4 M) y capsaicina (100 μM)) y la tos espontánea (sin ninguna provocación).
4. Evaluación de la sensibilidad a la tos
- Preparación del instrumento
- Use un sistema no invasivo de pletismografía de cuerpo entero (WBP, por sus siglas en inglés) para medir la sensibilidad a la tos. Conecte las cámaras, los transductores de flujo, el flujo de polarización y otros componentes de acuerdo con el manual de aplicación (consulte la Tabla de materiales).
- Realice un proceso de calibración para garantizar mediciones precisas haciendo clic en el botón Calibrar . Una pantalla de estado mostrará el progreso y, una vez que la barra de estado alcance el 100%, la calibración se completará.
- Detección de tos
- Cree un estudio de tos para ratones y configure los parámetros para 1 minuto de aclimatación, 10 minutos de tiempo de respuesta y 10 minutos de administración de solución química.
- Coloque los ratones conscientes en cámaras individuales, asegurándose de que solo haya un ratón por cámara.
NOTA: Asegúrese de que el mouse esté completamente dentro de la cámara antes de cerrar la tapa para evitar dañar su cola y dedos. - Agregue 1 mL de las soluciones químicas (NS, CA o capsaicina) al nebulizador.
NOTA: El número de eventos de tos, cada uno de los cuales consta de tres fases: inspiratoria, compresiva y expulsiva15 (como se muestra en la Figura 3), se registrará una vez que comience el estudio. Después de 10 minutos de grabación, la detección de tos estará completa. Limpie la cámara después de detectar a cada animal para evitar la contaminación cruzada.
5. Medición de la hiperreactividad de las vías respiratorias (AHR)
- Preparación del instrumento
- Prepare los instrumentos como se describe en el paso 4.1.
- Medición de AHR
- Cree un estudio de dosis-respuesta para ratones, configurando los tipos de medición, los parámetros y la secuencia de tareas: 1 min para la aclimatación, 30 s para la administración de la solución de metacolina, 3 min para el tiempo de respuesta y 1 min para la recuperación.
- Coloque los ratones conscientes en cámaras individuales, asegurándose de que solo haya un ratón por cámara.
- Añada 50 μL de las soluciones químicas (PBS o metacolina) al nebulizador e inicie el estudio.
- Registre el valor de Penh, un indicador de broncoconstricción, en respuesta a diferentes concentraciones de metacolina (0 mg/mL, 3,125 mg/mL, 6,25 mg/mL, 12,5 mg/mL, 25 mg/mL, 50 mg/mL).
6. Recolección de lavado broncoalveolar
- Sacrificio
- Sacrificar los ratones mediante hiperanestesia con pentobarbital sódico (50 mg/kg) administrado por inyección intraperitoneal (siguiendo protocolos aprobados institucionalmente).
- Recogida de muestras
- Recoja sangre del seno orbital del ratón en un tubo de microcentrífuga de 1,5 ml y luego coloque el tubo en hielo. Centrifugar la sangre a 3000 x g durante 10 min a 4°C. Utilice una pipeta para recoger el sobrenadante, alicústelo y guárdelo a -80 °C.
- Recoja el líquido de lavado broncoalveolar (BALF) abriendo el tórax para exponer la tráquea, insertando una aguja permanente de 22 G en la tráquea, luego lavando tres veces con 0,5 mL de PBS preenfriado y recogiendo el líquido.
- Después de la recolección, centrifugar el BALF a 500 x g durante 10 min a 4 °C. Recoja el sobrenadante, alícuota y guárdelo a -80 °C. Vuelva a suspender el pellet en 100 μL de PBS y prepare frotis celulares para su posterior análisis.
- Recoja los tejidos pulmonares abriendo el tórax para exponer los pulmones, extrayendo los tejidos pulmonares y colocándolos en viales criogénicos. Almacene los viales a -80 °C para futuros estudios.
7. RT-PCR cuantitativa
- Extraiga el ARN total del tejido pulmonar utilizando el reactivo TRIzol. Realice la síntesis de ADNc utilizando un kit de síntesis de ADNc de primera cadena, siguiendo las instrucciones del fabricante (consulte la Tabla de materiales).
- Realice PCR en un sistema de detección de PCR cuantitativa en tiempo real utilizando fluorescencia verde SYBR. Normalizar la cuantificación de la expresión relativa de ARNm de SP y CGRP a la expresión de β-actina9.
8. Análisis estadístico
- Presentar los datos como la media ± SEM. Utilice una prueba t para comparar los datos entre dos grupos, considerando P < 0,05 como estadísticamente significativos. Realizar todos los análisis estadísticos utilizando software estadístico y de gráficos.
Resultados
Como se muestra en la Figura 4A, la sensibilidad a la tos en el grupo modelo (grupo CA) aumentó significativamente después de 1 semana de exposición en comparación con el grupo control (grupo NS), y esta mayor sensibilidad persistió durante todo el período de exposición. Ni el grupo de control ni los ratones del grupo modelo experimentaron mortalidad durante el proceso de modelado (Figura 4B). Las figuras 4C y 4D demuestran que el número de eventos de tos espontánea aumentó significativamente en el grupo modelo después de la exposición. Además, la sensibilidad a la tos provocada por NS (Figura 4E y Figura 4F), CA (Figura 4G y Figura 4H) y capsaicina (Figura 4I y Figura 4J) fue sustancialmente mayor en el grupo modelo después del período de exposición.
En la Figura 5A,B, los dos grupos no tuvieron diferencias significativas en el número total de células inflamatorias y los recuentos diferenciales de células en el líquido de lavado broncoalveolar (BALF). La Figura 5C, D muestra las células BALF con tinción H&E. Como se muestra en la Figura 6, no hubo diferencias significativas en la hiperreactividad de las vías respiratorias entre el modelo y los grupos de control después del modelado. Además, se evaluaron los niveles de expresión de CGRP y SP, mediadores inflamatorios neurogénicos, en el tejido pulmonar mediante QPCR. Los resultados indicaron un aumento significativo en la expresión de SP en el grupo modelo (Figura 7A), mientras que no se observaron diferencias significativas en la expresión de CGRP entre los dos grupos (Figura 7B).

Figura 1: Cámara de exposición para el modelo de ratón. La cámara de exposición está hecha de vidrio acrílico, con unas dimensiones de 36 cm x 20 cm x 25 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Esquema del modelo de ratón con hipersensibilidad a la tos. Ilustración esquemática del establecimiento de un modelo de ratón con hipersensibilidad a la tos por inhalación de ácido cítrico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Imágenes representativas de un evento de tos. Imágenes representativas de un evento de tos registradas por un sistema de pletismografía de cuerpo entero no invasivo. El evento de tos consta de tres fases: (a) inspiratoria, (b) compresiva y (c) expulsiva. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Evaluación de la tos en un modelo de ratón. (A) Eventos de tos provocados por ácido cítrico 0.4 M durante el período de exposición de 14 días. La sensibilidad a la tos en el grupo de ácido cítrico (CA) fue significativamente mayor que en el grupo de control después de 7 días de exposición. (B) Curvas de supervivencia de los grupos de control y modelo durante el proceso de modelado. (C-J) Eventos espontáneos de tos (C,D) y eventos de tos provocados por solución salina normal (NS) (E,F), ácido cítrico (G,H) y capsaicina (I,J) antes y después del modelado. Los datos se representan como la media ± SEM, ***P < 0,001 en comparación con el grupo NS. Haga clic aquí para ver una versión más grande de esta figura.
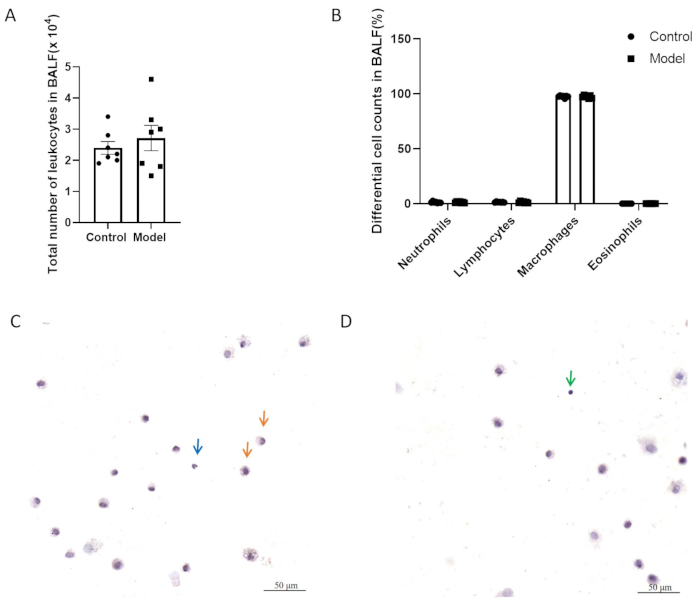
Figura 5: Recuentos de leucocitos en el líquido de lavado broncoalveolar (BALF). (A) Número total de leucocitos en BALF. (B) Recuentos diferenciales de células en BALF. Los datos se representan como la media ± SEM. (C, D) Imágenes representativas de células BALF con tinción de H&E. Las flechas indican macrófagos (naranja), neutrófilos (azul) y linfocitos (verde). Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Resistencia de la vía aérea en los grupos CA y NS. Resistencia de las vías respiratorias en el grupo de ácido cítrico (CA) en comparación con el grupo de solución salina normal (NS). Los datos se representan como la media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Niveles de expresión de ARNm de SP y CGRP en el tejido pulmonar. (A) Niveles relativos de expresión de ARNm de la sustancia P (SP) en el tejido pulmonar. (B) Niveles relativos de expresión de ARNm del péptido relacionado con el gen de la calcitonina (CGRP) en el tejido pulmonar. Los datos se representan como la media ± SEM, *P < 0,05 en comparación con el grupo NS. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este estudio estableció con éxito un modelo de ratón con hipersensibilidad a la tos a través de la inhalación continua de ácido cítrico (CA). Este modelo demostró un aumento fiable de la sensibilidad a la tos, tanto para la tos espontánea como para la tos refleja provocada por el ácido cítrico y la capsaicina. El ácido cítrico y la capsaicina son ampliamente utilizados para evaluar la sensibilidad del reflejo de la tos16.
Varios pasos críticos en este protocolo garantizan su efectividad. En primer lugar, la cámara de exposición utilizada para los experimentos no debe ser completamente hermética. Para garantizar una ventilación adecuada, las rejillas de ventilación deben colocarse en la parte posterior de la cámara. En segundo lugar, es importante evitar el hacinamiento dentro de la cámara; Limitar el número de ratones a 10-12 evita posibles estampidas. En tercer lugar, los cuidados posteriores a la exposición son cruciales: después de cada exposición, los ratones deben secarse con aire caliente para eliminar cualquier líquido restante de su pelaje.
Si bien los conejillos de indias se usan tradicionalmente para estudiar los mecanismos de la tos y evaluar los medicamentos antitusivos, los modelos de ratón ofrecen varias ventajas. Estudios anteriores han desarrollado modelos de hipersensibilidad a la tos inducida por la exposición al ácido cítrico en conejillos de indias. Por ejemplo, Nakaji et al. expusieron a conejillos de indias a ácido cítrico 0,5 M durante 10 min, tres veces por semana durante 2 semanas (ocho exposiciones en total)17. De manera similar, otro estudio realizado por Xu et al. estableció un modelo con mayor sensibilidad a la tos al hacer que los conejillos de indias inhalaran ácido cítrico 0,4 M durante 25 días18. Sin embargo, estos modelos de conejillos de indias mostraron una sensibilidad a la tos menos pronunciada en comparación con el modelo de ratón actual. Además, los modelos de cobayas enfrentan limitaciones, como la falta de herramientas transgénicas y reactivos comerciales, que dificultan el estudio de los mecanismos moleculares en la hipersensibilidad a la tos.
Los ratones, por otro lado, son más fáciles de mantener, más rentables y susceptibles de manipulación genética. Estudios previos han demostrado que los ratones también son modelos efectivos para el estudio de la tos 15,19,20,21. Además, los ratones se utilizan comúnmente en la investigación en neurociencia, lo que proporciona una ventaja para estudiar los mecanismos centrales de la hipersensibilidad a la tos. Por lo tanto, los ratones se consideran más adecuados para las investigaciones mecánicas de la tos crónica.
A pesar del exitoso establecimiento del modelo, existen algunas limitaciones a considerar. En primer lugar, el ácido cítrico, aunque se usa comúnmente en las industrias alimentaria, farmacéutica, química y metalúrgica22,23, no imita con precisión las condiciones de exposición de la vida real que resultan en hipersensibilidad a la tos en los seres humanos. En segundo lugar, el mecanismo preciso de la hipersensibilidad a la tos en este modelo sigue sin estar claro. Si bien la inflamación pulmonar se considera un mediador potencial del aumento de la sensibilidad a la tos6, la evaluación de los recuentos de células inflamatorias totales y los recuentos diferenciales de células en el líquido de lavado broncoalveolar (BALF) no mostró cambios significativos entre los dos grupos. Además, la hiperreactividad bronquial, un desencadenante conocido de la tos crónica24, no mostró diferencias significativas en la resistencia de las vías respiratorias entre el modelo y los grupos de control después de 14 días de exposición.
En conclusión, se ha establecido un modelo de ratón con hipersensibilidad a la tos mediante inhalación continua de ácido cítrico (CA). Este modelo es fácil de operar y produce resultados reproducibles, lo que lo convierte en una herramienta valiosa para estudios posteriores sobre los mecanismos y posibles tratamientos novedosos para la tos crónica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (NSFC 82100034), Proyecto de Planificación de Ciencia y Tecnología de Guangzhou (202102010168).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% normal saline | Biosharp | BL158A | |
| Capsaicin | Cayman chemical | 92350 | |
| Citric Acid | Sigma-Aldrich | C2404 | |
| Ethanol | Guangzhou chemical reagent factory | GSHB15-AR-0.5L | |
| First-strand cDNA synthesis kit | TransGen Biotech | AT341 | |
| Methacholine | Sigma-Aldrich | A2251 | |
| Non-invasive whole-body plethysmography (WBP) system | DSI | 601-1400-001 | |
| Pentobarbital sodium | Merk | P3761 | |
| PerfectStart Green qPCR SuperMix | TransGen Biotech | AQ601 | |
| Phosphate Buffered Saline (PBS) | Meilunbio | MA0015 | |
| Real-time quantitative PCR detecting system | Bio-rad | CFX Connect | |
| TRIzol reagent | Invitrogen | 15596026CN | |
| Tween-80 | Solarbio | T8360-100 | |
| Ultrasonic nebulizer | Yuwell | 402AI |
Referencias
- Morice, A. H. Epidemiology of cough. Pulm Pharmacol Ther. 15 (3), 253-259 (2002).
- Lai, K., Long, L. Current status and future directions of chronic cough in China. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional European survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Mazzone, S. B., Undem, B. J. Vagal afferent innervation of the airways in health and disease. Physiol Rev. 96 (3), 975-1024 (2016).
- Shapiro, C. O., et al. Airway sensory nerve density is increased in chronic cough. Am J Respir Crit Care Med. 203 (3), 348-355 (2021).
- Ando, A., et al. Neural correlates of cough hypersensitivity in humans: Evidence for central sensitization and dysfunctional inhibitory control. Thorax. 71 (4), 323-329 (2016).
- Plevkova, J., et al. Animal models of cough. Respir Physiol Neurobiol. 290, 103656 (2021).
- Smith, J. A., Hilton, E. C. Y., Saulsberry, L., Canning, B. J. Antitussive effects of memantine in guinea pigs. Chest. 141 (4), 996-1002 (2012).
- Hewitt, M. M., et al. Pharmacology of bradykinin-evoked coughing in guinea pigs. J Pharmacol Exp Ther. 357 (3), 620-628 (2016).
- Zhong, S., et al. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models. J Ethnopharmacol. 194, 378-385 (2016).
- Zhong, S., et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure. J Ethnopharmacol. 165, 73-82 (2015).
- Wei, L., et al. Effects of Shiwei longdanhua formula on LPS-induced airway mucus hypersecretion, cough hypersensitivity, oxidative stress and pulmonary inflammation. Biomed Pharmacother. 163, 114793 (2023).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Gibson, P., et al. Treatment of unexplained chronic cough: Chest guideline and expert panel report. Chest. 149 (1), 27-44 (2016).
- Nakaji, H., et al. Airway remodeling associated with cough hypersensitivity as a consequence of persistent cough: An experimental study. Respir Investig. 54 (6), 419-427 (2016).
- Xu, X., et al. Association of cough hypersensitivity with tracheal trpv1 activation and neurogenic inflammation in a novel guinea pig model of citric acid-induced chronic cough. J Int Med Res. 46 (7), 2913-2924 (2018).
- Iwata, T., et al. Mechanical stimulation by postnasal drip evokes cough. PLoS One. 10 (11), e0141823 (2015).
- Chen, L., et al. Establishment of a mouse model with all four clinical features of eosinophilic bronchitis. Sci Rep. 10 (1), 10557 (2020).
- Zhang, C., Lin, R. L., Hong, J., Khosravi, M., Lee, L. Y. Cough and expiration reflexes elicited by inhaled irritant gases are intensified in ovalbumin-sensitized mice. Am J Physiol Regul Integr Comp Physiol. 312 (5), R718-R726 (2017).
- Amato, A., Becci, A., Beolchini, F. Citric acid bioproduction: The technological innovation change. Crit Rev Biotechnol. 40 (2), 199-212 (2020).
- Hu, W., Li, W. J., Yang, H. Q., Chen, J. H. Current strategies and future prospects for enhancing microbial production of citric acid. Appl Microbiol Biotechnol. 103 (1), 201-209 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados