Method Article
Estabelecimento de um modelo de camundongo com hipersensibilidade à tosse por inalação de ácido cítrico
Neste Artigo
Resumo
Este protocolo descreve o desenvolvimento de um modelo de camundongo com hipersensibilidade à tosse, que pode servir como um modelo ideal para estudar os mecanismos da tosse crônica.
Resumo
A tosse é um dos sintomas mais comuns de muitas doenças respiratórias. A tosse crônica afeta significativamente a qualidade de vida e impõe um ônus econômico considerável. O aumento da sensibilidade à tosse é uma característica fisiopatológica da tosse crônica. Observou-se que a hipersensibilidade à tosse está relacionada à inflamação das vias aéreas, remodelamento dos nervos sensoriais das vias aéreas e alterações no sistema nervoso central. No entanto, os mecanismos moleculares precisos permanecem obscuros e requerem mais elucidação usando modelos animais adequados. Estudos anteriores utilizaram cobaias como modelos para estudar a tosse, mas esses modelos apresentam várias limitações experimentais, incluindo altos custos, falta de ferramentas transgênicas e escassez de reagentes comerciais. Além disso, os porquinhos-da-índia geralmente exibem baixa tolerância ambiental e alta mortalidade quando expostos a estímulos. Em contraste, os camundongos são menores, mais fáceis de manter, mais econômicos e passíveis de manipulação genética, tornando-os mais adequados para investigações mecanicistas. Neste estudo, estabelecemos um modelo de camundongo com hipersensibilidade à tosse por inalação contínua de ácido cítrico (CA). Este modelo é simples de operar e produz resultados reprodutíveis, tornando-o uma ferramenta valiosa para estudos adicionais sobre os mecanismos e potenciais novos tratamentos para a tosse crônica.
Introdução
A tosse é um reflexo defensivo crucial que ajuda a limpar secreções respiratórias ou materiais estranhos das vias aéreas. No entanto, é também um dos sintomas mais comuns de muitas doenças respiratórias, muitas vezes levando os pacientes a procurar atendimento médico1. A tosse crônica, definida como uma tosse persistente com duração superior a 8 semanas em adultos, afeta significativamente a qualidade de vida, causando problemas como incontinência, insônia, refluxo e outras experiências desagradáveis, além de um ônus econômico substancial 2,3,4. Acredita-se amplamente que o aumento da sensibilidade à tosse é uma característica fisiopatológica da tosse crônica, onde baixos níveis de irritantes térmicos, mecânicos e químicos podem desencadear a tosse5. A hipersensibilidade à tosse está associada à inflamação das vias aéreas6, remodelação dos nervos sensoriais das vias aéreas7 e alterações no sistema nervoso central8, embora os mecanismos moleculares precisos permaneçam obscuros e exijam maior elucidação por meio de modelos animais adequados.
Vários animais, incluindo porquinhos-da-índia, gatos, coelhos, cães e porcos, têm sido usados para estudar os mecanismos da tosse9. As cobaias têm sido tradicionalmente reconhecidas como o modelo mais adequado para estudar os mecanismos da tosse e a eficácia das drogas antitússicas 9,10,11,12. No entanto, esses modelos têm várias limitações experimentais, incluindo altos custos, falta de ferramentas transgênicas e escassez de reagentes comerciais. Além disso, os porquinhos-da-índia geralmente exibem baixa tolerância ambiental e alta mortalidade quando expostos a estímulos. Em contraste, os camundongos são menores, mais fáceis de manter, mais econômicos e passíveis de manipulação genética, tornando-os mais adequados para investigações mecanicistas. Estudos anteriores sobre modelos de tosse se concentraram principalmente na tosse induzida por inflamação das vias aéreas, usada principalmente para avaliar a eficácia de drogas antitússicas e mecanismos periféricos13,14. Atualmente, faltam modelos animais para hipersensibilidade à tosse.
Em resposta, introduzimos um método para estabelecer um modelo de camundongo de hipersensibilidade à tosse por inalação contínua de ácido cítrico (CA). Este modelo é mais simples, mais fácil de construir e mais viável em comparação com outros modelos animais.
Protocolo
Todos os procedimentos de experimentação animal foram aprovados pelo Comitê de Ética em Animais de Laboratório do Primeiro Hospital Afiliado da Universidade Médica de Guangzhou (20230656). Camundongos C57BL/6 adultos machos livres de patógenos específicos, com idade entre 8 e 10 semanas e pesando 20 a 25 g, foram usados neste estudo. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Preparação de reagentes químicos
- Preparação da solução de ácido cítrico (CA)
- Para avaliação da tosse, prepare uma solução 0,4 M dissolvendo 3,84 g de ácido cítrico em pó em solução salina normal até um volume final de 50 mL.
- Para o tratamento animal, prepare uma solução 0,1 M dissolvendo 9,6 g de ácido cítrico em pó em solução salina normal até um volume final de 500 mL.
- Preparação da solução de capsaicina
- Dissolva 30,5 mg de pó de capsaicina em PBS contendo 10% de etanol e 10% de Tween-80 para fazer uma solução estoque de 10 mM.
- Dilua a solução estoque 1:100 em solução salina normal para fazer uma solução de trabalho de 100 μM.
- Preparação da solução de metacolina
- Dissolva 100 mg de metacolina em pó em PBS até um volume final de 2 mL para fazer uma solução de 50 mg / mL.
- Dilua esta solução com PBS para obter concentrações de 25 mg / mL, 12,5 mg / mL, 6,25 mg / mL e 3,125 mg / mL.
2. Preparação animal
- Condições de moradia
- Ratos domésticos em gaiolas com livre acesso a comida e água, mantidos a uma temperatura de 22 ± 1 °C com um ciclo padrão de 12 horas claro/escuro. As manipulações experimentais foram realizadas após 1 semana de aclimatação ao ambiente alimentar.
- Aclimatação
- Permita que os ratos se aclimatem ao ambiente de alimentação por 1 semana antes de realizar manipulações experimentais.
3. Desenvolvimento do modelo
- Atribuição em grupo
- Divida aleatoriamente os camundongos em um grupo modelo e um grupo controle, com 8 camundongos em cada grupo.
- Configuração de exposição
- Coloque os camundongos em duas câmaras independentes (conforme mostrado na Figura 1), cada uma conectada a um nebulizador ultrassônico.
- Exponha o grupo modelo ao aerossol de ácido cítrico (CA) 0,1 M e o grupo controle ao aerossol de solução salina normal (NS) a 0,9% a uma taxa de atomização de 3 mL / min por 2 h por dia durante 2 semanas (conforme mostrado na Figura 2). Devolva os ratos às suas gaiolas após cada exposição.
- Avaliação da sensibilidade à tosse
- Após a última exposição, avalie a sensibilidade à tosse avaliando a tosse reflexa (desafiada com SN, CA (0,4 M) e capsaicina (100 μM)) e tosse espontânea (sem qualquer desafio).
NOTA: Para monitorar as mudanças dinâmicas na sensibilidade à tosse durante o desenvolvimento do modelo, avalie a sensibilidade à tosse nos dias 0, 3, 7 e 10 usando um desafio CA (0,4 M).
- Após a última exposição, avalie a sensibilidade à tosse avaliando a tosse reflexa (desafiada com SN, CA (0,4 M) e capsaicina (100 μM)) e tosse espontânea (sem qualquer desafio).
4. Avaliação da sensibilidade à tosse
- Preparação do instrumento
- Use um sistema não invasivo de pletismografia de corpo inteiro (WBP) para medir a sensibilidade à tosse. Conecte as câmaras, transdutores de fluxo, fluxo de polarização e outros componentes de acordo com o manual de aplicação (consulte a Tabela de Materiais).
- Execute um processo de calibração para garantir medições precisas clicando no botão Calibrar . Uma tela de status exibirá o progresso e, quando a barra de status atingir 100%, a calibração estará concluída.
- Detecção de tosse
- Crie um estudo de tosse para camundongos e configure os parâmetros para 1 minuto de aclimatação, 10 minutos de tempo de resposta e 10 minutos de administração de solução química.
- Coloque os ratos conscientes em câmaras individuais, garantindo que haja apenas um rato por câmara.
NOTA: Certifique-se de que o mouse esteja completamente dentro da câmara antes de fechar a tampa para evitar danificar sua cauda e dedos. - Adicione 1 mL das soluções químicas (NS, CA ou capsaicina) ao nebulizador.
NOTA: O número de eventos de tosse - cada um consistindo em três fases: inspiratória, compressiva e expulsiva15 (conforme mostrado na Figura 3) - será registrado assim que o estudo começar. Após 10 minutos de gravação, a detecção da tosse estará completa. Limpe a câmara após detectar cada animal para evitar contaminação cruzada.
5. Medição da hiperresponsividade das vias aéreas (AHR)
- Preparação do instrumento
- Prepare os instrumentos conforme descrito na etapa 4.1.
- Medição de AHR
- Crie um estudo dose-resposta para camundongos, configurando os tipos de medição, parâmetros e sequência de tarefas: 1 min para aclimatação, 30 s para entrega de solução de metacolina, 3 min para tempo de resposta e 1 min para recuperação.
- Coloque os ratos conscientes em câmaras individuais, garantindo que haja apenas um rato por câmara.
- Adicione 50 μL das soluções químicas (PBS ou metacolina) ao nebulizador e inicie o estudo.
- Registre o valor de Penh, um indicador de broncoconstrição, em resposta a diferentes concentrações de metacolina (0 mg / mL, 3,125 mg / mL, 6,25 mg / mL, 12,5 mg / mL, 25 mg / mL, 50 mg / mL).
6. Coleta de lavado broncoalveolar
- Sacrifício
- Sacrifique os camundongos usando hiperanestesia com pentobarbital sódico (50 mg / kg) administrado por injeção intraperitoneal (seguindo protocolos aprovados institucionalmente).
- Coleta de amostras
- Colete sangue do seio orbital do camundongo em um tubo de microcentrífuga de 1,5 mL e coloque o tubo no gelo. Centrifugue o sangue a 3000 x g por 10 min a 4 ° C. Utilizar uma pipeta para recolher o sobrenadante, alíquota e armazená-lo a -80 °C.
- Colete o fluido de lavagem broncoalveolar (BALF) abrindo o tórax para expor a traqueia, inserindo uma agulha de demora de 22 G na traqueia, lavando-a três vezes com 0,5 mL de PBS pré-resfriado e coletando o fluido.
- Após a colheita, centrifugar o LBA a 500 x g durante 10 min a 4 °C. Recolher o sobrenadante, alíquota e armazená-lo a -80 °C. Ressuspenda o pellet em 100 μL de PBS e prepare esfregaços celulares para análise posterior.
- Colete tecidos pulmonares abrindo o tórax para expor os pulmões, removendo os tecidos pulmonares e colocando-os em frascos criogênicos. Conservar os frascos para injetáveis a -80 °C para estudos futuros.
7. RT-PCR quantitativo
- Extraia o RNA total do tecido pulmonar usando o reagente TRIzol. Realize a síntese de cDNA usando um kit de síntese de cDNA de primeira fita, seguindo as instruções do fabricante (consulte a Tabela de Materiais).
- Realize PCR em um sistema de detecção de PCR quantitativo em tempo real usando fluorescência verde SYBR. Normalize a quantificação da expressão relativa de mRNA de SP e CGRP para a expressão de β-Actina9.
8. Análise estatística
- Apresentar os dados como média ± EPM. Utilizar o teste t para comparar os dados entre dois grupos, considerando P < 0,05 como estatisticamente significativo. Realize todas as análises estatísticas usando software estatístico e gráfico.
Resultados
Conforme mostrado na Figura 4A, a sensibilidade à tosse no grupo modelo (grupo CA) aumentou significativamente após 1 semana de exposição em comparação com o grupo controle (grupo NS), e essa sensibilidade aumentada persistiu durante todo o período de exposição. Nem o grupo controle nem os camundongos do grupo modelo experimentaram mortalidade durante o processo de modelagem (Figura 4B). A Figura 4C e a Figura 4D demonstram que o número de eventos espontâneos de tosse aumentou significativamente no grupo modelo pós-exposição. Além disso, a sensibilidade à tosse provocada por NS (Figura 4E e Figura 4F), CA (Figura 4G e Figura 4H) e capsaicina (Figura 4I e Figura 4J) foi substancialmente maior no grupo modelo após o período de exposição.
Na Figura 5A,B, os dois grupos não apresentaram diferença significativa no número total de células inflamatórias e na contagem diferencial de células no lavado broncoalveolar (LBA). A Figura 5C,D mostra células BALF com coloração H&E. Conforme ilustrado na Figura 6, não houve diferença significativa na hiper-responsividade das vias aéreas entre os grupos modelo e controle após a modelagem. Além disso, os níveis de expressão de CGRP e SP, mediadores inflamatórios neurogênicos, no tecido pulmonar foram avaliados por QPCR. Os resultados indicaram um aumento significativo na expressão de SP no grupo modelo (Figura 7A), enquanto nenhuma diferença significativa na expressão de CGRP foi observada entre os dois grupos (Figura 7B).

Figura 1: Câmara de exposição para modelo de camundongo. A câmara de exposição é feita de vidro acrílico, com dimensões de 36 cm x 20 cm x 25 cm. Clique aqui para ver uma versão maior desta figura.

Figura 2: Esquema do modelo de camundongo com hipersensibilidade à tosse. Ilustração esquemática do estabelecimento de um modelo de camundongo com hipersensibilidade à tosse por inalação de ácido cítrico. Clique aqui para ver uma versão maior desta figura.

Figura 3: Imagens representativas de um evento de tosse. Imagens representativas de um evento de tosse registrado por um sistema de pletismografia não invasiva de corpo inteiro. O evento de tosse consiste em três fases: (a) inspiratória, (b) compressiva e (c) expulsiva. Clique aqui para ver uma versão maior desta figura.

Figura 4: Avaliação da tosse em modelo de camundongo. (A) Eventos de tosse provocados por ácido cítrico 0,4 M durante o período de exposição de 14 dias. A sensibilidade à tosse no grupo ácido cítrico (CA) foi significativamente maior do que no grupo controle após 7 dias de exposição. (B) Curvas de sobrevivência dos grupos controle e modelo durante o processo de modelagem. (CJ) Eventos de tosse espontânea (C,D) e eventos de tosse provocados por solução salina normal (NS) (E,F), ácido cítrico (G,H) e capsaicina (I,J) antes e após a modelagem. Os dados são representados como a média ± EPM, ***P < 0,001 em comparação com o grupo SN. Clique aqui para ver uma versão maior desta figura.
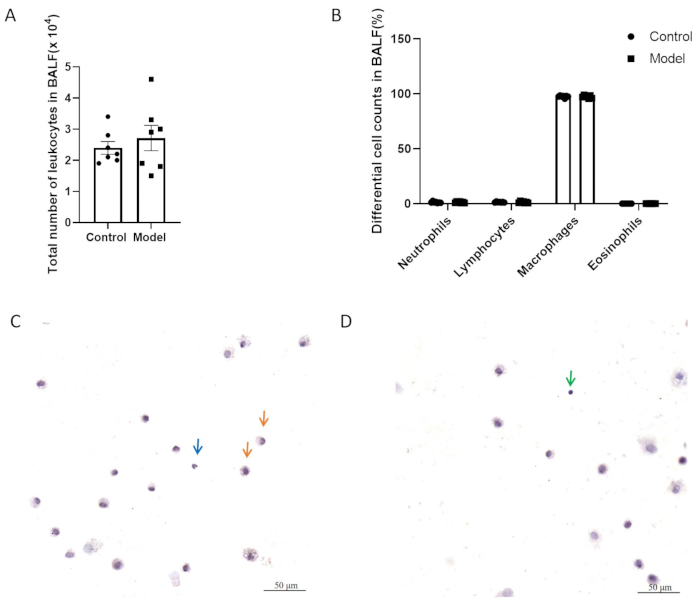
Figura 5: Contagem de leucócitos no lavado broncoalveolar (LBA). (A) Número total de leucócitos no LBA. (B) Contagens diferenciais de células em BALF. Os dados são representados como a média ± SEM. (C, D) Imagens representativas de células BALF com coloração H & E. As setas indicam macrófagos (laranja), neutrófilos (azul) e linfócitos (verde). Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Resistência das vias aéreas nos grupos AC e SN. Resistência das vias aéreas no grupo ácido cítrico (CA) em comparação com o grupo solução salina normal (NS). Os dados são representados como a média ± SEM. Clique aqui para ver uma versão maior desta figura.

Figura 7: Níveis de expressão de mRNA de SP e CGRP no tecido pulmonar. (A) Níveis relativos de expressão de mRNA da substância P (SP) no tecido pulmonar. (B) Níveis relativos de expressão de mRNA do peptídeo relacionado ao gene da calcitonina (CGRP) no tecido pulmonar. Os dados são representados como a média ± EPM, *P < 0,05 em comparação com o grupo SN. Clique aqui para ver uma versão maior desta figura.
Discussão
Este estudo estabeleceu com sucesso um modelo de camundongo com hipersensibilidade à tosse por inalação contínua de ácido cítrico (CA). Este modelo demonstrou um aumento confiável na sensibilidade à tosse tanto para tosse espontânea quanto para tosses reflexivas provocadas por ácido cítrico e capsaicina. O ácido cítrico e a capsaicina são amplamente utilizados para avaliar a sensibilidade ao reflexo da tosse16.
Várias etapas críticas neste protocolo garantem sua eficácia. Em primeiro lugar, a câmara de exposição utilizada para as experiências não deve ser totalmente hermética. Para garantir uma ventilação adequada, as aberturas devem ser colocadas na parte de trás da câmara. Em segundo lugar, é importante evitar a sobrelotação no hemiciclo; Limitar o número de ratos a 10-12 evita possíveis debandadas. Em terceiro lugar, os cuidados pós-exposição são cruciais: após cada exposição, os ratos devem ser secos com ar quente para remover qualquer fluido restante de sua pele.
Embora os porquinhos-da-índia sejam tradicionalmente usados para estudar os mecanismos da tosse e avaliar medicamentos antitússicos, os modelos de camundongos oferecem várias vantagens. Estudos anteriores desenvolveram modelos de hipersensibilidade à tosse induzida pela exposição ao ácido cítrico em cobaias. Por exemplo, Nakaji et al. expuseram cobaias a ácido cítrico 0,5 M por 10 min, três vezes por semana durante 2 semanas (oito exposições no total)17. Da mesma forma, outro estudo de Xu et al. estabeleceu um modelo com aumento da sensibilidade à tosse ao fazer com que porquinhos-da-índia inalassem ácido cítrico 0,4 M por 25 dias18. No entanto, esses modelos de cobaias exibiram sensibilidade à tosse menos pronunciada em comparação com o modelo atual de camundongos. Além disso, os modelos de cobaias enfrentam limitações, como a falta de ferramentas transgênicas e reagentes comerciais, que dificultam o estudo dos mecanismos moleculares na hipersensibilidade à tosse.
Os camundongos, por outro lado, são mais fáceis de manter, mais econômicos e passíveis de manipulação genética. Estudos anteriores mostraram que os camundongos também são modelos eficazes para o estudo da tosse 15,19,20,21. Além disso, os camundongos são comumente usados em pesquisas em neurociência, proporcionando uma vantagem para estudar os mecanismos centrais da hipersensibilidade à tosse. Assim, os camundongos são considerados mais adequados para investigações mecanicistas da tosse crônica.
Apesar do estabelecimento bem-sucedido do modelo, existem algumas limitações a serem consideradas. Em primeiro lugar, o ácido cítrico, embora comumente usado nas indústrias alimentícia, farmacêutica, química e metalúrgica22,23, não imita com precisão as condições de exposição da vida real que resultam em hipersensibilidade à tosse em humanos. Em segundo lugar, o mecanismo preciso de hipersensibilidade à tosse neste modelo permanece obscuro. Embora a inflamação pulmonar seja considerada um potencial mediador do aumento da sensibilidade à tosse6, a avaliação da contagem total de células inflamatórias e da contagem diferencial de células no lavado broncoalveolar (LBA) não mostrou alterações significativas entre os dois grupos. Além disso, a hiper-responsividade brônquica, um conhecido gatilho de tosse crônica24, não mostrou diferença significativa na resistência das vias aéreas entre os grupos modelo e controle após 14 dias de exposição.
Em conclusão, um modelo de camundongo foi estabelecido com hipersensibilidade à tosse por inalação contínua de ácido cítrico (CA). Este modelo é simples de operar e produz resultados reprodutíveis, tornando-o uma ferramenta valiosa para estudos adicionais sobre os mecanismos e potenciais novos tratamentos para a tosse crônica.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este estudo foi apoiado pela Fundação Nacional de Ciências Naturais da China (NSFC 82100034), Projeto de Planejamento de Ciência e Tecnologia de Guangzhou (202102010168).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% normal saline | Biosharp | BL158A | |
| Capsaicin | Cayman chemical | 92350 | |
| Citric Acid | Sigma-Aldrich | C2404 | |
| Ethanol | Guangzhou chemical reagent factory | GSHB15-AR-0.5L | |
| First-strand cDNA synthesis kit | TransGen Biotech | AT341 | |
| Methacholine | Sigma-Aldrich | A2251 | |
| Non-invasive whole-body plethysmography (WBP) system | DSI | 601-1400-001 | |
| Pentobarbital sodium | Merk | P3761 | |
| PerfectStart Green qPCR SuperMix | TransGen Biotech | AQ601 | |
| Phosphate Buffered Saline (PBS) | Meilunbio | MA0015 | |
| Real-time quantitative PCR detecting system | Bio-rad | CFX Connect | |
| TRIzol reagent | Invitrogen | 15596026CN | |
| Tween-80 | Solarbio | T8360-100 | |
| Ultrasonic nebulizer | Yuwell | 402AI |
Referências
- Morice, A. H. Epidemiology of cough. Pulm Pharmacol Ther. 15 (3), 253-259 (2002).
- Lai, K., Long, L. Current status and future directions of chronic cough in China. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional European survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Mazzone, S. B., Undem, B. J. Vagal afferent innervation of the airways in health and disease. Physiol Rev. 96 (3), 975-1024 (2016).
- Shapiro, C. O., et al. Airway sensory nerve density is increased in chronic cough. Am J Respir Crit Care Med. 203 (3), 348-355 (2021).
- Ando, A., et al. Neural correlates of cough hypersensitivity in humans: Evidence for central sensitization and dysfunctional inhibitory control. Thorax. 71 (4), 323-329 (2016).
- Plevkova, J., et al. Animal models of cough. Respir Physiol Neurobiol. 290, 103656 (2021).
- Smith, J. A., Hilton, E. C. Y., Saulsberry, L., Canning, B. J. Antitussive effects of memantine in guinea pigs. Chest. 141 (4), 996-1002 (2012).
- Hewitt, M. M., et al. Pharmacology of bradykinin-evoked coughing in guinea pigs. J Pharmacol Exp Ther. 357 (3), 620-628 (2016).
- Zhong, S., et al. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models. J Ethnopharmacol. 194, 378-385 (2016).
- Zhong, S., et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure. J Ethnopharmacol. 165, 73-82 (2015).
- Wei, L., et al. Effects of Shiwei longdanhua formula on LPS-induced airway mucus hypersecretion, cough hypersensitivity, oxidative stress and pulmonary inflammation. Biomed Pharmacother. 163, 114793 (2023).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Gibson, P., et al. Treatment of unexplained chronic cough: Chest guideline and expert panel report. Chest. 149 (1), 27-44 (2016).
- Nakaji, H., et al. Airway remodeling associated with cough hypersensitivity as a consequence of persistent cough: An experimental study. Respir Investig. 54 (6), 419-427 (2016).
- Xu, X., et al. Association of cough hypersensitivity with tracheal trpv1 activation and neurogenic inflammation in a novel guinea pig model of citric acid-induced chronic cough. J Int Med Res. 46 (7), 2913-2924 (2018).
- Iwata, T., et al. Mechanical stimulation by postnasal drip evokes cough. PLoS One. 10 (11), e0141823 (2015).
- Chen, L., et al. Establishment of a mouse model with all four clinical features of eosinophilic bronchitis. Sci Rep. 10 (1), 10557 (2020).
- Zhang, C., Lin, R. L., Hong, J., Khosravi, M., Lee, L. Y. Cough and expiration reflexes elicited by inhaled irritant gases are intensified in ovalbumin-sensitized mice. Am J Physiol Regul Integr Comp Physiol. 312 (5), R718-R726 (2017).
- Amato, A., Becci, A., Beolchini, F. Citric acid bioproduction: The technological innovation change. Crit Rev Biotechnol. 40 (2), 199-212 (2020).
- Hu, W., Li, W. J., Yang, H. Q., Chen, J. H. Current strategies and future prospects for enhancing microbial production of citric acid. Appl Microbiol Biotechnol. 103 (1), 201-209 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.