Method Article
クエン酸吸入による咳過敏症マウスモデルの確立
要約
このプロトコルは、慢性咳嗽のメカニズムを研究するための理想的なモデルとして役立つことができる、咳過敏症のマウスモデルの開発について説明しています。
要約
咳は、多くの呼吸器疾患の最も一般的な症状の1つです。慢性的な咳嗽は生活の質に大きな影響を与え、かなりの経済的負担を強います。咳過敏症の増加は、慢性咳嗽の病態生理学的特徴です。咳過敏症は、気道の炎症、気道感覚神経のリモデリング、および中枢神経系の変化に関連していることが観察されています。しかし、その正確な分子メカニズムは未だに解明されておらず、適切な動物モデルを用いてさらに解明する必要があります。これまでの研究では、モルモットを咳の研究モデルとして利用してきたが、これらのモデルには、高コスト、トランスジェニックツールの欠如、市販試薬の不足など、いくつかの実験的な限界がある。さらに、モルモットは通常、刺激にさらされると環境耐性が低く、死亡率が高くなります。対照的に、マウスは小さく、メンテナンスが容易で、費用対効果が高く、遺伝子操作に適しているため、メカニズムの研究に適しています。本研究では、 クエン酸(CA)の連続吸入により咳過敏症のマウスモデルを確立した。このモデルは操作が簡単で、再現性のある結果が得られるため、慢性咳嗽のメカニズムと潜在的な新しい治療法に関するさらなる研究のための貴重なツールとなっています。
概要
咳は、気道から呼吸器分泌物や異物を取り除くのに役立つ重要な防御反射です。しかし、それは多くの呼吸器疾患の最も一般的な症状の1つでもあり、しばしば患者が医師の診察を受けるように促します1。慢性咳嗽は、成人で8週間以上続く持続的な咳嗽と定義され、生活の質に大きく影響し、失禁、不眠症、逆流、その他の不快な経験などの問題を引き起こし、かなりの経済的負担を引き起こします2,3,4。咳過敏症の増加は慢性咳嗽の病態生理学的特徴であると広く信じられており、低レベルの熱的、機械的、化学的刺激物が咳を引き起こす可能性があります5。咳過敏症は、気道炎症6、気道感覚神経のリモデリング7、中枢神経系の変化8と関連しているが、正確な分子メカニズムは不明であり、適切な動物モデルによるさらなる解明が必要である。
モルモット、ネコ、ウサギ、イヌ、ブタなど、さまざまな動物が咳9のメカニズムを研究するために使用されてきました。モルモットは伝統的に、咳のメカニズムと鎮咳薬の有効性を研究するための最も適したモデルとして認識されてきました9,10,11,12。しかし、これらのモデルには、高コスト、トランスジェニックツールの欠如、市販の試薬の不足など、いくつかの実験的な制限があります。さらに、モルモットは、刺激にさらされると、環境耐性が低く、死亡率が高いことがよくあります。対照的に、マウスは小さく、メンテナンスが容易で、費用対効果が高く、遺伝子操作に適しているため、メカニズムの研究に適しています。咳モデルに関する以前の研究は、主に気道の炎症によって引き起こされる咳に焦点を当てており、主に鎮咳薬の有効性と末梢メカニズムの評価に使用されていました13,14。現在、咳過敏症の動物モデルが不足しています。
そこで、クエン酸(CA)の連続吸入による咳過敏症のマウスモデルを確立する方法を紹介します。このモデルは、他の動物モデルと比較して、よりシンプルで構築が容易で、実現可能です。
プロトコル
すべての動物実験手順は、広州医科大学第一附属病院(20230656)の実験動物倫理委員会によって承認されました。この研究では、8〜10週齢、体重20〜25 gの成体雄特異的病原体フリーC57BL / 6マウスを使用しました。使用した試薬や機器の詳細は、資料表に記載されています。
1. 化学試薬の調製
- クエン酸(CA)溶液の調製
- 咳の評価では、3.84 gのクエン酸粉末を生理食塩水に溶解して0.4 M溶液を調製し、最終容量50 mLにします。
- 動物への治療では、9.6 gのクエン酸粉末を生理食塩水に9.6 gを最終容量500 mLまで溶解して、0.1 M溶液を調製します。
- カプサイシン溶液の調製
- 10%エタノールと10%Tween-80を含むPBSに30.5 mgのカプサイシン粉末を溶解して、10 mMのストック溶液を作ります。
- 原液を生理食塩水で1:100に希釈し、100 μMの作業溶液を作ります。
- メタコリン溶液の調製
- 100 mgのメタコリン粉末をPBSに最終容量2 mLに溶解して、50 mg / mL溶液を作ります。.
- この溶液をPBSで希釈して、25 mg/mL、12.5 mg/mL、6.25 mg/mL、および3.125 mg/mLの濃度を得ます。
2.動物の調理
- 住居条件
- 餌と水に自由にアクセスできるケージに入ったイエネズミは、標準的な12時間の明暗サイクルで22±1°Cの温度に維持されています。実験的操作は、摂食環境に順応してから1週間後に行われました。
- 順化
- マウスが摂食環境に1週間順応するのを待ってから、実験操作を行います。
3. モデルの開発
- グループの割り当て
- マウスをモデルグループとコントロールグループにランダムに分け、各グループに8匹のマウスを配置します。
- 露出設定
- マウスを2つの独立したチャンバー(図1を参照)に入れ、それぞれが超音波ネブライザーに接続されています。
- モデル群を0.1 Mクエン酸(CA)エアロゾルに、対照群を0.9%生理食塩水(NS)エアロゾルに噴霧速度3 mL/minで1日2時間、2週間にわたって曝露します( 図2を参照)。曝露のたびにマウスをケージに戻します。
- 咳過敏性評価
- 最後のばく露後、再帰性咳嗽(NS、CA(0.4 M)、およびカプサイシン(100 μM)でチャレンジ)および自発的な咳(チャレンジなし)を評価して、咳の感受性を評価します。
注:モデル開発中の咳感受性の動的変化を監視するには、CA(0.4 M)チャレンジを使用して、0、3、7、および10日目の咳感受性を評価します。
- 最後のばく露後、再帰性咳嗽(NS、CA(0.4 M)、およびカプサイシン(100 μM)でチャレンジ)および自発的な咳(チャレンジなし)を評価して、咳の感受性を評価します。
4. 咳過敏性評価
- 機器の準備
- 非侵襲的な全身プレチスモグラフィー(WBP)システムを使用して、咳の感受性を測定します。チャンバー、流量トランスデューサー、バイアスフロー、およびその他のコンポーネントを、アプリケーションマニュアルに従って接続します( 材料の表を参照)。
- キャリブレーションプロセスを実行して、正確な測定を確保するには、[ キャリブレーション ]ボタンをクリックします。ステータス画面に進行状況が表示され、ステータスバーが100%に達するとキャリブレーションが完了します。
- 咳検出
- マウスの咳嗽研究を作成し、1 分間の順応、10 分間の応答時間、および 10 分間の化学溶液送達のパラメーターを設定します。
- 意識のあるマウスを個々のチャンバーに配置し、チャンバーごとにマウスが1匹だけ存在するようにします。
注意: マウスの尾と指の損傷を避けるために、蓋を閉じる前にマウスがチャンバー内に完全に入っていることを確認してください。 - 1 mLの化学溶液(NS、CA、またはカプサイシン)をネブライザーに加えます。
注: 咳イベントの数は、それぞれが吸気、圧縮、および排出15 の 3 つのフェーズで構成されます ( 図 3 を参照) 研究が始まると記録されます。10分間の録音後、咳の検出が完了します。各動物を検出した後は、二次汚染を避けるためにチャンバーを清掃してください。
5. 気道過敏症(AHR)測定
- 機器の準備
- ステップ4.1の説明に従って機器を準備します。
- AHR測定
- マウスの用量反応試験を作成し、測定タイプ、パラメーター、およびタスクシーケンスを設定します:順応に1分、メタコリン溶液の送達に30秒、応答時間に3分、回復に1分。
- 意識のあるマウスを個々のチャンバーに配置し、チャンバーごとにマウスが1匹だけ存在するようにします。
- 50 μLの化学溶液(PBSまたはメタコリン)をネブライザーに加え、試験を開始します。
- さまざまな濃度のメタコリン(0 mg / mL、3.125 mg / mL、6.25 mg / mL、12.5 mg / mL、25 mg / mL、50 mg / mL)に応答して、気管支収縮の指標であるPenhの値を記録します。.
6.気管支肺胞洗浄コレクション
- 犠牲
- 腹 腔内注射 (施設で承認されたプロトコルに従って) を介して投与されたペントバルビタールナトリウム (50 mg/kg) による過麻酔を使用してマウスを犠牲にします。
- サンプルコレクション
- マウスの眼窩洞から血液を1.5mLの微量遠心チューブに採取し、チューブを氷の上に置きます。血液を3000 x g で4°Cで10分間遠心分離します。 ピペットを使用して上清を採取し、分注し、-80°Cで保存します。
- 胸部を開いて気管を露出させ、22 Gの留置針を気管に挿入し、0.5 mLの予冷済みPBSで3回洗浄して体液を採取することにより、気管支肺胞洗浄液(BALF)を収集します。
- 回収後、BALFを500 x g で4°Cで10分間遠心分離します。 上清を集めて分注し、-80°Cで保存します。 ペレットを100 μLのPBSに再懸濁し、さらなる分析のために細胞塗抹標本を調製します。
- 胸部を開いて肺を露出させ、肺組織を取り出して極低温バイアルに入れることにより、肺組織を採取します。バイアルは、将来の研究のために-80°Cで保存してください。
7. 定量的RT-PCR
- TRIzol試薬を用いて肺組織から全RNAを抽出します。ファーストストランドcDNA合成キットを使用して、製造元の指示に従ってcDNA合成を行います( 材料表を参照)。
- SYBR緑色蛍光を用いたリアルタイム定量PCR解析システムでPCRを実施します。相対的なSPおよびCGRP mRNA発現の定量をβ-Actin9の発現に正規化します。
8. 統計分析
- SEM±データを平均として提示し、 t検定 を使用して2つのグループ間のデータを比較し、 P <0.05を統計的に有意であると考慮します。すべての統計分析は、統計ソフトウェアとグラフ作成ソフトウェアを使用して実施します。
結果
図4Aに示すように、モデル群(CA群)の咳感受性は、対照群(NS群)と比較して、ばく露の1週間後に有意に増加し、この感度の上昇はばく露期間を通じて持続した。対照群マウスもモデル群マウスも、モデリングプロセス中に死亡を経験しませんでした(図4B)。図 4C と図 4D は、曝露後のモデル群で自然発生的な咳嗽イベントの数が有意に増加したことを示しています。さらに、NS(図4Eおよび図4F)、CA(図4Gおよび図4H)、およびカプサイシン(図4Iおよび図4J)によって誘発された咳感受性は、ばく露期間後のモデルグループで大幅に高かった。
図5A、Bでは、2つのグループでは、気管支肺胞洗浄液(BALF)中の炎症細胞の総数と異なる細胞数に有意差はありませんでした。図5C、DはH&E染色を施したBALF細胞を示しています。図6に示すように、モデリング後のモデル群と対照群との間に気道過敏性に有意差はありませんでした。さらに、肺組織における神経原性炎症メディエーターであるCGRPおよびSPの発現レベルをQPCRによって評価しました。その結果、モデルグループではSP発現の有意な増加が示されましたが(図7A)、2つのグループ間でCGRP発現に有意差は観察されませんでした(図7B)。

図1:マウスモデルの露光チャンバー。 露光室はアクリルガラスでできており、寸法は36 cm x 20 cm x 25 cmです。 この図の拡大版を表示するには、ここをクリックしてください。

図2:咳過敏症のマウスモデルの概略図。 クエン酸吸入による咳過敏症のマウスモデルを確立するための模式図。 この図の拡大版を表示するには、ここをクリックしてください。

図3:咳イベントの代表的な画像。 非侵襲的な全身プレチスモグラフィーシステムによって記録された咳イベントの代表的な画像。咳イベントは、(a)吸気、(b)圧縮、(c)排出の3つのフェーズで構成されています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:マウスモデルでの咳の評価。(A)14日間の曝露期間中に0.4Mクエン酸によって誘発された咳イベント。クエン酸(CA)群の咳感受性は、7日間の曝露後、対照群よりも有意に高かった。(B)モデリングプロセス中のコントロールグループとモデルグループの生存曲線。(C-J)モデリング前後の生理食塩水 (NS) (E,F)、クエン酸 (G,H)、およびカプサイシン (I,J) によって誘発される自然咳イベント (C,D) および咳イベント (C,D)データは、平均±SEMとして表され、***Pこの図の拡大版を表示するには、ここをクリックしてください。
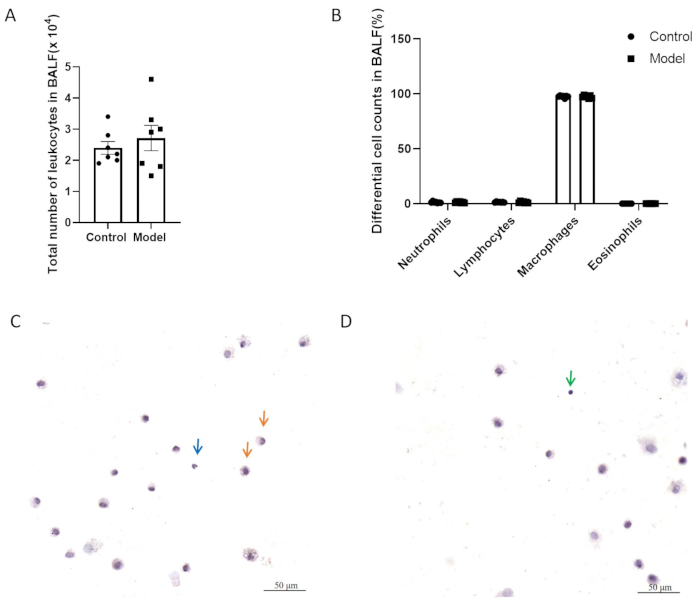
図5:気管支肺胞洗浄液(BALF)中の白血球数。 (A)BALFの白血球の総数。(B)BALFの微分セル数。±(C, D) H&E染色を施したBALF細胞の代表的な画像。矢印はマクロファージ(オレンジ)、好中球(青)、リンパ球(緑)を示しています。スケールバー:50μmこの 図の拡大版を表示するには、ここをクリックしてください。

図6:CA群とNS群の気道抵抗。 クエン酸(CA)群の気道抵抗性は、通常の生理食塩水(NS)群と比較されました。データは平均±SEMとして表されます。 この図の拡大版を表示するには、ここをクリックしてください。

図7:肺組織におけるSPおよびCGRPのmRNA発現レベル。 (A)肺組織におけるサブスタンスP(SP)の相対的なmRNA発現レベル。(B)肺組織におけるカルシトニン遺伝子関連ペプチド(CGRP)の相対mRNA発現レベル。データは、平均±SEMとして表され、NSグループと比較した*P<0.05です。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本研究では、クエン酸(CA)の連続吸入により、咳過敏症のマウスモデルを確立することに成功しました。このモデルは、クエン酸とカプサイシンによって誘発される自発的な咳嗽と反射性咳の両方について、咳の感受性が確実に増加することを示しました。クエン酸とカプサイシンは、咳反射の感受性を評価するために広く使用されています16。
このプロトコルのいくつかの重要なステップにより、その有効性が確保されます。まず、実験に使用する露光室は、完全に気密であってはなりません。適切な換気を確保するために、チャンバーの後ろに通気口を配置する必要があります。次に、チャンバー内の過密を避けることが重要です。マウスの数を10〜12匹に制限することで、潜在的なスタンピードを防ぎます。第三に、曝露後のケアが重要です:各曝露後、マウスは暖かい空気で乾燥させて、毛皮に残っている液体を取り除く必要があります。
モルモットは伝統的に咳のメカニズムを研究し、鎮咳薬を評価するために使用されますが、マウスモデルにはいくつかの利点があります。以前の研究では、クエン酸曝露によって引き起こされる咳過敏症のモルモットモデルが開発されました。例えば、Nakajiらは、モルモットを0.5Mクエン酸に10分間、週に3回、2週間(合計8回の曝露)に曝露した17。同様に、Xuらによる別の研究では、モルモットに0.4Mクエン酸を25日間吸入させることにより、咳の感受性が増加するモデルを確立しました18。しかし、これらのモルモットモデルは、現在のマウスモデルと比較して、咳の感受性があまり顕著ではありませんでした。さらに、モルモットモデルは、トランスジェニックツールや市販試薬の不足などの制限に直面しており、咳過敏症の分子メカニズムの研究を妨げています。
一方、マウスは、メンテナンスが容易で、費用対効果が高く、遺伝子操作に適しています。以前の研究では、マウスも咳の研究に効果的なモデルであることが示されています 15,19,20,21.さらに、マウスは神経科学研究で一般的に使用されており、咳過敏症の中心的なメカニズムを研究するための利点を提供します。したがって、マウスは慢性咳嗽の機構的研究により適していると考えられています。
このモデルは成功裏に確立されましたが、考慮すべきいくつかの制限があります。第一に、クエン酸は、食品、製薬、化学、および冶金業界で一般的に使用されていますが、22,23、人間の咳過敏症を引き起こす実際の曝露条件を正確に模倣していません。第二に、このモデルにおける咳過敏症の正確なメカニズムは不明のままです。肺の炎症は咳感受性の増加の潜在的なメディエーターと考えられていますが 6、気管支肺胞洗浄液 (BALF) の総炎症性細胞数と差のある細胞数の評価では、2 つのグループ間で有意な変化は示されませんでした。さらに、慢性咳嗽の既知の引き金である気管支過敏症24 は、14 日間の曝露後、モデル群と対照群との間の気道抵抗に有意差を示さなかった。
結論として、クエン酸(CA)の連続吸入による咳過敏症のマウスモデルが確立されました。このモデルは操作が簡単で、再現性のある結果が得られるため、慢性咳嗽のメカニズムと潜在的な新しい治療法に関するさらなる研究のための貴重なツールとなっています。
開示事項
著者は何も開示していません。
謝辞
本研究は、中国国家自然科学基金会(NSFC 82100034)、広州科学技術計画プロジェクト(202102010168)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% normal saline | Biosharp | BL158A | |
| Capsaicin | Cayman chemical | 92350 | |
| Citric Acid | Sigma-Aldrich | C2404 | |
| Ethanol | Guangzhou chemical reagent factory | GSHB15-AR-0.5L | |
| First-strand cDNA synthesis kit | TransGen Biotech | AT341 | |
| Methacholine | Sigma-Aldrich | A2251 | |
| Non-invasive whole-body plethysmography (WBP) system | DSI | 601-1400-001 | |
| Pentobarbital sodium | Merk | P3761 | |
| PerfectStart Green qPCR SuperMix | TransGen Biotech | AQ601 | |
| Phosphate Buffered Saline (PBS) | Meilunbio | MA0015 | |
| Real-time quantitative PCR detecting system | Bio-rad | CFX Connect | |
| TRIzol reagent | Invitrogen | 15596026CN | |
| Tween-80 | Solarbio | T8360-100 | |
| Ultrasonic nebulizer | Yuwell | 402AI |
参考文献
- Morice, A. H. Epidemiology of cough. Pulm Pharmacol Ther. 15 (3), 253-259 (2002).
- Lai, K., Long, L. Current status and future directions of chronic cough in China. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional European survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Mazzone, S. B., Undem, B. J. Vagal afferent innervation of the airways in health and disease. Physiol Rev. 96 (3), 975-1024 (2016).
- Shapiro, C. O., et al. Airway sensory nerve density is increased in chronic cough. Am J Respir Crit Care Med. 203 (3), 348-355 (2021).
- Ando, A., et al. Neural correlates of cough hypersensitivity in humans: Evidence for central sensitization and dysfunctional inhibitory control. Thorax. 71 (4), 323-329 (2016).
- Plevkova, J., et al. Animal models of cough. Respir Physiol Neurobiol. 290, 103656 (2021).
- Smith, J. A., Hilton, E. C. Y., Saulsberry, L., Canning, B. J. Antitussive effects of memantine in guinea pigs. Chest. 141 (4), 996-1002 (2012).
- Hewitt, M. M., et al. Pharmacology of bradykinin-evoked coughing in guinea pigs. J Pharmacol Exp Ther. 357 (3), 620-628 (2016).
- Zhong, S., et al. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models. J Ethnopharmacol. 194, 378-385 (2016).
- Zhong, S., et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure. J Ethnopharmacol. 165, 73-82 (2015).
- Wei, L., et al. Effects of Shiwei longdanhua formula on LPS-induced airway mucus hypersecretion, cough hypersensitivity, oxidative stress and pulmonary inflammation. Biomed Pharmacother. 163, 114793 (2023).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Gibson, P., et al. Treatment of unexplained chronic cough: Chest guideline and expert panel report. Chest. 149 (1), 27-44 (2016).
- Nakaji, H., et al. Airway remodeling associated with cough hypersensitivity as a consequence of persistent cough: An experimental study. Respir Investig. 54 (6), 419-427 (2016).
- Xu, X., et al. Association of cough hypersensitivity with tracheal trpv1 activation and neurogenic inflammation in a novel guinea pig model of citric acid-induced chronic cough. J Int Med Res. 46 (7), 2913-2924 (2018).
- Iwata, T., et al. Mechanical stimulation by postnasal drip evokes cough. PLoS One. 10 (11), e0141823 (2015).
- Chen, L., et al. Establishment of a mouse model with all four clinical features of eosinophilic bronchitis. Sci Rep. 10 (1), 10557 (2020).
- Zhang, C., Lin, R. L., Hong, J., Khosravi, M., Lee, L. Y. Cough and expiration reflexes elicited by inhaled irritant gases are intensified in ovalbumin-sensitized mice. Am J Physiol Regul Integr Comp Physiol. 312 (5), R718-R726 (2017).
- Amato, A., Becci, A., Beolchini, F. Citric acid bioproduction: The technological innovation change. Crit Rev Biotechnol. 40 (2), 199-212 (2020).
- Hu, W., Li, W. J., Yang, H. Q., Chen, J. H. Current strategies and future prospects for enhancing microbial production of citric acid. Appl Microbiol Biotechnol. 103 (1), 201-209 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved