Sign In
Method Article
إنشاء نموذج فأر مع فرط حساسية السعال عن طريق استنشاق حامض الستريك
In This Article
Summary
يصف هذا البروتوكول تطوير نموذج فأر يعاني من فرط حساسية السعال ، والذي يمكن أن يكون بمثابة نموذج مثالي لدراسة آليات السعال المزمن.
Abstract
السعال هو أحد أكثر الأعراض شيوعا للعديد من أمراض الجهاز التنفسي. يؤثر السعال المزمن بشكل كبير على نوعية الحياة ويفرض عبئا اقتصاديا كبيرا. زيادة حساسية السعال هي السمة المميزة الفيزيولوجية المرضية للسعال المزمن. وقد لوحظ أن فرط الحساسية للسعال يرتبط بالتهاب مجرى الهواء ، وإعادة تشكيل الأعصاب الحسية لمجرى الهواء ، والتغيرات في الجهاز العصبي المركزي. ومع ذلك ، لا تزال الآليات الجزيئية الدقيقة غير واضحة وتتطلب مزيدا من التوضيح باستخدام نماذج حيوانية مناسبة. استخدمت الدراسات السابقة خنازير غينيا كنماذج لدراسة السعال ، لكن هذه النماذج تمثل العديد من القيود التجريبية ، بما في ذلك التكاليف المرتفعة ، ونقص الأدوات المعدلة وراثيا ، وندرة الكواشف التجارية. بالإضافة إلى ذلك ، تظهر خنازير غينيا عادة تسامحا بيئيا ضعيفا ومعدل وفيات مرتفع عند تعرضها للمنبهات. في المقابل ، تكون الفئران أصغر حجما وأسهل في الصيانة وأكثر فعالية من حيث التكلفة وقابلة للتلاعب الجيني ، مما يجعلها أكثر ملاءمة للتحقيقات الميكانيكية. في هذه الدراسة ، أنشأنا نموذجا للفأر يعاني من فرط حساسية السعال عن طريق الاستنشاق المستمر لحمض الستريك (CA). هذا النموذج سهل التشغيل وينتج عنه نتائج قابلة للتكرار ، مما يجعله أداة قيمة لمزيد من الدراسات حول الآليات والعلاجات الجديدة المحتملة للسعال المزمن.
Introduction
السعال هو رد فعل دفاعي حاسم يساعد على إزالة إفرازات الجهاز التنفسي أو المواد الغريبة من مجرى الهواء. ومع ذلك ، فهو أيضا أحد أكثر الأعراض شيوعا للعديد من أمراض الجهاز التنفسي ، وغالبا ما يدفع المرضى إلى طلب العناية الطبية1. يؤثر السعال المزمن ، الذي يعرف بأنه سعال مستمر يستمر لأكثر من 8 أسابيع عند البالغين ، بشكل كبير على نوعية الحياة ، مما يسبب مشاكل مثل سلس البول والأرق والارتجاع وغيرها من التجارب غير السارة ، إلى جانب عبء اقتصادي كبير2،3،4. يعتقد على نطاق واسع أن زيادة حساسية السعال هي سمة مميزة للسعال المزمن ، حيث يمكن أن تؤدي المستويات المنخفضة من المهيجات الحرارية والميكانيكية والكيميائية إلى السعال5. يرتبط فرط حساسية السعال بالتهاب مجرى الهواء6 ، وإعادة تشكيل الأعصاب الحسية لمجرى الهواء7 ، والتغيرات في الجهاز العصبيالمركزي 8 ، على الرغم من أن الآليات الجزيئية الدقيقة لا تزال غير واضحة وتتطلب مزيدا من التوضيح من خلال نماذج حيوانية مناسبة.
تم استخدام مختلفة ، بما في ذلك خنازير غينيا والقطط والأرانب والخنازير ، لدراسة آليات السعال9. تم الاعتراف بخنازير غينيا تقليديا بأنها النموذج الأنسب لدراسة آليات السعال وفعالية الأدوية المضادةللسعال 9،10،11،12. ومع ذلك ، فإن هذه النماذج لها العديد من القيود التجريبية ، بما في ذلك التكاليف المرتفعة ، ونقص الأدوات المعدلة وراثيا ، وندرة الكواشف التجارية. بالإضافة إلى ذلك ، غالبا ما تظهر خنازير غينيا تسامحا بيئيا ضعيفا ومعدل وفيات مرتفع عند تعرضها للمنبهات. في المقابل ، تكون الفئران أصغر حجما وأسهل في الصيانة وأكثر فعالية من حيث التكلفة وقابلة للتلاعب الجيني ، مما يجعلها أكثر ملاءمة للتحقيقات الميكانيكية. ركزت الدراسات السابقة على نماذج السعال بشكل أساسي على السعال الناجم عن التهاب مجرى الهواء ، ويستخدم بشكل أساسي لتقييم فعالية الأدوية المضادة للسعال والآليات الطرفية13 ، 14. يوجد حاليا نقص في النماذج الحيوانية لفرط حساسية السعال.
ردا على ذلك ، نقدم طريقة لإنشاء نموذج فأر لفرط حساسية السعال عن طريق الاستنشاق المستمر لحمض الستريك (CA). هذا النموذج أبسط وأسهل في البناء وأكثر جدوى مقارنة بالنماذج الحيوانية الأخرى.
Protocol
تمت الموافقة على جميع إجراءات التجارب على من قبل لجنة أخلاقيات المختبر التابعة للمستشفى الأول التابع لجامعة قوانغتشو الطبية (20230656). تم استخدام الفئران البالغة الذكور الخالية من مسببات الأمراض C57BL / 6 ، الذين تتراوح أعمارهم بين 8-10 أسابيع ووزنهم 20-25 جم ، في هذه الدراسة. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. تحضير الكاشف الكيميائي
- تحضير محلول حامض الستريك (CA)
- لتقييم السعال ، قم بإعداد محلول 0.4 متر عن طريق إذابة 3.84 جم من مسحوق حامض الستريك في محلول ملحي عادي إلى حجم نهائي قدره 50 مل.
- لعلاج ، قم بإعداد محلول 0.1 متر عن طريق إذابة 9.6 جم من مسحوق حامض الستريك في محلول ملحي عادي إلى حجم نهائي قدره 500 مل.
- تحضير محلول الكابسيسين
- قم بإذابة 30.5 مجم من مسحوق الكابسيسين في PBS الذي يحتوي على 10٪ إيثانول و 10٪ Tween-80 لصنع محلول مخزون 10 ملليمتر.
- قم بتخفيف محلول المخزون 1: 100 في محلول ملحي عادي لعمل محلول عمل 100 ميكرومتر.
- تحضير محلول الميثاكولين
- قم بإذابة 100 مجم من مسحوق الميثاكولين في PBS إلى حجم نهائي قدره 2 مل لعمل محلول 50 مجم / مل.
- قم بتخفيف هذا المحلول باستخدام PBS للحصول على تركيزات 25 مجم / مل و 12.5 مجم / مل و 6.25 مجم / مل و 3.125 مجم / مل.
2. تحضير
- ظروف السكن
- الفئران المنزلية في أقفاص مع حرية الوصول إلى الطعام والماء ، ويتم الحفاظ عليها عند درجة حرارة 22 ± 1 درجة مئوية مع دورة إضاءة / ظلام قياسية مدتها 12 ساعة. تم إجراء التلاعب التجريبي بعد أسبوع واحد من التأقلم مع بيئة التغذية.
- التأقلم
- اسمح للفئران بالتأقلم مع بيئة التغذية لمدة أسبوع واحد قبل إجراء التلاعب التجريبي.
3. تطوير النموذج
- تعيين المجموعة
- قسم الفئران بشكل عشوائي إلى مجموعة نموذجية ومجموعة تحكم ، مع 8 فئران في كل مجموعة.
- إعداد التعريض الضوئي
- ضع الفئران في غرفتين مستقلتين (كما هو موضح في الشكل 1) ، كل منهما متصل ببخاخات بالموجات فوق الصوتية.
- تعرض المجموعة النموذجية للرذاذ 0.1 M من حامض الستريك (CA) والمجموعة الضابطة إلى 0.9٪ من الهباء الجوي الملحي العادي (NS) بمعدل انحلال 3 مل / دقيقة لمدة ساعتين يوميا على مدار أسبوعين (كما هو موضح في الشكل 2). أعد الفئران إلى أقفاصها بعد كل تعرض.
- تقييم حساسية السعال
- بعد التعرض الأخير ، قم بتقييم حساسية السعال من خلال تقييم السعال الانعكاسي (الذي يواجه تحديا مع NS، CA (0.4 M)، والكبخاخات (100 ميكرومتر)) والسعال التلقائي (دون أي تحدي).
ملاحظة: لمراقبة التغيرات الديناميكية في حساسية السعال أثناء تطوير النموذج ، قم بتقييم حساسية السعال في الأيام 0 و 3 و 7 و 10 باستخدام تحدي CA (0.4 M).
- بعد التعرض الأخير ، قم بتقييم حساسية السعال من خلال تقييم السعال الانعكاسي (الذي يواجه تحديا مع NS، CA (0.4 M)، والكبخاخات (100 ميكرومتر)) والسعال التلقائي (دون أي تحدي).
4. تقييم حساسية السعال
- تحضير الأداة
- استخدم نظام تخطيط التحجم لكامل الجسم (WBP) غير الجراحي لقياس حساسية السعال. قم بتوصيل الغرف ومحولات التدفق وتدفق التحيز والمكونات الأخرى وفقا لدليل التطبيق (انظر جدول المواد).
- قم بإجراء عملية معايرة لضمان قياسات دقيقة من خلال النقر على زر المعايرة . ستعرض شاشة الحالة التقدم، وبمجرد أن يصل شريط الحالة إلى 100٪، تكتمل المعايرة.
- كشف السعال
- قم بإنشاء دراسة سعال للفئران وقم بتكوين المعلمات لمدة دقيقة واحدة من التأقلم ، و 10 دقائق من وقت الاستجابة ، و 10 دقائق من تسليم المحلول الكيميائي.
- ضع الفئران الواعية في غرف فردية ، مع التأكد من وجود فأر واحد فقط لكل حجرة.
ملاحظة: تأكد من وجود الماوس بالكامل داخل الغرفة قبل إغلاق الغطاء لتجنب إتلاف ذيله وأرقامه. - أضف 1 مل من المحاليل الكيميائية (NS، CA، أو الكابسيسين) إلى البخاخات.
ملاحظة: سيتم تسجيل عدد أحداث السعال - كل منها يتكون من ثلاث مراحل: الشهيق ، والضاغط ، والطرد15 (كما هو موضح في الشكل 3) - بمجرد بدء الدراسة. بعد 10 دقائق من التسجيل ، سيكتمل اكتشاف السعال. نظف الغرفة بعد اكتشاف كل لتجنب التلوث المتبادل.
5. قياس فرط الاستجابة في مجرى الهواء (AHR)
- تحضير الأداة
- إعداد الأدوات كما هو موضح في الخطوة 4.1.
- قياس AHR
- قم بإنشاء دراسة استجابة الجرعة للفئران ، وتكوين أنواع القياس والمعلمات وتسلسل المهام: 1 دقيقة للتأقلم ، و 30 ثانية لتسليم محلول الميثاكولين ، و 3 دقائق لوقت الاستجابة ، و 1 دقيقة للاسترداد.
- ضع الفئران الواعية في غرف فردية ، مع التأكد من وجود فأر واحد فقط لكل حجرة.
- أضف 50 ميكرولتر من المحاليل الكيميائية (PBS أو الميثاكولين) إلى البخاخات وابدأ الدراسة.
- سجل قيمة بنه، وهو مؤشر على تضيق الشعب الهوائية، استجابة لتركيزات مختلفة من الميثاكولين (0 ملغم/مل، 3.125 ملغم/مل، 6.25 ملغم/مل، 12.5 ملغم/مل، 25 ملغم/مل، 50 ملغم/مل).
6. جمع غسل القصبات الهوائية
- فداء
- التضحية بالفئران باستخدام فرط التخدير مع البنتوباربيتال الصوديوم (50 ملغم/كغ) الذي يتم إعطاؤه عن طريق الحقن داخل الصفاق (باتباع البروتوكولات المعتمدة مؤسسيا).
- جمع العينات
- اجمع الدم من الجيب الحجاجي للفأر في أنبوب طرد مركزي دقيق سعة 1.5 مل ، ثم ضع الأنبوب على الجليد. قم بالطرد المركزي للدم عند 3000 × جم لمدة 10 دقائق عند 4 درجات مئوية. استخدم ماصة لجمع المادة الطافية ، وقم بتقسيبها ، وتخزينها عند -80 درجة مئوية.
- اجمع سائل غسيل القصبات الهوائية (BALF) عن طريق فتح الصدر لكشف القصبة الهوائية ، وإدخال إبرة 22 جم في القصبة الهوائية ، ثم الغسل ثلاث مرات باستخدام 0.5 مل من PBS المبرد مسبقا وجمع السائل.
- بعد التجميع ، قم بجهاز الطرد المركزي BALF عند 500 × جم لمدة 10 دقائق عند 4 درجات مئوية. اجمع المادة الطافية ، وقم بتخزينها عند -80 درجة مئوية. أعد تعليق الحبيبات في 100 ميكرولتر من PBS وقم بإعداد مسحات الخلايا لمزيد من التحليل.
- اجمع أنسجة الرئة عن طريق فتح الصدر لكشف الرئتين وإزالة أنسجة الرئة ووضعها في قوارير مبردة. قم بتخزين القوارير في درجة حرارة -80 درجة مئوية للدراسات المستقبلية.
7. RT-PCR الكمي
- استخرج الحمض النووي الريبي الكلي من أنسجة الرئة باستخدام كاشف TRIzol. قم بإجراء تخليق (كدنا) باستخدام مجموعة توليف (كدنا) ذات الخيط الأول ، باتباع تعليمات الشركة المصنعة (انظر جدول المواد).
- إجراء تفاعل البوليميراز المتسلسل في نظام الكشف الكمي عن تفاعل البوليميراز المتسلسل في الوقت الفعلي باستخدام التألق الأخضر SYBR. تطبيع التقدير الكمي لتعبير SP و CGRP mRNA النسبي للتعبير عن β-Actin9.
8. التحليل الإحصائي
- اعرض البيانات كمتوسط ± SEM. استخدم اختبار t لمقارنة البيانات بين مجموعتين ، مع الأخذ في الاعتبار P < 0.05 على أنها ذات دلالة إحصائية. إجراء جميع التحليلات الإحصائية باستخدام البرامج الإحصائية والرسوم البيانية.
النتائج
كما هو موضح في الشكل 4 أ ، زادت حساسية السعال في المجموعة النموذجية (مجموعة CA) بشكل ملحوظ بعد أسبوع واحد من التعرض مقارنة بالمجموعة الضابطة (مجموعة NS) ، واستمرت هذه الحساسية المتزايدة طوال فترة التعرض. لم تتعرض المجموعة الضابطة ولا فئران المجموعة النموذجية للوفيات أثناء عملية النمذجة (الشكل 4 ب). يوضح الشكل 4C والشكل 4D أن عدد أحداث السعال التلقائي زاد بشكل كبير في المجموعة النموذجية بعد التعرض. بالإضافة إلى ذلك ، كانت حساسية السعال الناتجة عن NS (الشكل 4E والشكل 4F) و CA (الشكل 4G والشكل 4H) والكابسيسين (الشكل 4I والشكل 4J) أعلى بكثير في مجموعة النموذج بعد فترة التعرض.
في الشكل 5 أ ، ب ، لم يكن لدى المجموعتين فرق كبير في العدد الإجمالي للخلايا الالتهابية وعدد الخلايا التفاضلية في سائل غسل القصبات الهوائية (BALF). يوضح الشكل 5C ، D خلايا BALF مع تلطيخ H & E. كما هو موضح في الشكل 6 ، لم يكن هناك فرق كبير في فرط استجابة مجرى الهواء بين النموذج ومجموعات التحكم بعد النمذجة. بالإضافة إلى ذلك ، تم تقييم مستويات التعبير عن CGRP و SP ، الوسطاء الالتهابيين العصبيين ، في أنسجة الرئة بواسطة QPCR. أشارت النتائج إلى زيادة كبيرة في تعبير SP في المجموعة النموذجية (الشكل 7 أ) ، بينما لم يلاحظ أي فرق كبير في تعبير CGRP بين المجموعتين (الشكل 7 ب).

الشكل 1: غرفة التعرض لنموذج الماوس. غرفة التعريض الضوئي مصنوعة من زجاج الأكريليك ، بأبعاد 36 سم × 20 سم × 25 سم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: تخطيطي لنموذج الماوس مع فرط الحساسية للسعال. رسم تخطيطي لإنشاء نموذج فأر مع فرط حساسية السعال من خلال استنشاق حامض الستريك. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: صور تمثيلية لحدث السعال. صور تمثيلية لحدث سعال تم تسجيله بواسطة نظام تخطيط تحجم الجسم بالكامل غير الغازي. يتكون حدث السعال من ثلاث مراحل: (أ) الشهيق ، (ب) الانضغاطي ، (ج) الطرد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تقييم السعال في نموذج الفأر. (أ) أحداث السعال الناجمة عن 0.4 مليون حامض الستريك خلال فترة التعرض البالغة 14 يوما. كانت حساسية السعال في مجموعة حامض الستريك (CA) أعلى بشكل ملحوظ منها في المجموعة الضابطة بعد 7 أيام من التعرض. (ب) منحنيات البقاء على قيد الحياة لمجموعات التحكم والنماذج أثناء عملية النمذجة. (سي جي) أحداث السعال التلقائي (C ، D) وأحداث السعال الناتجة عن المحلول الملحي الطبيعي (NS) (E ، F) وحمض الستريك (G ، H) والكابسيسين (I ، J) قبل وبعد النمذجة. يتم تمثيل البيانات كمتوسط ± SEM ، ***P < 0.001 مقارنة بمجموعة NS. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
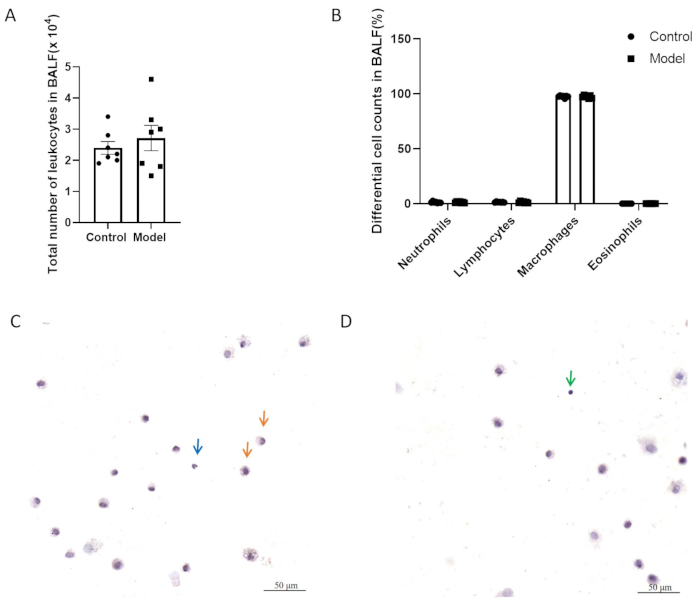
الشكل 5: عدد الكريات البيض في سائل غسل القصبات الهوائية (BALF). (أ) العدد الإجمالي للكريات البيض في BALF. (ب) تعداد الخلايا التفاضلية في BALF. يتم تمثيل البيانات كمتوسط ± SEM. (C ، D) صور تمثيلية لخلايا BALF مع تلطيخ H & E. تشير الأسهم إلى البلاعم (البرتقالية) والعدلات (الزرقاء) والخلايا الليمفاوية (الأخضر). أشرطة المقياس: 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 6: مقاومة مجرى الهواء في مجموعات CA و NS. مقاومة مجرى الهواء في مجموعة حامض الستريك (CA) مقارنة بمجموعة المحلول الملحي الطبيعي (NS). يتم تمثيل البيانات كمتوسط ± التسويق عبر محرك البحث. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: مستويات تعبير mRNA ل SP و CGRP في أنسجة الرئة. (أ) مستويات التعبير النسبية عن الرنا المرسال للمادة P (SP) في أنسجة الرئة. (ب) مستويات التعبير النسبية عن mRNA للببتيد المرتبط بجين الكالسيتونين (CGRP) في أنسجة الرئة. يتم تمثيل البيانات كمتوسط ± SEM ، * P < 0.05 مقارنة بمجموعة NS. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
نجحت هذه الدراسة في إنشاء نموذج فأر يعاني من فرط حساسية السعال من خلال الاستنشاق المستمر لحمض الستريك (CA). أظهر هذا النموذج زيادة موثوقة في حساسية السعال لكل من السعال التلقائي والسعال الانعكاسي الناجم عن حامض الستريك والكابسيسين. يستخدم حامض الستريك والكابسيسين على نطاق واسع لتقييم حساسية منعكس السعال16.
تضمن العديد من الخطوات الحاسمة في هذا البروتوكول فعاليته. أولا ، يجب ألا تكون غرفة التعرض المستخدمة في التجارب محكمة الإغلاق تماما. لضمان التهوية المناسبة ، يجب وضع فتحات في الجزء الخلفي من الغرفة. ثانيا، من المهم تجنب الاكتظاظ داخل الغرفة؛ الحد من عدد الفئران إلى 10-12 يمنع التدافع المحتمل. ثالثا ، تعتبر رعاية ما بعد التعرض أمرا بالغ الأهمية: بعد كل تعرض ، يجب تجفيف الفئران بالهواء الدافئ لإزالة أي سائل متبقي من فرائها.
بينما تستخدم خنازير غينيا تقليديا لدراسة آليات السعال وتقييم الأدوية المضادة للسعال ، فإن نماذج الفئران تقدم العديد من المزايا. طورت الدراسات السابقة نماذج خنزير غينيا لفرط حساسية السعال الناجم عن التعرض لحمض الستريك. على سبيل المثال ، ناكاجي وآخرون عرض خنازير غينيا إلى 0.5 مليون حامض الستريك لمدة 10 دقائق ، ثلاث مرات في الأسبوع لمدة أسبوعين (ثمانية تعرضات في المجموع)17. وبالمثل ، فإن دراسة أخرى أجراها Xu et al. أنشأت نموذجا به حساسية متزايدة للسعال من خلال استنشاق خنازير غينيا 0.4 M من حامض الستريك لمدة 25 يوما18. ومع ذلك ، أظهرت نماذج خنزير غينيا هذه حساسية أقل وضوحا للسعال مقارنة بنموذج الفأر الحالي. بالإضافة إلى ذلك ، تواجه نماذج خنزير غينيا قيودا ، مثل نقص الأدوات المعدلة وراثيا والكواشف التجارية ، مما يعيق دراسة الآليات الجزيئية في فرط حساسية السعال.
الفئران ، من ناحية أخرى ، أسهل في الصيانة وأكثر فعالية من حيث التكلفة وقابلة للتلاعب الجيني. أظهرت الدراسات السابقة أن الفئران هي أيضا نماذج فعالة لدراسة السعال15،19،20،21. بالإضافة إلى ذلك ، تستخدم الفئران بشكل شائع في أبحاث علم الأعصاب ، مما يوفر ميزة لدراسة الآليات المركزية لفرط حساسية السعال. وبالتالي ، تعتبر الفئران أكثر ملاءمة للتحقيقات الميكانيكية للسعال المزمن.
على الرغم من التأسيس الناجح للنموذج ، إلا أن هناك بعض القيود التي يجب مراعاتها. أولا ، حامض الستريك ، على الرغم من استخدامه بشكل شائع في الصناعات الغذائية والصيدلانية والكيميائية والمعدنية22،23 ، لا يحاكي بدقة ظروف التعرض الواقعية التي تؤدي إلى فرط حساسية السعال لدى البشر. ثانيا ، لا تزال الآلية الدقيقة لفرط حساسية السعال في هذا النموذج غير واضحة. في حين أن الالتهاب الرئوي يعتبر وسيطا محتملا لزيادة حساسية السعال6 ، فإن تقييم إجمالي عدد الخلايا الالتهابية وعدد الخلايا التفاضلية في سائل غسل القصبات الهوائية (BALF) لم يظهر أي تغييرات ذات دلالة إحصائية بين المجموعتين. بالإضافة إلى ذلك ، لم يظهر فرط استجابة الشعب الهوائية ، وهو سبب معروف للسعالالمزمن 24 ، فرقا كبيرا في مقاومة مجرى الهواء بين النموذج والمجموعات الضابطة بعد 14 يوما من التعرض.
في الختام ، تم إنشاء نموذج فأر مع فرط حساسية السعال عن طريق الاستنشاق المستمر لحمض الستريك (CA). هذا النموذج سهل التشغيل وينتج عنه نتائج قابلة للتكرار ، مما يجعله أداة قيمة لمزيد من الدراسات حول الآليات والعلاجات الجديدة المحتملة للسعال المزمن.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (NSFC 82100034) ، مشروع قوانغتشو لتخطيط العلوم والتكنولوجيا (202102010168).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% normal saline | Biosharp | BL158A | |
| Capsaicin | Cayman chemical | 92350 | |
| Citric Acid | Sigma-Aldrich | C2404 | |
| Ethanol | Guangzhou chemical reagent factory | GSHB15-AR-0.5L | |
| First-strand cDNA synthesis kit | TransGen Biotech | AT341 | |
| Methacholine | Sigma-Aldrich | A2251 | |
| Non-invasive whole-body plethysmography (WBP) system | DSI | 601-1400-001 | |
| Pentobarbital sodium | Merk | P3761 | |
| PerfectStart Green qPCR SuperMix | TransGen Biotech | AQ601 | |
| Phosphate Buffered Saline (PBS) | Meilunbio | MA0015 | |
| Real-time quantitative PCR detecting system | Bio-rad | CFX Connect | |
| TRIzol reagent | Invitrogen | 15596026CN | |
| Tween-80 | Solarbio | T8360-100 | |
| Ultrasonic nebulizer | Yuwell | 402AI |
References
- Morice, A. H. Epidemiology of cough. Pulm Pharmacol Ther. 15 (3), 253-259 (2002).
- Lai, K., Long, L. Current status and future directions of chronic cough in China. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional European survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Mazzone, S. B., Undem, B. J. Vagal afferent innervation of the airways in health and disease. Physiol Rev. 96 (3), 975-1024 (2016).
- Shapiro, C. O., et al. Airway sensory nerve density is increased in chronic cough. Am J Respir Crit Care Med. 203 (3), 348-355 (2021).
- Ando, A., et al. Neural correlates of cough hypersensitivity in humans: Evidence for central sensitization and dysfunctional inhibitory control. Thorax. 71 (4), 323-329 (2016).
- Plevkova, J., et al. Animal models of cough. Respir Physiol Neurobiol. 290, 103656 (2021).
- Smith, J. A., Hilton, E. C. Y., Saulsberry, L., Canning, B. J. Antitussive effects of memantine in guinea pigs. Chest. 141 (4), 996-1002 (2012).
- Hewitt, M. M., et al. Pharmacology of bradykinin-evoked coughing in guinea pigs. J Pharmacol Exp Ther. 357 (3), 620-628 (2016).
- Zhong, S., et al. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models. J Ethnopharmacol. 194, 378-385 (2016).
- Zhong, S., et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure. J Ethnopharmacol. 165, 73-82 (2015).
- Wei, L., et al. Effects of Shiwei longdanhua formula on LPS-induced airway mucus hypersecretion, cough hypersensitivity, oxidative stress and pulmonary inflammation. Biomed Pharmacother. 163, 114793 (2023).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Gibson, P., et al. Treatment of unexplained chronic cough: Chest guideline and expert panel report. Chest. 149 (1), 27-44 (2016).
- Nakaji, H., et al. Airway remodeling associated with cough hypersensitivity as a consequence of persistent cough: An experimental study. Respir Investig. 54 (6), 419-427 (2016).
- Xu, X., et al. Association of cough hypersensitivity with tracheal trpv1 activation and neurogenic inflammation in a novel guinea pig model of citric acid-induced chronic cough. J Int Med Res. 46 (7), 2913-2924 (2018).
- Iwata, T., et al. Mechanical stimulation by postnasal drip evokes cough. PLoS One. 10 (11), e0141823 (2015).
- Chen, L., et al. Establishment of a mouse model with all four clinical features of eosinophilic bronchitis. Sci Rep. 10 (1), 10557 (2020).
- Zhang, C., Lin, R. L., Hong, J., Khosravi, M., Lee, L. Y. Cough and expiration reflexes elicited by inhaled irritant gases are intensified in ovalbumin-sensitized mice. Am J Physiol Regul Integr Comp Physiol. 312 (5), R718-R726 (2017).
- Amato, A., Becci, A., Beolchini, F. Citric acid bioproduction: The technological innovation change. Crit Rev Biotechnol. 40 (2), 199-212 (2020).
- Hu, W., Li, W. J., Yang, H. Q., Chen, J. H. Current strategies and future prospects for enhancing microbial production of citric acid. Appl Microbiol Biotechnol. 103 (1), 201-209 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.