Method Article
Etablissement d’un modèle murin d’hypersensibilité à la toux par inhalation d’acide citrique
Dans cet article
Résumé
Ce protocole décrit le développement d’un modèle murin présentant une hypersensibilité à la toux, qui peut servir de modèle idéal pour étudier les mécanismes de la toux chronique.
Résumé
La toux est l’un des symptômes les plus courants de nombreuses maladies respiratoires. La toux chronique a un impact significatif sur la qualité de vie et impose un fardeau économique considérable. L’augmentation de la sensibilité à la toux est une caractéristique physiopathologique de la toux chronique. Il a été observé que l’hypersensibilité à la toux est liée à l’inflammation des voies respiratoires, au remodelage des nerfs sensoriels des voies respiratoires et aux altérations du système nerveux central. Cependant, les mécanismes moléculaires précis restent flous et nécessitent une élucidation plus poussée à l’aide de modèles animaux appropriés. Des études antérieures ont utilisé des cobayes comme modèles pour étudier la toux, mais ces modèles présentent plusieurs limites expérimentales, notamment des coûts élevés, un manque d’outils transgéniques et une rareté de réactifs commerciaux. De plus, les cochons d’Inde présentent généralement une faible tolérance à l’environnement et une mortalité élevée lorsqu’ils sont exposés à des stimuli. En revanche, les souris sont plus petites, plus faciles à entretenir, plus rentables et plus susceptibles d’être manipulées génétiquement, ce qui les rend plus adaptées aux investigations mécanistes. Dans cette étude, nous avons établi un modèle murin d’hypersensibilité à la toux via l’inhalation continue d’acide citrique (AC). Ce modèle est simple à utiliser et donne des résultats reproductibles, ce qui en fait un outil précieux pour des études ultérieures sur les mécanismes et les nouveaux traitements potentiels de la toux chronique.
Introduction
La toux est un réflexe défensif crucial qui aide à éliminer les sécrétions respiratoires ou les corps étrangers des voies respiratoires. Cependant, c’est aussi l’un des symptômes les plus courants de nombreuses maladies respiratoires, incitant souvent les patients à consulter un médecin1. La toux chronique, définie comme une toux persistante qui dure plus de 8 semaines chez les adultes, a un impact significatif sur la qualité de vie, causant des problèmes tels que l’incontinence, l’insomnie, le reflux et d’autres expériences désagréables, ainsi qu’un fardeau économique substantiel 2,3,4. Il est largement admis que l’augmentation de la sensibilité à la toux est une caractéristique physiopathologique de la toux chronique, où de faibles niveaux d’irritants thermiques, mécaniques et chimiques peuvent déclencher la toux5. L’hypersensibilité à la toux est associée à une inflammation des voies respiratoires6, à un remodelage des nerfs sensoriels des voies respiratoires7 et à des altérations du système nerveux central8, bien que les mécanismes moléculaires précis restent flous et nécessitent une élucidation plus approfondie par des modèles animaux appropriés.
Divers animaux, y compris les cochons d’Inde, les chats, les lapins, les chiens et les cochons, ont été utilisés pour étudier les mécanismes de la toux9. Les cobayes ont traditionnellement été reconnus comme le modèle le plus approprié pour étudier les mécanismes de la toux et l’efficacité des médicaments antitussifs 9,10,11,12. Cependant, ces modèles présentent plusieurs limites expérimentales, notamment des coûts élevés, un manque d’outils transgéniques et une rareté de réactifs commerciaux. De plus, les cochons d’Inde présentent souvent une faible tolérance à l’environnement et une mortalité élevée lorsqu’ils sont exposés à des stimuli. En revanche, les souris sont plus petites, plus faciles à entretenir, plus rentables et plus susceptibles d’être manipulées génétiquement, ce qui les rend plus adaptées aux investigations mécanistes. Des études antérieures sur des modèles de toux se sont principalement concentrées sur la toux induite par l’inflammation des voies respiratoires, principalement utilisée pour évaluer l’efficacité des médicaments antitussifs et des mécanismes périphériques13,14. Il y a actuellement un manque de modèles animaux pour l’hypersensibilité à la toux.
En réponse, nous introduisons une méthode pour établir un modèle murin d’hypersensibilité à la toux via l’inhalation continue d’acide citrique (AC). Ce modèle est plus simple, plus facile à construire et plus réalisable par rapport à d’autres modèles animaux.
Protocole
Toutes les procédures d’expérimentation animale ont été approuvées par le Comité d’éthique des animaux de laboratoire du premier hôpital affilié de l’Université de médecine de Guangzhou (20230656). Des souris C57BL/6 mâles adultes exemptes d’agents pathogènes spécifiques, âgées de 8 à 10 semaines et pesant de 20 à 25 g, ont été utilisées dans cette étude. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. Préparation des réactifs chimiques
- Préparation d’une solution d’acide citrique (CA)
- Pour l’évaluation de la toux, préparez une solution à 0,4 M en dissolvant 3,84 g de poudre d’acide citrique dans une solution saline normale jusqu’à ce qu’elle atteigne un volume final de 50 ml.
- Pour le traitement des animaux, préparer une solution 0,1 M en dissolvant 9,6 g de poudre d’acide citrique dans une solution saline normale jusqu’à un volume final de 500 mL.
- Préparation de la solution de capsaïcine
- Dissoudre 30,5 mg de poudre de capsaïcine dans du PBS contenant 10 % d’éthanol et 10 % de Tween-80 pour obtenir une solution mère de 10 mM.
- Diluer la solution mère 1:100 dans une solution saline normale pour obtenir une solution de travail de 100 μM.
- Préparation de la solution de méthacholine
- Dissoudre 100 mg de poudre de méthacholine dans du PBS jusqu’à ce qu’il atteigne un volume final de 2 mL pour obtenir une solution à 50 mg/mL.
- Diluez cette solution avec du PBS pour obtenir des concentrations de 25 mg/mL, 12,5 mg/mL, 6,25 mg/mL et 3,125 mg/mL.
2. Préparation des animaux
- Conditions de logement
- Souris domestiques dans des cages avec accès libre à la nourriture et à l’eau, maintenues à une température de 22 ± 1 °C avec un cycle standard lumière/obscurité de 12 heures. Des manipulations expérimentales ont été effectuées après 1 semaine d’acclimatation à l’environnement alimentaire.
- Acclimatation
- Laissez les souris s’acclimater à l’environnement d’alimentation pendant 1 semaine avant d’effectuer des manipulations expérimentales.
3. Développement du modèle
- Affectation de groupe
- Divisez au hasard les souris en un groupe modèle et un groupe témoin, avec 8 souris dans chaque groupe.
- Configuration de l’exposition
- Placez les souris dans deux chambres indépendantes (comme illustré à la figure 1), chacune reliée à un nébuliseur à ultrasons.
- Exposer le groupe modèle à un aérosol d’acide citrique (AC) à 0,1 M et le groupe témoin à un aérosol salin normal (NS) à 0,9 % à un taux d’atomisation de 3 mL/min pendant 2 h par jour pendant 2 semaines (comme le montre la figure 2). Remettez les souris dans leurs cages après chaque exposition.
- Évaluation de la sensibilité à la toux
- Après la dernière exposition, évaluer la sensibilité à la toux en évaluant la toux réflexe (stimulée par NS, CA (0,4 M) et capsaïcine (100 μM)) et la toux spontanée (sans aucune provocation).
REMARQUE : Pour surveiller les changements dynamiques de la sensibilité à la toux pendant l’élaboration du modèle, évaluez la sensibilité à la toux aux jours 0, 3, 7 et 10 à l’aide d’un test d’AC (0,4 M).
- Après la dernière exposition, évaluer la sensibilité à la toux en évaluant la toux réflexe (stimulée par NS, CA (0,4 M) et capsaïcine (100 μM)) et la toux spontanée (sans aucune provocation).
4. Évaluation de la sensibilité à la toux
- Préparation de l’instrument
- Utilisez un système non invasif de pléthysmographie du corps entier (WBP) pour mesurer la sensibilité à la toux. Connectez les chambres, les transducteurs de débit, le flux de polarisation et d’autres composants conformément au manuel d’application (voir le tableau des matériaux).
- Effectuez un processus d’étalonnage pour garantir des mesures précises en cliquant sur le bouton Calibrer . Un écran d’état affichera la progression, et une fois que la barre d’état atteint 100 %, l’étalonnage est terminé.
- Détection de la toux
- Créez une étude sur la toux chez la souris et configurez les paramètres pour 1 min d’acclimatation, 10 min de temps de réponse et 10 min d’administration de solution chimique.
- Placez les souris conscientes dans des chambres individuelles, en vous assurant qu’il n’y a qu’une seule souris par chambre.
REMARQUE : Assurez-vous que la souris est complètement à l’intérieur de la chambre avant de fermer le couvercle pour éviter d’endommager sa queue et ses doigts. - Ajouter 1 mL de solutions chimiques (NS, CA ou capsaïcine) dans le nébuliseur.
REMARQUE : Le nombre de quintes de toux, chacune composée de trois phases : inspiratoire, compressive et expulsive15 (comme le montre la figure 3), sera enregistré une fois l’étude commencée. Après 10 min d’enregistrement, la détection de la toux sera terminée. Nettoyez la chambre après avoir détecté chaque animal pour éviter la contamination croisée.
5. Mesure de l’hyperréactivité des voies respiratoires (AHR)
- Préparation de l’instrument
- Préparez les instruments comme décrit à l’étape 4.1.
- Mesure de l’AHR
- Créez une étude dose-réponse pour les souris, en configurant les types de mesures, les paramètres et la séquence des tâches : 1 min pour l’acclimatation, 30 s pour l’administration de la solution de méthacholine, 3 min pour le temps de réponse et 1 min pour la récupération.
- Placez les souris conscientes dans des chambres individuelles, en vous assurant qu’il n’y a qu’une seule souris par chambre.
- Ajouter 50 μL de solutions chimiques (PBS ou méthacholine) dans le nébuliseur et commencer l’étude.
- Noter la valeur de Penh, un indicateur de bronchoconstriction, en réponse à différentes concentrations de méthacholine (0 mg/mL, 3,125 mg/mL, 6,25 mg/mL, 12,5 mg/mL, 25 mg/mL, 50 mg/mL).
6. Prélèvement de lavage broncho-alvéolaire
- Sacrifice
- Sacrifiez les souris en utilisant une hyperanesthésie avec du pentobarbital sodique (50 mg/kg) administré par injection intrapéritonéale (selon les protocoles approuvés par l’établissement).
- Prélèvement d’échantillons
- Prélevez du sang du sinus orbitaire de la souris dans un tube de microcentrifugation de 1,5 ml, puis placez le tube sur de la glace. Centrifuger le sang à 3000 x g pendant 10 min à 4°C. À l’aide d’une pipette, recueillez le surnageant, aliquotez-le et conservez-le à -80 °C.
- Prélever le liquide de lavage broncho-alvéolaire (BALF) en ouvrant le thorax pour exposer la trachée, en insérant une aiguille à demeure de 22 G dans la trachée, puis en lavant trois fois avec 0,5 mL de PBS pré-refroidi et en recueillant le liquide.
- Après le prélèvement, centrifuger le BALF à 500 x g pendant 10 min à 4 °C. Récupérez le surnageant, aliquotez-le et stockez-le à -80 °C. Remettre la pastille en suspension dans 100 μL de PBS et préparer des frottis cellulaires pour une analyse plus approfondie.
- Prélevez les tissus pulmonaires en ouvrant la poitrine pour exposer les poumons, en retirant les tissus pulmonaires et en les plaçant dans des flacons cryogéniques. Conservez les flacons à -80 °C pour les études futures.
7. RT-PCR quantitative
- Extraire l’ARN total du tissu pulmonaire à l’aide du réactif TRIzol. Effectuez la synthèse de l’ADNc à l’aide d’un kit de synthèse d’ADNc premier brin, en suivant les instructions du fabricant (voir la table des matériaux).
- Effectuez une PCR dans un système de détection PCR quantitative en temps réel à l’aide de la fluorescence verte SYBR. Normaliser la quantification de l’expression relative de l’ARNm SP et CGRP à l’expression de la β-actine9.
8. Analyse statistique
- Présentez les données sous forme ± moyenne SEM. Utilisez un test t pour comparer les données entre deux groupes, en considérant que P < 0,05 comme statistiquement significatif. Effectuer toutes les analyses statistiques à l’aide de logiciels statistiques et graphiques.
Résultats
Comme le montre la figure 4A, la sensibilité à la toux dans le groupe modèle (groupe CA) a augmenté de manière significative après 1 semaine d’exposition par rapport au groupe témoin (groupe NS), et cette sensibilité accrue a persisté tout au long de la période d’exposition. Ni les souris du groupe témoin ni celles du groupe modèle n’ont connu de mortalité au cours du processus de modélisation (figure 4B). Les figures 4C et 4D montrent que le nombre d’épisodes de toux spontanée a augmenté de manière significative dans le groupe modèle après l’exposition. De plus, la sensibilité à la toux provoquée par la NS (figures 4E et Figure 4F), l’AC (figure 4G et Figure 4H) et la capsaïcine (figure 4I et figure 4J) était considérablement plus élevée dans le groupe modèle après la période d’exposition.
Dans les figures 5A, B, les deux groupes n’ont pas présenté de différence significative dans le nombre total de cellules inflammatoires et le nombre différentiel de cellules dans le liquide de lavage broncho-alvéolaire (BALF). La figure 5C,D montre des cellules BALF avec coloration H&E. Comme le montre la figure 6, il n’y avait pas de différence significative dans l’hyperréactivité des voies respiratoires entre le modèle et les groupes témoins après la modélisation. De plus, les niveaux d’expression du CGRP et du SP, médiateurs inflammatoires neurogènes, dans le tissu pulmonaire ont été évalués par QPCR. Les résultats ont indiqué une augmentation significative de l’expression de SP dans le groupe modèle (figure 7A), tandis qu’aucune différence significative dans l’expression de CGRP n’a été observée entre les deux groupes (figure 7B).

Figure 1 : Chambre d’exposition pour modèle murin. La chambre d’exposition est en verre acrylique, avec des dimensions de 36 cm x 20 cm x 25 cm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Schéma du modèle murin avec hypersensibilité à la toux. Illustration schématique de l’établissement d’un modèle murin d’hypersensibilité à la toux par inhalation d’acide citrique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Images représentatives d’une quinte de toux. Images représentatives d’un épisode de toux enregistré par un système de pléthysmographie corps entier non invasif. La toux se compose de trois phases : (a) inspiratoire, (b) compressive et (c) expulsive. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Évaluation de la toux dans un modèle murin. (A) Toux provoquée par l’acide citrique 0,4 M pendant la période d’exposition de 14 jours. La sensibilité à la toux dans le groupe acide citrique (AC) était significativement plus élevée que dans le groupe témoin après 7 jours d’exposition. (B) Courbes de survie des groupes de contrôle et des groupes de modèles au cours du processus de modélisation. (C-J) Toux spontanée (C,D) et toux provoquée par une solution saline normale (NS) (E,F), de l’acide citrique (G,H) et de la capsaïcine (I,J) avant et après la modélisation. Les données sont représentées par la moyenne ± MEB, ***P < 0,001 par rapport au groupe NS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
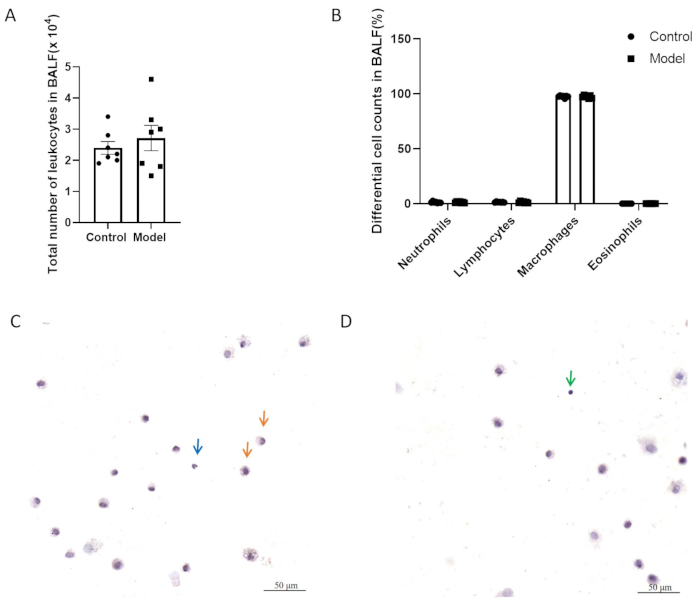
Figure 5 : Numération des leucocytes dans le liquide de lavage broncho-alvéolaire (BALF). (A) Nombre total de leucocytes dans BALF. (B) Numération différentielle des cellules dans BALF. Les données sont représentées sous la forme de la moyenne ± MEB. (C, D) Images représentatives des cellules BALF avec coloration H&E. Les flèches indiquent les macrophages (orange), les neutrophiles (bleu) et les lymphocytes (vert). Barres d’échelle : 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Résistance des voies respiratoires dans les groupes CA et NS. Résistance des voies respiratoires dans le groupe de l’acide citrique (AC) par rapport au groupe salin normal (NS). Les données sont représentées par la moyenne ± SEM. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Niveaux d’expression de l’ARNm de SP et CGRP dans le tissu pulmonaire. (A) Niveaux relatifs d’expression de l’ARNm de la substance P (SP) dans le tissu pulmonaire. (B) Niveaux relatifs d’expression de l’ARNm du peptide lié au gène de la calcitonine (CGRP) dans le tissu pulmonaire. Les données sont représentées par la moyenne ± MEB, *P < 0,05 par rapport au groupe NS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette étude a permis d’établir un modèle murin d’hypersensibilité à la toux par inhalation continue d’acide citrique (AC). Ce modèle a démontré une augmentation fiable de la sensibilité à la toux pour les toux spontanées et les toux réflexes provoquées par l’acide citrique et la capsaïcine. L’acide citrique et la capsaïcine sont largement utilisés pour évaluer la sensibilité du réflexe de toux16.
Plusieurs étapes critiques de ce protocole garantissent son efficacité. Tout d’abord, la chambre d’exposition utilisée pour les expériences ne doit pas être complètement étanche à l’air. Pour assurer une bonne ventilation, des évents doivent être placés à l’arrière de la chambre. Deuxièmement, il est important d’éviter l’engorgement de l’hémicycle. Limiter le nombre de souris à 10-12 empêche les bousculades potentielles. Troisièmement, les soins post-exposition sont cruciaux : après chaque exposition, les souris doivent être séchées à l’air chaud pour éliminer tout liquide restant de leur fourrure.
Alors que les cobayes sont traditionnellement utilisés pour étudier les mécanismes de la toux et évaluer les médicaments antitussifs, les modèles murins offrent plusieurs avantages. Des études antérieures ont mis au point des modèles de cobaye d’hypersensibilité à la toux induite par l’exposition à l’acide citrique. Par exemple, Nakaji et al. ont exposé des cobayes à 0,5 M d’acide citrique pendant 10 minutes, trois fois par semaine pendant 2 semaines (huit expositions au total)17. De même, une autre étude de Xu et al. a établi un modèle avec une sensibilité accrue à la toux en faisant inhaler à des cobayes 0,4 M d’acide citrique pendant 25 jours18. Cependant, ces modèles de cobayes présentaient une sensibilité à la toux moins prononcée que le modèle murin actuel. De plus, les modèles de cobayes sont confrontés à des limites, telles que le manque d’outils transgéniques et de réactifs commerciaux, ce qui entrave l’étude des mécanismes moléculaires de l’hypersensibilité à la toux.
Les souris, en revanche, sont plus faciles à entretenir, plus rentables et plus susceptibles d’être manipulées génétiquement. Des études antérieures ont montré que les souris sont également des modèles efficaces pour l’étude de la toux 15,19,20,21. De plus, les souris sont couramment utilisées dans la recherche en neurosciences, ce qui offre un avantage pour l’étude des mécanismes centraux de l’hypersensibilité à la toux. Ainsi, les souris sont considérées comme plus appropriées pour les investigations mécanistes de la toux chronique.
Malgré la mise en place réussie du modèle, il y a certaines limites à prendre en compte. Tout d’abord, l’acide citrique, bien qu’il soit couramment utilisé dans les industries alimentaire, pharmaceutique, chimique et métallurgique22,23, n’imite pas avec précision les conditions d’exposition réelles qui entraînent une hypersensibilité à la toux chez l’homme. Deuxièmement, le mécanisme précis de l’hypersensibilité à la toux dans ce modèle reste incertain. Alors que l’inflammation pulmonaire est considérée comme un médiateur potentiel de l’augmentation de la sensibilité à la toux6, l’évaluation du nombre total de cellules inflammatoires et du nombre différentiel de cellules dans le liquide de lavage broncho-alvéolaire (BALF) n’a montré aucun changement significatif entre les deux groupes. De plus, l’hyperréactivité bronchique, un déclencheur connu de la toux chronique24, n’a montré aucune différence significative dans la résistance des voies respiratoires entre le modèle et les groupes témoins après 14 jours d’exposition.
En conclusion, un modèle murin d’hypersensibilité à la toux a été établi via l’inhalation continue d’acide citrique (AC). Ce modèle est simple à utiliser et donne des résultats reproductibles, ce qui en fait un outil précieux pour des études ultérieures sur les mécanismes et les nouveaux traitements potentiels de la toux chronique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par la Fondation nationale des sciences naturelles de Chine (NSFC 82100034), le Projet de planification scientifique et technologique de Guangzhou (202102010168).
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% normal saline | Biosharp | BL158A | |
| Capsaicin | Cayman chemical | 92350 | |
| Citric Acid | Sigma-Aldrich | C2404 | |
| Ethanol | Guangzhou chemical reagent factory | GSHB15-AR-0.5L | |
| First-strand cDNA synthesis kit | TransGen Biotech | AT341 | |
| Methacholine | Sigma-Aldrich | A2251 | |
| Non-invasive whole-body plethysmography (WBP) system | DSI | 601-1400-001 | |
| Pentobarbital sodium | Merk | P3761 | |
| PerfectStart Green qPCR SuperMix | TransGen Biotech | AQ601 | |
| Phosphate Buffered Saline (PBS) | Meilunbio | MA0015 | |
| Real-time quantitative PCR detecting system | Bio-rad | CFX Connect | |
| TRIzol reagent | Invitrogen | 15596026CN | |
| Tween-80 | Solarbio | T8360-100 | |
| Ultrasonic nebulizer | Yuwell | 402AI |
Références
- Morice, A. H. Epidemiology of cough. Pulm Pharmacol Ther. 15 (3), 253-259 (2002).
- Lai, K., Long, L. Current status and future directions of chronic cough in China. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional European survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Mazzone, S. B., Undem, B. J. Vagal afferent innervation of the airways in health and disease. Physiol Rev. 96 (3), 975-1024 (2016).
- Shapiro, C. O., et al. Airway sensory nerve density is increased in chronic cough. Am J Respir Crit Care Med. 203 (3), 348-355 (2021).
- Ando, A., et al. Neural correlates of cough hypersensitivity in humans: Evidence for central sensitization and dysfunctional inhibitory control. Thorax. 71 (4), 323-329 (2016).
- Plevkova, J., et al. Animal models of cough. Respir Physiol Neurobiol. 290, 103656 (2021).
- Smith, J. A., Hilton, E. C. Y., Saulsberry, L., Canning, B. J. Antitussive effects of memantine in guinea pigs. Chest. 141 (4), 996-1002 (2012).
- Hewitt, M. M., et al. Pharmacology of bradykinin-evoked coughing in guinea pigs. J Pharmacol Exp Ther. 357 (3), 620-628 (2016).
- Zhong, S., et al. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models. J Ethnopharmacol. 194, 378-385 (2016).
- Zhong, S., et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure. J Ethnopharmacol. 165, 73-82 (2015).
- Wei, L., et al. Effects of Shiwei longdanhua formula on LPS-induced airway mucus hypersecretion, cough hypersensitivity, oxidative stress and pulmonary inflammation. Biomed Pharmacother. 163, 114793 (2023).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Gibson, P., et al. Treatment of unexplained chronic cough: Chest guideline and expert panel report. Chest. 149 (1), 27-44 (2016).
- Nakaji, H., et al. Airway remodeling associated with cough hypersensitivity as a consequence of persistent cough: An experimental study. Respir Investig. 54 (6), 419-427 (2016).
- Xu, X., et al. Association of cough hypersensitivity with tracheal trpv1 activation and neurogenic inflammation in a novel guinea pig model of citric acid-induced chronic cough. J Int Med Res. 46 (7), 2913-2924 (2018).
- Iwata, T., et al. Mechanical stimulation by postnasal drip evokes cough. PLoS One. 10 (11), e0141823 (2015).
- Chen, L., et al. Establishment of a mouse model with all four clinical features of eosinophilic bronchitis. Sci Rep. 10 (1), 10557 (2020).
- Zhang, C., Lin, R. L., Hong, J., Khosravi, M., Lee, L. Y. Cough and expiration reflexes elicited by inhaled irritant gases are intensified in ovalbumin-sensitized mice. Am J Physiol Regul Integr Comp Physiol. 312 (5), R718-R726 (2017).
- Amato, A., Becci, A., Beolchini, F. Citric acid bioproduction: The technological innovation change. Crit Rev Biotechnol. 40 (2), 199-212 (2020).
- Hu, W., Li, W. J., Yang, H. Q., Chen, J. H. Current strategies and future prospects for enhancing microbial production of citric acid. Appl Microbiol Biotechnol. 103 (1), 201-209 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon