Method Article
Etablierung eines Mausmodells mit Hustenüberempfindlichkeit durch Inhalation von Zitronensäure
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Entwicklung eines Mausmodells mit Hustenüberempfindlichkeit, das als ideales Modell für die Untersuchung der Mechanismen des chronischen Hustens dienen kann.
Zusammenfassung
Husten ist eines der häufigsten Symptome vieler Atemwegserkrankungen. Chronischer Husten beeinträchtigt die Lebensqualität erheblich und stellt eine erhebliche wirtschaftliche Belastung dar. Eine erhöhte Hustenempfindlichkeit ist ein pathophysiologisches Kennzeichen des chronischen Hustens. Es wurde beobachtet, dass Hustenüberempfindlichkeit mit einer Entzündung der Atemwege, dem Umbau der sensorischen Nerven der Atemwege und Veränderungen im Zentralnervensystem zusammenhängt. Die genauen molekularen Mechanismen sind jedoch noch unklar und bedürfen weiterer Aufklärung mit geeigneten Tiermodellen. Frühere Studien haben Meerschweinchen als Modelle für die Untersuchung von Husten verwendet, aber diese Modelle weisen mehrere experimentelle Einschränkungen auf, darunter hohe Kosten, einen Mangel an transgenen Werkzeugen und einen Mangel an kommerziellen Reagenzien. Darüber hinaus weisen Meerschweinchen in der Regel eine geringe Umweltverträglichkeit und eine hohe Sterblichkeit auf, wenn sie Reizen ausgesetzt sind. Im Gegensatz dazu sind Mäuse kleiner, pflegeleichter, kostengünstiger und anfällig für genetische Manipulationen, wodurch sie sich besser für mechanistische Untersuchungen eignen. In dieser Studie haben wir ein Mausmodell mit Hustenüberempfindlichkeit durch kontinuierliche Inhalation von Zitronensäure (CA) etabliert. Dieses Modell ist einfach zu bedienen und liefert reproduzierbare Ergebnisse, was es zu einem wertvollen Werkzeug für weitere Studien über die Mechanismen und potenziellen neuen Behandlungen von chronischem Husten macht.
Einleitung
Husten ist ein wichtiger Abwehrreflex, der hilft, Atemwegssekrete oder Fremdstoffe aus den Atemwegen zu entfernen. Sie ist aber auch eines der häufigsten Symptome vieler Atemwegserkrankungen und veranlasst Patienten oft, einen Arzt aufzusuchen1. Chronischer Husten, definiert als ein anhaltender Husten, der bei Erwachsenen länger als 8 Wochen anhält, beeinträchtigt die Lebensqualität erheblich und verursacht Probleme wie Inkontinenz, Schlaflosigkeit, Reflux und andere unangenehme Erfahrungen sowie eine erhebliche wirtschaftliche Belastung 2,3,4. Es wird allgemein angenommen, dass eine erhöhte Hustenempfindlichkeit ein pathophysiologisches Kennzeichen von chronischem Husten ist, bei dem geringe Mengen an thermischen, mechanischen und chemischen Reizstoffen Husten auslösen können5. Hustenüberempfindlichkeit ist mit einer Entzündung der Atemwege6, einem Umbau der sensorischen Nerven der Atemwege7 und Veränderungen im Zentralnervensystem8 verbunden, obwohl die genauen molekularen Mechanismen unklar bleiben und einer weiteren Aufklärung durch geeignete Tiermodelle bedürfen.
Verschiedene Tiere, darunter Meerschweinchen, Katzen, Kaninchen, Hunde und Schweine, wurden verwendet, um die Mechanismen des Hustens zu untersuchen9. Meerschweinchen gelten traditionell als das am besten geeignete Modell für die Untersuchung der Hustenmechanismen und der Wirksamkeit von Hustenmitteln 9,10,11,12. Diese Modelle weisen jedoch mehrere experimentelle Einschränkungen auf, darunter hohe Kosten, einen Mangel an transgenen Werkzeugen und einen Mangel an kommerziellen Reagenzien. Darüber hinaus weisen Meerschweinchen oft eine geringe Umweltverträglichkeit und eine hohe Sterblichkeit auf, wenn sie Reizen ausgesetzt sind. Im Gegensatz dazu sind Mäuse kleiner, pflegeleichter, kostengünstiger und anfällig für genetische Manipulationen, wodurch sie sich besser für mechanistische Untersuchungen eignen. Frühere Studien zu Hustenmodellen konzentrierten sich hauptsächlich auf Husten, der durch Atemwegsentzündungen induziert wurde, und wurden hauptsächlich zur Bewertung der Wirksamkeit von Hustenmitteln und peripheren Mechanismen verwendet13,14. Derzeit fehlt es an Tiermodellen für die Hustenüberempfindlichkeit.
Als Reaktion darauf stellen wir eine Methode vor, mit der ein Mausmodell für Hustenüberempfindlichkeit durch kontinuierliche Inhalation von Zitronensäure (CA) etabliert werden kann. Dieses Modell ist einfacher, leichter zu konstruieren und im Vergleich zu anderen Tiermodellen praktikabler.
Protokoll
Alle Tierversuche wurden von der Ethikkommission für Labortiere des First Affiliated Hospital der Guangzhou Medical University (20230656) genehmigt. In dieser Studie wurden adulte männliche spezifisch pathogenfreie C57BL/6-Mäuse im Alter von 8-10 Wochen und mit einem Gewicht von 20-25 g verwendet. Die Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Herstellung chemischer Reagenzien
- Zubereitung der Zitronensäure (CA)-Lösung
- Für die Beurteilung des Hustens bereiten Sie eine 0,4-M-Lösung vor, indem Sie 3,84 g Zitronensäurepulver in normaler Kochsalzlösung auf ein Endvolumen von 50 ml auflösen.
- Für die Behandlung von Tieren ist eine 0,1-M-Lösung herzustellen, indem 9,6 g Zitronensäurepulver in normaler Kochsalzlösung auf ein Endvolumen von 500 ml aufgelöst werden.
- Zubereitung der Capsaicin-Lösung
- 30,5 mg Capsaicin-Pulver werden in PBS gelöst, das 10 % Ethanol und 10 % Tween-80 enthält, um eine 10 mM Stammlösung herzustellen.
- Verdünnen Sie die Stammlösung 1:100 in normaler Kochsalzlösung, um eine Arbeitslösung von 100 μM herzustellen.
- Zubereitung der Methacholinlösung
- Lösen Sie 100 mg Methacholinpulver in PBS auf ein Endvolumen von 2 ml, um eine Lösung von 50 mg/ml herzustellen.
- Verdünnen Sie diese Lösung mit PBS, um Konzentrationen von 25 mg/ml, 12,5 mg/ml, 6,25 mg/ml und 3,125 mg/ml zu erhalten.
2. Vorbereitung der Tiere
- Bedingungen der Unterbringung
- Halten Sie Mäuse in Käfigen mit freiem Zugang zu Futter und Wasser, die bei einer Temperatur von 22 ± 1 °C mit einem standardmäßigen Hell-Dunkel-Zyklus von 12 Stunden gehalten werden. Experimentelle Manipulationen wurden nach 1 Woche Eingewöhnung an die Fütterungsumgebung durchgeführt.
- Akklimatisierung
- Lassen Sie die Mäuse sich 1 Woche lang an die Fütterungsumgebung gewöhnen, bevor Sie experimentelle Manipulationen durchführen.
3. Entwicklung des Modells
- Gruppenzuordnung
- Teilen Sie die Mäuse nach dem Zufallsprinzip in eine Modellgruppe und eine Kontrollgruppe mit jeweils 8 Mäusen auf.
- Belichtung einrichten
- Platzieren Sie die Mäuse in zwei unabhängigen Kammern (wie in Abbildung 1 gezeigt), die jeweils mit einem Ultraschallvernebler verbunden sind.
- Die Modellgruppe wurde 2 Wochen lang 2 h pro Tag 0,1 M Zitronensäure (CA) Aerosol und die Kontrollgruppe 0,9 % normalem Kochsalz (NS) Aerosol bei einer Zerstäubungsrate von 3 ml/min ausgesetzt (wie in Abbildung 2 gezeigt). Bringen Sie die Mäuse nach jeder Exposition in ihre Käfige zurück.
- Bewertung der Hustenempfindlichkeit
- Nach der letzten Exposition ist die Hustenempfindlichkeit zu beurteilen, indem der reflexive Husten (kontradiktorisch mit NS, CA (0,4 M) und Capsaicin (100 μM)) und der spontane Husten (ohne jegliche Provokation) untersucht werden.
HINWEIS: Um dynamische Veränderungen der Hustenempfindlichkeit während der Modellentwicklung zu überwachen, beurteilen Sie die Hustenempfindlichkeit an den Tagen 0, 3, 7 und 10 mit einer CA (0,4 M) Challenge.
- Nach der letzten Exposition ist die Hustenempfindlichkeit zu beurteilen, indem der reflexive Husten (kontradiktorisch mit NS, CA (0,4 M) und Capsaicin (100 μM)) und der spontane Husten (ohne jegliche Provokation) untersucht werden.
4. Bewertung der Hustenempfindlichkeit
- Vorbereitung des Instruments
- Verwenden Sie ein nicht-invasives Ganzkörperplethysmographie-System (WBP), um die Hustenempfindlichkeit zu messen. Schließen Sie die Kammern, die Durchflussmessumformer, die Bias-Strömung und andere Komponenten gemäß dem Anwendungshandbuch an (siehe Materialtabelle).
- Führen Sie einen Kalibrierungsprozess durch, um genaue Messungen zu gewährleisten, indem Sie auf die Schaltfläche Kalibrieren klicken. Ein Statusbildschirm zeigt den Fortschritt an, und sobald die Statusleiste 100 % erreicht, ist die Kalibrierung abgeschlossen.
- Husten-Erkennung
- Erstellen Sie eine Hustenstudie für Mäuse und konfigurieren Sie die Parameter für 1 Minute Akklimatisierung, 10 Minuten Reaktionszeit und 10 Minuten Verabreichung chemischer Lösung.
- Platzieren Sie die bewussten Mäuse in einzelnen Kammern, so dass nur eine Maus pro Kammer vorhanden ist.
HINWEIS: Stellen Sie sicher, dass sich die Maus vollständig in der Kammer befindet, bevor Sie den Deckel schließen, um eine Beschädigung des Schwanzes und der Finger zu vermeiden. - Geben Sie 1 ml der chemischen Lösungen (NS, CA oder Capsaicin) in den Vernebler.
HINWEIS: Die Anzahl der Hustenereignisse, die jeweils aus drei Phasen bestehen: inspiratorisch, kompressiv und expultiv15 (wie in Abbildung 3 gezeigt), wird aufgezeichnet, sobald die Studie beginnt. Nach 10 Minuten der Aufzeichnung ist die Hustenerkennung abgeschlossen. Reinigen Sie die Kammer nach der Erkennung jedes Tieres, um Kreuzkontaminationen zu vermeiden.
5. Messung der Hyperreagibilität der Atemwege (AHR)
- Vorbereitung des Instruments
- Bereiten Sie die Instrumente wie in Schritt 4.1 beschrieben vor.
- AHR-Messung
- Erstellen Sie eine Dosis-Wirkungs-Studie für Mäuse, indem Sie die Messtypen, Parameter und Aufgabensequenz konfigurieren: 1 Minute für die Akklimatisierung, 30 s für die Abgabe von Methacholinlösung, 3 Minuten für die Reaktionszeit und 1 Minute für die Erholung.
- Platzieren Sie die bewussten Mäuse in einzelnen Kammern, so dass nur eine Maus pro Kammer vorhanden ist.
- Geben Sie 50 μl der chemischen Lösungen (PBS oder Methacholin) in den Vernebler und starten Sie die Studie.
- Notieren Sie den Wert von Penh, einem Indikator für Bronchokonstriktion, als Reaktion auf unterschiedliche Konzentrationen von Methacholin (0 mg/ml, 3,125 mg/ml, 6,25 mg/ml, 12,5 mg/ml, 25 mg/ml, 50 mg/ml).
6. Bronchoalveoläre Lavage-Kollektion
- Opfer
- Die Mäuse werden unter Verwendung einer Hyperanästhesie mit Pentobarbital-Natrium (50 mg/kg) getötet, das über intraperitoneale Injektion verabreicht wird (gemäß institutionell anerkannten Protokollen).
- Musterkollektion
- Sammeln Sie Blut aus dem Orbitalsinus der Maus in ein 1,5-ml-Mikrozentrifugenröhrchen und legen Sie das Röhrchen dann auf Eis. Das Blut bei 3000 x g für 10 min bei 4°C zentrifugieren. Den Überstand mit einer Pipette auffangen, aliquotieren und bei -80 °C lagern.
- Sammeln Sie die bronchoalveoläre Lavageflüssigkeit (BALF), indem Sie den Brustkorb öffnen, um die Luftröhre freizulegen, eine 22-G-Verweilnadel in die Luftröhre einführen, dann dreimal mit 0,5 ml vorgekühltem PBS spülen und die Flüssigkeit auffangen.
- Nach der Entnahme zentrifugieren Sie den BALF bei 500 x g für 10 min bei 4 °C. Der Überstand wird aufgefangen, aliquotiert und bei -80 °C gelagert. Resuspendieren Sie das Pellet in 100 μl PBS und bereiten Sie Zellabstriche für die weitere Analyse vor.
- Sammeln Sie Lungengewebe, indem Sie den Brustkorb öffnen, um die Lunge freizulegen, das Lungengewebe entfernen und in kryogene Fläschchen legen. Lagern Sie die Fläschchen bei -80 °C für zukünftige Studien.
7. Quantitative RT-PCR
- Extrahieren Sie die Gesamt-RNA aus Lungengewebe mit dem TRIzol-Reagenz. Führen Sie die cDNA-Synthese mit einem Erststrang-cDNA-Synthesekit gemäß den Anweisungen des Herstellers durch (siehe Materialtabelle).
- Führen Sie die PCR in einem quantitativen Echtzeit-PCR-Nachweissystem mit grüner SYBR-Fluoreszenz durch. Normalisieren Sie die Quantifizierung der relativen SP- und CGRP-mRNA-Expression auf die Expression von β-Aktin9.
8. Statistische Auswertung
- Präsentieren Sie die Daten als Mittelwert ± SEM. Verwenden Sie einen t-Test , um Daten zwischen zwei Gruppen zu vergleichen, wobei P < 0,05 als statistisch signifikant betrachtet wird. Führen Sie alle statistischen Analysen mit Hilfe von Statistik- und Grafiksoftware durch.
Ergebnisse
Wie in Abbildung 4A gezeigt, stieg die Hustenempfindlichkeit in der Modellgruppe (CA-Gruppe) nach 1 Woche Exposition im Vergleich zur Kontrollgruppe (NS-Gruppe) signifikant an, und diese erhöhte Empfindlichkeit blieb während des gesamten Expositionszeitraums bestehen. Weder in der Kontrollgruppe noch in der Modellgruppe kam es während des Modellierungsprozesses zu Mortalität (Abbildung 4B). Abbildung 4C und Abbildung 4D zeigen, dass die Anzahl der spontanen Hustenereignisse in der Modellgruppe nach der Exposition signifikant zunahm. Darüber hinaus war die Hustenempfindlichkeit, die durch NS (Abbildung 4E und Abbildung 4F), CA (Abbildung 4G und Abbildung 4H) und Capsaicin (Abbildung 4I und Abbildung 4J) hervorgerufen wurde, in der Modellgruppe nach der Expositionsphase wesentlich höher.
In Abbildung 5A,B zeigten die beiden Gruppen keinen signifikanten Unterschied in der Gesamtzahl der Entzündungszellen und der differentiellen Zellzahl in der bronchoalveolären Lavageflüssigkeit (BALF). Abbildung 5C,D zeigt BALF-Zellen mit H&E-Färbung. Wie in Abbildung 6 dargestellt, gab es nach der Modellierung keinen signifikanten Unterschied in der Hyperreagibilität der Atemwege zwischen dem Modell und der Kontrollgruppe. Zusätzlich wurden die Expressionsniveaus von CGRP und SP, neurogenen Entzündungsmediatoren, im Lungengewebe mittels QPCR bestimmt. Die Ergebnisse zeigten einen signifikanten Anstieg der SP-Expression in der Modellgruppe (Abbildung 7A), während kein signifikanter Unterschied in der CGRP-Expression zwischen den beiden Gruppen beobachtet wurde (Abbildung 7B).

Abbildung 1: Expositionskammer für Mausmodell. Die Belichtungskammer besteht aus Acrylglas mit den Maßen 36 cm x 20 cm x 25 cm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Schematische Darstellung des Mausmodells mit Hustenüberempfindlichkeit. Schematische Darstellung der Etablierung eines Mausmodells mit Hustenüberempfindlichkeit durch Zitronensäureinhalation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Repräsentative Bilder eines Hustenereignisses. Repräsentative Bilder eines Hustenereignisses, aufgenommen von einem nicht-invasiven Ganzkörper-Plethysmographie-System. Das Hustenereignis besteht aus drei Phasen: (a) inspiratorisch, (b) kompressiv und (c) austreibend. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Beurteilung des Hustens im Mausmodell. (A) Hustenereignisse, die während des 14-tägigen Expositionszeitraums durch 0,4 M Zitronensäure ausgelöst wurden. Die Hustenempfindlichkeit in der Zitronensäure (CA)-Gruppe war nach 7-tägiger Exposition signifikant höher als in der Kontrollgruppe. (B) Überlebenskurven von Kontroll- und Modellgruppen während des Modellierungsprozesses. (C-J) Spontane Hustenereignisse (C,D) und Hustenereignisse, die durch normale Kochsalzlösung (NS) (E,F), Zitronensäure (G,H) und Capsaicin (I,J) vor und nach der Modellierung hervorgerufen wurden. Die Daten werden als Mittelwert ± SEM, ***P < 0,001 im Vergleich zur NS-Gruppe dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
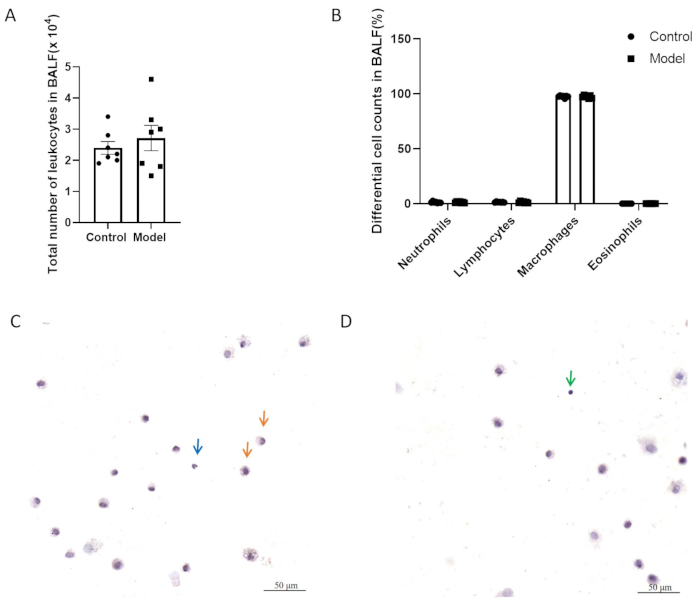
Abbildung 5: Leukozytenzahlen in der bronchoalveolären Lavageflüssigkeit (BALF). (A) Gesamtzahl der Leukozyten bei BALF. (B) Differentielle Zellzahlen bei BALF. Die Daten werden als Mittelwert ± SEM dargestellt. (C, D) Repräsentative Bilder von BALF-Zellen mit H&E-Färbung. Die Pfeile zeigen Makrophagen (orange), Neutrophile (blau) und Lymphozyten (grün). Maßstabsstäbe: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Atemwegswiderstand in CA- und NS-Gruppen. Atemwegswiderstand in der Zitronensäure (CA)-Gruppe im Vergleich zur Gruppe mit normaler Kochsalzlösung (NS). Die Daten werden als Mittelwert ± SEM dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: mRNA-Expressionsniveaus von SP und CGRP im Lungengewebe. (A) Relative mRNA-Expressionsniveaus der Substanz P (SP) im Lungengewebe. (B) Relative mRNA-Expressionsniveaus von Calcitonin-Gen-verwandtem Peptid (CGRP) im Lungengewebe. Die Daten werden als Mittelwert ± SEM, *P < 0,05 im Vergleich zur NS-Gruppe dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Studie wurde erfolgreich ein Mausmodell mit Hustenüberempfindlichkeit durch kontinuierliche Inhalation von Zitronensäure (CA) etabliert. Dieses Modell zeigte eine zuverlässige Erhöhung der Hustenempfindlichkeit sowohl bei spontanem Husten als auch bei reflexivem Husten, der durch Zitronensäure und Capsaicin ausgelöst wurde. Zitronensäure und Capsaicin werden häufig zur Beurteilung der Hustenreflexempfindlichkeit verwendet16.
Mehrere kritische Schritte in diesem Protokoll stellen seine Wirksamkeit sicher. Erstens darf die Expositionskammer, die für die Experimente verwendet wird, nicht vollständig luftdicht sein. Um eine gute Belüftung zu gewährleisten, sollten Belüftungsöffnungen an der Rückseite der Kammer angebracht werden. Zweitens ist es wichtig, eine Überfüllung des Plenarsaals zu vermeiden; Die Begrenzung der Anzahl der Mäuse auf 10-12 verhindert mögliche Stampedes. Drittens ist die Pflege nach der Exposition von entscheidender Bedeutung: Nach jeder Exposition müssen die Mäuse mit warmer Luft getrocknet werden, um die verbleibende Flüssigkeit aus ihrem Fell zu entfernen.
Während Meerschweinchen traditionell zur Untersuchung von Hustenmechanismen und zur Bewertung von Hustenmitteln verwendet werden, bieten Mausmodelle mehrere Vorteile. Frühere Studien haben Versuchskaninchenmodelle für die durch Zitronensäureexposition induzierte Hustenüberempfindlichkeit entwickelt. Zum Beispiel setzten Nakaji et al. Meerschweinchen 2 Wochen lang dreimal pro Woche 0,5 M Zitronensäure für 10 Minuten aus (insgesamt acht Expositionen)17. In ähnlicher Weise etablierte eine andere Studie von Xu et al. ein Modell mit erhöhter Hustenempfindlichkeit, indem Meerschweinchen 25 Tage lang 0,4 M Zitronensäure inhalierten18. Diese Meerschweinchenmodelle zeigten jedoch eine weniger ausgeprägte Hustenempfindlichkeit im Vergleich zum aktuellen Mausmodell. Darüber hinaus stoßen Meerschweinchenmodelle auf Einschränkungen, wie z. B. den Mangel an transgenen Werkzeugen und kommerziellen Reagenzien, die die Untersuchung der molekularen Mechanismen der Hustenüberempfindlichkeit behindern.
Mäuse hingegen sind einfacher zu pflegen, kostengünstiger und anfällig für genetische Manipulationen. Frühere Studien haben gezeigt, dass Mäuse auch wirksame Modelle für die Untersuchung von Husten sind 15,19,20,21. Darüber hinaus werden Mäuse häufig in der neurowissenschaftlichen Forschung eingesetzt, was für die Untersuchung der zentralen Mechanismen der Hustenüberempfindlichkeit von Vorteil ist. Daher gelten Mäuse als geeigneter für mechanistische Untersuchungen des chronischen Hustens.
Trotz der erfolgreichen Etablierung des Modells gibt es einige Einschränkungen zu beachten. Erstens ahmt Zitronensäure, obwohl sie häufig in der Lebensmittel-, Pharma-, Chemie- und Metallindustrie verwendet wird 22,23, die realen Expositionsbedingungen nicht genau nach, die beim Menschen zu Hustenüberempfindlichkeit führen. Zweitens bleibt der genaue Mechanismus der Hustenüberempfindlichkeit in diesem Modell unklar. Während eine Lungenentzündung als potenzieller Mediator einer erhöhten Hustenempfindlichkeit angesehen wird6, zeigte die Beurteilung der Gesamtanzahl der entzündlichen Zellen und der differentiellen Zellzahlen in der bronchoalveolären Lavageflüssigkeit (BALF) keine signifikanten Veränderungen zwischen den beiden Gruppen. Darüber hinaus zeigte die bronchiale Hyperreagibilität, ein bekannter Auslöser von chronischem Husten24, nach 14-tägiger Exposition keinen signifikanten Unterschied im Atemwegswiderstand zwischen der Modell- und der Kontrollgruppe.
Zusammenfassend konnte ein Mausmodell mit Hustenüberempfindlichkeit durch kontinuierliche Inhalation von Zitronensäure (CA) etabliert werden. Dieses Modell ist einfach zu bedienen und liefert reproduzierbare Ergebnisse, was es zu einem wertvollen Werkzeug für weitere Studien über die Mechanismen und potenziellen neuen Behandlungen von chronischem Husten macht.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde von der National Natural Science Foundation of China (NSFC 82100034), Guangzhou Science and Technology Planning Project (202102010168), unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% normal saline | Biosharp | BL158A | |
| Capsaicin | Cayman chemical | 92350 | |
| Citric Acid | Sigma-Aldrich | C2404 | |
| Ethanol | Guangzhou chemical reagent factory | GSHB15-AR-0.5L | |
| First-strand cDNA synthesis kit | TransGen Biotech | AT341 | |
| Methacholine | Sigma-Aldrich | A2251 | |
| Non-invasive whole-body plethysmography (WBP) system | DSI | 601-1400-001 | |
| Pentobarbital sodium | Merk | P3761 | |
| PerfectStart Green qPCR SuperMix | TransGen Biotech | AQ601 | |
| Phosphate Buffered Saline (PBS) | Meilunbio | MA0015 | |
| Real-time quantitative PCR detecting system | Bio-rad | CFX Connect | |
| TRIzol reagent | Invitrogen | 15596026CN | |
| Tween-80 | Solarbio | T8360-100 | |
| Ultrasonic nebulizer | Yuwell | 402AI |
Referenzen
- Morice, A. H. Epidemiology of cough. Pulm Pharmacol Ther. 15 (3), 253-259 (2002).
- Lai, K., Long, L. Current status and future directions of chronic cough in China. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional European survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Mazzone, S. B., Undem, B. J. Vagal afferent innervation of the airways in health and disease. Physiol Rev. 96 (3), 975-1024 (2016).
- Shapiro, C. O., et al. Airway sensory nerve density is increased in chronic cough. Am J Respir Crit Care Med. 203 (3), 348-355 (2021).
- Ando, A., et al. Neural correlates of cough hypersensitivity in humans: Evidence for central sensitization and dysfunctional inhibitory control. Thorax. 71 (4), 323-329 (2016).
- Plevkova, J., et al. Animal models of cough. Respir Physiol Neurobiol. 290, 103656 (2021).
- Smith, J. A., Hilton, E. C. Y., Saulsberry, L., Canning, B. J. Antitussive effects of memantine in guinea pigs. Chest. 141 (4), 996-1002 (2012).
- Hewitt, M. M., et al. Pharmacology of bradykinin-evoked coughing in guinea pigs. J Pharmacol Exp Ther. 357 (3), 620-628 (2016).
- Zhong, S., et al. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models. J Ethnopharmacol. 194, 378-385 (2016).
- Zhong, S., et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure. J Ethnopharmacol. 165, 73-82 (2015).
- Wei, L., et al. Effects of Shiwei longdanhua formula on LPS-induced airway mucus hypersecretion, cough hypersensitivity, oxidative stress and pulmonary inflammation. Biomed Pharmacother. 163, 114793 (2023).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Gibson, P., et al. Treatment of unexplained chronic cough: Chest guideline and expert panel report. Chest. 149 (1), 27-44 (2016).
- Nakaji, H., et al. Airway remodeling associated with cough hypersensitivity as a consequence of persistent cough: An experimental study. Respir Investig. 54 (6), 419-427 (2016).
- Xu, X., et al. Association of cough hypersensitivity with tracheal trpv1 activation and neurogenic inflammation in a novel guinea pig model of citric acid-induced chronic cough. J Int Med Res. 46 (7), 2913-2924 (2018).
- Iwata, T., et al. Mechanical stimulation by postnasal drip evokes cough. PLoS One. 10 (11), e0141823 (2015).
- Chen, L., et al. Establishment of a mouse model with all four clinical features of eosinophilic bronchitis. Sci Rep. 10 (1), 10557 (2020).
- Zhang, C., Lin, R. L., Hong, J., Khosravi, M., Lee, L. Y. Cough and expiration reflexes elicited by inhaled irritant gases are intensified in ovalbumin-sensitized mice. Am J Physiol Regul Integr Comp Physiol. 312 (5), R718-R726 (2017).
- Amato, A., Becci, A., Beolchini, F. Citric acid bioproduction: The technological innovation change. Crit Rev Biotechnol. 40 (2), 199-212 (2020).
- Hu, W., Li, W. J., Yang, H. Q., Chen, J. H. Current strategies and future prospects for enhancing microbial production of citric acid. Appl Microbiol Biotechnol. 103 (1), 201-209 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten