Method Article
구연산 흡입을 통한 기침 과민증을 가진 Mouse Model 구축
요약
이 프로토콜은 기침 과민증을 가진 마우스 모델의 개발을 설명하며, 이는 만성 기침의 메커니즘을 연구하기 위한 이상적인 모델 역할을 할 수 있습니다.
초록
기침은 많은 호흡기 질환의 가장 흔한 증상 중 하나입니다. 만성 기침은 삶의 질에 큰 영향을 미치고 상당한 경제적 부담을 줍니다. 기침 민감도가 높아지는 것은 만성 기침의 병태생리학적 특징입니다. 기침 과민증은 기도 염증, 기도 감각 신경의 리모델링, 중추 신경계의 변화와 관련이 있는 것으로 관찰되었습니다. 그러나 정확한 분자 메커니즘은 불분명하며 적절한 동물 모델을 사용한 추가 설명이 필요합니다. 이전 연구에서는 기니피그를 기침 연구를 위한 모델로 활용했지만, 이러한 모델은 높은 비용, 형질전환 도구의 부족, 상업용 시약의 부족 등 몇 가지 실험적 한계를 가지고 있습니다. 또한 기니피그는 일반적으로 자극에 노출될 때 환경 내성이 낮고 폐사율이 높습니다. 대조적으로, 마우스는 더 작고, 유지 관리가 더 쉽고, 비용 효율적이며, 유전자 조작에 순응하기 때문에 기계론적 조사에 더 적합합니다. 본 연구에서는 구연산(CA)의 지속적인 흡입을 통해 기침 과민증을 보이는 마우스 모델을 확립하였다. 이 모델은 작동이 간단하고 재현 가능한 결과를 산출하므로 만성 기침에 대한 메커니즘과 잠재적인 새로운 치료법에 대한 추가 연구를 위한 귀중한 도구입니다.
서문
기침은 기도에서 호흡기 분비물이나 이물질을 제거하는 데 도움이 되는 중요한 방어 반사 작용입니다. 그러나 이는 많은 호흡기 질환의 가장 흔한 증상 중 하나이기도 하며, 종종 환자가 치료를 받도록 유도합니다1. 성인의 경우 8주 이상 지속되는 기침으로 정의되는 만성 기침은 삶의 질에 큰 영향을 미쳐 요실금, 불면증, 역류 및 기타 불쾌한 경험과 같은 문제를 일으키고 상당한 경제적 부담을 초래합니다 2,3,4. 기침 민감도의 증가는 만성 기침의 병태생리학적 특징이며, 열적, 기계적, 화학적 자극 물질의 수치가 낮으면 기침이 유발될 수 있다고 널리 알려져 있다5. 기침 과민증은 기도 염증6, 기도 감각 신경의 리모델링7, 중추 신경계8의 변화와 관련이 있지만, 정확한 분자 메커니즘은 불분명하며 적절한 동물 모델을 통한 추가 설명이 필요합니다.
기니피그, 고양이, 토끼, 개, 돼지 등 다양한 동물이 기침의 메커니즘을 연구하는 데 사용되었다9. 기니피그는 전통적으로 기침 메커니즘과 진해설제의 효능을 연구하는 데 가장 적합한 모델로 인식되어 왔습니다 9,10,11,12. 그러나 이러한 모델에는 높은 비용, 형질전환 도구의 부족, 상용 시약의 부족 등 몇 가지 실험적 한계가 있습니다. 또한 기니피그는 종종 자극에 노출될 때 환경 내성이 낮고 사망률이 높습니다. 대조적으로, 마우스는 더 작고, 유지 관리가 더 쉽고, 비용 효율적이며, 유전자 조작에 순응하기 때문에 기계론적 조사에 더 적합합니다. 기침 모델에 대한 이전 연구는 주로 기도 염증에 의해 유발되는 기침에 초점을 맞추었으며, 주로 진해진마와 말초 기전의 효능을 평가하는 데 사용되었다13,14. 현재 기침 과민증에 대한 동물 모델은 부족합니다.
이에 대응하여 구연산(CA)의 지속적인 흡입을 통한 기침 과민증의 마우스 모델을 확립하는 방법을 소개합니다. 이 모델은 다른 동물 모델에 비해 더 간단하고 구성하기 쉬우며 실현 가능성이 높습니다.
프로토콜
모든 동물 실험 절차는 광저우 의과대학(20230656) 제1부속병원의 실험동물윤리위원회의 승인을 받았습니다. 이 연구에는 8-10주령, 체중 20-25g의 성인 남성 특이적 병원체가 없는 C57BL/6 마우스가 사용되었습니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 화학 시약 준비
- 구연산(CA) 용액 준비
- 기침 평가를 위해 3.84g의 구연산 분말을 일반 식염수에 최종 부피 50mL까지 용해하여 0.4M 용액을 준비합니다.
- 동물 치료의 경우, 구연산 분말 9.6g을 일반 식염수에 0.1 g을 최종 부피 500 mL로 용해시켜 용액을 준비합니다.
- Capsaicin 용액 준비
- 10% 에탄올과 10% Tween-80을 함유한 PBS에 캡사이신 분말 30.5mg을 용해하여 10mM 원액을 만듭니다.
- 원액을 생리식염수에 1:100으로 희석하여 100μM 작업 용액을 만듭니다.
- 메타콜린 용액 준비
- PBS에 메타콜린 분말 100mg을 최종 부피 2mL로 용해시켜 50mg/mL 용액을 만듭니다.
- 이 용액을 PBS로 희석하여 25mg/mL, 12.5mg/mL, 6.25mg/mL 및 3.125mg/mL의 농도를 얻습니다.
2. 동물 준비
- 주거 환경
- 음식과 물을 자유롭게 이용할 수 있는 케이지에 있는 사육 쥐는 표준 12시간 라이트/다크 주기로 22 ± 1°C의 온도를 유지합니다. 실험적 조작은 섭식 환경에 적응한 지 1주일 후에 수행되었습니다.
- 적응
- 실험적 조작을 수행하기 전에 생쥐가 1주일 동안 섭식 환경에 적응하도록 합니다.
3. 모델 개발
- 그룹 과제
- 마우스를 모델 그룹과 통제 그룹으로 무작위로 나누고, 각 그룹에는 8마리의 마우스가 있습니다.
- 노출 설정
- 마우스를 두 개의 독립적인 챔버(그림 1 참조)에 배치하고, 각각 초음파 분무기에 연결합니다.
- 모델 그룹은 0.1M 구연산(CA) 에어로졸에 노출시키고 대조군은 2주 동안 하루 2시간 동안 3mL/분의 분무 속도로 0.9% 생리식염수(NS) 에어로졸에 노출시킵니다( 그림 2 참조). 노출될 때마다 쥐를 우리로 되돌립니다.
- 기침 민감도 평가
- 마지막 노출 후 반사성 기침(NS, CA(0.4M) 및 캡사이신(100μM)으로 이의를 제기함) 및 자발적인 기침(이의 제기 없음)을 평가하여 기침 민감도를 평가합니다.
참고: 모델 개발 중 기침 민감도의 동적 변화를 모니터링하려면 CA(0.4M) 챌린지를 사용하여 0, 3, 7, 10일에 기침 민감도를 평가합니다.
- 마지막 노출 후 반사성 기침(NS, CA(0.4M) 및 캡사이신(100μM)으로 이의를 제기함) 및 자발적인 기침(이의 제기 없음)을 평가하여 기침 민감도를 평가합니다.
4. 기침 민감도 평가
- 기기 준비
- 비침습적 전신 혈량측정(WBP) 시스템을 사용하여 기침 민감도를 측정합니다. 챔버, 유량 변환기, 바이어스 흐름 및 기타 구성 요소를 application manual에 따라 연결합니다( 재료 표 참조).
- 정확한 측정을 보장하기 위해 Calibrate 버튼을 클릭하여 교정 프로세스를 수행합니다. 상태 화면에 진행 상황이 표시되고 상태 표시줄이 100%에 도달하면 보정이 완료된 것입니다.
- 기침 감지
- 마우스에 대한 기침 연구를 생성하고 적응 1분, 반응 시간 10분, 화학 용액 전달 10분에 대한 매개변수를 구성합니다.
- 의식이 있는 마우스를 개별 챔버에 넣고 챔버당 하나의 마우스만 있도록 합니다.
알림: 꼬리와 손가락이 손상되지 않도록 뚜껑을 닫기 전에 마우스가 챔버 내부에 완전히 들어 있는지 확인하십시오. - 분무기에 화학 용액(NS, CA 또는 캡사이신) 1mL를 추가합니다.
참고: 기침 이벤트의 횟수는 각각 흡기, 압박 및 배출의 세 단계로 구성되며15 ( 그림 3 참조))가 연구가 시작되면 기록됩니다. 10분 동안 녹음하면 기침 감지가 완료됩니다. 교차 오염을 방지하기 위해 각 동물을 감지한 후 챔버를 청소하십시오.
5. 기도 과민반응(AHR) 측정
- 기기 준비
- 4.1단계에 설명된 대로 기기를 준비합니다.
- AHR 측정
- 마우스에 대한 용량-반응 연구를 생성하고 측정 유형, 매개변수 및 작업 순서(적응에 1분, 메타콜린 용액 전달에 30초, 응답 시간에 3분, 회복에 1분)를 구성합니다.
- 의식이 있는 마우스를 개별 챔버에 넣고 챔버당 하나의 마우스만 있도록 합니다.
- 50μL의 화학 용액(PBS 또는 메타콜린)을 분무기에 추가하고 연구를 시작합니다.
- 메타콜린의 다양한 농도(0 mg/mL, 3.125 mg/mL, 6.25 mg/mL, 12.5 mg/mL, 25 mg/mL, 50 mg/mL)에 대한 반응으로 기관지 수축의 지표인 Penh의 값을 기록합니다.
6. 기관지폐포 세척 수집
- 희생
- 복강내 주사를 통해 투여된 펜토바르비탈 나트륨(50mg/kg)과 함께 고마취를 사용하여 마우스를 희생합니다(기관에서 승인한 프로토콜에 따름).
- 시료 채취
- 마우스의 안와동에서 채혈한 혈액을 1.5mL 마이크로 원심분리 튜브에 넣은 다음 튜브를 얼음 위에 놓습니다. 혈액을 3000 x g 에서 4°C에서 10분 동안 원심분리합니다. 피펫을 사용하여 상층액을 수집하고, 분취한 후 -80 °C에서 보관합니다.
- 흉부를 열어 기관을 노출시키고 22G의 내주 바늘을 기관에 삽입한 다음 0.5mL의 예냉각된 PBS로 3회 세척하고 액체를 채취하여 기관지폐포 세척액(BALF)을 수집합니다.
- 채취 후 500 x g 에서 BALF를 4°C에서 10분 동안 원심분리합니다. 상등액을 모아 분취한 후 -80°C에서 보관합니다. 펠릿을 100μL의 PBS에 재현탁하고 추가 분석을 위해 세포 도말을 준비합니다.
- 흉부를 열어 폐를 드러내고 폐 조직을 제거한 다음 극저온 바이알에 넣어 폐 조직을 수집합니다. 향후 연구를 위해 바이알을 -80°C에서 보관하십시오.
7. 양이 많은 RT-PCR
- TRIzol 시약을 사용하여 폐 조직에서 총 RNA를 추출합니다. 제조업체의 지침에 따라 First-strand cDNA synthesis kit를 사용하여 cDNA 합성을 수행합니다( Table of Materials(재료표 참조).
- SYBR 녹색 형광을 사용하여 Real-time 정량적 PCR 검출 시스템에서 PCR을 수행합니다. 상대 SP 및 CGRP mRNA 발현의 정량화를 β-Actin9의 발현으로 정규화합니다.
8. 통계 분석
- 데이터를 SEM± 평균으로 제시합니다. T 검정 을 사용하여 P < 0.05를 통계적으로 유의한 것으로 간주하여 두 그룹 간의 데이터를 비교합니다. 통계 및 그래프 소프트웨어를 사용하여 모든 통계 분석을 수행합니다.
결과
도 4A에서 볼 수 있듯이, 모델군(CA군)의 기침 민감도는 대조군(NS군)에 비해 노출 1주일 후 유의하게 증가했으며, 이러한 민감도 증가는 노출 기간 내내 지속되었다. 대조군과 모델군 마우스 모두 모델링 과정에서 폐사율을 경험하지 않았습니다(그림 4B). 그림 4C와 그림 4D는 노출 후 모델 그룹에서 자발적인 기침 횟수가 유의하게 증가했음을 보여줍니다. 또한, NS(그림 4E 및 그림 4F), CA(그림 4G 및 그림 4H) 및 캡사이신(그림 4I 및 그림 4J)에 의해 유발된 기침 민감도는 노출 기간 후 모델 그룹에서 상당히 높았습니다.
그림 5A,B에서 두 그룹은 기관지폐포 세척액(BALF)의 총 염증 세포 수와 감별 세포 수에서 큰 차이가 없었습니다. 그림 5C,D는 H&E 염색이 있는 BALF 세포를 보여줍니다. 그림 6에서 볼 수 있듯이, 모델링 후 모델과 대조군 간에 기도 과민반응에는 유의한 차이가 없었습니다. 또한, 폐 조직에서 신경인성 염증 매개체인 CGRP 및 SP의 발현 수준을 QPCR에 의해 평가했습니다. 그 결과 모델 그룹에서 SP 발현이 유의하게 증가한 것으로 나타났으며(그림 7A), 두 그룹 간에 CGRP 발현의 유의미한 차이는 관찰되지 않았습니다(그림 7B).

그림 1: 마우스 모델의 노출 챔버. 노출 챔버는 36cm x 20cm x 25cm 크기의 아크릴 유리로 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 기침 과민증이 있는 마우스 모델의 개략도. 구연산 흡입을 통한 기침 과민증이 있는 마우스 모델을 설정하는 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 기침 증상의 대표 이미지. 비침습적 전신 혈량측정 시스템에 의해 기록된 기침 이벤트의 대표적인 이미지. 기침 증상은 (a) 흡기성, (b) 압박성, (c) 배출성의 세 단계로 구성됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 마우스 모델의 기침 평가. (A) 14일의 노출 기간 동안 0.4M 구연산에 의해 유발된 기침 사건. 구연산(CA) 그룹의 기침 민감도는 노출 7일 후 대조군보다 유의하게 높았습니다. (B) 모델링 프로세스 중 제어 및 모델 그룹의 생존 곡선. (씨-제이) 모델링 전후에 생리식염수(NS)(E,F), 구연산(G,H) 및 캡사이신(I,J)에 의해 유발된 자발적인 기침 사건(C,D) 및 기침 사건. 데이터는 NS 그룹에 비해 평균 ± SEM, ***P < 0.001로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
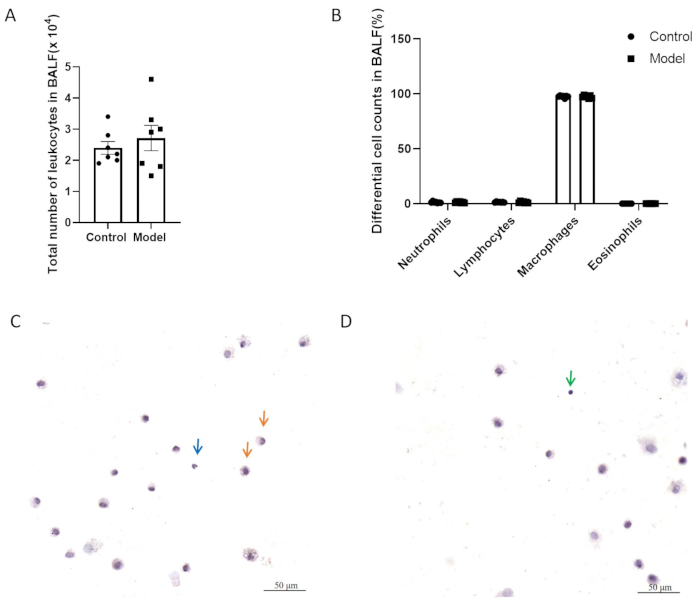
그림 5: 기관지폐포 세척액(BALF)의 백혈구 수. (A) BALF에 있는 총 백혈구 수. (B) BALF의 차등 세포 수. 데이터는 평균 ± SEM으로 표시됩니다. (C, D) H&E 염색이 있는 BALF 세포의 대표 이미지. 화살표는 대식세포(주황색), 호중구(파란색), 림프구(녹색)를 나타냅니다. 스케일 바: 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: CA 및 NS 그룹의 기도 저항. 구연산(CA) 그룹의 기도 저항은 생리 식염수(NS) 그룹과 비교했습니다. 데이터는 SEM± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 폐 조직에서 SP 및 CGRP의 mRNA 발현 수준. (A) 폐 조직에서 물질 P(SP)의 상대적 mRNA 발현 수준. (B) 폐 조직에서 칼시토닌 유전자 관련 펩타이드(CGRP)의 상대적 mRNA 발현 수준. 데이터는 NS 그룹에 비해 평균 ± SEM, *P < 0.05로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 연구는 구연산(CA)의 지속적인 흡입을 통해 기침 과민증을 보이는 마우스 모델을 성공적으로 확립하였다. 이 모델은 구연산과 캡사이신에 의해 유발된 자발적 기침과 반사성 기침 모두에 대해 기침 민감도가 안정적으로 증가했음을 보여주었습니다. 구연산(Citric acid)과 캡사이신(capsaicin)은 기침 반사 민감도를 평가하는 데 널리 사용된다16.
이 프로토콜의 몇 가지 중요한 단계는 그 효과를 보장합니다. 첫째, 실험에 사용되는 노출 챔버는 완전히 밀폐되어서는 안 됩니다. 적절한 환기를 위해 챔버 뒤쪽에 통풍구를 배치해야 합니다. 둘째, 챔버 내 과밀을 피하는 것이 중요합니다. 생쥐의 수를 10-12마리로 제한하면 잠재적인 압사 사고를 방지할 수 있습니다. 셋째, 노출 후 관리가 중요합니다: 노출될 때마다 쥐는 털에 남아 있는 액체를 제거하기 위해 따뜻한 공기로 건조해야 합니다.
기니피그는 전통적으로 기침 메커니즘을 연구하고 진해약을 평가하는 데 사용되지만, 마우스 모델은 몇 가지 이점을 제공합니다. 이전 연구에서는 구연산 노출로 인한 기침 과민증의 기니피그 모델을 개발했다. 예를 들어, Nakaji 등은 기니피그를 0.5M 구연산에 10분 동안 노출시켰고, 2주 동안 일주일에 3번(총 8회 노출)17. 이와 유사하게, Xu 등의 또 다른 연구에서는 기니피그가 0.4M 양의 구연산을 25일 동안 흡입하도록 하여 기침 민감도가 증가한 모델을 확립했습니다18. 그러나 이러한 기니피그 모델은 현재 마우스 모델에 비해 기침 민감도가 낮았습니다. 또한 기니피그 모델은 형질전환 도구 및 상용 시약의 부족과 같은 한계에 직면해 있어 기침 과민증의 분자 메커니즘에 대한 연구를 방해합니다.
반면에 생쥐는 유지 관리가 더 쉽고 비용 효율적이며 유전자 조작에 순응합니다. 이전 연구에서는 생쥐가 기침 15,19,20,21 연구에 효과적인 모델이기도 하다는 것을 보여주었습니다. 또한 생쥐는 신경 과학 연구에 일반적으로 사용되어 기침 과민증의 핵심 메커니즘을 연구하는 데 이점을 제공합니다. 따라서 마우스는 만성 기침의 기계론적 조사에 더 적합한 것으로 간주됩니다.
모델이 성공적으로 구축되었음에도 불구하고 고려해야 할 몇 가지 제한 사항이 있습니다. 첫째, 구연산은 식품, 제약, 화학 및 야금 산업에서 일반적으로 사용되지만22,23 인간에게 기침 과민증을 유발하는 실제 노출 조건을 정확하게 모방하지 않습니다. 둘째, 이 모델에서 기침 과민증의 정확한 메커니즘은 불분명합니다. 폐 염증은 기침 민감도 증가의 잠재적 매개체로 간주되지만, 6, 기관지폐포 세척액(BALF)의 총 염증 세포 수와 감별 세포 수를 평가한 결과, 두 그룹 간에 유의미한 변화는 없었다. 또한, 만성 기침24의 유발 요인으로 알려진 기관지 과민반응은 노출 14일 후 모델과 대조군 간에 기도 저항에 유의한 차이가 없었다.
결론적으로, 구연산(CA)의 지속적인 흡입을 통한 기침 과민증을 가진 마우스 모델이 확립되었습니다. 이 모델은 작동이 간단하고 재현 가능한 결과를 산출하므로 만성 기침에 대한 메커니즘과 잠재적인 새로운 치료법에 대한 추가 연구를 위한 귀중한 도구입니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단 (NSFC 82100034), 광저우 과학 기술 계획 프로젝트 (202102010168)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.9% normal saline | Biosharp | BL158A | |
| Capsaicin | Cayman chemical | 92350 | |
| Citric Acid | Sigma-Aldrich | C2404 | |
| Ethanol | Guangzhou chemical reagent factory | GSHB15-AR-0.5L | |
| First-strand cDNA synthesis kit | TransGen Biotech | AT341 | |
| Methacholine | Sigma-Aldrich | A2251 | |
| Non-invasive whole-body plethysmography (WBP) system | DSI | 601-1400-001 | |
| Pentobarbital sodium | Merk | P3761 | |
| PerfectStart Green qPCR SuperMix | TransGen Biotech | AQ601 | |
| Phosphate Buffered Saline (PBS) | Meilunbio | MA0015 | |
| Real-time quantitative PCR detecting system | Bio-rad | CFX Connect | |
| TRIzol reagent | Invitrogen | 15596026CN | |
| Tween-80 | Solarbio | T8360-100 | |
| Ultrasonic nebulizer | Yuwell | 402AI |
참고문헌
- Morice, A. H. Epidemiology of cough. Pulm Pharmacol Ther. 15 (3), 253-259 (2002).
- Lai, K., Long, L. Current status and future directions of chronic cough in China. Lung. 198 (1), 23-29 (2020).
- Zeiger, R. S., et al. Patient-reported burden of chronic cough in a managed care organization. J Allergy Clin Immunol Pract. 9 (4), 1624-1637.e10 (2021).
- Chamberlain, S. A., et al. The impact of chronic cough: A cross-sectional European survey. Lung. 193 (3), 401-408 (2015).
- Morice, A. H., et al. Expert opinion on the cough hypersensitivity syndrome in respiratory medicine. Eur Respir J. 44 (5), 1132-1148 (2014).
- Mazzone, S. B., Undem, B. J. Vagal afferent innervation of the airways in health and disease. Physiol Rev. 96 (3), 975-1024 (2016).
- Shapiro, C. O., et al. Airway sensory nerve density is increased in chronic cough. Am J Respir Crit Care Med. 203 (3), 348-355 (2021).
- Ando, A., et al. Neural correlates of cough hypersensitivity in humans: Evidence for central sensitization and dysfunctional inhibitory control. Thorax. 71 (4), 323-329 (2016).
- Plevkova, J., et al. Animal models of cough. Respir Physiol Neurobiol. 290, 103656 (2021).
- Smith, J. A., Hilton, E. C. Y., Saulsberry, L., Canning, B. J. Antitussive effects of memantine in guinea pigs. Chest. 141 (4), 996-1002 (2012).
- Hewitt, M. M., et al. Pharmacology of bradykinin-evoked coughing in guinea pigs. J Pharmacol Exp Ther. 357 (3), 620-628 (2016).
- Zhong, S., et al. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models. J Ethnopharmacol. 194, 378-385 (2016).
- Zhong, S., et al. Effects of Schisandra chinensis extracts on cough and pulmonary inflammation in a cough hypersensitivity guinea pig model induced by cigarette smoke exposure. J Ethnopharmacol. 165, 73-82 (2015).
- Wei, L., et al. Effects of Shiwei longdanhua formula on LPS-induced airway mucus hypersecretion, cough hypersensitivity, oxidative stress and pulmonary inflammation. Biomed Pharmacother. 163, 114793 (2023).
- Chen, L., Lai, K., Lomask, J. M., Jiang, B., Zhong, N. Detection of mouse cough based on sound monitoring and respiratory airflow waveforms. PLoS One. 8 (3), e59263 (2013).
- Gibson, P., et al. Treatment of unexplained chronic cough: Chest guideline and expert panel report. Chest. 149 (1), 27-44 (2016).
- Nakaji, H., et al. Airway remodeling associated with cough hypersensitivity as a consequence of persistent cough: An experimental study. Respir Investig. 54 (6), 419-427 (2016).
- Xu, X., et al. Association of cough hypersensitivity with tracheal trpv1 activation and neurogenic inflammation in a novel guinea pig model of citric acid-induced chronic cough. J Int Med Res. 46 (7), 2913-2924 (2018).
- Iwata, T., et al. Mechanical stimulation by postnasal drip evokes cough. PLoS One. 10 (11), e0141823 (2015).
- Chen, L., et al. Establishment of a mouse model with all four clinical features of eosinophilic bronchitis. Sci Rep. 10 (1), 10557 (2020).
- Zhang, C., Lin, R. L., Hong, J., Khosravi, M., Lee, L. Y. Cough and expiration reflexes elicited by inhaled irritant gases are intensified in ovalbumin-sensitized mice. Am J Physiol Regul Integr Comp Physiol. 312 (5), R718-R726 (2017).
- Amato, A., Becci, A., Beolchini, F. Citric acid bioproduction: The technological innovation change. Crit Rev Biotechnol. 40 (2), 199-212 (2020).
- Hu, W., Li, W. J., Yang, H. Q., Chen, J. H. Current strategies and future prospects for enhancing microbial production of citric acid. Appl Microbiol Biotechnol. 103 (1), 201-209 (2019).
- Morice, A. H., Kastelik, J. A., Thompson, R. Cough challenge in the assessment of cough reflex. Br J Clin Pharmacol. 52 (4), 365-375 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유