Method Article
Применение лапароскопической частичной спленэктомии с окклюзией тотального кровотока при доброкачественных поражениях селезенки
В этой статье
Резюме
В этом исследовании мы описываем технику интраоперационного контроля кровотечения при лапароскопической частичной спленэктомии, повышающую безопасность и точность резекции селезенки.
Аннотация
Лапароскопическая частичная спленэктомия (ЛПС) постепенно становится предпочтительным методом лечения доброкачественных поражений селезенки. Однако из-за обильного кровоснабжения и ее мягкой, хрупкой текстуры тканей, особенно когда поражение расположено рядом с воротами селезенки или имеет особенно большие размеры, выполнение частичной спленэктомии (ПС) в клинической практике является чрезвычайно сложной задачей. Поэтому мы постоянно изучаем и оптимизируем методы контроля кровотечения при ПС, и здесь мы предлагаем метод выполнения ЛПС с полной окклюзией кровотока селезенки.
В этом исследовании описан оптимизированный подход к контролю интраоперационного кровотечения во время ЛПС. Во-первых, он включает в себя тщательное рассечение связок селезенки и тщательное отделение хвоста поджелудочной железы от селезенки. При полном воздействии на селезеночную оккупацию мы временно окклюзируем все кровоснабжение селезенки с помощью лапароскопического бульдожьего зажима. Затем мы используем интраоперационное ультразвуковое исследование для определения границы поражения и резекции соответствующего участка селезенки под полным контролем кровотока. Этот подход воплощает в себе суть «сохранения селезенки» благодаря эффективному контролю кровотечения и точной резекции. Он особенно подходит для лапароскопической хирургии и заслуживает дальнейшего клинического продвижения.
Введение
Обладая глубоким пониманием физиологических функций селезенки, исследование подчеркивает ее ключевую роль в иммунном ответе организма, кроветворении и клиренсе эритроцитов. Осложнения после спленэктомии, такие как подавляющие постпленэктомические инфекции (ОПСИ), легочная гипертензия и тромбоэмболия, оказывают существенное влияние на выбор хирургических методов в клинической практике 2,3. Согласно литературным данным, у пациентов после тотальной спленэктомии наблюдается снижение способности к выведению эритроцитов, паразитирующих на малярии, и более высокий риск развития менингита и сепсиса после инфекций, вызванных Streptococcus pneumoniae, Neisseria meningitidis и Haemophilus influenzae типа B4. PS сохраняет функцию селезенки, обеспечивая при этом эффективность лечения, что делает его широко применяемым в клинической практике.
В 1959 году о первом успешном ПС сообщил Cristo5. Селезенка является хрупким органом, состоящим из четко определенных сегментов селезенки, каждый из которых имеет свое отличительное артериальное и венозное снабжение, ограниченное относительно аваскулярными областями6. Эти факторы в совокупности создают анатомическую основу для ПС. Тем не менее, обычная открытая хирургия имеет неотъемлемые недостатки, включая значительную травму, косметические недостатки и послеоперационные боли. В последние годы, наряду с развитием лапароскопических инструментов и методов, ЛПС стала предпочтительным терапевтическим методом для лечения доброкачественных поражений селезенки. Тем не менее, из-за богатого кровоснабжения селезенки, значительное интраоперационное кровоизлияние во время лапароскопии может привести к переходу к открытой хирургии. Romboli et al. рассмотрели 457 случаев ЛПС, выявив среднее время операции примерно 128 ± 43,7 мин, и продемонстрировали, что около 3,9% пациентов нуждались в конверсии из-за кровотечения, а среднее послеоперационное пребывание составляет 4,9 ± 3,8 дня7. Всесторонние знания анатомии селезенки и скрупулезные хирургические навыки препятствовали широкому клиническому применению ЛПС.
Чтобы снизить риск интраоперационного кровотечения и ускорить процесс обучения, мы стараемся выполнять ЛПС с полной окклюзией кровотока. В данном исследовании мы представляем 72-летнюю пациентку с массивной опухолью селезеночного сосуда, расположенной в верхнем среднем полюсе селезенки и примыкающей к воротам селезенки. Этот новый метод отличается эффективностью в контроле кровотечения и обеспечивает безопасность, эффективность и высокий уровень воспроизводимости.
протокол
Это исследование проводится в соответствии с рекомендациями Комитета по этике больницы Шунде Южного медицинского университета. Перед операцией было получено информированное согласие пациента на передачу данных и видео.
1. Отбор пациентов
- Применяют данный хирургический метод в следующих случаях:
- Включают пациентов, испытывающих боль или дискомфорт в животе в сочетании с рентгенологическими исследованиями, подтверждающими наличие доброкачественных новообразований.
- Не накладывайте специфических ограничений на размер опухоли, но поддерживайте остаточный объем селезенки, превышающий 25%.
- Убедитесь, что у пациентов нормальные уровни АФП, РЭА и CA-199 или подтвердите отсутствие злокачественного новообразования.
- Рассмотрим ожирение, которое приводит к увеличению висцерального жира, потенциально влияющего на интраоперационную анатомию, но не рассматривает его как абсолютное ограничение.
- Исключить пациентов из данной операции следует при следующих состояниях:
- Исключить, если у пациента сильно подозревается метастазирование селезенки из злокачественных опухолей.
- Исключите пациентов со спленомегалией, возникшей в результате гематологических заболеваний или лимфомы.
- Исключите пациентов со спленомегалией на фоне цирроза печени.
- Исключить пациентов с угрожающим жизни травматическим разрывом селезенки.
- Исключите пациентов с плохим общим состоянием здоровья и неспособностью выдержать хирургическое вмешательство.
2. Хирургическая техника
- Подготовка к операции.
- Расположите пациента под общим наркозом в обратной позе Тренделенбурга с наклоном левой стороны тела примерно на 10-30°.
ПРИМЕЧАНИЕ: При необходимости вносите коррективы в положение на протяжении всей хирургической процедуры. - Расположите первого хирурга и ассистента с лапароскопом с правой стороны пациента, а первого ассистента – с левой стороны пациента.
- Установите и поддерживайте пневмоперитонеум на уровне 12-14 мм рт.ст.
- Установите четыре порта на брюшной стенке с помощью лапароскопической визуализации, как показано на рисунке 1.
- Расположите пациента под общим наркозом в обратной позе Тренделенбурга с наклоном левой стороны тела примерно на 10-30°.
- Осмотрите брюшную полость под лапароскопией, чтобы подтвердить отсутствие злокачественных новообразований.
- Выполнить временную окклюзию селезеночной артерии.
- Используйте систему герметизации сосудов, чтобы рассечь желудочно-селезеночную связку вдоль большего изгиба желудка, входя в малый мешок.
- Возьмитесь за живот и переместите его в правый верхний угол для лучшего воздействия на операционное поле.
- Скрупулезно рассекайте основной ствол селезеночной артерии у верхнего края поджелудочной железы и временно окклюзируйте его бульдожьим зажимом.
ПРИМЕЧАНИЕ: После окклюзии кровотока селезенка демонстрирует уменьшение объема и более мягкую текстуру, что обеспечивает достаточное хирургическое пространство.
- Рассеките периспезеночную связку, включая спленоколическую, спленоренальную и спленофреническую связки.
ПРИМЕЧАНИЕ: Необходимо соблюдать осторожность при отделении хвоста поджелудочной железы от селезенки, особенно в случаях спленомегалии или массивных поражений селезенки, чтобы предотвратить неконтролируемое кровотечение и возникновение послеоперационного свища поджелудочной железы (ПЗП). - Проведите временную окклюзию селезеночной кости.
- Обнажите ворота селезенки, резекционировав крепления вокруг него с помощью ультразвукового скальпеля, затем осуществите временную окклюзию ворот селезенки с помощью зажима «бульдога».
ПРИМЕЧАНИЕ: В случаях с изменениями в кровеносных сосудах селезенки, простая окклюзия селезеночной артерии может не привести к желаемым ишемическим изменениям селезенки. - После этого шага проведите тщательную повторную оценку цвета, размера и текстуры селезенки.
- Обнажите ворота селезенки, резекционировав крепления вокруг него с помощью ультразвукового скальпеля, затем осуществите временную окклюзию ворот селезенки с помощью зажима «бульдога».
- Проведите интраоперационное ультразвуковое исследование для определения границ поражения.
- Используйте интраоперационное ультразвуковое исследование для определения границы поражения во время операции.
- С помощью электрокоагуляции разметьте демаркационную линию на расстоянии не менее 1 см от границы поражения.
- Проводят диссекцию паренхимы селезенки.
- Введите биполярный радиочастотный аппарат в паренхиму селезенки по линии разграничения для коагуляции и абляции, установив радиочастотную энергию на уровне 80 Вт.
- С помощью ультразвукового скальпеля рассекайте паренхиму селезенки в зоне некротического свертывания.
- Надежно зажмите толстые протоки с помощью сосудистых зажимов Hem-o-lok, а затем аккуратно разрежьте, обеспечив безопасную резекцию верхней селезенки, содержащей поражение.
ПРИМЕЧАНИЕ: Сосуды, снабжающие удаленную часть селезенки, должны быть тщательно перевязаны и пересечены
- Извлеките образец.
- Отпустите зажим бульдога, убедившись, что у края разреза селезенки не было кровотечения, и убедитесь в достаточном кровоснабжении оставшейся селезенки.
- С помощью биполярного электрокоагуляции прижгите край разреза селезенки и нанесите на него рассасывающиеся кровоостанавливающие средства.
- Поместите дренажную трубку в селезеночную ямку.
- Поместите образец в мешок для образцов, раздробите его овальными щипцами и извлеките через увеличенный порт.
- Освободите пневмоперитонеум и зашите колотые раны.
3. Послеоперационные детали
- Проводить непрерывную электрокардиографию в течение 24 ч после операции. Контролируйте основные признаки, включая частоту сердечных сокращений, артериальное давление, дыхание, сатурацию кислорода, центральное венозное давление, зрачковый ответ и уровень сознания, чтобы своевременно выявлять ранние послеоперационные осложнения.
- Назначайте антибиотики (цефуроксим натрия, 1,5 г каждые 12 ч) и ингибиторы протонной помпы в плановом порядке после операции.
- Удалите желудочный зонд на второй послеоперационный день и разрешите пациенту полноценную жидкую диету.
- Удалите брюшную дренажную трубку, когда выход дренажа составляет менее 100 мл/24 ч.
- Запланируйте последующую компьютерную томографию брюшной полости через 2 месяца после операции, чтобы оценить состояние брюшной полости.
Результаты
В данном случае 72-летняя пациентка была госпитализирована с обширным поражением селезенки, обнаруженным при обычном осмотре в местной больнице. В анамнезе у нее были операции на брюшной полости. Ее история болезни была ничем не примечательной, а ИМТ в норме (20,1 кг/м2). Абдоминальная КТ с контрастированием показала массивное поражение, расположенное в верхнем среднем полюсе селезенки, диаметром около 15 см (Рисунок 2). Предоперационные обследования не выявили признаков злокачественного новообразования. Из-за большого размера поражения, после полного обсуждения, была предпринята попытка ЛПС с полной окклюзией кровотока селезенки. Репрезентативные интраоперационные лапароскопические изображения представлены на рисунке 3.
Время операции составило 102 минуты, с интраоперационной кровопотерей 30 мл, и было резецировано примерно 65% селезенки. Интраоперационных осложнений не произошло, и не было конверсии в лапаротомию. Интраоперационное переливание крови не потребовалось. Брюшной дренаж был удален через 4 дня после операции, а пациентка была выписана на7-е сутки после операции. Послеоперационных осложнений, включая послеоперационный свищ поджелудочной железы, внутрибрюшинную инфекцию, кровоизлияние, тромбоз портала или инфаркт селезенки, не было. Конкретные детали можно увидеть в таблице 1. Патологический диагноз – гемангиома. Последующая КТ брюшной полости через 2 месяца показала, что оставшаяся селезенка имеет хорошее кровоснабжение, рецидивов не наблюдалось.
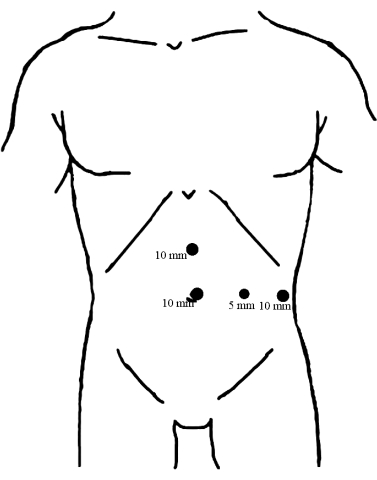
Рисунок 1: Распределение троакаров. Поместите троакар диаметром 10 мм под пупок в качестве смотрового окна. Вставляются два других 10-миллиметровых троакара, один в средней точке между пупком и мечевидным отростком, а другой на левой передней подмышечной линии, параллельно пупку, оба служат основными операционными портами. Затем троакар диаметром 5 мм был вставлен по средней линии левой ключицы на уровне пупка в качестве вспомогательного операционного порта. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
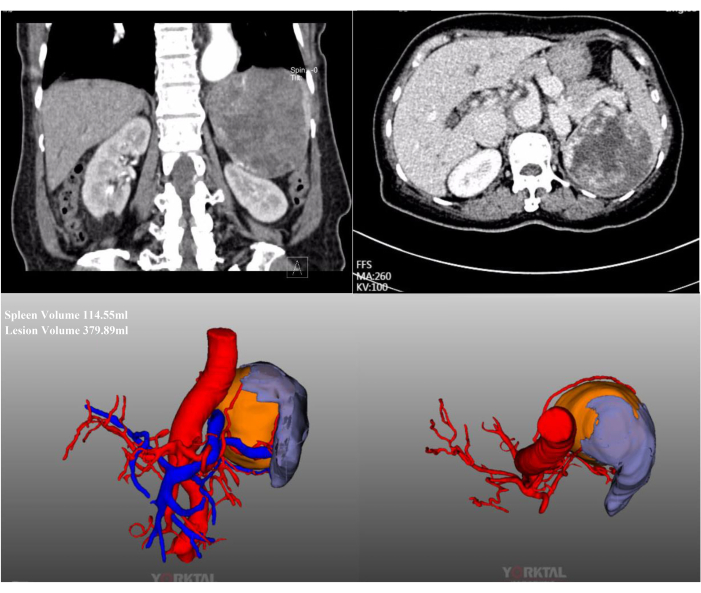
Рисунок 2: КТ с контрастным усилением и КТ-3D реконструкция. КТ с контрастированием брюшной полости и реконструкция КТ-3D показывают массивное поражение, расположенное в верхнем среднем полюсе селезенки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
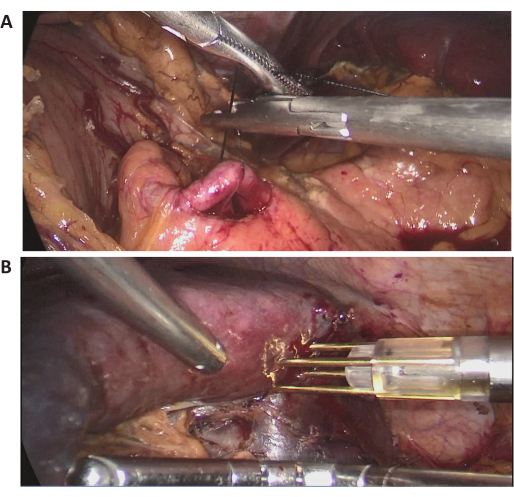
Рисунок 3: Интраоперационные лапароскопические изображения. (А,Б) Репрезентативные интраоперационные лапароскопические изображения хирургической процедуры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Элементы | Результат |
| Время работы (мин) | 102 |
| Интраоперационная кровопотеря (мл) | 30 |
| Конверсия в лапаротомию | Нет |
| Интраоперационное переливание крови | Нет |
| Послеоперационное пребывание в стационаре (дней) | 7 |
| Послеоперационные осложнения | Нет |
Таблица 1: Оперативные и послеоперационные детали ЛПС.
Обсуждение
В течение многих лет тотальная спленэктомия была основным методом лечения опухолей селезенки, спленомегалии и гематологических заболеваний. Тем не менее, при наблюдении за обширными случаями, осложнения после тотальной спленэктомии, включая инфекционные осложнения и тромбоэмболические осложнения, постепенно привлекли внимание8. Подавляющее большинство инфекций после спленэктомии (ОПСИ) является наиболее тяжелым осложнением после спленэктомии, характеризующимся быстрым прогрессированием заболевания со смертностью около 50%9. Этот повышенный риск бактериальных инфекций у пациентов с пленэктомией объясняется ролью В-клеток памяти IgM в маргинальной зоне селезенки, что имеет решающее значение для очистки инкапсулированных бактерий10,11. Кроме того, необходимо отметить послеоперационные осложнения, такие как тромбоз портала, тромбоз кавальной системы и тромбоэмболия легочной артерии. Пациенты с циррозом печени, перенесшие спленэктомию, имеют более высокую частоту портального тромбоза12, возможно, связанного с гиперкоагуляционным состоянием13. ПС позволяет достичь терапевтических эффектов при сохранении функции селезенки. Таким образом, для пациентов, соответствующих критериям, ПС стала предпочтительной альтернативой. Лапароскопическая хирургия, предлагающая такие преимущества, как минимальная травма, эстетические результаты и более короткие послеоперационные сроки, широко используется при ПС в последние годы.
Впервые о ЛПС сообщил Пулен в 1995-14 гг. ЛПС предполагает селективную окклюзию сосудов определенных сегментов селезенки с последующей резекцией вдоль демаркационной линии. Как правило, концевые ветви селезеночной артерии делятся на 2-3 ветви, прежде чем войти в отчетливые сегменты селезенки. Каждый сегмент разделен относительно аваскулярными областями15. Тем не менее, применение ЛПС затруднено из-за неконтролируемого интраоперационного кровотечения. Ренато рассмотрел 344 случая операции ЛПС, проведенной в период с 1960 года по июль 2017 года, указав, что средняя интраоперационная кровопотеря варьировалась от 0 до 1200 кубических сантиметров. Среди случаев 6,4% (22 из 344) потребовалась конверсия в лапаротомию, а в 14 случаях была выполнена тотальная спленэктомия из-за интраоперационного кровотечения16. Исходя из нашего опыта, основные причины следующие: (i) Селезенка обладает богатым кровоснабжением, а ее нежная текстура делает ее подверженной травмам во время операции, что затрудняет гемостаз. (ii) Недостаточная диссекция периспезеночной связки затрудняет мобилизацию селезенки, что приводит к разрывам паренхимы селезенки. (iii) Рассечение ветвей селезеночной артерии представляет значительную трудность и сопряжено с потенциальным риском повреждения соседних структур брюшной полости.
В многочисленных исследованиях сообщалось о методах уменьшения интраоперационного кровотечения во время ЛПС. В основном существует три основных метода: окклюзия селезеночного кровоснабжения, использование радиочастотных устройств и роботизированная помощь. Бори сообщил о временной окклюзии селезеночной артерии с использованием петлевого зажима для контроля интраоперационного кровотечения во время ЛПС17. В исследовании Peng18 46 пациентам была выполнена ЛПС с временной окклюзией селезеночной артерии. Они временно блокировали главную селезеночную артерию бульдожьим зажимом перед рассечением соответствующих ветвей селезеночной артерии. В отличие от нас, в это исследование были включены только опухоли, расположенные на верхнем и нижнем полюсах селезенки, с размерами селезенки менее 20 см. Предоперационная сосудистая эмболизация также была предпринята для контроля кровоизлияния при ЛПС19,20, что продемонстрировало удовлетворительные клинические результаты. Catalin et al.21 рассмотрели 10 случаев роботизированного ПС, которые имели меньшее интраоперационное кровотечение и более короткие послеоперационные периоды по сравнению с ЛПС. Однако его высокая стоимость ограничивает его широкое использование. Наш центр первым применил радиочастотный аппарат Habibi4X для спленэктомии22. Он создает коагулятивно-некротическую область с помощью радиочастоты, что позволяет проводить бескровную спленэктомию. Он стал стандартизированным методом в центре с неизменной клинической эффективностью.
Учитывая ограниченность вышеуказанных методов и уникальный опыт нашего центра, мы попробовали использовать клипсу «Бульдог» для временной окклюзии селезеночной артерии и воротника, выполняя ЛПС при полной ишемии селезенки. В исследовании сообщалось, что 95% ствола основной артерии селезенки проходит по верхнему краю поджелудочной железы23. Временная окклюзия с помощью бульдожьего зажима после интраоперационной локализации и изоляции легко осуществима. Однако важно подчеркнуть, что рассечение ворот селезенки требует значительного лапароскопического хирургического опыта. На сложность этой процедуры влияют такие факторы, как высокий ИМТ, поражение, расположенное рядом с селезеночным отверстием, большой объем поражения, а также наличие в анамнезе операций на брюшной полости. Для предотвращения травмирования хвоста поджелудочной железы и коротких желудочных сосудов требуется точная хирургическая техника. Полная блокада селезеночного кровотока может обеспечить желаемый ишемический эффект селезенки, особенно при работе с вариантами кровеносных сосудов.
Радиочастотные аппараты демонстрируют отличные показатели при гемостазе24,25. Мы обычно используем радиочастотные устройства для введения в паренхиму селезенки по предварительно разрезанному краю для коагуляции, образуя коагулятивно-некротическую область. Затем с помощью ультразвукового скальпеля мы рассекаем паренхиму селезенки, достигая бескровной частичной спленэктомии. В этом исследовании мы выполнили резекцию большого поражения селезенки с помощью радиочастоты. Интраоперационная кровопотеря составила 30 мл, а время операции – 102 минуты, без перехода в открытую операцию. Пациентка была выписана через 7 дней после операции без послеоперационных осложнений, что было достоверно лучше, чем в большинстве других исследований16,26. Контрольная КТ верхних отделов брюшной полости через 2 месяца после операции показала отсутствие тромбоза, остаточная селезенка имела хорошее кровоснабжение, демонстрируя удовлетворительный терапевтический эффект.
Teperman et al. указывают, что безопасное, теплое ишемическое время для селезенки человека составляет 1 ч27. Основываясь на обширном хирургическом опыте, мы можем завершить диссекцию паренхимы селезенки в безопасное время. Кроме того, послеоперационная компьютерная томография брюшной полости неизменно не показала тромбоза или инфаркта селезенки. Это подтверждает безопасность ЛПС при полной окклюзии селезеночного кровотока. Тем не менее, мы рекомендуем во время начальной кривой обучения избегать сложных случаев, в том числе с ИМТ > 25 кг/м², историей абдоминальной хирургии и поражениями ворот селезенки большого размера или почти селезеночной области, чтобы предотвратить длительное время ишемии, которое может повредить функцию селезенки. Метод, описанный в данном исследовании, не применим к очагам поражения, расположенным в области селезеночного пояса. Послеоперационный мониторинг также не менее важен для выявления потенциальных нежелательных явлений.
По сравнению с тотальной спленэктомией, ФС имеет преимущество в сохранении физиологической функции селезенки при одновременном достижении терапевтической эффективности и снижении частоты долгосрочных осложнений2. Как правило, рекомендуется, чтобы остаточный объем селезенки превышал 25% для эффективного сохранения функции селезенки. Для оценки остаточного объема селезенки мы используем технологию предоперационной реконструкции CT-3D. В случаях массивных поражений селезенки традиционный подход к выявлению и окклюзии соответствующих ветвей селезеночной артерии создает проблемы для сохранения достаточного количества паренхимы селезенки. В этом исследовании, сочетая предоперационную реконструкцию CT-3D и интраоперационную ультразвуковую оценку, мы оптимизировали подход к ЛПС для максимального сохранения нормальной ткани селезенки. Было резецировано примерно 65% селезенки, что позволяет достичь как терапевтических целей, так и поддержания функции селезенки.
Для того, чтобы обеспечить безопасность данного метода, мы рекомендуем проводить предоперационную компьютерную томографию брюшной полости для уточнения взаимосвязи между очагом поражения, сосудами селезенки и важными структурами брюшной полости, а также наличия вариантов кровеносных сосудов. Если это возможно, реконструкция CT-3D может еще больше улучшить предоперационную оценку. Важно отметить, что этот метод подходит для пациентов с травмой, ограниченной одной стороной селезенки, и мы не рекомендуем использовать этот метод в случаях угрожающего жизни травматического разрыва селезенки или для пациентов с гематологическими нарушениями. Первые могут представлять риск ненужного сохранения селезенки, что приведет к летальному исходу. Для пациентов, перенесших ПС в связи с гематологическими нарушениями, долгосрочное наблюдение показало высокий риск рецидива и последующей конверсии в тотальную спленэктомию2. Идеальным показанием к применению данного метода являются доброкачественные поражения селезенки. Этот метод не требует рассечения ветвей селезеночной артерии, тем самым несколько упрощая кривую обучения ЛПС. Тем не менее, следует проявлять осторожность при отборе пациентов на начальном этапе обучения.
В заключение следует отметить, что ЛПС при окклюзии тотального селезеночного кровотока является безопасным, осуществимым и воспроизводимым методом, дающим удовлетворительные результаты. Тем не менее, все еще необходимы дальнейшие обширные исследования для всесторонней оценки его безопасности и эффективности.
Раскрытие информации
Никакой
Благодарности
Никакой
Материалы
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable trocar | Kangji Medical | 101Y.307,101Y.311 | |
| Endo bag | Medtronic | https://www.medtronic.com/covidien/en-us/search.html#q=endo%20bag | specimen bag |
| Jaw sealer/divider | Covidien Medical | LF1737 | |
| Laparoscopic radiofrequency device | AngioDynamics, Inc | Rita 700-103659 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | |
| LigaSure | Medtronic | https://www.medtronic.com/covidien/en-us/products/vessel-sealing/ligasure-technology.html | vessel sealing system |
| Ligation clips (Hem-o-lok) | Teleflex Medical | 544240,544230,544220 | |
| Ultrasonic scalpel | ETHICON Medical | HAR36 |
Ссылки
- Lewis, S. M., Williams, A., Eisenbarth, S. C. Structure and function of the immune system in the spleen. Sci Immunol. 4 (33), eaau6085 (2019).
- Kristinsson, S. Y., Gridley, G., Hoover, R. N., Check, D., Landgren, O. Long-term risks after splenectomy among 8,149 cancer-free American veterans: a cohort study with up to 27 years follow-up. Haematologica. 99 (2), 392-398 (2014).
- Guizzetti, L. Total versus partial splenectomy in pediatric hereditary spherocytosis: A systematic review and meta-analysis. Pediatr Blood Cancer. 63 (10), 1713-1722 (2016).
- Bronte, V., Pittet, M. J. The spleen in local and systemic regulation of immunity. Immunity. 39 (5), 806-818 (2013).
- Christo, M. C. Partial regulated splenectomies. Preliminary note on the first 3 cases operated on. Hospital (Rio J). 56, 645-650 (1959).
- Redmond, H. P., Redmond, J. M., Rooney, B. P., Duignan, J. P., Bouchier-Hayes, D. J. Surgical anatomy of the human spleen. Br J Surg. 76 (2), 198-201 (2005).
- Romboli, A., et al. Laparoscopic partial splenectomy: A critical appraisal of an emerging technique. A review of the first 457 published cases. J Laparoendosc Adv Surg Tech A. 31 (10), 1130-1142 (2021).
- Buzelé, R., Barbier, L., Sauvanet, A., Fantin, B. Medical complications following splenectomy. J Visc Surg. 153 (4), 277-286 (2016).
- Bisharat, N., Omari, H., Lavi, I., Raz, R. Risk of infection and death among post-splenectomy patients. J Infect. 43 (3), 182-186 (2001).
- Kruetzmann, S., et al. Human immunoglobulin M memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J Exp Med. 197 (7), 939-945 (2003).
- Leone, G., Pizzigallo, E. Bacterial infections following splenectomy for malignant and nonmalignant hematologic diseases. Mediterr J Hematol Infect Dis. 7 (1), e2015057 (2015).
- Romano, F., et al. Thrombosis of the splenoportal axis after splenectomy. Langenbecks Arch Surg. 391 (5), 483-488 (2006).
- Watters, J. M., et al. Splenectomy leads to a persistent hypercoagulable state after trauma. Am J Surg. 199 (5), 646-651 (2010).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report. Surg Laparosc Endosc. 5 (4), 306-310 (1995).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surg Radiol Anat. 27 (1), 15-18 (2005).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Borie, F. Laparoscopic partial splenectomy: Surgical technique. J Visc Surg. 153 (5), 371-376 (2016).
- Ouyang, G., et al. Laparoscopic partial splenectomy with temporary occlusion of the trunk of the splenic artery in fifty-one cases: experience at a single center. Surg Endosc. 35 (1), 367-373 (2021).
- Mignon, F., et al. Preoperative selective embolization allowing a partial splenectomy for splenic hamartoma. Ann Chir. 128 (2), 112-116 (2003).
- Zheng, L., et al. Treatment of hemangioma of the spleen by preoperative partial splenic embolization plus laparoscopic partial splenectomy: A case report. Medicine (Baltimore). 97 (17), e0498 (2018).
- Vasilescu, C., Stanciulea, O., Tudor, S. Laparoscopic versus robotic subtotal splenectomy in hereditary spherocytosis. Potential advantages and limits of an expensive approach. Surg Endosc. 26 (10), 2802-2809 (2012).
- Wang, W. -. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World J Gastroenterol. 21 (11), 3420-3424 (2015).
- Liu, D. L., et al. Anatomy of vasculature of 850 spleen specimens and its application in partial splenectomy. Surgery. 119 (1), 27-33 (1996).
- Habib, N. A. How we do a bloodless partial splenectomy. Am J Surg. 186 (2), 164-166 (2003).
- Gumbs, A. A., Bouhanna, P., Bar-Zakai, B., Briennon, X., Gayet, B. Laparoscopic partial splenectomy using radiofrequency ablation. J Laparoendosc Adv Surg Tech A. 18 (4), 611-613 (2008).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World J Surg. 43 (6), 1505-1518 (2019).
- Teperman, S. H., et al. Bloodless splenic surgery: The safe warm-ischemic time. J Pediatr Surg. 29 (1), 88-92 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены