Method Article
Aplicação de esplenectomia parcial laparoscópica com oclusão do fluxo sanguíneo total em lesões esplênicas benignas
Neste Artigo
Resumo
Neste estudo, descrevemos uma técnica de controle de hemorragia intraoperatória para esplenectomia parcial laparoscópica, melhorando a segurança e a precisão da ressecção do baço.
Resumo
A esplenectomia parcial laparoscópica (LPS) está gradualmente se tornando o método preferido para o tratamento de lesões esplênicas benignas. No entanto, devido ao suprimento sanguíneo abundante e à sua textura de tecido macio e frágil, especialmente quando a lesão está localizada perto do hilo esplênico ou é particularmente grande, a realização da esplenectomia parcial (PS) na prática clínica é extremamente desafiadora. Portanto, temos explorado e otimizado continuamente os métodos de controle de hemorragia durante a SP, e aqui propomos um método para realizar LPS com oclusão completa do fluxo sanguíneo do baço.
Este estudo descreve uma abordagem otimizada para controlar a hemorragia intraoperatória durante o LPS. Primeiro, envolve a dissecção completa dos ligamentos esplênicos e a separação cuidadosa da cauda pancreática do baço. Com a exposição completa ao hilo esplênico, ocluímos temporariamente todo o suprimento sanguíneo do baço usando um clipe de buldogue laparoscópico. Posteriormente, empregamos ultrassom intraoperatório para identificar o limite da lesão e ressecar a porção correspondente do baço sob controle completo do fluxo sanguíneo. Essa abordagem incorpora a essência da 'preservação do baço' por meio do controle eficaz da hemorragia e da ressecção precisa. É particularmente adequado para cirurgia laparoscópica e merece mais promoção clínica.
Introdução
Com uma compreensão profunda das funções fisiológicas do baço, a pesquisa ressalta seu papel fundamental na resposta imune do corpo, hematopoiese e depuraçãodos glóbulos vermelhos. Complicações após a esplenectomia, como infecções pós-esplenectomia avassaladoras (OPSIs), hipertensão pulmonar e tromboembolismo, influenciam significativamente a escolha de métodos cirúrgicos na prática clínica 2,3. De acordo com a literatura, os pacientes após esplenectomia total apresentam diminuição da capacidade de eliminação de hemácias parasitadas por malária e maior risco de desenvolver meningite e sepse após infecções por Streptococcus pneumoniae, Neisseria meningitidis e Haemophilus influenzae tipoB 4. O PS preserva a função esplênica enquanto garante a eficácia do tratamento, tornando-o amplamente aplicado na prática clínica.
Em 1959, o primeiro PS bem-sucedido foi relatado por Cristo5. O baço é um órgão frágil composto por segmentos esplênicos bem definidos, cada um com seu suprimento arterial e venoso distinto, demarcados por regiões relativamente avasculares6. Esses fatores estabelecem coletivamente a base anatômica para a SP. No entanto, a cirurgia aberta convencional traz desvantagens inerentes, incluindo trauma significativo, desvantagens estéticas e dor pós-operatória. Nos últimos anos, juntamente com o amadurecimento de instrumentos e técnicas laparoscópicas, o LPS emergiu como a modalidade terapêutica preferida para lesões esplênicas benignas. No entanto, devido ao rico suprimento sanguíneo do baço, uma hemorragia intraoperatória substancial durante a laparoscopia pode causar uma conversão para cirurgia aberta. Romboli et al. revisaram 457 casos de LPS, revelando um tempo operatório médio de aproximadamente 128 ± 43,7 min, e demonstraram que cerca de 3,9% dos pacientes necessitaram de conversão devido a hemorragia, e o tempo médio de permanência pós-operatória é de 4,9 ± 3,8 dias7. O conhecimento abrangente da anatomia esplênica e as habilidades cirúrgicas meticulosas impediram a ampla aplicação clínica do LPS.
Para mitigar o risco de hemorragia intraoperatória e agilizar a curva de aprendizado, tentamos realizar LPS com oclusão completa do fluxo sanguíneo. Neste estudo, apresentamos uma paciente de 72 anos com um tumor vascular esplênico maciço localizado no polo médio superior do baço e adjacente ao hilo esplênico. Esta nova técnica se destaca no controle eficaz de hemorragias e garante segurança, eficácia e alto nível de reprodutibilidade.
Protocolo
Este estudo segue as diretrizes do Comitê de Ética do Hospital Shunde da Southern Medical University. O consentimento informado foi obtido do paciente antes da cirurgia para os dados e vídeo.
1. Seleção de pacientes
- Aplicar este método cirúrgico nos seguintes casos:
- Inclua pacientes com dor ou desconforto abdominal, juntamente com exames radiológicos que confirmem a presença de lesões benignas.
- Não imponha restrições específicas ao tamanho do tumor, mas mantenha um volume residual do baço superior a 25%.
- Certifique-se de que os pacientes apresentem níveis normais de AFP, CEA e CA-199 ou confirme a ausência de malignidade.
- Considere a obesidade, que resulta em aumento da gordura visceral potencialmente afetando a anatomia intraoperatória, mas não a vê como uma limitação absoluta.
- Exclua pacientes desta cirurgia nas seguintes condições:
- Exclua se o paciente tiver alta suspeita de metástase esplênica de tumores malignos.
- Excluir pacientes com esplenomegalia resultante de doenças hematológicas ou linfoma.
- Exclua pacientes com esplenomegalia secundária à cirrose hepática.
- Exclua pacientes com ruptura traumática do baço com risco de vida.
- Exclua pacientes com problemas de saúde geral e incapacidade de resistir à cirurgia.
2. Técnica cirúrgica
- Configure para a operação.
- Posicione o paciente sob anestesia geral em uma postura de Trendelenburg reversa com o lado esquerdo do corpo inclinado aproximadamente 10-30°.
NOTA: Faça ajustes na posição conforme necessário durante todo o procedimento cirúrgico. - Posicione o primeiro cirurgião e o assistente com o laparoscópio no lado direito do paciente e o primeiro assistente no lado esquerdo do paciente.
- Estabeleça e mantenha o pneumoperitônio em 12-14 mmHg.
- Instale quatro portas na parede abdominal com o auxílio da visualização laparoscópica, conforme ilustrado na Figura 1.
- Posicione o paciente sob anestesia geral em uma postura de Trendelenburg reversa com o lado esquerdo do corpo inclinado aproximadamente 10-30°.
- Examine a cavidade peritoneal sob laparoscopia para confirmar a ausência de malignidades.
- Realize a oclusão temporária da artéria esplênica.
- Use um sistema de vedação de vasos para dissecar o ligamento gastroesplênico ao longo da curvatura maior do estômago, entrando no saco menor.
- Segure o estômago e mova-o para o canto superior direito para melhor exposição ao campo cirúrgico.
- Disseque meticulosamente o tronco principal da artéria esplênica na borda superior do pâncreas e oclua-o temporariamente com um clipe de buldogue.
NOTA: Após a oclusão do fluxo sanguíneo, o baço apresenta diminuição de volume e textura mais macia, o que proporcionará espaço cirúrgico adequado.
- Disseque os ligamentos periesplênicos, incluindo os ligamentos esplenocólico, esplenorrenal e esplenofrênico.
NOTA: Deve-se ter cuidado ao separar a cauda pancreática do baço, particularmente em casos de esplenomegalia ou lesões esplênicas maciças, para evitar hemorragia descontrolada e a ocorrência de fístula pancreática pós-operatória (FPPO). - Realize a oclusão temporária do hilo esplênico.
- Exponha o hilo esplênico ressecando os acessórios ao seu redor com um bisturi ultrassônico e, em seguida, implemente uma oclusão temporária do hilo esplênico com um clipe de buldogue.
NOTA: Nos casos com variações nos vasos sanguíneos esplênicos, a mera oclusão da artéria esplênica pode não atingir as alterações isquêmicas esplênicas desejadas. - Após esta etapa, realize uma reavaliação completa da cor, tamanho e textura do baço.
- Exponha o hilo esplênico ressecando os acessórios ao seu redor com um bisturi ultrassônico e, em seguida, implemente uma oclusão temporária do hilo esplênico com um clipe de buldogue.
- Realize ultrassom intraoperatório para identificação dos limites da lesão.
- Use ultrassom intraoperatório para identificar o limite da lesão durante a cirurgia.
- Aplique eletrocautério para marcar a linha de demarcação a pelo menos 1 cm de distância do limite da lesão.
- Realize a dissecção do parênquima do baço.
- Insira um dispositivo de radiofrequência bipolar no parênquima esplênico ao longo da linha de demarcação para coagulação e ablação, ajustando a energia de radiofrequência em 80 W.
- Use um bisturi ultrassônico para dissecar o parênquima esplênico na zona de coagulação necrótica.
- Prenda com segurança os dutos grossos usando clipes vasculares Hem-o-lok e, em seguida, corte com cuidado, garantindo uma ressecção segura do baço superior contendo a lesão.
NOTA: Os vasos que suprem a porção removida do baço precisam ser cuidadosamente ligados e seccionados
- Remova a amostra.
- Solte o clipe bulldog, garantindo que não haja sangramento da borda cortada esplênica, e confirme o suprimento sanguíneo adequado para o baço remanescente.
- Use eletrocautério bipolar para cauterizar a borda de corte esplênica e aplique agentes hemostáticos absorvíveis sobre ela.
- Posicione um tubo de drenagem na fossa esplênica.
- Coloque a amostra em um saco de amostra, fragmente-a com uma pinça oval e remova-a pela porta ampliada.
- Solte o pneumoperitônio e suture as feridas de punção.
3. Detalhes pós-operatórios
- Realizar eletrocardiografia contínua por 24 horas de pós-operatório. Monitore os sinais essenciais, incluindo frequência cardíaca, pressão arterial, respiração, saturação de oxigênio, pressão venosa central, resposta pupilar e nível de consciência, para detectar complicações pós-operatórias precoces em tempo hábil.
- Administre antibióticos (cefuroxima sódica, 1,5 g a cada 12 h) e inibidores da bomba de prótons rotineiramente após a cirurgia.
- Remova o tubo gástrico no segundo dia de pós-operatório e permita ao paciente uma dieta líquida completa.
- Remova o tubo de drenagem abdominal quando a saída de drenagem for inferior a 100 mL / 24 h.
- Agende uma tomografia computadorizada abdominal de acompanhamento 2 meses após a cirurgia para avaliar a condição abdominal.
Resultados
Neste caso, uma paciente de 72 anos foi internada por uma lesão esplênica maciça encontrada em um exame de rotina em um hospital local. Ela tinha uma história de cirurgia abdominal prévia. Sua história médica não apresentava nada digno de nota e seu IMC era normal (20,1 kg/m2). A TC de abdome com contraste mostrou lesão maciça localizada no polo médio superior do baço, com diâmetro de aproximadamente 15 cm (Figura 2). As avaliações pré-operatórias não revelaram evidências de malignidade. Devido ao grande tamanho da lesão, após discussão completa, tentou-se LPS com oclusão completa do fluxo sanguíneo do baço. Imagens laparoscópicas intraoperatórias representativas são mostradas na Figura 3.
O tempo operatório foi de 102 min, com perda sanguínea intraoperatória de 30 mL, e aproximadamente 65% do baço foi ressecado. Não ocorreram complicações intraoperatórias e não houve conversão para laparotomia. Não foi necessária transfusão sanguínea intraoperatória. O dreno abdominal foi removido com 4 dias de pós-operatório, e o paciente recebeu alta no7º dia de pós-operatório. Não houve complicações pós-operatórias, incluindo fístula pancreática pós-operatória, infecção intraperitoneal, hemorragia, trombose portal ou infarto esplênico. Detalhes específicos podem ser vistos na Tabela 1. O diagnóstico anatomopatológico foi hemangioma. A TC abdominal de acompanhamento após 2 meses mostrou que o baço remanescente tinha bom suprimento sanguíneo e nenhuma recorrência foi observada.
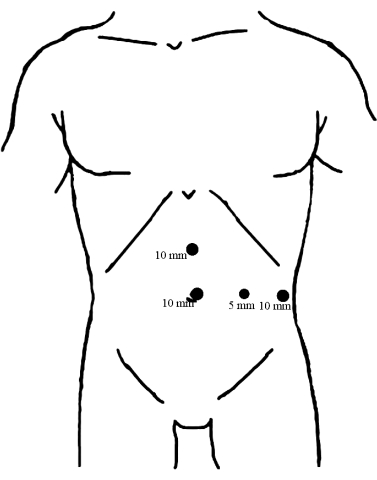
Figura 1: Distribuição dos trocartes. Coloque um trocarte de 10 mm abaixo do umbigo como uma porta de observação. Os outros dois trocartes de 10 mm são inseridos, um no ponto médio entre o umbigo e o apêndice xifóide e o outro na linha axilar anterior esquerda, paralela ao umbigo, ambos servindo como principais portas de operação. Em seguida, o trocarte de 5 mm foi inserido ao longo da linha média da clavícula esquerda ao nível do umbigo como porta de operação assistida. Clique aqui para ver uma versão maior desta figura.
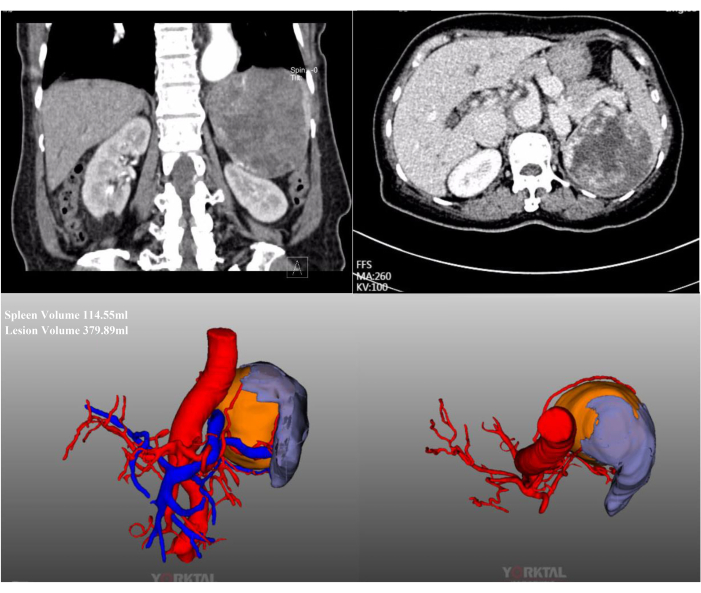
Figura 2: Reconstrução por TC e TC-3D com contraste. A TC com contraste abdominal e a reconstrução por TC-3D mostram uma lesão maciça localizada no polo médio superior do baço. Clique aqui para ver uma versão maior desta figura.
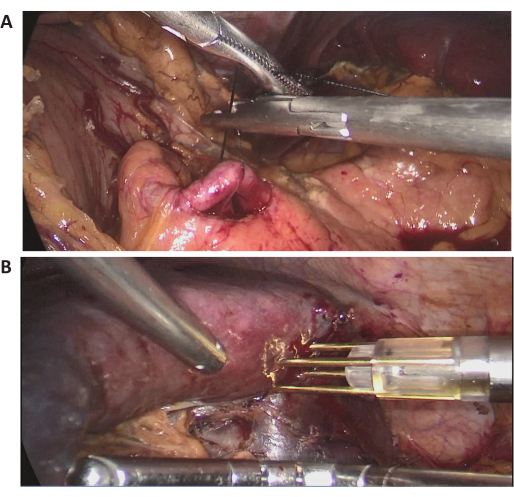
Figura 3: Imagens laparoscópicas intraoperatórias. (A, B) Imagens laparoscópicas intraoperatórias representativas do procedimento cirúrgico. Clique aqui para ver uma versão maior desta figura.
| Itens | Resultado |
| Tempo operatório (min) | 102 |
| Perda sanguínea intraoperatória (mL) | 30 |
| Conversão para laparotomia | Não |
| Transfusão de sangue intraoperatória | Não |
| Permanência hospitalar pós-operatória (dias) | 7 |
| Complicações pós-operatórias | Não |
Tabela 1: Detalhes operatórios e pós-operatórios do LPS.
Discussão
Durante anos, a esplenectomia total foi o tratamento primário para tumores esplênicos, esplenomegalia e distúrbios hematológicos. No entanto, com casos extensos acompanhados, as complicações após a esplenectomia total, incluindo complicações infecciosas e complicações tromboembólicas, têm despertado gradualmente aatenção8. As infecções avassaladoras pós-esplenectomia (OPSIs) são a complicação mais grave após a esplenectomia, caracterizadas pela rápida progressão da doença com uma taxa de mortalidade de aproximadamente 50%9. Esse risco aumentado de infecções bacterianas em pacientes esplenectomizados é atribuído ao papel das células B de memória IgM na zona marginal do baço, que é crucial para a eliminação de bactérias encapsuladas10,11. Além disso, complicações pós-operatórias, como trombose portal, trombose do sistema cavo e embolia pulmonar, precisam ser observadas. Pacientes cirróticos submetidos à esplenectomia apresentam maior incidência de tromboseportal12, possivelmente relacionada a um estadohipercoagulável13. O PS pode alcançar efeitos terapêuticos, preservando a função do baço. Portanto, para pacientes elegíveis, o PS tornou-se uma alternativa preferida. A cirurgia laparoscópica, que oferece benefícios como trauma mínimo, resultados estéticos e estadias pós-operatórias mais curtas, tem sido amplamente utilizada na SP nos últimos anos.
O LPS foi relatado pela primeira vez por Poulin em 199514. O LPS envolve a oclusão vascular seletiva de segmentos específicos do baço, seguida de ressecção ao longo da linha de demarcação. Normalmente, os ramos terminais da artéria esplênica se dividem em 2-3 ramos antes de entrar em segmentos distintos do baço. Cada segmento é separado por regiões relativamente avasculares15. No entanto, a aplicação do LPS é desafiadora devido à hemorragia intraoperatória descontrolada. Renato revisou 344 casos de cirurgia de LPS realizada entre 1960 e julho de 2017, indicando que a perda sanguínea intraoperatória média variou de 0 a 1200 cc. Entre os casos, 6,4% (22/344) necessitaram de conversão para laparotomia e 14 casos foram submetidos à esplenectomia total devido à hemorragia intraoperatória16. Com base em nossa experiência, os principais motivos são os seguintes: (i) O baço possui um rico suprimento sanguíneo e sua textura delicada o torna propenso a lesões durante a cirurgia, tornando a hemostasia desafiadora. (ii) A dissecção insuficiente do ligamento periesplênico complica a mobilização do baço, levando a rupturas do parênquima esplênico. (iii) A dissecação dos ramos da artéria esplênica apresenta dificuldade significativa e acarreta o risco potencial de danificar as estruturas abdominais adjacentes.
Numerosos estudos relataram métodos para reduzir a hemorragia intraoperatória durante o LPS. Existem basicamente três métodos principais: oclusão do suprimento sanguíneo esplênico, uso de dispositivos de radiofrequência e assistência robótica. Borie relatou a oclusão temporária da artéria esplênica usando uma pinça de alça para controlar a hemorragia intraoperatória durante o LPS17. No estudo de Peng18, 46 pacientes foram submetidos a LPS com oclusão temporária da artéria esplênica. Eles bloquearam temporariamente a artéria esplênica principal com um clipe de buldogue antes de dissecar os ramos correspondentes da artéria esplênica. Ao contrário de nós, este estudo incluiu apenas tumores localizados nos polos superior e inferior do baço, com tamanhos de baço menores que 20 cm. A embolização vascular pré-operatória também foi tentada para controle da hemorragia no LPS19,20, demonstrando resultados clínicos satisfatórios. Catalin et al.21 revisaram 10 casos de PS assistida por robótica, que tiveram menos hemorragia intraoperatória e menor tempo de permanência pós-operatória em comparação com o LPS. No entanto, seu alto custo limita seu uso generalizado. Nosso centro foi o primeiro a aplicar o aparelho de radiofrequência Habibi4X para esplenectomia22. Cria uma área necrótica coagulativa por radiofrequência, permitindo esplenectomia sem sangue. Tornou-se um método padronizado no centro com eficácia clínica consistente.
Considerando as limitações dos métodos acima e a experiência única de nosso centro, tentamos usar um clipe bulldog para oclusão temporária da artéria esplênica e hilo, realizando LPS sob isquemia esplênica completa. O estudo relatou que 95% do tronco da artéria esplênica principal corre na borda superior do pâncreas23. A oclusão temporária usando um clipe bulldog após localização e isolamento intraoperatórios é facilmente viável. No entanto, é essencial ressaltar que a dissecção do hilo esplênico requer considerável experiência cirúrgica laparoscópica. A complexidade desse procedimento é influenciada por fatores como IMC elevado, lesão localizada próxima ao hilo esplênico, grande volume da lesão e história de cirurgia abdominal. É necessária uma técnica cirúrgica precisa para evitar lesões na cauda pancreática e nos vasos gástricos curtos. Um bloqueio completo do fluxo sanguíneo esplênico pode garantir o efeito isquêmico esplênico desejado, principalmente quando se trata de casos de vasos sanguíneos variantes.
Os aparelhos de radiofrequência demonstram excelente desempenho na hemostasia 24,25. Rotineiramente, usamos dispositivos de radiofrequência para inserir no parênquima esplênico ao longo da borda pré-cortada para coagulação, formando uma área necrótica coagulativa. Posteriormente, utilizamos bisturi ultrassônico para dissecar o parênquima esplênico, obtendo esplenectomia parcial sem sangue. Neste estudo, realizamos uma grande ressecção da lesão esplênica assistida com radiofrequência. A perda sanguínea intraoperatória foi de 30 mL e o tempo operatório foi de 102 min, sem conversão para cirurgia aberta. O paciente recebeu alta 7 dias após a cirurgia sem complicações pós-operatórias, o que foi significativamente melhor do que a maioria dos outros estudos16,26. O acompanhamento da TC de abdome superior aos 2 meses de pós-operatório não mostrou trombose, e o baço remanescente apresentava bom suprimento sanguíneo, demonstrando efeito terapêutico satisfatório.
Teperman et al. indicam que o tempo isquêmico seguro e quente para o baço humano é de 1 h27. Com base na extensa experiência cirúrgica, podemos concluir a dissecção do parênquima esplênico dentro de um tempo seguro. Além disso, as tomografias computadorizadas de abdome pós-operatórias não mostraram trombose ou infarto esplênico. Isso confirma a segurança do LPS sob oclusão completa do fluxo sanguíneo esplênico. No entanto, recomendamos que, durante a curva de aprendizado inicial, casos desafiadores sejam evitados, incluindo aqueles com IMC > 25 kg/m², história de cirurgia abdominal e lesões superdimensionadas ou próximas ao hilo esplênico, para evitar tempo isquêmico prolongado que pode prejudicar a função esplênica. O método descrito neste estudo não é aplicável a lesões localizadas no hilo esplênico. O monitoramento pós-operatório também é igualmente importante para detectar possíveis eventos adversos.
Em comparação com a esplenectomia total, a PS oferece a vantagem de preservar a função fisiológica do baço, ao mesmo tempo em que alcança eficácia terapêutica e reduz as taxas de complicações a longo prazo2. Geralmente, recomenda-se que o volume do baço remanescente exceda 25% para preservar efetivamente a função esplênica. Para avaliar o volume do baço remanescente, empregamos a tecnologia de reconstrução CT-3D pré-operatória. Nos casos que envolvem lesões esplênicas maciças, a abordagem convencional de identificar e ocluir os ramos da artéria esplênica correspondentes apresenta desafios para preservar o parênquima esplênico suficiente. Neste estudo, combinando reconstrução pré-operatória de CT-3D e avaliação ultrassonográfica intraoperatória, otimizamos a abordagem do LPS para maximizar a preservação do tecido normal do baço. Aproximadamente 65% do baço foi ressecado, o que pode atingir tanto os objetivos terapêuticos quanto a manutenção da função esplênica.
Para garantir a segurança desse método, recomendamos a realização de tomografias computadorizadas abdominais pré-operatórias para esclarecer a relação entre a lesão, os vasos esplênicos e estruturas abdominais importantes, bem como a presença de vasos sanguíneos variantes. Se possível, a reconstrução CT-3D pode melhorar ainda mais a avaliação pré-operatória. É importante ressaltar que esse método é adequado para pacientes com trauma confinado a um lado do baço, e não aconselhamos o emprego desse método em casos de ruptura esplênica traumática com risco de vida ou para pacientes com distúrbios hematológicos. O primeiro pode representar um risco de preservação esplênica desnecessária levando à morte. Para pacientes submetidos a PS devido a distúrbios hematológicos, o acompanhamento a longo prazo mostrou um alto risco de recorrência e subsequente conversão para esplenectomia total2. A indicação ideal para este método são lesões benignas do baço. Este método não requer a dissecção de ramos da artéria esplênica, simplificando um pouco a curva de aprendizado para LPS. No entanto, deve-se ter cuidado ao selecionar pacientes durante a fase inicial de aprendizado.
Em conclusão, o LPS sob oclusão do fluxo sanguíneo esplênico total é um método seguro, viável e reprodutível que produz resultados satisfatórios. No entanto, ainda são necessárias mais pesquisas extensas para avaliar sua segurança e eficácia de forma abrangente.
Divulgações
Nenhum
Agradecimentos
Nenhum
Materiais
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable trocar | Kangji Medical | 101Y.307,101Y.311 | |
| Endo bag | Medtronic | https://www.medtronic.com/covidien/en-us/search.html#q=endo%20bag | specimen bag |
| Jaw sealer/divider | Covidien Medical | LF1737 | |
| Laparoscopic radiofrequency device | AngioDynamics, Inc | Rita 700-103659 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | |
| LigaSure | Medtronic | https://www.medtronic.com/covidien/en-us/products/vessel-sealing/ligasure-technology.html | vessel sealing system |
| Ligation clips (Hem-o-lok) | Teleflex Medical | 544240,544230,544220 | |
| Ultrasonic scalpel | ETHICON Medical | HAR36 |
Referências
- Lewis, S. M., Williams, A., Eisenbarth, S. C. Structure and function of the immune system in the spleen. Sci Immunol. 4 (33), eaau6085 (2019).
- Kristinsson, S. Y., Gridley, G., Hoover, R. N., Check, D., Landgren, O. Long-term risks after splenectomy among 8,149 cancer-free American veterans: a cohort study with up to 27 years follow-up. Haematologica. 99 (2), 392-398 (2014).
- Guizzetti, L. Total versus partial splenectomy in pediatric hereditary spherocytosis: A systematic review and meta-analysis. Pediatr Blood Cancer. 63 (10), 1713-1722 (2016).
- Bronte, V., Pittet, M. J. The spleen in local and systemic regulation of immunity. Immunity. 39 (5), 806-818 (2013).
- Christo, M. C. Partial regulated splenectomies. Preliminary note on the first 3 cases operated on. Hospital (Rio J). 56, 645-650 (1959).
- Redmond, H. P., Redmond, J. M., Rooney, B. P., Duignan, J. P., Bouchier-Hayes, D. J. Surgical anatomy of the human spleen. Br J Surg. 76 (2), 198-201 (2005).
- Romboli, A., et al. Laparoscopic partial splenectomy: A critical appraisal of an emerging technique. A review of the first 457 published cases. J Laparoendosc Adv Surg Tech A. 31 (10), 1130-1142 (2021).
- Buzelé, R., Barbier, L., Sauvanet, A., Fantin, B. Medical complications following splenectomy. J Visc Surg. 153 (4), 277-286 (2016).
- Bisharat, N., Omari, H., Lavi, I., Raz, R. Risk of infection and death among post-splenectomy patients. J Infect. 43 (3), 182-186 (2001).
- Kruetzmann, S., et al. Human immunoglobulin M memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J Exp Med. 197 (7), 939-945 (2003).
- Leone, G., Pizzigallo, E. Bacterial infections following splenectomy for malignant and nonmalignant hematologic diseases. Mediterr J Hematol Infect Dis. 7 (1), e2015057 (2015).
- Romano, F., et al. Thrombosis of the splenoportal axis after splenectomy. Langenbecks Arch Surg. 391 (5), 483-488 (2006).
- Watters, J. M., et al. Splenectomy leads to a persistent hypercoagulable state after trauma. Am J Surg. 199 (5), 646-651 (2010).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report. Surg Laparosc Endosc. 5 (4), 306-310 (1995).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surg Radiol Anat. 27 (1), 15-18 (2005).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Borie, F. Laparoscopic partial splenectomy: Surgical technique. J Visc Surg. 153 (5), 371-376 (2016).
- Ouyang, G., et al. Laparoscopic partial splenectomy with temporary occlusion of the trunk of the splenic artery in fifty-one cases: experience at a single center. Surg Endosc. 35 (1), 367-373 (2021).
- Mignon, F., et al. Preoperative selective embolization allowing a partial splenectomy for splenic hamartoma. Ann Chir. 128 (2), 112-116 (2003).
- Zheng, L., et al. Treatment of hemangioma of the spleen by preoperative partial splenic embolization plus laparoscopic partial splenectomy: A case report. Medicine (Baltimore). 97 (17), e0498 (2018).
- Vasilescu, C., Stanciulea, O., Tudor, S. Laparoscopic versus robotic subtotal splenectomy in hereditary spherocytosis. Potential advantages and limits of an expensive approach. Surg Endosc. 26 (10), 2802-2809 (2012).
- Wang, W. -. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World J Gastroenterol. 21 (11), 3420-3424 (2015).
- Liu, D. L., et al. Anatomy of vasculature of 850 spleen specimens and its application in partial splenectomy. Surgery. 119 (1), 27-33 (1996).
- Habib, N. A. How we do a bloodless partial splenectomy. Am J Surg. 186 (2), 164-166 (2003).
- Gumbs, A. A., Bouhanna, P., Bar-Zakai, B., Briennon, X., Gayet, B. Laparoscopic partial splenectomy using radiofrequency ablation. J Laparoendosc Adv Surg Tech A. 18 (4), 611-613 (2008).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World J Surg. 43 (6), 1505-1518 (2019).
- Teperman, S. H., et al. Bloodless splenic surgery: The safe warm-ischemic time. J Pediatr Surg. 29 (1), 88-92 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados