Method Article
Applicazione della splenectomia parziale laparoscopica con occlusione del flusso sanguigno totale nelle lesioni spleniche benigne
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo studio, descriviamo una tecnica di controllo dell'emorragia intraoperatoria per la splenectomia parziale laparoscopica, migliorando la sicurezza e la precisione della resezione della milza.
Abstract
La splenectomia parziale laparoscopica (LPS) sta gradualmente diventando il metodo preferito per il trattamento delle lesioni spleniche benigne. Tuttavia, a causa dell'abbondante afflusso di sangue e della sua struttura tissutale molle e fragile, soprattutto quando la lesione si trova vicino all'ilo splenico o è particolarmente grande, l'esecuzione della splenectomia parziale (PS) nella pratica clinica è estremamente impegnativa. Pertanto, abbiamo continuamente esplorato e ottimizzato i metodi di controllo dell'emorragia durante la PS e qui proponiamo un metodo per eseguire LPS con l'occlusione completa del flusso sanguigno della milza.
Questo studio descrive un approccio ottimizzato per controllare l'emorragia intraoperatoria durante l'LPS. In primo luogo, comporta la dissezione completa dei legamenti splenici e un'attenta separazione della coda pancreatica dalla milza. Con l'esposizione completa all'ilo splenico, occludiamo temporaneamente l'intero afflusso di sangue della milza utilizzando una clip per bulldog laparoscopica. Successivamente, impieghiamo l'ecografia intraoperatoria per identificare il confine della lesione e resecare la porzione corrispondente della milza sotto il completo controllo del flusso sanguigno. Questo approccio incarna l'essenza della "conservazione della milza" attraverso un efficace controllo dell'emorragia e una resezione precisa. È particolarmente indicato per la chirurgia laparoscopica e merita un'ulteriore promozione clinica.
Introduzione
Con una profonda comprensione delle funzioni fisiologiche della milza, la ricerca sottolinea il suo ruolo fondamentale nella risposta immunitaria dell'organismo, nell'emopoiesi e nella clearance dei globuli rossi1. Le complicanze successive alla splenectomia, come le infezioni post-splenectomia (OPSI), l'ipertensione polmonare e il tromboembolismo, influenzano significativamente la scelta dei metodi chirurgici nella pratica clinica 2,3. Secondo la letteratura, i pazienti dopo splenectomia totale mostrano una ridotta capacità di eliminare i globuli rossi parassitati dalla malaria e un rischio più elevato di sviluppare meningite e sepsi a seguito di infezioni da Streptococcus pneumoniae, Neisseria meningitidis e Haemophilus influenzae di tipo B4. La PS preserva la funzione splenica garantendo al contempo l'efficacia del trattamento, rendendolo ampiamente applicato nella pratica clinica.
Nel 1959, il primo PS di successo fu segnalato da Cristo5. La milza è un organo fragile che comprende segmenti splenici ben definiti, ciascuno con il suo caratteristico apporto arterioso e venoso, delimitati da regioni relativamente avascolari6. Questi fattori stabiliscono collettivamente le basi anatomiche per la PS. Tuttavia, la chirurgia aperta convenzionale comporta inconvenienti intrinseci, tra cui traumi significativi, svantaggi estetici e dolore postoperatorio. Negli ultimi anni, accanto alla maturazione degli strumenti e delle tecniche laparoscopiche, la LPS si è affermata come la modalità terapeutica preferita per le lesioni spleniche benigne. Tuttavia, a causa del ricco afflusso di sangue alla milza, una sostanziale emorragia intraoperatoria durante la laparoscopia può causare una conversione alla chirurgia a cielo aperto. Romboli et al. hanno esaminato 457 casi di LPS, rivelando un tempo operatorio medio di circa 128 ± 43,7 minuti, e hanno dimostrato che circa il 3,9% dei pazienti ha richiesto la conversione a causa di emorragia e la degenza postoperatoria media è di 4,9 ± 3,8 giorni7. La conoscenza completa dell'anatomia splenica e le meticolose competenze chirurgiche hanno ostacolato l'ampia applicazione clinica della LPS.
Per mitigare il rischio di emorragia intraoperatoria e accelerare la curva di apprendimento, cerchiamo di eseguire LPS con occlusione completa del flusso sanguigno. In questo studio, presentiamo una paziente di 72 anni con un tumore vascolare splenico massivo localizzato nel polo medio superiore della milza e adiacente all'ilo splenico. Questa nuova tecnica eccelle nel controllo efficace dell'emorragia e garantisce sicurezza, efficacia e un alto livello di riproducibilità.
Protocollo
Questo studio segue le linee guida del Comitato Etico dello Shunde Hospital della Southern Medical University. Il consenso informato è stato ottenuto dal paziente prima dell'intervento chirurgico per i dati e il video.
1. Selezione del paziente
- Applicare questo metodo chirurgico nei seguenti casi:
- Includere i pazienti che avvertono dolore o fastidio addominale, insieme a esami radiologici che confermano la presenza di lesioni benigne.
- Non imporre restrizioni specifiche sulle dimensioni del tumore, ma mantenere un volume residuo della milza superiore al 25%.
- Assicurarsi che i pazienti mostrino livelli normali di AFP, CEA e CA-199 o confermare l'assenza di malignità.
- Si consideri l'obesità, che si traduce in un aumento del grasso viscerale che potenzialmente influisce sull'anatomia intraoperatoria, ma non la considera una limitazione assoluta.
- Escludere i pazienti da questo intervento chirurgico nelle seguenti condizioni:
- Escludere se il paziente è altamente sospetto di metastasi spleniche da tumori maligni.
- Escludere i pazienti con splenomegalia derivante da malattie ematologiche o linfoma.
- Escludere i pazienti con splenomegalia secondaria a cirrosi epatica.
- Escludere i pazienti con rottura traumatica della milza pericolosa per la vita.
- Escludere i pazienti che hanno una cattiva salute generale e l'incapacità di sopportare un intervento chirurgico.
2. Tecnica chirurgica
- Impostare per l'operazione.
- Posizionare il paziente in anestesia generale in una posizione di Trendelenburg inversa con il lato sinistro del corpo inclinato di circa 10-30°.
NOTA: Apportare le regolazioni in posizione secondo necessità durante la procedura chirurgica. - Posizionare il primo chirurgo e l'assistente con il laparoscopio sul lato destro del paziente e il primo assistente sul lato sinistro del paziente.
- Stabilire e mantenere il pneumoperitoneo a 12-14 mmHg.
- Installare quattro porte sulla parete addominale con l'assistenza della visualizzazione laparoscopica, come illustrato nella Figura 1.
- Posizionare il paziente in anestesia generale in una posizione di Trendelenburg inversa con il lato sinistro del corpo inclinato di circa 10-30°.
- Esaminare la cavità peritoneale in laparoscopia per confermare l'assenza di tumori maligni.
- Eseguire l'occlusione temporanea dell'arteria splenica.
- Utilizzare un sistema di sigillatura dei vasi per sezionare il legamento gastrosplenico lungo la maggiore curvatura dello stomaco, entrando nel sacco minore.
- Afferra lo stomaco e spostalo in alto a destra per una migliore esposizione al campo chirurgico.
- Sezionare meticolosamente il tronco principale dell'arteria splenica sul bordo superiore del pancreas e occluderlo temporaneamente con una clip da bulldog.
NOTA: A seguito dell'occlusione del flusso sanguigno, la milza mostra una diminuzione di volume e una consistenza più morbida, che fornirà uno spazio chirurgico adeguato.
- Sezionare i legamenti perisplenici, compresi i legamenti splenocolico, splenorenale e splenofrenico.
NOTA: È necessario prestare attenzione quando si separa la coda pancreatica dalla milza, in particolare in caso di splenomegalia o lesioni spleniche massive, per prevenire l'emorragia incontrollata e l'insorgenza di fistola pancreatica postoperatoria (POPF). - Eseguire l'occlusione temporanea dell'ilo splenico.
- Esporre l'ilo splenico resecando gli attacchi attorno ad esso con un bisturi a ultrasuoni, quindi implementare un'occlusione temporanea dell'ilo splenico con una clip per bulldog.
NOTA: Nei casi con variazioni nei vasi sanguigni splenici, la semplice occlusione dell'arteria splenica potrebbe non ottenere le alterazioni ischemiche spleniche desiderate. - Dopo questo passaggio, condurre una rivalutazione approfondita del colore, delle dimensioni e della consistenza della milza.
- Esporre l'ilo splenico resecando gli attacchi attorno ad esso con un bisturi a ultrasuoni, quindi implementare un'occlusione temporanea dell'ilo splenico con una clip per bulldog.
- Eseguire l'ecografia intraoperatoria per l'identificazione del confine della lesione.
- Utilizzare l'ecografia intraoperatoria per identificare il confine della lesione durante l'intervento chirurgico.
- Applicare l'elettrocauterizzazione per segnare la linea di demarcazione ad almeno 1 cm di distanza dal confine della lesione.
- Eseguire la dissezione del parenchima della milza.
- Inserire un dispositivo a radiofrequenza bipolare nel parenchima splenico lungo la linea di demarcazione per la coagulazione e l'ablazione, impostando l'energia di radiofrequenza a 80 W.
- Utilizzare un bisturi a ultrasuoni per sezionare il parenchima splenico nella zona di coagulazione necrotica.
- Bloccare saldamente i dotti spessi utilizzando le clip vascolari Hem-o-lok e quindi tagliarli con cura, garantendo una resezione sicura della milza superiore contenente la lesione.
NOTA: I vasi che forniscono la parte rimossa della milza devono essere accuratamente legati e sezionati
- Rimuovere il campione.
- Rilasciare la clip bulldog, assicurandosi che non si verifichino sanguinamenti dal bordo del taglio splenico, e confermare un adeguato afflusso di sangue alla milza rimanente.
- Utilizzare l'elettrocauterizzazione bipolare per cauterizzare il bordo di taglio splenico e applicare agenti emostatici riassorbibili su di esso.
- Posizionare un tubo di drenaggio nella fossa splenica.
- Posizionare il campione in un sacchetto per campioni, frammentarlo con una pinza ovale e rimuoverlo attraverso la porta allargata.
- Rilasciare il pneumoperitoneo e suturare le ferite da puntura.
3. Dettagli postoperatori
- Eseguire l'elettrocardiografia continua per 24 ore dopo l'intervento. Monitorare i segni essenziali, tra cui la frequenza cardiaca, la pressione sanguigna, la respirazione, la saturazione di ossigeno, la pressione venosa centrale, la risposta pupillare e il livello di coscienza, per rilevare tempestivamente le complicanze postoperatorie precoci.
- Somministrare antibiotici (cefuroxima sodica, 1,5 g ogni 12 ore) e inibitori della pompa protonica di routine dopo l'intervento chirurgico.
- Rimuovere il sondino gastrico il secondo giorno postoperatorio e consentire al paziente una dieta completa di liquidi.
- Rimuovere il tubo di drenaggio addominale quando l'uscita di drenaggio è inferiore a 100 mL/24 h.
- Programmare una TAC addominale di follow-up 2 mesi dopo l'intervento chirurgico per valutare la condizione addominale.
Risultati
In questo caso, una paziente di 72 anni è stata ricoverata per una massiccia lesione splenica riscontrata in un esame di routine in un ospedale locale. Aveva una storia di precedenti interventi chirurgici addominali. La sua storia medica era irrilevante e il suo BMI era normale (20,1 kg/m2). La TC addominale con mezzo di contrasto ha mostrato una lesione massiva localizzata nel polo medio superiore della milza, con un diametro di circa 15 cm (Figura 2). Le valutazioni preoperatorie non hanno rivelato alcuna evidenza di malignità. A causa delle grandi dimensioni della lesione, dopo una discussione completa, è stata tentata la LPS con occlusione completa del flusso sanguigno della milza. Le immagini laparoscopiche intraoperatorie rappresentative sono mostrate nella Figura 3.
Il tempo operatorio è stato di 102 minuti, con una perdita di sangue intraoperatoria di 30 ml, e circa il 65% della milza è stato resecato. Non si sono verificate complicanze intraoperatorie e non c'è stata conversione alla laparotomia. Non è stata necessaria una trasfusione di sangue intraoperatoria. Il drenaggio addominale è stato rimosso 4 giorni dopo l'intervento e il paziente è stato dimesso il 7° giorno dopo l'intervento. Non ci sono state complicanze postoperatorie, tra cui fistola pancreatica postoperatoria, infezione intraperitoneale, emorragia, trombosi portale o infarto splenico. I dettagli specifici possono essere visti nella Tabella 1. La diagnosi patologica era emangioma. La TC addominale di follow-up dopo 2 mesi ha mostrato che la milza residua aveva un buon afflusso di sangue e non è stata osservata alcuna recidiva.
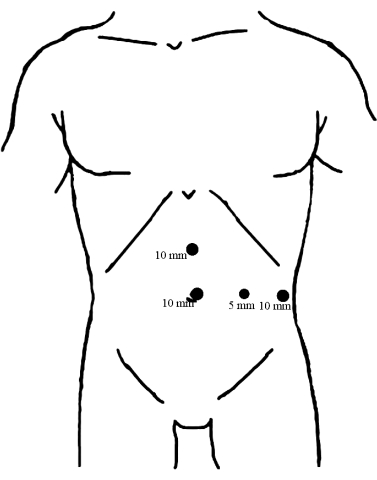
Figura 1: Distribuzione dei trocar. Posizionare un trocar da 10 mm sotto l'ombelico come porta di osservazione. Gli altri due trocar da 10 mm sono inseriti, uno nel punto medio tra l'ombelico e il processo xifoideo e l'altro sulla linea ascellare anteriore sinistra, parallela all'ombelico, entrambi fungono da porte operative principali. Quindi, il trocar da 5 mm è stato inserito lungo la linea mediana della clavicola sinistra a livello dell'ombelico come porta operatoria assistita. Clicca qui per visualizzare una versione più grande di questa figura.
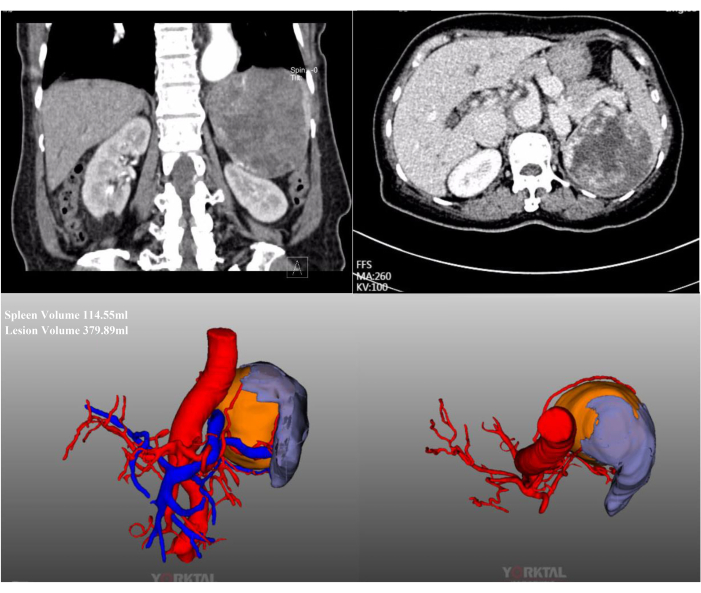
Figura 2: Ricostruzione TC e CT-3D con mezzo di contrasto. La TC addominale con mezzo di contrasto e la ricostruzione CT-3D mostrano una lesione massiva localizzata nel polo medio superiore della milza. Clicca qui per visualizzare una versione più grande di questa figura.
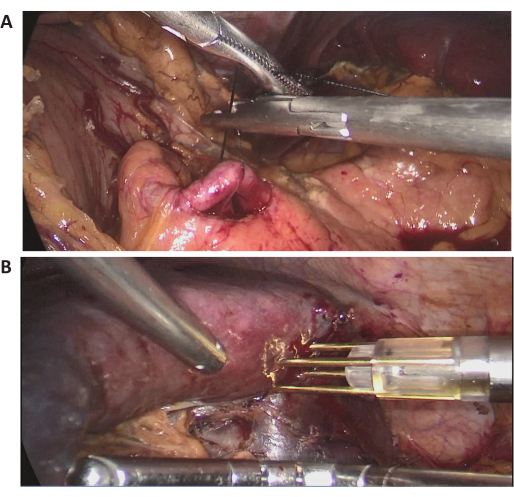
Figura 3: Immagini laparoscopiche intraoperatorie. (A,B) Immagini laparoscopiche intraoperatorie rappresentative della procedura chirurgica. Clicca qui per visualizzare una versione più grande di questa figura.
| Elementi | Risultato |
| Tempo operativo (min) | 102 |
| Perdita di sangue intraoperatoria (mL) | 30 |
| Conversione in laparotomia | No |
| Trasfusione di sangue intraoperatoria | No |
| Degenza ospedaliera postoperatoria (giorni) | 7 |
| Complicanze postoperatorie | No |
Tabella 1: Dettagli operativi e postoperatori di LPS.
Discussione
Per anni, la splenectomia totale è stata il trattamento primario per i tumori splenici, la splenomegalia e i disturbi ematologici. Tuttavia, con l'ampio follow-up dei casi, le complicanze dopo la splenectomia totale, comprese le complicanze infettive e le complicanze tromboemboliche, hanno gradualmente suscitato l'attenzione8. Le infezioni post-splenectomia (OPSI) sono la complicanza più grave dopo la splenectomia, caratterizzate da una rapida progressione della malattia con un tasso di mortalità di circa il 50%9. Questo aumento del rischio di infezioni batteriche nei pazienti splenectomizzati è attribuito al ruolo delle cellule B di memoria IgM nella zona marginale della milza, che è fondamentale per l'eliminazione dei batteri incapsulati10,11. Inoltre, è necessario notare complicanze postoperatorie come la trombosi portale, la trombosi del sistema cavale e l'embolia polmonare. I pazienti con cirrosi sottoposti a splenectomia hanno una maggiore incidenza di trombosi portale12, possibilmente correlata a uno stato di ipercoagulabilità13. Il PS può ottenere effetti terapeutici preservando la funzione della milza. Pertanto, per i pazienti idonei, la PS è diventata un'alternativa preferita. La chirurgia laparoscopica, che offre vantaggi come traumi minimi, esiti estetici e degenze postoperatorie più brevi, è stata ampiamente utilizzata nella PS negli ultimi anni.
LPS è stato segnalato per la prima volta da Poulin nel 199514. La LPS comporta l'occlusione vascolare selettiva di specifici segmenti della milza, seguita da resezione lungo la linea di demarcazione. Tipicamente, i rami terminali dell'arteria splenica si dividono in 2-3 rami prima di entrare in segmenti distinti della milza. Ogni segmento è separato da regioni relativamente avascolari15. Tuttavia, l'applicazione dell'LPS è impegnativa a causa dell'emorragia intraoperatoria incontrollata. Renato ha esaminato 344 casi di chirurgia LPS eseguiti tra il 1960 e il luglio 2017, indicando che la perdita media di sangue intraoperatoria variava da 0 a 1200 cc. Tra i casi, il 6,4% (22/344) ha richiesto la conversione alla laparotomia e 14 casi sono stati sottoposti a splenectomia totale a causa di emorragia intraoperatoria16. Sulla base della nostra esperienza, i motivi principali sono i seguenti: (i) La milza possiede un ricco afflusso di sangue e la sua consistenza delicata la rende soggetta a lesioni durante l'intervento chirurgico, rendendo difficile l'emostasi. (ii) Un'insufficiente dissezione del legamento perisplenico complica la mobilizzazione della milza, portando a lacerazioni del parenchima splenico. (iii) La dissezione dei rami dell'arteria splenica pone notevoli difficoltà e comporta il potenziale rischio di danneggiare le strutture addominali adiacenti.
Numerosi studi hanno riportato metodi per ridurre l'emorragia intraoperatoria durante l'LPS. Le metodiche principali sono principalmente tre: l'occlusione dell'afflusso di sangue splenico, l'uso di dispositivi a radiofrequenza e l'assistenza robotica. Borie ha riportato l'occlusione temporanea dell'arteria splenica utilizzando un morsetto ad ansa per controllare l'emorragia intraoperatoria durante LPS17. Nello studio di Peng18, 46 pazienti sono stati sottoposti a LPS con occlusione temporanea dell'arteria splenica. Hanno temporaneamente bloccato l'arteria splenica principale con una clip bulldog prima di sezionare i rami corrispondenti dell'arteria splenica. A differenza di noi, questo studio ha incluso solo tumori localizzati ai poli superiore e inferiore della milza, con dimensioni della milza inferiori a 20 cm. È stata anche tentata l'embolizzazione vascolare preoperatoria per il controllo dell'emorragia in LPS19,20, dimostrando risultati clinici soddisfacenti. Catalin et al.21 hanno esaminato 10 casi di PS robotico-assistita, che avevano meno emorragia intraoperatoria e degenze postoperatorie più brevi rispetto all'LPS. Tuttavia, il suo costo elevato ne limita l'uso diffuso. Il nostro centro è stato il primo ad applicare il dispositivo a radiofrequenza Habibi4X per la splenectomia22. Crea un'area necrotica coagulativa attraverso la radiofrequenza, consentendo la splenectomia senza sangue. È diventato un metodo standardizzato presso il centro con un'efficacia clinica costante.
Considerando i limiti dei metodi di cui sopra e l'esperienza unica del nostro centro, abbiamo tentato di utilizzare una clip per bulldog per l'occlusione temporanea dell'arteria splenica e dell'ilo, eseguendo LPS in ischemia splenica completa. Lo studio ha riportato che il 95% del tronco principale dell'arteria splenica corre al bordo superiore del pancreas23. L'occlusione temporanea con una clip bulldog dopo la localizzazione e l'isolamento intraoperatorio è facilmente fattibile. Tuttavia, è fondamentale sottolineare che la dissezione dell'ilo splenico richiede una notevole esperienza chirurgica laparoscopica. La complessità di questa procedura è influenzata da fattori quali un BMI elevato, una lesione localizzata vicino all'ilo splenico, un grande volume della lesione e una storia di chirurgia addominale. È necessaria una tecnica chirurgica precisa per prevenire lesioni alla coda pancreatica e ai vasi gastrici corti. Un blocco completo del flusso sanguigno splenico può garantire l'effetto ischemico splenico desiderato, in particolare quando si tratta di casi di vasi sanguigni variabili.
I dispositivi a radiofrequenza dimostrano prestazioni eccellenti nell'emostasi24,25. Utilizziamo abitualmente dispositivi a radiofrequenza da inserire nel parenchima splenico lungo il bordo pre-tagliato per la coagulazione, formando un'area necrotica coagulativa. Successivamente, utilizziamo un bisturi a ultrasuoni per sezionare il parenchima splenico, ottenendo una splenectomia parziale senza sangue. In questo studio, abbiamo eseguito una resezione di lesioni spleniche di grandi dimensioni assistita con radiofrequenza. La perdita di sangue intraoperatoria è stata di 30 ml e il tempo operatorio è stato di 102 minuti, senza conversione in chirurgia a cielo aperto. Il paziente è stato dimesso 7 giorni dopo l'intervento chirurgico senza complicanze postoperatorie, il che è stato significativamente migliore rispetto alla maggior parte degli altri studi16,26. Il follow-up TC addominale superiore a 2 mesi dopo l'operazione non ha mostrato trombosi e la milza residua aveva un buon afflusso di sangue, dimostrando un effetto terapeutico soddisfacente.
Teperman et al. indicano che il tempo ischemico caldo e sicuro per la milza umana è di 1 orae 27 minuti. Sulla base di una vasta esperienza chirurgica, siamo in grado di completare la dissezione del parenchima splenico in un tempo sicuro. Inoltre, le scansioni TC addominali postoperatorie non hanno costantemente mostrato trombosi o infarto splenico. Ciò conferma la sicurezza dell'LPS in caso di occlusione completa del flusso sanguigno splenico. Tuttavia, si raccomanda che durante la curva di apprendimento iniziale si evitino casi difficili, compresi quelli con BMI > 25 kg/m², una storia di chirurgia addominale e lesioni dell'ilo sovradimensionate o vicine alla milza, per prevenire un tempo ischemico prolungato che può danneggiare la funzione splenica. Il metodo descritto in questo studio non è applicabile alle lesioni localizzate all'ilo splenico. Anche il monitoraggio postoperatorio è altrettanto importante per rilevare potenziali eventi avversi.
Rispetto alla splenectomia totale, la PS offre il vantaggio di preservare la funzione fisiologica della milza, ottenendo al contempo un'efficacia terapeutica e riducendo i tassi di complicanze a lungo termine2. In genere si raccomanda che il volume residuo della milza superi il 25% per preservare efficacemente la funzione splenica. Per valutare il volume residuo della milza, impieghiamo la tecnologia di ricostruzione CT-3D preoperatoria. Nei casi che coinvolgono lesioni spleniche massive, l'approccio convenzionale di identificare e occludere i corrispondenti rami dell'arteria splenica pone sfide nel preservare un parenchima splenico sufficiente. In questo studio, combinando la ricostruzione CT-3D preoperatoria e la valutazione ecografica intraoperatoria, abbiamo ottimizzato l'approccio all'LPS per massimizzare la conservazione del tessuto normale della milza. Circa il 65% della milza è stato resecato, il che può raggiungere sia gli obiettivi terapeutici che il mantenimento della funzione splenica.
Al fine di garantire la sicurezza di questo metodo, si consiglia di eseguire scansioni TC addominali preoperatorie per chiarire la relazione tra la lesione, i vasi splenici e importanti strutture addominali, nonché la presenza di vasi sanguigni varianti. Se possibile, la ricostruzione CT-3D può migliorare ulteriormente la valutazione preoperatoria. È importante notare che questo metodo è adatto per pazienti con traumi confinati a un lato della milza e non consigliamo di utilizzare questo metodo in caso di rottura traumatica della milza pericolosa per la vita o per pazienti con disturbi ematologici. Il primo può rappresentare un rischio di inutile conservazione della milza che porta alla morte. Per i pazienti sottoposti a PS a causa di disturbi ematologici, il follow-up a lungo termine ha mostrato un alto rischio di recidiva e successiva conversione alla splenectomia totale2. L'indicazione ideale per questo metodo sono le lesioni benigne della milza. Questo metodo non richiede la dissezione dei rami dell'arteria splenica, semplificando così in qualche modo la curva di apprendimento per LPS. Tuttavia, è necessario prestare attenzione quando si selezionano i pazienti durante la fase iniziale di apprendimento.
In conclusione, l'LPS in occlusione totale del flusso sanguigno splenico è un metodo sicuro, fattibile e riproducibile che produce risultati soddisfacenti. Tuttavia, sono ancora necessarie ulteriori ricerche approfondite per valutarne la sicurezza e l'efficacia in modo completo.
Divulgazioni
Nessuno
Riconoscimenti
Nessuno
Materiali
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable trocar | Kangji Medical | 101Y.307,101Y.311 | |
| Endo bag | Medtronic | https://www.medtronic.com/covidien/en-us/search.html#q=endo%20bag | specimen bag |
| Jaw sealer/divider | Covidien Medical | LF1737 | |
| Laparoscopic radiofrequency device | AngioDynamics, Inc | Rita 700-103659 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | |
| LigaSure | Medtronic | https://www.medtronic.com/covidien/en-us/products/vessel-sealing/ligasure-technology.html | vessel sealing system |
| Ligation clips (Hem-o-lok) | Teleflex Medical | 544240,544230,544220 | |
| Ultrasonic scalpel | ETHICON Medical | HAR36 |
Riferimenti
- Lewis, S. M., Williams, A., Eisenbarth, S. C. Structure and function of the immune system in the spleen. Sci Immunol. 4 (33), eaau6085 (2019).
- Kristinsson, S. Y., Gridley, G., Hoover, R. N., Check, D., Landgren, O. Long-term risks after splenectomy among 8,149 cancer-free American veterans: a cohort study with up to 27 years follow-up. Haematologica. 99 (2), 392-398 (2014).
- Guizzetti, L. Total versus partial splenectomy in pediatric hereditary spherocytosis: A systematic review and meta-analysis. Pediatr Blood Cancer. 63 (10), 1713-1722 (2016).
- Bronte, V., Pittet, M. J. The spleen in local and systemic regulation of immunity. Immunity. 39 (5), 806-818 (2013).
- Christo, M. C. Partial regulated splenectomies. Preliminary note on the first 3 cases operated on. Hospital (Rio J). 56, 645-650 (1959).
- Redmond, H. P., Redmond, J. M., Rooney, B. P., Duignan, J. P., Bouchier-Hayes, D. J. Surgical anatomy of the human spleen. Br J Surg. 76 (2), 198-201 (2005).
- Romboli, A., et al. Laparoscopic partial splenectomy: A critical appraisal of an emerging technique. A review of the first 457 published cases. J Laparoendosc Adv Surg Tech A. 31 (10), 1130-1142 (2021).
- Buzelé, R., Barbier, L., Sauvanet, A., Fantin, B. Medical complications following splenectomy. J Visc Surg. 153 (4), 277-286 (2016).
- Bisharat, N., Omari, H., Lavi, I., Raz, R. Risk of infection and death among post-splenectomy patients. J Infect. 43 (3), 182-186 (2001).
- Kruetzmann, S., et al. Human immunoglobulin M memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J Exp Med. 197 (7), 939-945 (2003).
- Leone, G., Pizzigallo, E. Bacterial infections following splenectomy for malignant and nonmalignant hematologic diseases. Mediterr J Hematol Infect Dis. 7 (1), e2015057 (2015).
- Romano, F., et al. Thrombosis of the splenoportal axis after splenectomy. Langenbecks Arch Surg. 391 (5), 483-488 (2006).
- Watters, J. M., et al. Splenectomy leads to a persistent hypercoagulable state after trauma. Am J Surg. 199 (5), 646-651 (2010).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report. Surg Laparosc Endosc. 5 (4), 306-310 (1995).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surg Radiol Anat. 27 (1), 15-18 (2005).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Borie, F. Laparoscopic partial splenectomy: Surgical technique. J Visc Surg. 153 (5), 371-376 (2016).
- Ouyang, G., et al. Laparoscopic partial splenectomy with temporary occlusion of the trunk of the splenic artery in fifty-one cases: experience at a single center. Surg Endosc. 35 (1), 367-373 (2021).
- Mignon, F., et al. Preoperative selective embolization allowing a partial splenectomy for splenic hamartoma. Ann Chir. 128 (2), 112-116 (2003).
- Zheng, L., et al. Treatment of hemangioma of the spleen by preoperative partial splenic embolization plus laparoscopic partial splenectomy: A case report. Medicine (Baltimore). 97 (17), e0498 (2018).
- Vasilescu, C., Stanciulea, O., Tudor, S. Laparoscopic versus robotic subtotal splenectomy in hereditary spherocytosis. Potential advantages and limits of an expensive approach. Surg Endosc. 26 (10), 2802-2809 (2012).
- Wang, W. -. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World J Gastroenterol. 21 (11), 3420-3424 (2015).
- Liu, D. L., et al. Anatomy of vasculature of 850 spleen specimens and its application in partial splenectomy. Surgery. 119 (1), 27-33 (1996).
- Habib, N. A. How we do a bloodless partial splenectomy. Am J Surg. 186 (2), 164-166 (2003).
- Gumbs, A. A., Bouhanna, P., Bar-Zakai, B., Briennon, X., Gayet, B. Laparoscopic partial splenectomy using radiofrequency ablation. J Laparoendosc Adv Surg Tech A. 18 (4), 611-613 (2008).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World J Surg. 43 (6), 1505-1518 (2019).
- Teperman, S. H., et al. Bloodless splenic surgery: The safe warm-ischemic time. J Pediatr Surg. 29 (1), 88-92 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.