Method Article
Aplicación de la esplenectomía parcial laparoscópica con oclusión total del flujo sanguíneo en lesiones esplénicas benignas
En este artículo
Resumen
En este estudio describimos una técnica de control de la hemorragia intraoperatoria para la esplenectomía parcial laparoscópica, que mejora la seguridad y precisión de la resección del bazo.
Resumen
La esplenectomía parcial laparoscópica (SPL) se está convirtiendo gradualmente en el método preferido para tratar las lesiones esplénicas benignas. Sin embargo, debido al abundante suministro de sangre y a la textura blanda y frágil de los tejidos, especialmente cuando la lesión se encuentra cerca del hilio esplénico o es particularmente grande, la realización de una esplenectomía parcial (EP) en la práctica clínica es extremadamente difícil. Por lo tanto, hemos estado continuamente explorando y optimizando los métodos de control de hemorragias durante la EP, y aquí proponemos un método para realizar LPS con oclusión completa del flujo sanguíneo del bazo.
Este estudio describe un enfoque optimizado para controlar la hemorragia intraoperatoria durante la LPS. En primer lugar, implica la disección completa de los ligamentos esplénicos y la separación cuidadosa de la cola pancreática del bazo. Con la exposición completa al hilio esplénico, ocluimos temporalmente todo el suministro de sangre del bazo utilizando una pinza laparoscópica de bulldog. Posteriormente, empleamos la ecografía intraoperatoria para identificar el límite de la lesión y resecar la porción correspondiente del bazo bajo control completo del flujo sanguíneo. Este enfoque encarna la esencia de la "preservación del bazo" a través de un control eficaz de la hemorragia y una resección precisa. Está especialmente indicado para la cirugía laparoscópica y merece una mayor promoción clínica.
Introducción
Con un profundo conocimiento de las funciones fisiológicas del bazo, la investigación subraya su papel fundamental en la respuesta inmunitaria del cuerpo, la hematopoyesis y la eliminaciónde los glóbulos rojos. Las complicaciones posteriores a la esplenectomía, como las infecciones post-esplenectomía abrumadoras (OPSIs), la hipertensión pulmonar y el tromboembolismo, influyen significativamente en la elección de los métodos quirúrgicos en la práctica clínica 2,3. De acuerdo con la literatura, los pacientes después de la esplenectomía total exhiben una menor capacidad para eliminar los glóbulos rojos parasitados por malaria y un mayor riesgo de desarrollar meningitis y sepsis después de infecciones por Streptococcus pneumoniae, Neisseria meningitidis y Haemophilus influenzae tipo B4. La PS preserva la función esplénica al tiempo que garantiza la eficacia del tratamiento, por lo que se aplica ampliamente en la práctica clínica.
En 1959, el primer PS exitoso fue reportado por Cristo5. El bazo es un órgano frágil que comprende segmentos esplénicos bien definidos, cada uno con su irrigación arterial y venosa distintiva, demarcados por regiones relativamente avasculares6. Estos factores establecen colectivamente la base anatómica de la PS. Sin embargo, la cirugía abierta convencional conlleva inconvenientes inherentes, incluidos traumatismos significativos, desventajas estéticas y dolor postoperatorio. En los últimos años, junto con la maduración de los instrumentos y técnicas laparoscópicas, el LPS se ha convertido en la modalidad terapéutica preferida para las lesiones esplénicas benignas. No obstante, debido al rico suministro de sangre del bazo, una hemorragia intraoperatoria sustancial durante la laparoscopia puede causar una conversión a cirugía abierta. Romboli et al. revisaron 457 casos de LPS, revelando un tiempo operatorio promedio de aproximadamente 128 ± 43,7 min, y demostraron que alrededor del 3,9% de los pacientes requirieron conversión debido a la hemorragia, y la estancia postoperatoria promedio es de 4,9 ± 3,8 días7. El conocimiento exhaustivo de la anatomía esplénica y las habilidades quirúrgicas meticulosas han dificultado la amplia aplicación clínica de la LPS.
Para mitigar el riesgo de hemorragia intraoperatoria y acelerar la curva de aprendizaje, intentamos realizar LPS con oclusión completa del flujo sanguíneo. En este estudio, presentamos una paciente femenina de 72 años con un tumor vascular esplénico masivo localizado en el polo medio superior del bazo y adyacente al hilio esplénico. Esta novedosa técnica destaca por su eficacia en el control eficaz de la hemorragia y garantiza la seguridad, la eficacia y un alto nivel de reproducibilidad.
Protocolo
Este estudio sigue las directrices del Comité de Ética del Hospital Shunde de la Universidad Médica del Sur. Se obtuvo el consentimiento informado del paciente antes de la cirugía para los datos y el video.
1. Selección de pacientes
- Aplicar este método quirúrgico en los siguientes casos:
- Incluir pacientes que experimenten dolor o malestar abdominal, junto con exámenes radiológicos que confirmen la presencia de lesiones benignas.
- No imponga restricciones específicas sobre el tamaño del tumor, pero mantenga un volumen residual del bazo superior al 25%.
- Asegúrese de que los pacientes presenten niveles normales de AFP, CEA y CA-199 o confirme la ausencia de malignidad.
- Pensemos en la obesidad, que provoca un aumento de la grasa visceral que puede afectar a la anatomía intraoperatoria, pero no la considera una limitación absoluta.
- Excluir a los pacientes de esta cirugía en las siguientes condiciones:
- Excluir si el paciente tiene una alta sospecha de metástasis esplénica de tumores malignos.
- Excluir a los pacientes con esplenomegalia resultante de enfermedades hematológicas o linfoma.
- Excluir pacientes con esplenomegalia secundaria a cirrosis hepática.
- Excluir a los pacientes con ruptura traumática del bazo que ponga en peligro su vida.
- Excluir a los pacientes que tienen una mala salud general e incapacidad para resistir la cirugía.
2. Técnica quirúrgica
- Configuración para la operación.
- Coloque al paciente bajo anestesia general en una postura de Trendelenburg inversa con el lado izquierdo del cuerpo inclinado aproximadamente 10-30°.
NOTA: Realice ajustes en la posición según sea necesario durante todo el procedimiento quirúrgico. - Coloque al primer cirujano y al asistente con el laparoscopio en el lado derecho del paciente y el primer asistente en el lado izquierdo del paciente.
- Establecer y mantener el neumoperitoneo a 12-14 mmHg.
- Instale cuatro puertos en la pared abdominal con la ayuda de la visualización laparoscópica, como se muestra en la Figura 1.
- Coloque al paciente bajo anestesia general en una postura de Trendelenburg inversa con el lado izquierdo del cuerpo inclinado aproximadamente 10-30°.
- Examinar la cavidad peritoneal por laparoscopia para confirmar la ausencia de neoplasias malignas.
- Realizar la oclusión temporal de la arteria esplénica.
- Utilice un sistema de sellado de vasos para diseccionar el ligamento gastrosplénico a lo largo de la curvatura mayor del estómago, entrando en el saco menor.
- Agarre el estómago y muévalo hacia la parte superior derecha para una mejor exposición al campo quirúrgico.
- Disecciona meticulosamente el tronco principal de la arteria esplénica en el borde superior del páncreas y ocúyelo temporalmente con una pinza de bulldog.
NOTA: Después de la oclusión del flujo sanguíneo, el bazo exhibe una disminución de volumen y una textura más suave, lo que proporcionará un espacio quirúrgico adecuado.
- Diseccionar los ligamentos periesplénicos, incluidos los ligamentos esplenocólicos, esplenorenales y esplenofrénicos.
NOTA: Se debe tener precaución al separar la cola pancreática del bazo, particularmente en casos de esplenomegalia o lesiones esplénicas masivas, para prevenir hemorragias incontroladas y la aparición de fístula pancreática postoperatoria (POPF). - Realizar la oclusión temporal del hilio esplénico.
- Exponga el hilio esplénico resecando los accesorios a su alrededor con un bisturí ultrasónico, luego implemente una oclusión temporal del hilio esplénico con una pinza de bulldog.
NOTA: En los casos con variaciones en los vasos sanguíneos esplénicos, la mera oclusión de la arteria esplénica puede no lograr los cambios isquémicos esplénicos deseados. - Después de este paso, realice una reevaluación exhaustiva del color, el tamaño y la textura del bazo.
- Exponga el hilio esplénico resecando los accesorios a su alrededor con un bisturí ultrasónico, luego implemente una oclusión temporal del hilio esplénico con una pinza de bulldog.
- Realizar ecografía intraoperatoria para la identificación de los límites de la lesión.
- Utilice la ecografía intraoperatoria para identificar el límite de la lesión durante la cirugía.
- Aplique electrocauterio para marcar la línea de demarcación al menos a 1 cm del límite de la lesión.
- Realizar la disección del parénquima del bazo.
- Inserte un dispositivo de radiofrecuencia bipolar en el parénquima esplénico a lo largo de la línea de demarcación para la coagulación y la ablación, ajustando la energía de radiofrecuencia a 80 W.
- Utilice un bisturí ultrasónico para diseccionar el parénquima esplénico en la zona de coagulación necrótica.
- Sujete de forma segura los conductos gruesos con clips vasculares Hem-o-lok y luego córtelos con cuidado, asegurando una resección segura del bazo superior que contiene la lesión.
NOTA: Los vasos que irrigan la porción extraída del bazo deben ligarse y seccionarse cuidadosamente
- Retire la muestra.
- Suelte la pinza de bulldog, asegurándose de que no haya sangrado por el borde cortado esplénico y confirme el suministro adecuado de sangre al bazo remanente.
- Utilice la electrocauterización bipolar para cauterizar el borde de corte esplénico y aplicar agentes hemostáticos absorbibles sobre él.
- Coloque un tubo de drenaje en la fosa esplénica.
- Coloque el espécimen en una bolsa para muestras, disprímelo con pinzas ovaladas y retírelo a través del puerto ampliado.
- Liberar el neumoperitoneo y suturar las heridas punzantes.
3. Detalles postoperatorios
- Realizar electrocardiografía continua durante 24 h en el postoperatorio. Monitorizar los signos esenciales, como la frecuencia cardíaca, la presión arterial, la respiración, la saturación de oxígeno, la presión venosa central, la respuesta pupilar y el nivel de conciencia, para detectar a tiempo las complicaciones postoperatorias tempranas.
- Administrar antibióticos (cefuroxima sódica, 1,5 g cada 12 h) e inhibidores de la bomba de protones de forma rutinaria después de la cirugía.
- Retirar la sonda gástrica en el segundo día postoperatorio y permitir al paciente una dieta líquida completa.
- Retire el tubo de drenaje abdominal cuando la salida de drenaje sea inferior a 100 mL/24 h.
- Programe una tomografía computarizada abdominal de seguimiento 2 meses después de la cirugía para evaluar la afección abdominal.
Resultados
En este caso, una paciente femenina de 72 años ingresó por una lesión esplénica masiva encontrada en un examen de rutina en un hospital local. Tenía antecedentes de cirugía abdominal previa. Su historial clínico era normal y su IMC era normal (20,1 kg/m2). La TC abdominal con contraste mostró una lesión masiva localizada en el polo medio superior del bazo, con un diámetro aproximado de 15 cm (Figura 2). Las evaluaciones preoperatorias no revelaron evidencia de malignidad. Debido al gran tamaño de la lesión, después de una discusión completa, se intentó una LPS con oclusión completa del flujo sanguíneo del bazo. En la Figura 3 se muestran imágenes laparoscópicas intraoperatorias representativas.
El tiempo operatorio fue de 102 min, con una pérdida de sangre intraoperatoria de 30 mL, y se resecó aproximadamente el 65% del bazo. No se presentaron complicaciones intraoperatorias y no hubo conversión a laparotomía. No se requirió transfusión de sangre intraoperatoria. El drenaje abdominal se retiró a los 4 días del postoperatorio y el paciente fue dado de alta al7º día después de la cirugía. No hubo complicaciones postoperatorias, incluyendo fístula pancreática postoperatoria, infección intraperitoneal, hemorragia, trombosis portal o infarto esplénico. Los detalles específicos se pueden ver en la Tabla 1. El diagnóstico anatomopatológico fue hemangioma. La TC abdominal de seguimiento a los 2 meses mostró que el bazo remanente tenía un buen riego sanguíneo y no se observó recurrencia.
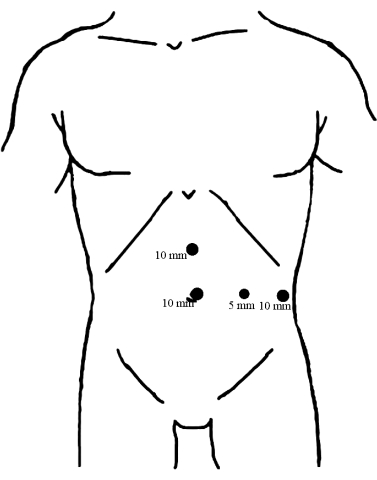
Figura 1: Distribución de los trócares. Coloque un trocar de 10 mm debajo del ombligo como puerto de observación. Se insertan los otros dos trócares de 10 mm, uno en el punto medio entre el ombligo y la apófisis xifoides y el otro en la línea axilar anterior izquierda, paralela al ombligo, sirviendo ambos como puertos operativos principales. A continuación, se insertó el trocar de 5 mm a lo largo de la línea media de la clavícula izquierda a la altura del ombligo como puerto de operación asistida. Haga clic aquí para ver una versión más grande de esta figura.
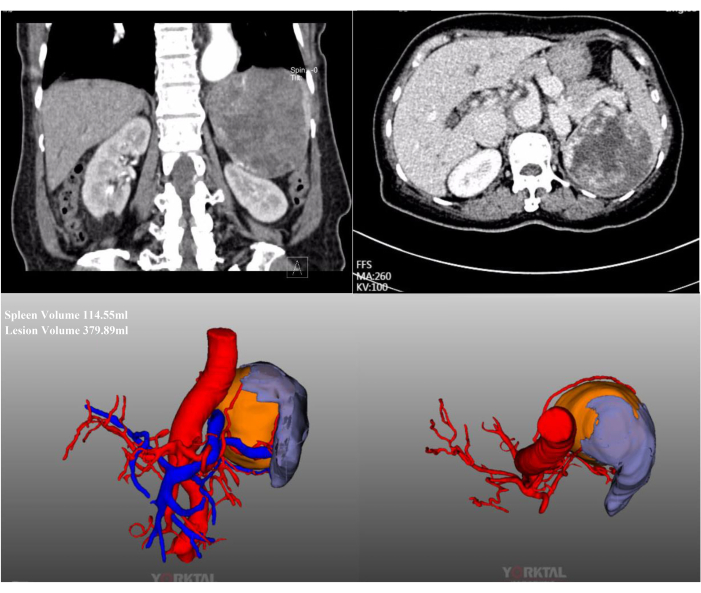
Figura 2: TC con contraste y reconstrucción TC-3D. La TC abdominal con contraste y la reconstrucción TC-3D muestran una lesión masiva localizada en el polo medio superior del bazo. Haga clic aquí para ver una versión más grande de esta figura.
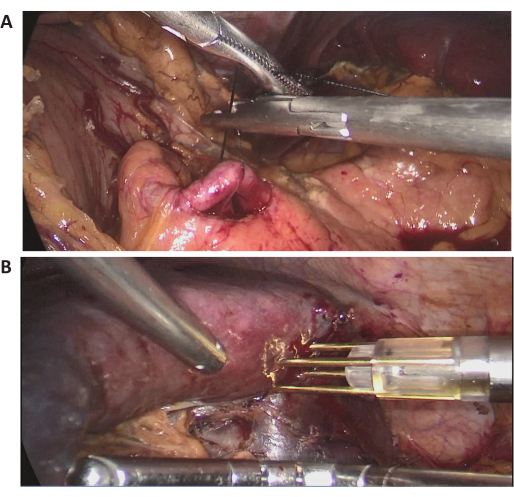
Figura 3: Imágenes laparoscópicas intraoperatorias. (A,B) Imágenes laparoscópicas intraoperatorias representativas del procedimiento quirúrgico. Haga clic aquí para ver una versión más grande de esta figura.
| Artículos | Resultado |
| Tiempo de funcionamiento (min) | 102 |
| Pérdida de sangre intraoperatoria (mL) | 30 |
| Conversión a laparotomía | No |
| Transfusión de sangre intraoperatoria | No |
| Estancia hospitalaria postoperatoria (días) | 7 |
| Complicaciones postoperatorias | No |
Tabla 1: Detalles operatorios y postoperatorios de LPS.
Discusión
Durante años, la esplenectomía total fue el tratamiento primario para los tumores esplénicos, la esplenomegalia y los trastornos hematológicos. Sin embargo, con un seguimiento extenso de los casos, las complicaciones posteriores a la esplenectomía total, incluyendo complicaciones infecciosas y complicaciones tromboembólicas, han despertado gradualmente la atención8. Las abrumadoras infecciones post-esplenectomía (OPSIs) son la complicación más grave después de la esplenectomía, caracterizadas por una rápida progresión de la enfermedad con una tasa de mortalidad de aproximadamente el 50%9. Este mayor riesgo de infecciones bacterianas en pacientes esplenectomizados se atribuye al papel de las células B de memoria IgM en la zona marginal del bazo, que es crucial para la eliminación de bacterias encapsuladas10,11. Además, hay que tener en cuenta las complicaciones postoperatorias como la trombosis portal, la trombosis del sistema cavo y la embolia pulmonar. Los pacientes con cirrosis que se someten a esplenectomía tienen una mayor incidencia de trombosis portal12, posiblemente relacionada con un estado de hipercoagulabilidad13. La PS puede lograr efectos terapéuticos al tiempo que preserva la función del bazo. Por lo tanto, para los pacientes elegibles, la PS se ha convertido en una alternativa preferida. La cirugía laparoscópica, que ofrece beneficios como un traumatismo mínimo, resultados estéticos y estancias postoperatorias más cortas, ha sido ampliamente utilizada en la EP en los últimos años.
El LPS fue reportado por primera vez por Poulin en 199514. La LPS implica la oclusión vascular selectiva de segmentos específicos del bazo, seguida de resección a lo largo de la línea de demarcación. Por lo general, las ramas terminales de la arteria esplénica se dividen en 2-3 ramas antes de ingresar a segmentos distintos del bazo. Cada segmento está separado por regiones relativamente avasculares15. Sin embargo, la aplicación de LPS es difícil debido a la hemorragia intraoperatoria incontrolada. Renato revisó 344 casos de cirugía de LPS realizados entre 1960 y julio de 2017, indicando que el promedio de pérdida de sangre intraoperatoria osciló entre 0 y 1200 cc. Entre los casos, el 6,4% (22/344) requirieron conversión a laparotomía, y 14 casos se sometieron a esplenectomía total por hemorragia intraoperatoria16. Según nuestra experiencia, las principales razones son las siguientes: (i) El bazo posee un rico suministro de sangre y su delicada textura lo hace propenso a lesiones durante la cirugía, lo que dificulta la hemostasia. (ii) Una disección insuficiente del ligamento periesplénico complica la movilización del bazo, lo que provoca desgarros del parénquima esplénico. (iii) La disección de las ramas de la arteria esplénica plantea una dificultad significativa y conlleva el riesgo potencial de dañar las estructuras abdominales adyacentes.
Numerosos estudios han reportado métodos para reducir la hemorragia intraoperatoria durante la LPS. Existen principalmente tres métodos principales: la oclusión del suministro de sangre esplénica, el uso de dispositivos de radiofrecuencia y la asistencia robótica. Borie informó de la oclusión temporal de la arteria esplénica utilizando una pinza de asa para controlar la hemorragia intraoperatoria durante la LPS17. En el estudio de Peng18, 46 pacientes se sometieron a LPS con oclusión temporal de la arteria esplénica. Bloquearon temporalmente la arteria esplénica principal con una pinza de bulldog antes de diseccionar las ramas correspondientes de la arteria esplénica. A diferencia de nosotros, en este estudio solo se incluyeron tumores localizados en los polos superior e inferior del bazo, con tamaños de bazo inferiores a 20 cm. También se ha intentado la embolización vascular preoperatoria para el control de la hemorragia en LPS19,20, demostrando resultados clínicos satisfactorios. Catalin et al.21 revisaron 10 casos de EP asistida por robot, que presentaron menor hemorragia intraoperatoria y estancias postoperatorias más cortas en comparación con la LPS. Sin embargo, su alto costo limita su uso generalizado. Nuestro centro fue el primero en aplicar el dispositivo de radiofrecuencia Habibi4X para la esplenectomía22. Crea un área necrótica coagulativa a través de la radiofrecuencia, lo que permite una esplenectomía sin sangre. Se ha convertido en un método estandarizado en el centro con una eficacia clínica constante.
Teniendo en cuenta las limitaciones de los métodos anteriores y la experiencia única de nuestro centro, intentamos utilizar una pinza de bulldog para la oclusión temporal de la arteria esplénica y el hilio, realizando LPS bajo isquemia esplénica completa. El estudio reportó que el 95% del tronco de la arteria esplénica principal discurre por el borde superior del páncreas23. La oclusión temporal con una pinza de bulldog después de la localización y el aislamiento intraoperatorios es fácilmente factible. Sin embargo, es fundamental destacar que la disección del hilio esplénico requiere una considerable experiencia quirúrgica laparoscópica. La complejidad de este procedimiento está influenciada por factores como un IMC alto, una lesión localizada cerca del hilio esplénico, un gran volumen de la lesión y antecedentes de cirugía abdominal. Se requiere una técnica quirúrgica precisa para prevenir lesiones en la cola pancreática y los vasos gástricos cortos. Un bloqueo completo del flujo sanguíneo esplénico puede garantizar el efecto isquémico esplénico deseado, particularmente cuando se trata de casos de vasos sanguíneos variantes.
Los dispositivos de radiofrecuencia demuestran un excelente rendimiento en la hemostasia24,25. Utilizamos habitualmente dispositivos de radiofrecuencia para insertar en el parénquima esplénico a lo largo del borde precortado para la coagulación, formando un área necrótica coagulante. Posteriormente, utilizamos un bisturí ultrasónico para diseccionar el parénquima esplénico, consiguiendo una esplenectomía parcial incruenta. En este estudio se realizó una resección de lesión esplénica de gran tamaño asistida con radiofrecuencia. La pérdida de sangre intraoperatoria fue de 30 mL y el tiempo operatorio de 102 min, sin conversión a cirugía abierta. El paciente fue dado de alta 7 días después de la cirugía, sin complicaciones postoperatorias, lo que fue significativamente mejor que la mayoría de los otros estudios16,26. El seguimiento de la TC abdominal superior a los 2 meses después de la operación no mostró trombosis y el bazo remanente tenía un buen riego sanguíneo, demostrando un efecto terapéutico satisfactorio.
Teperman et al. indican que el tiempo isquémico cálido y seguro para el bazo humano es de 1 h27. Basándonos en una amplia experiencia quirúrgica, podemos completar la disección del parénquima esplénico en un tiempo seguro. Además, las tomografías computarizadas abdominales postoperatorias no han mostrado sistemáticamente trombosis ni infarto esplénico. Esto confirma la seguridad de LPS bajo oclusión completa del flujo sanguíneo esplénico. Sin embargo, recomendamos que durante la curva de aprendizaje inicial, se eviten los casos difíciles, incluidos aquellos con IMC > 25 kg/m², antecedentes de cirugía abdominal y lesiones de hilio de gran tamaño o casi esplénicas, para evitar un tiempo isquémico prolongado que pueda dañar la función esplénica. El método descrito en este estudio no es aplicable a las lesiones localizadas en el hilio esplénico. El seguimiento postoperatorio también es igualmente importante para detectar posibles eventos adversos.
En comparación con la esplenectomía total, la EP ofrece la ventaja de preservar la función fisiológica del bazo, al tiempo que logra la eficacia terapéutica y reduce las tasas de complicaciones a largo plazo2. Por lo general, se recomienda que el volumen remanente del bazo supere el 25% para preservar eficazmente la función esplénica. Para evaluar el volumen remanente del bazo, empleamos la tecnología de reconstrucción CT-3D preoperatoria. En los casos de lesiones esplénicas masivas, el enfoque convencional de identificar y ocluir las ramas correspondientes de la arteria esplénica plantea desafíos para preservar un parénquima esplénico suficiente. En este estudio, mediante la combinación de la reconstrucción preoperatoria con TC-3D y la evaluación ecográfica intraoperatoria, optimizamos el enfoque de la LPS para maximizar la preservación del tejido normal del bazo. Se resecó aproximadamente el 65% del bazo, lo que puede lograr tanto objetivos terapéuticos como mantener la función esplénica.
Con el fin de garantizar la seguridad de este método, recomendamos realizar una tomografía computarizada abdominal preoperatoria para aclarar la relación entre la lesión, los vasos esplénicos y estructuras abdominales importantes, así como la presencia de vasos sanguíneos variantes. Si es posible, la reconstrucción CT-3D puede mejorar aún más la evaluación preoperatoria. Es importante tener en cuenta que este método es adecuado para pacientes con traumatismos confinados a un lado del bazo, y no recomendamos emplear este método en casos de ruptura esplénica traumática potencialmente mortal o para pacientes con trastornos hematológicos. El primero puede suponer un riesgo de conservación esplénica innecesaria que conduzca a la muerte. Para los pacientes sometidos a EP debido a trastornos hematológicos, el seguimiento a largo plazo ha demostrado un alto riesgo de recurrencia y posterior conversión a esplenectomía total2. La indicación ideal para este método son las lesiones benignas del bazo. Este método no requiere la disección de las ramas de la arteria esplénica, lo que simplifica un poco la curva de aprendizaje de la LPS. Sin embargo, se debe tener precaución al seleccionar pacientes durante la fase inicial de aprendizaje.
En conclusión, la LPS bajo oclusión de flujo sanguíneo esplénico total es un método seguro, factible y reproducible que produce resultados satisfactorios. Sin embargo, aún se necesita más investigación exhaustiva para evaluar su seguridad y eficacia de manera integral.
Divulgaciones
Ninguno
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable trocar | Kangji Medical | 101Y.307,101Y.311 | |
| Endo bag | Medtronic | https://www.medtronic.com/covidien/en-us/search.html#q=endo%20bag | specimen bag |
| Jaw sealer/divider | Covidien Medical | LF1737 | |
| Laparoscopic radiofrequency device | AngioDynamics, Inc | Rita 700-103659 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | |
| LigaSure | Medtronic | https://www.medtronic.com/covidien/en-us/products/vessel-sealing/ligasure-technology.html | vessel sealing system |
| Ligation clips (Hem-o-lok) | Teleflex Medical | 544240,544230,544220 | |
| Ultrasonic scalpel | ETHICON Medical | HAR36 |
Referencias
- Lewis, S. M., Williams, A., Eisenbarth, S. C. Structure and function of the immune system in the spleen. Sci Immunol. 4 (33), eaau6085 (2019).
- Kristinsson, S. Y., Gridley, G., Hoover, R. N., Check, D., Landgren, O. Long-term risks after splenectomy among 8,149 cancer-free American veterans: a cohort study with up to 27 years follow-up. Haematologica. 99 (2), 392-398 (2014).
- Guizzetti, L. Total versus partial splenectomy in pediatric hereditary spherocytosis: A systematic review and meta-analysis. Pediatr Blood Cancer. 63 (10), 1713-1722 (2016).
- Bronte, V., Pittet, M. J. The spleen in local and systemic regulation of immunity. Immunity. 39 (5), 806-818 (2013).
- Christo, M. C. Partial regulated splenectomies. Preliminary note on the first 3 cases operated on. Hospital (Rio J). 56, 645-650 (1959).
- Redmond, H. P., Redmond, J. M., Rooney, B. P., Duignan, J. P., Bouchier-Hayes, D. J. Surgical anatomy of the human spleen. Br J Surg. 76 (2), 198-201 (2005).
- Romboli, A., et al. Laparoscopic partial splenectomy: A critical appraisal of an emerging technique. A review of the first 457 published cases. J Laparoendosc Adv Surg Tech A. 31 (10), 1130-1142 (2021).
- Buzelé, R., Barbier, L., Sauvanet, A., Fantin, B. Medical complications following splenectomy. J Visc Surg. 153 (4), 277-286 (2016).
- Bisharat, N., Omari, H., Lavi, I., Raz, R. Risk of infection and death among post-splenectomy patients. J Infect. 43 (3), 182-186 (2001).
- Kruetzmann, S., et al. Human immunoglobulin M memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J Exp Med. 197 (7), 939-945 (2003).
- Leone, G., Pizzigallo, E. Bacterial infections following splenectomy for malignant and nonmalignant hematologic diseases. Mediterr J Hematol Infect Dis. 7 (1), e2015057 (2015).
- Romano, F., et al. Thrombosis of the splenoportal axis after splenectomy. Langenbecks Arch Surg. 391 (5), 483-488 (2006).
- Watters, J. M., et al. Splenectomy leads to a persistent hypercoagulable state after trauma. Am J Surg. 199 (5), 646-651 (2010).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report. Surg Laparosc Endosc. 5 (4), 306-310 (1995).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surg Radiol Anat. 27 (1), 15-18 (2005).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Borie, F. Laparoscopic partial splenectomy: Surgical technique. J Visc Surg. 153 (5), 371-376 (2016).
- Ouyang, G., et al. Laparoscopic partial splenectomy with temporary occlusion of the trunk of the splenic artery in fifty-one cases: experience at a single center. Surg Endosc. 35 (1), 367-373 (2021).
- Mignon, F., et al. Preoperative selective embolization allowing a partial splenectomy for splenic hamartoma. Ann Chir. 128 (2), 112-116 (2003).
- Zheng, L., et al. Treatment of hemangioma of the spleen by preoperative partial splenic embolization plus laparoscopic partial splenectomy: A case report. Medicine (Baltimore). 97 (17), e0498 (2018).
- Vasilescu, C., Stanciulea, O., Tudor, S. Laparoscopic versus robotic subtotal splenectomy in hereditary spherocytosis. Potential advantages and limits of an expensive approach. Surg Endosc. 26 (10), 2802-2809 (2012).
- Wang, W. -. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World J Gastroenterol. 21 (11), 3420-3424 (2015).
- Liu, D. L., et al. Anatomy of vasculature of 850 spleen specimens and its application in partial splenectomy. Surgery. 119 (1), 27-33 (1996).
- Habib, N. A. How we do a bloodless partial splenectomy. Am J Surg. 186 (2), 164-166 (2003).
- Gumbs, A. A., Bouhanna, P., Bar-Zakai, B., Briennon, X., Gayet, B. Laparoscopic partial splenectomy using radiofrequency ablation. J Laparoendosc Adv Surg Tech A. 18 (4), 611-613 (2008).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World J Surg. 43 (6), 1505-1518 (2019).
- Teperman, S. H., et al. Bloodless splenic surgery: The safe warm-ischemic time. J Pediatr Surg. 29 (1), 88-92 (1994).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados