Method Article
יישום כריתת טחול חלקי לפרוסקופית עם חסימת זרימת דם כוללת בנגעים שפירים
In This Article
Summary
במחקר זה אנו מתארים טכניקת בקרת דימום תוך ניתוחית לכריתת טחול חלקית לפרוסקופית, המשפרת את הבטיחות והדיוק של כריתת הטחול.
Abstract
כריתת טחול חלקית לפרוסקופית (LPS) הופכת בהדרגה לשיטה המועדפת לטיפול בנגעים שפירים בטחול. עם זאת, בשל אספקת הדם השופעת ומרקם הרקמה הרכה והשברירית שלו, במיוחד כאשר הנגע ממוקם בסמוך להילום הטחול או גדול במיוחד, ביצוע כריתת טחול חלקית (PS) בפרקטיקה הקלינית הוא מאתגר ביותר. לכן, אנו בוחנים ללא הרף ומייעלים שיטות בקרת דימום במהלך PS, ואנו מציעים כאן שיטה לביצוע LPS עם חסימה מלאה של זרימת הדם בטחול.
מחקר זה מתאר גישה אופטימלית לשליטה בדימום תוך ניתוחי במהלך LPS. ראשית, מדובר בדיסקציה יסודית של רצועות הטחול והפרדה זהירה של זנב הלבלב מהטחול. עם חשיפה מלאה להילום הטחול, אנו חוסמים באופן זמני את כל אספקת הדם של הטחול באמצעות קליפס בולדוג לפרוסקופי. לאחר מכן, אנו משתמשים באולטרסאונד תוך ניתוחי כדי לזהות את גבול הנגע ולכרות את החלק המתאים של הטחול תחת בקרת זרימת דם מלאה. גישה זו מגלמת את המהות של 'שימור טחול' באמצעות שליטה יעילה בדימום וכריתה מדויקת. הוא מתאים במיוחד לניתוחים לפרוסקופיים וראוי לקידום קליני נוסף.
Introduction
עם הבנה מעמיקה של התפקודים הפיזיולוגיים של הטחול, המחקר מדגיש את תפקידו המרכזי בתגובה החיסונית של הגוף, hematopoiesis, ופינוי של כדוריות דם אדומות1. סיבוכים לאחר כריתת טחול, כגון זיהומים מכריעים לאחר כריתת הטחול (OPSIs), יתר לחץ דם ריאתי וטרומבואמבוליזם, משפיעים באופן משמעותי על בחירת שיטות הניתוח בפרקטיקה הקלינית 2,3. על פי הספרות, חולים לאחר כריתת טחול מלאה מפגינים יכולת מופחתת לפנות RBCs טפילי מלריה וסיכון גבוה יותר לפתח דלקת קרום המוח ואלח דם בעקבות זיהומים עם סטרפטוקוקוס דלקת ריאות, Neisseria meningitidis, ו Haemophilus influenzae סוג B4. PS משמר את תפקוד הטחול תוך הבטחת יעילות הטיפול, מה שהופך אותו ליישום נרחב בפרקטיקה הקלינית.
בשנת 1959, ה-PS המוצלח הראשון דווח על ידי כריסטו5. הטחול הוא איבר שביר המורכב ממקטעים טחוליים מוגדרים היטב, שלכל אחד מהם אספקה עורקית וורידית ייחודית, המתוחמים על ידי אזורים אווסקולריים יחסית6. גורמים אלה ביחד מבססים את הבסיס האנטומי עבור PS. עם זאת, לניתוח פתוח קונבנציונלי יש חסרונות מובנים, כולל טראומה משמעותית, חסרונות קוסמטיים וכאבים לאחר הניתוח. בשנים האחרונות, לצד הבשלת מכשירים וטכניקות לפרוסקופיות, LPS התגלה כשיטה הטיפולית המועדפת לנגעים שפירים של טחול. עם זאת, בשל אספקת הדם העשירה של הטחול, דימום תוך ניתוחי משמעותי במהלך לפרוסקופיה עלול לגרום להמרה לניתוח פתוח. Romboli et al. סקרו 457 מקרים של LPS, חשפו זמן ניתוח ממוצע של כ 128 ± 43.7 דקות, והראו כי כ -3.9% מהחולים נזקקו להמרה עקב דימום, והשהייה הממוצעת לאחר הניתוח היא 4.9 ± 3.8 ימים7. ידע מקיף באנטומיה טחולית ומיומנויות כירורגיות קפדניות עיכבו את היישום הקליני הרחב של LPS.
כדי להפחית את הסיכון לדימום תוך ניתוחי ולזרז את עקומת הלמידה, אנו מנסים לבצע LPS עם חסימה מלאה של זרימת הדם. במחקר זה, אנו מציגים מטופלת בת 72 עם גידול כלי דם טבורי מסיבי הממוקם בקוטב האמצעי העליון של הטחול ובסמוך להילום הטחול. טכניקה חדשנית זו מצטיינת בבקרת דימום יעילה ומבטיחה בטיחות, יעילות ורמה גבוהה של יכולת שחזור.
Protocol
מחקר זה עוקב אחר הנחיות ועדת האתיקה של בית החולים שונדה של האוניברסיטה הרפואית הדרומית. התקבלה הסכמה מדעת מהמטופל לפני הניתוח לנתונים ולסרטון.
1. בחירת המטופל
- החל שיטה כירורגית זו במקרים הבאים:
- כלול חולים החווים כאבי בטן או אי נוחות, יחד עם בדיקות רדיולוגיות המאשרות את נוכחותם של נגעים שפירים.
- אין להטיל מגבלות ספציפיות על גודל הגידול, אך לשמור על נפח טחול שיורי העולה על 25%.
- ודא שהמטופלים מציגים רמות נורמליות של AFP, CEA ו- CA-199 או לאשר היעדר ממאירות.
- קחו בחשבון השמנת יתר, שגורמת לעלייה בשומן הקרבי שעלולה להשפיע על האנטומיה התוך ניתוחית, אך אינה רואה בה מגבלה מוחלטת.
- אין לכלול מטופלים בניתוח זה בתנאים הבאים:
- לא לכלול אם החולה חשוד מאוד גרורות טחול מגידולים ממאירים.
- לא לכלול חולים עם splenomegaly כתוצאה ממחלות המטולוגיות או לימפומה.
- לא לכלול חולים עם splenomegaly משני שחמת הכבד.
- לא לכלול חולים שיש להם קרע טחול טראומטי מסכן חיים.
- לא לכלול חולים שיש להם בריאות כללית ירודה וחוסר יכולת לעמוד בניתוח.
2. טכניקה כירורגית
- הגדר את הפעולה.
- מקם את המטופל בהרדמה כללית בתנוחת טרנדלנבורג הפוכה כאשר צד שמאל של הגוף נוטה בערך 10-30 מעלות.
הערה: בצע התאמות בתנוחה לפי הצורך במהלך ההליך הכירורגי. - מקם את המנתח הראשון ואת העוזר עם הלפרוסקופ בצד ימין של המטופל ואת העוזר הראשון בצד שמאל של המטופל.
- להקים ולתחזק pneumoperitoneum ב 12-14 מ"מ כספית.
- התקינו ארבע יציאות על דופן הבטן בעזרת הדמיה לפרוסקופית, כפי שמתואר באיור 1.
- מקם את המטופל בהרדמה כללית בתנוחת טרנדלנבורג הפוכה כאשר צד שמאל של הגוף נוטה בערך 10-30 מעלות.
- בדוק את חלל הצפק תחת לפרוסקופיה כדי לאשר את היעדר ממאירויות.
- בצע חסימה זמנית של עורק הטחול.
- השתמש במערכת איטום כלי כדי לנתח את הרצועה gastrosplenic לאורך העקמומיות הגדולה יותר של הבטן,נכנס השק פחות.
- אחזו בבטן והזיזו אותה למעלה מימין לחשיפה טובה יותר לשדה הניתוחי.
- נתחו בקפידה את הגזע הראשי של עורק הטחול בקצה העליון של הלבלב והסתירו אותו זמנית עם קליפס בולדוג.
הערה: לאחר חסימת זרימת הדם, הטחול מציג ירידה בנפח ומרקם רך יותר, אשר יספק מרחב כירורגי הולם.
- נתחו את הרצועות הפריספלניות, כולל הרצועות הטחוליות, הטחוליות והספלנופרניות.
הערה: יש לנקוט משנה זהירות בעת הפרדת זנב הלבלב מהטחול, במיוחד במקרים של ספלנומגליה או נגעים טחול מסיביים, כדי למנוע דימום בלתי מבוקר והתרחשות פיסטולה בלבלב לאחר הניתוח (POPF). - בצע חסימה זמנית של הילום הטחול.
- חשוף את הילום הטחול על ידי כריתת החיבורים סביבו עם אזמל קולי, ולאחר מכן ליישם חסימה זמנית של הילום ספלני עם קליפס בולדוג.
הערה: במקרים של שינויים בכלי הדם הטחוליים, חסימת העורק הטספרי בלבד עשויה שלא להשיג את השינויים האיסכמיים הטחולניים הרצויים. - לאחר שלב זה, בצעו הערכה מחודשת יסודית של צבע הטחול, גודלו ומרקמו.
- חשוף את הילום הטחול על ידי כריתת החיבורים סביבו עם אזמל קולי, ולאחר מכן ליישם חסימה זמנית של הילום ספלני עם קליפס בולדוג.
- ביצוע אולטרסאונד תוך ניתוחי לזיהוי גבול הנגע.
- השתמש אולטרסאונד תוך ניתוחי כדי לזהות את גבול הנגע במהלך הניתוח.
- יש למרוח אלקטרוצריבה כדי לסמן את קו התיחום במרחק של לפחות 1 ס"מ מגבול הנגע.
- לבצע דיסקציה parenchyma הטחול.
- הכנס מכשיר גלי רדיו דו קוטבי לתוך פרנכימה ספלנית לאורך קו התיחום עבור קרישה ואבלציה, הגדרת אנרגיית גלי רדיו על 80 W.
- השתמש אזמל קולי לנתח את parenchyma splenic באזור קרישה נמק.
- הדקו היטב צינורות עבים באמצעות אטבי כלי דם Hem-o-lok ולאחר מכן חתכו בזהירות, תוך הבטחת כריתה בטוחה של הטחול העליון המכיל את הנגע.
הערה: כלים המספקים את החלק שהוסר של הטחול צריכים להיות קשורים בזהירות וטרנסקט
- הסר את הדגימה.
- שחררו את אטב הבולדוג, וודאו שאין דימום מקצה החיתוך הטחולי, ואשרו אספקת דם נאותה לשאריות הטחול.
- השתמש electrocautery דו קוטבי כדי לצרוב את קצה לחתוך splenic ולהחיל חומרים המוסטטיים נספג על זה.
- מקם צינור ניקוז בפוסה הטחולית.
- הכניסו את הדגימה לשקית דגימה, שברו אותה בעזרת מלקחיים אליפטיים והוציאו אותה דרך היציאה המוגדלת.
- שחררו את ה-pneumoperitoneum ותפרו את פצעי הדקירה.
3. פרטים לאחר הניתוח
- בצע אלקטרוקרדיוגרפיה רציפה במשך 24 שעות לאחר הניתוח. עקוב אחר סימנים חיוניים, כולל קצב לב, לחץ דם, נשימה, רוויית חמצן, לחץ ורידי מרכזי, תגובת אישונים ורמת הכרה, כדי לזהות סיבוכים מוקדמים לאחר הניתוח במועד.
- מתן אנטיביוטיקה (cefuroxime נתרן, 1.5 גרם כל 12 שעות) ומעכבי משאבת פרוטונים באופן שגרתי לאחר הניתוח.
- הסר את צינור הקיבה ביום השני שלאחר הניתוח ולאפשר למטופל דיאטה נוזלית מלאה.
- יש להסיר את צינור ניקוז הבטן כאשר תפוקת הניקוז נמוכה מ-100 מ"ל/24 שעות.
- קבע תור לבדיקת CT בטן מעקב חודשיים לאחר הניתוח כדי להעריך את מצב הבטן.
תוצאות
במקרה זה, מטופלת בת 72 אושפזה בגלל נגע טחול מסיבי שנמצא בבדיקה שגרתית בבית חולים מקומי. הייתה לה היסטוריה של ניתוחי בטן קודמים. ההיסטוריה הרפואית שלה לא הייתה ראויה לציון, וה-BMI שלה היה תקין (20.1 ק"ג/מ"ר 2). CT משופר בניגודיות בטנית הראה נגע מסיבי הממוקם בקוטב האמצעי העליון של הטחול, בקוטר של כ-15 ס"מ (איור 2). בהערכות לפני הניתוח לא נמצאה עדות לממאירות. בשל גודלו הגדול של הנגע, לאחר דיון מלא, נעשה ניסיון לחסימת זרימת דם מלאה בטחול. תמונות לפרוסקופיות תוך ניתוחיות מייצגות מוצגות באיור 3.
זמן הניתוח היה 102 דקות, עם איבוד דם תוך ניתוחי של 30 מ"ל, וכ -65% מהטחול נכרת. לא התרחשו סיבוכים תוך ניתוחיים, ולא הייתה המרה ללפרוטומיה. עירוי דם תוך ניתוחי לא נדרש. ניקוז הבטן הוסר 4 ימים לאחר הניתוח, והמטופל שוחרר ביוםהשביעי לאחר הניתוח. לא היו סיבוכים לאחר הניתוח, כולל פיסטולה לבלב לאחר הניתוח, זיהום תוך צפקי, דימום, פקקת פורטלית או אוטם טחול. פרטים ספציפיים ניתן לראות בטבלה 1. האבחנה הפתולוגית הייתה המנגיומה. בדיקת CT הבטן העוקבת לאחר חודשיים הראתה כי אספקת הדם של שאריות הטחול הייתה טובה, ולא נצפתה הישנות.
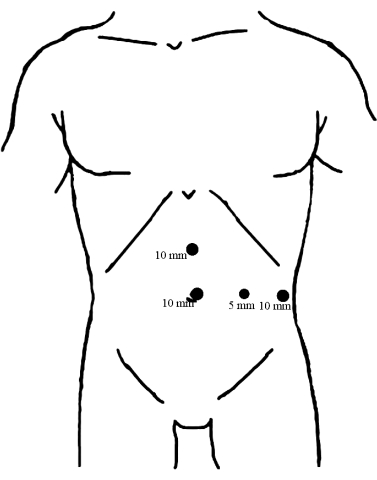
איור 1: התפלגות הטרוקרים. מניחים טרוקאר בקוטר 10 מ"מ מתחת לטבור כנקודת תצפית. שני הטרוקרים האחרים בקוטר 10 מ"מ מוכנסים, האחד בנקודת האמצע בין תהליך הטבור לתהליך הקסיפואיד והשני בקו בית השחי הקדמי השמאלי, במקביל לטבור, שניהם משמשים כיציאות ההפעלה העיקריות. לאחר מכן, הטרוקאר בקוטר 5 מ"מ הוכנס לאורך קו האמצע של עצם הבריח השמאלית בגובה הטבור כיציאת הניתוח המסייעת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
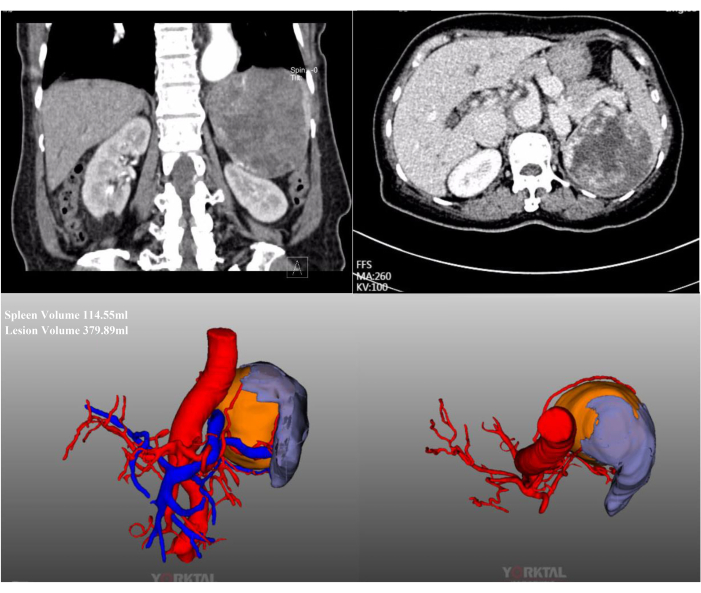
איור 2: שחזור CT ו-CT-3D משופר בניגודיות. שחזור CT ו-CT-3D משופר בניגודיות בטנית מראים נגע מסיבי הממוקם בקוטב האמצעי העליון של הטחול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
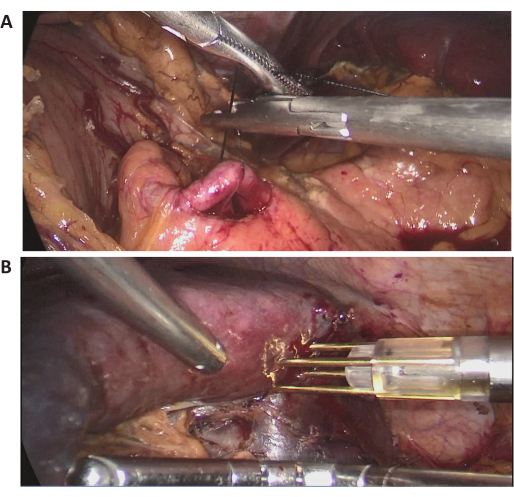
איור 3: תמונות לפרוסקופיות תוך ניתוחיות. (א,ב) תמונות לפרוסקופיות תוך ניתוחיות מייצגות של ההליך הכירורגי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| פריטים | תוצאה |
| זמן פעולה (מינימום) | 102 |
| איבוד דם תוך ניתוחי (מ"ל) | 30 |
| המרה ללפרוטומיה | לא |
| עירוי דם תוך ניתוחי | לא |
| אשפוז לאחר הניתוח (ימים) | 7 |
| סיבוכים לאחר הניתוח | לא |
טבלה 1: פרטים אופרטיביים ופוסט-ניתוחיים של LPS.
Discussion
במשך שנים, כריתת טחול מלאה הייתה הטיפול העיקרי בגידולי טחול, ספלנומגליה והפרעות המטולוגיות. עם זאת, עם מקרים נרחבים במעקב, סיבוכים לאחר כריתת טחול מלאה, כולל סיבוכים זיהומיים וסיבוכים טרומבואמבוליים, עוררו בהדרגה תשומת לב8. זיהומים מכריעים לאחר כריתת טחול (OPSIs) הם הסיבוך החמור ביותר לאחר כריתת טחול, המאופיינים בהתקדמות מחלה מהירה עם שיעור תמותה של כ 50%9. סיכון מוגבר זה לזיהומים חיידקיים בחולים עם כריתת טחול מיוחס לתפקידם של תאי זיכרון IgM B באזור השולי של הטחול, שהוא חיוני לניקוי חיידקים עטופים10,11. יתר על כן, יש לציין סיבוכים לאחר הניתוח כגון פקקת פורטלית, פקקת מערכת המערות ותסחיף ריאתי. חולים עם שחמת הכבד שעוברים כריתת טחול יש שכיחות גבוהה יותר של פקקת פורטל12, אולי קשור למצב קרישיות יתר13. PS יכול להשיג השפעות טיפוליות תוך שמירה על תפקוד הטחול. לכן, עבור חולים זכאים, PS הפך חלופה מועדפת. ניתוחים לפרוסקופיים, המציעים יתרונות כגון טראומה מינימלית, תוצאות אסתטיות ושהות קצרה יותר לאחר הניתוח, נמצאים בשימוש נרחב ב- PS בשנים האחרונות.
LPS דווח לראשונה על ידי פולין בשנת 199514. LPS כרוך בחסימת כלי דם סלקטיבית של מקטעי טחול ספציפיים, ולאחר מכן כריתה לאורך קו התיחום. בדרך כלל, הענפים הסופיים של עורק הטחול מתחלקים ל 2-3 ענפים לפני הכניסה לקטעי טחול נפרדים. כל קטע מופרד על ידי אזורים אווסקולריים יחסית15. עם זאת, היישום של LPS מאתגר עקב דימום תוך ניתוחי בלתי מבוקר. רנאטו סקר 344 מקרים של ניתוח LPS שבוצעו בין 1960 ליולי 2017, וציין כי איבוד הדם הממוצע תוך ניתוחי נע בין 0 ל -1200 סמ"ק. מבין המקרים, 6.4% (22/344) נזקקו להמרה ללפרוטומיה, ו-14 מקרים עברו כריתת טחול מלאה עקב דימום תוך ניתוחי16. בהתבסס על הניסיון שלנו, הסיבות העיקריות הן כדלקמן: (i) הטחול בעל אספקת דם עשירה, והמרקם העדין שלו הופך אותו למועד לפציעות במהלך הניתוח, מה שהופך את המוסטזיס למאתגר. (ii) דיסקציה לא מספקת של הרצועה ההיקפית מסבכת את גיוס הטחול, מה שמוביל לקרעים פרנכימליים טחוליים. (iii) כריתת ענפי עורק הטחול מהווה קושי משמעותי וטומנת בחובה סיכון פוטנציאלי לפגיעה במבני בטן סמוכים.
מחקרים רבים דיווחו על שיטות להפחתת דימום תוך ניתוחי במהלך LPS. ישנן בעיקר שלוש שיטות עיקריות: חסימת אספקת הדם הטחולית, שימוש במכשירי גלי רדיו וסיוע רובוטי. בורי דיווח על חסימה זמנית של עורק הטחול באמצעות מהדק לולאה כדי לשלוט בדימום תוך ניתוחי במהלך LPS17. במחקרשל פנג 18, 46 חולים עברו LPS עם חסימה זמנית של עורק הטחול. הם חסמו זמנית את עורק הטחול הראשי עם קליפס בולדוג לפני שניתחו את הענפים המתאימים של עורק הטחול. בניגוד אלינו, מחקר זה כלל רק גידולים הממוקמים בקטבים העליונים והתחתונים של הטחול, עם גודל טחול קטן מ -20 ס"מ. אמבוליזציה של כלי דם לפני הניתוח נוסתה גם לשליטה בדימום ב- LPS19,20, והדגים תוצאות קליניות משביעות רצון. Catalin et al.21 סקרו 10 מקרים של PS בסיוע רובוטי, שהיו להם פחות דימום תוך ניתוחי ושהות קצרה יותר לאחר הניתוח בהשוואה ל- LPS. עם זאת, עלותו הגבוהה מגבילה את השימוש הנרחב בו. המרכז שלנו היה הראשון ליישם את מכשיר גלי הרדיו Habibi4X עבור כריתת טחול22. זה יוצר אזור נמק קרישה באמצעות גלי רדיו, המאפשר כריתת טחול ללא דם. זה הפך לשיטה סטנדרטית במרכז עם יעילות קלינית עקבית.
בהתחשב במגבלות השיטות הנ"ל ובניסיון הייחודי של המרכז שלנו, ניסינו להשתמש בקליפ בולדוג לחסימה זמנית של עורק הטחול וההילום, ביצוע LPS תחת איסכמיה ספלנית מלאה. המחקר דיווח כי 95% מגזע העורק הראשי עובר בקצה העליון של הלבלב23. חסימה זמנית באמצעות קליפס בולדוג לאחר לוקליזציה תוך ניתוחית ובידוד אפשרית בקלות. עם זאת, חשוב להדגיש כי דיסקציה של הילום טחול דורש ניסיון כירורגי לפרוסקופי ניכר. מורכבותו של הליך זה מושפעת מגורמים כגון BMI גבוה, נגע הממוקם בסמוך להילום הטחול, נפח נגע גדול והיסטוריה של ניתוחי בטן. טכניקה כירורגית מדויקת נדרשת כדי למנוע פגיעה בזנב הלבלב וכלי קיבה קצרים. חסימה מוחלטת של זרימת הדם הטפלנית יכולה להבטיח את ההשפעה האיסכמית הטפלנית הרצויה, במיוחד כאשר מדובר במקרים של כלי דם שונים.
מכשירי גלי רדיו מפגינים ביצועים מצוינים בהמוסטאזיס24,25. אנו משתמשים באופן שגרתי במכשירי גלי רדיו כדי להחדיר לתוך הפרנכימה הטפלנית לאורך הקצה החתוך מראש לצורך קרישה, ויוצרים אזור נמק קרישתי. לאחר מכן, אנו משתמשים באזמל קולי כדי לנתח את פרנכימה טחולית, השגת כריתת טחול חלקית ללא דם. במחקר זה ביצענו כריתה של נגע טבורי גדול בסיוע גלי רדיו. איבוד הדם תוך ניתוחי היה 30 מ"ל, וזמן הניתוח היה 102 דקות, ללא המרה לניתוח פתוח. המטופל שוחרר 7 ימים לאחר הניתוח ללא סיבוכים לאחר הניתוח, וזה היה טוב משמעותית מרוב המחקרים האחרים 16,26. מעקב CT בטן עליונה לאחר חודשיים לאחר הניתוח לא הראה פקקת, ולטחול שארית הייתה אספקת דם טובה, מה שהדגים השפעה טיפולית משביעת רצון.
Teperman et al. מצביעים על כך שהזמן האיסכמי הבטוח והחם לטחול האנושי הוא 1 שעות27. בהתבסס על ניסיון כירורגי רב, אנו יכולים להשלים את הדיסקציה של פרנכימה טחול בתוך זמן בטוח. יתר על כן, סריקות CT בטן לאחר הניתוח לא הראו באופן עקבי פקקת או אוטם טחול. זה מאשר את הבטיחות של LPS תחת חסימה מלאה של זרימת הדם הטפלנית. עם זאת, אנו ממליצים כי במהלך עקומת הלמידה הראשונית, יש להימנע ממקרים מאתגרים, כולל אלה עם BMI > 25 ק"ג / מ"ר, היסטוריה של ניתוחי בטן, ונגעי הילום גדולים או כמעט טחוליים, כדי למנוע זמן איסכמי ממושך שעלול לפגוע בתפקוד הטחול. השיטה המתוארת במחקר זה אינה ישימה לנגעים הממוקמים בהילום הטחול. ניטור לאחר הניתוח חשוב באותה מידה גם לאיתור תופעות לוואי פוטנציאליות.
בהשוואה לכריתת טחול כוללת, PS מציע את היתרון של שימור התפקוד הפיזיולוגי של הטחול תוך השגת יעילות טיפולית והפחתת שיעורי סיבוכים לטווח ארוך2. בדרך כלל מומלץ כי נפח הטחול שאריות צריך לעלות על 25% כדי לשמור ביעילות על תפקוד הטחול. כדי להעריך את נפח שאריות הטחול, אנו משתמשים בטכנולוגיית שחזור CT-3D לפני הניתוח. במקרים של נגעים ספלניים מסיביים, הגישה המקובלת של זיהוי והסתרה של ענפי עורק טחול תואמים מציבה אתגרים בשימור פרנכימה ספלנית מספקת. במחקר זה, על ידי שילוב של שחזור CT-3D לפני הניתוח והערכת אולטרסאונד תוך ניתוחית, ביצענו אופטימיזציה של הגישה ל- LPS כדי למקסם את השימור של רקמת הטחול הרגילה. כ-65% מהטחול נכרת, מה שיכול להשיג הן מטרות טיפוליות והן שמירה על תפקוד הטחול.
על מנת להבטיח את בטיחותה של שיטה זו, אנו ממליצים לבצע סריקות CT בטן טרום ניתוחיות כדי להבהיר את הקשר בין הנגע, כלי הדם הטחוליים ומבני בטן חשובים, כמו גם נוכחות של כלי דם שונים. במידת האפשר, שחזור CT-3D יכול לשפר עוד יותר את ההערכה לפני הניתוח. חשוב לציין כי שיטה זו מתאימה למטופלים עם טראומה המרותקת לצד אחד של הטחול, ואיננו ממליצים להשתמש בשיטה זו במקרים של קרע טראומטי מסכן חיים או לחולים עם הפרעות המטולוגיות. הראשון עלול להוות סיכון של שימור טחול מיותר המוביל למוות. עבור חולים שעברו PS עקב הפרעות המטולוגיות, מעקב ארוך טווח הראה סיכון גבוה להישנות והמרה לאחר מכן לכריתת טחול מלאה2. האינדיקציה האידיאלית לשיטה זו היא נגעים שפירים של הטחול. שיטה זו אינה דורשת דיסקציה של ענפי עורק טחול, ובכך מפשטת במידת מה את עקומת הלמידה עבור LPS. עם זאת, יש לנקוט משנה זהירות בעת בחירת חולים בשלב הלמידה הראשוני.
לסיכום, LPS תחת חסימת זרימת דם מלאה היא שיטה בטוחה, ישימה וניתנת לשחזור המניבה תוצאות משביעות רצון. עם זאת, עדיין נדרש מחקר מקיף נוסף כדי להעריך את בטיחותו ויעילותו באופן מקיף.
Disclosures
ללא
Acknowledgements
ללא
Materials
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable trocar | Kangji Medical | 101Y.307,101Y.311 | |
| Endo bag | Medtronic | https://www.medtronic.com/covidien/en-us/search.html#q=endo%20bag | specimen bag |
| Jaw sealer/divider | Covidien Medical | LF1737 | |
| Laparoscopic radiofrequency device | AngioDynamics, Inc | Rita 700-103659 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | |
| LigaSure | Medtronic | https://www.medtronic.com/covidien/en-us/products/vessel-sealing/ligasure-technology.html | vessel sealing system |
| Ligation clips (Hem-o-lok) | Teleflex Medical | 544240,544230,544220 | |
| Ultrasonic scalpel | ETHICON Medical | HAR36 |
References
- Lewis, S. M., Williams, A., Eisenbarth, S. C. Structure and function of the immune system in the spleen. Sci Immunol. 4 (33), eaau6085 (2019).
- Kristinsson, S. Y., Gridley, G., Hoover, R. N., Check, D., Landgren, O. Long-term risks after splenectomy among 8,149 cancer-free American veterans: a cohort study with up to 27 years follow-up. Haematologica. 99 (2), 392-398 (2014).
- Guizzetti, L. Total versus partial splenectomy in pediatric hereditary spherocytosis: A systematic review and meta-analysis. Pediatr Blood Cancer. 63 (10), 1713-1722 (2016).
- Bronte, V., Pittet, M. J. The spleen in local and systemic regulation of immunity. Immunity. 39 (5), 806-818 (2013).
- Christo, M. C. Partial regulated splenectomies. Preliminary note on the first 3 cases operated on. Hospital (Rio J). 56, 645-650 (1959).
- Redmond, H. P., Redmond, J. M., Rooney, B. P., Duignan, J. P., Bouchier-Hayes, D. J. Surgical anatomy of the human spleen. Br J Surg. 76 (2), 198-201 (2005).
- Romboli, A., et al. Laparoscopic partial splenectomy: A critical appraisal of an emerging technique. A review of the first 457 published cases. J Laparoendosc Adv Surg Tech A. 31 (10), 1130-1142 (2021).
- Buzelé, R., Barbier, L., Sauvanet, A., Fantin, B. Medical complications following splenectomy. J Visc Surg. 153 (4), 277-286 (2016).
- Bisharat, N., Omari, H., Lavi, I., Raz, R. Risk of infection and death among post-splenectomy patients. J Infect. 43 (3), 182-186 (2001).
- Kruetzmann, S., et al. Human immunoglobulin M memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J Exp Med. 197 (7), 939-945 (2003).
- Leone, G., Pizzigallo, E. Bacterial infections following splenectomy for malignant and nonmalignant hematologic diseases. Mediterr J Hematol Infect Dis. 7 (1), e2015057 (2015).
- Romano, F., et al. Thrombosis of the splenoportal axis after splenectomy. Langenbecks Arch Surg. 391 (5), 483-488 (2006).
- Watters, J. M., et al. Splenectomy leads to a persistent hypercoagulable state after trauma. Am J Surg. 199 (5), 646-651 (2010).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report. Surg Laparosc Endosc. 5 (4), 306-310 (1995).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surg Radiol Anat. 27 (1), 15-18 (2005).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Borie, F. Laparoscopic partial splenectomy: Surgical technique. J Visc Surg. 153 (5), 371-376 (2016).
- Ouyang, G., et al. Laparoscopic partial splenectomy with temporary occlusion of the trunk of the splenic artery in fifty-one cases: experience at a single center. Surg Endosc. 35 (1), 367-373 (2021).
- Mignon, F., et al. Preoperative selective embolization allowing a partial splenectomy for splenic hamartoma. Ann Chir. 128 (2), 112-116 (2003).
- Zheng, L., et al. Treatment of hemangioma of the spleen by preoperative partial splenic embolization plus laparoscopic partial splenectomy: A case report. Medicine (Baltimore). 97 (17), e0498 (2018).
- Vasilescu, C., Stanciulea, O., Tudor, S. Laparoscopic versus robotic subtotal splenectomy in hereditary spherocytosis. Potential advantages and limits of an expensive approach. Surg Endosc. 26 (10), 2802-2809 (2012).
- Wang, W. -. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World J Gastroenterol. 21 (11), 3420-3424 (2015).
- Liu, D. L., et al. Anatomy of vasculature of 850 spleen specimens and its application in partial splenectomy. Surgery. 119 (1), 27-33 (1996).
- Habib, N. A. How we do a bloodless partial splenectomy. Am J Surg. 186 (2), 164-166 (2003).
- Gumbs, A. A., Bouhanna, P., Bar-Zakai, B., Briennon, X., Gayet, B. Laparoscopic partial splenectomy using radiofrequency ablation. J Laparoendosc Adv Surg Tech A. 18 (4), 611-613 (2008).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World J Surg. 43 (6), 1505-1518 (2019).
- Teperman, S. H., et al. Bloodless splenic surgery: The safe warm-ischemic time. J Pediatr Surg. 29 (1), 88-92 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved