Method Article
良性脾臓病変における全血流閉塞を伴う腹腔鏡下部分脾臓摘出術の適用
要約
本研究では、腹腔鏡下脾臓部分切除術における術中出血制御技術について述べ、脾臓切除術の安全性と精度を向上させる方法を検討する。
要約
腹腔鏡下脾臓部分切除術 (LPS) は、良性の脾臓病変を治療するための好ましい方法になりつつあります。しかし、血液が豊富で柔らかく壊れやすい組織の質感のため、特に病変が脾臓門の近くに位置しているか、特に大きい場合、臨床診療で脾臓部分切除術(PS)を行うことは非常に困難です。そこで、PS時の出血制御法を継続的に検討・最適化してきましたが、ここでは脾臓血流完全閉塞症でLPSを行う方法を提案します。
この研究では、LPS 中の術中出血を制御するための最適化されたアプローチについて説明します。まず、脾の靭帯を徹底的に解剖し、膵臓の尾部を脾臓から慎重に分離します。脾臓の門に完全にさらされると、腹腔鏡ブルドッグクリップを使用して脾臓の全血液供給を一時的に閉塞します。その後、術中超音波を使用して病変の境界を特定し、完全な血流制御下で脾臓の対応する部分を切除します。このアプローチは、効果的な出血制御と精密な切除による「脾臓温存」の本質を体現しています。特に腹腔鏡手術に適しており、さらなる臨床推進に値します。
概要
脾臓の生理学的機能を深く理解することで、この研究は、体の免疫応答、造血、および赤血球のクリアランスにおける脾臓の重要な役割を強調しています1。圧倒的な脾臓摘出術後感染症(OPSI)、肺高血圧症、血栓塞栓症など、脾臓摘出術後の合併症は、臨床診療における外科的方法の選択に大きく影響します2,3。文献によると、脾臓全摘出術後の患者は、マラリアに寄生した赤血球を除去する能力が低下し、肺炎連鎖球菌、髄膜炎菌、およびインフルエンザ菌B型4の感染後に髄膜炎および敗血症を発症するリスクが高くなります。PSは、治療効果を確保しながら脾臓の機能を維持するため、臨床現場で広く応用されています。
1959年、最初の成功したPSはCristo5によって報告されました。脾臓は、明確に定義された脾臓セグメントを含む壊れやすい器官であり、それぞれが独自の動脈と静脈の供給を持ち、比較的無血管領域によって区切られています6。これらの要因が集合的にPSの解剖学的基盤を確立します。しかし、従来の開腹手術には、重大な外傷、美容上の欠点、術後の痛みなど、固有の欠点があります。近年、腹腔鏡器具と技術の成熟に伴い、LPSは良性の脾臓病変の好ましい治療法として浮上しています。それにもかかわらず、脾臓の豊富な血液供給のために、腹腔鏡検査中の術中出血が大量になると、開腹手術への転換を引き起こす可能性があります。ロンボリらは LPS の 457 例をレビューし、平均手術時間が約 128 ± 43.7 分であることを明らかにし、患者の約 3.9% が出血のために転換を必要とし、術後平均滞在期間は 4.9 ± 3.8 日であることを示しました7。脾臓の解剖学に関する包括的な知識と細心の注意を払った外科的技術が、LPSの広範な臨床応用を妨げてきました。
術中出血のリスクを軽減し、学習曲線を早めるために、完全血流閉塞を伴うLPSの実施を試みます。この研究では、脾臓の上部中央極に位置し、脾臓の丘に隣接する巨大な脾管血管腫瘍を持つ 72 歳の女性患者を紹介します。この新技術は、効果的な出血制御に優れており、安全性、有効性、および高レベルの再現性を保証します。
プロトコル
この研究は、南医科大学順徳病院の倫理委員会のガイドラインに従っています。データとビデオについては、手術前に患者からインフォームド コンセントが得られました。
1. 患者様の選択
- この外科的方法は、次の場合に適用します。
- 腹痛や不快感を経験している患者と、良性病変の存在を確認する放射線検査が含まれます。
- 腫瘍のサイズに特定の制限を課さず、25%を超える脾臓の残存量を維持してください。
- 患者が正常なレベルのAFP、CEA、およびCA-199を示すか、悪性腫瘍がないことを確認します。
- 肥満は、内臓脂肪の増加を引き起こし、術中の解剖学的構造に影響を与える可能性がありますが、それを絶対的な制限とは見なしていません。
- 次の条件では、この手術から患者を除外します。
- 患者が悪性腫瘍からの脾臓転移の疑いが強い場合は除外します。.
- 血液疾患またはリンパ腫に起因する脾腫の患者を除外します。
- 肝硬変に続発する脾腫の患者を除外します。
- 生命を脅かす外傷性脾臓破裂の患者を除外します。
- 全体的な健康状態が悪く、手術に耐えられない患者は除外します。
2.手術手技
- 操作の設定。
- 全身麻酔下で患者を逆トレンデレンブルグ姿勢で配置し、体の左側を約10〜30°傾けます。
注:外科的処置全体を通して、必要に応じて位置を調整します。 - 腹腔鏡を持つ最初の外科医と助手を患者の右側に配置し、最初の助手を患者の左側に配置します。
- 気腹を12〜14mmHgに確立し、維持します。
- 図 1 に示すように、腹腔鏡下視覚化の助けを借りて、腹壁に 4 つのポートを取り付けます。
- 全身麻酔下で患者を逆トレンデレンブルグ姿勢で配置し、体の左側を約10〜30°傾けます。
- 腹腔鏡検査下で腹腔を検査し、悪性腫瘍がないことを確認します。
- 脾動脈の一時的な閉塞を行います。
- 血管シーリングシステムを使用して、胃の大きな湾曲に沿って胃脾靭帯を解剖し、小嚢に入ります。
- 胃をつかんで右上に動かすと、手術野への露出が良くなります。
- 膵臓の上端にある脾動脈の主幹を細心の注意を払って解剖し、ブルドッグクリップで一時的に閉塞します。
注:血流が閉塞すると、脾臓のボリュームが減少し、テクスチャーが柔らかくなり、十分な手術スペースが提供されます。
- 脾臓結腸靭帯、脾関節靭帯、脾腎靭帯を含む脾周囲靭帯を解剖します。
注:脾臓から膵尾を分離する場合、特に脾腫または大量の脾臓病変の場合、制御不能な出血や術後膵瘻(POPF)の発生を防ぐために注意が必要です。 - 脾臓の肺弓の一時的な閉塞を行います。
- 超音波メスで周囲のアタッチメントを切除して脾臓門を露出させ、ブルドッグクリップで脾臓門を一時的に閉塞させます。
注:脾臓血管にばらつきがある場合、単に脾動脈を閉塞するだけでは、望ましい脾臓虚血性変化が得られない場合があります。 - この手順に続いて、脾臓の色、サイズ、および質感の徹底的な再評価を行います。
- 超音波メスで周囲のアタッチメントを切除して脾臓門を露出させ、ブルドッグクリップで脾臓門を一時的に閉塞させます。
- 病変境界の特定のために術中超音波検査を行います。
- 術中超音波を使用して、手術中に病変の境界を特定します。
- 電気焼灼を適用して、病変境界から少なくとも1cm離れた境界線をマークします。
- 脾臓実質解剖を行います。
- バイポーラ無線周波デバイスを凝固とアブレーションの境界線に沿って脾実質に挿入し、高周波エネルギーを80Wに設定します。
- 超音波メスを使用して、壊死性凝固ゾーンの脾臓実質を解剖します。
- Hem-o-lokの血管クリップを使用して太い管をしっかりと固定し、慎重に切断して、病変を含む上部脾臓の安全な切除を確保します。
注:脾臓の除去部分を供給する血管は、慎重に結紮および交換する必要があります
- 試料を取り出します。
- ブルドッグクリップを放し、脾臓の切り口から出血しないようにし、残りの脾臓への十分な血液供給を確認します。
- バイポーラ電気焼灼を使用して、脾臓の切断端を焼灼し、その上に吸収性止血剤を塗布します。
- 脾臓窩にドレンチューブを配置します。
- 標本を標本袋に入れ、楕円形の鉗子で断片化し、拡大したポートから取り出します。
- 気腹を解放し、穿刺傷を縫合します。
3. 術後の詳細
- 術後24時間連続心電図検査を行います。心拍数、血圧、呼吸、酸素飽和度、中心静脈圧、瞳孔反応、意識レベルなどの重要な兆候を監視して、術後早期の合併症をタイムリーに検出します。
- 手術後、抗生物質(セフロキシムナトリウム、12時間ごとに1.5 g)とプロトンポンプ阻害剤を定期的に投与します。.
- 術後2日目に胃管を取り外し、患者に完全な流動食を許可します。
- ドレナージ出力が100 mL / 24時間未満の場合は、腹部ドレーンチューブを取り外します。.
- 手術の2か月後にフォローアップ腹部CTスキャンをスケジュールして、腹部の状態を評価します。
結果
このケースでは、72歳の女性患者が地元の病院の定期検査で発見された巨大な脾臓病変で入院しました。彼女は以前に腹部手術の病歴がありました。彼女の病歴は目立たず、BMIは正常でした(20.1 kg / m2)。腹部造影CTでは、脾臓の中央上端に直径約15cmの大きな病変が認められました(図2)。術前評価では悪性腫瘍の証拠は示されませんでした。病変のサイズが大きいため、十分な議論の後、脾臓の血流を完全に閉塞するLPSが試みられました。代表的な術中腹腔鏡画像を 図3に示します。
手術時間は102分で、術中失血は30mLで、脾臓の約65%が切除されました。術中の合併症は発生せず、開腹術への転換はありませんでした。術中輸血は不要でした。術後4日で腹部ドレーンを抜去し、手術後7日目に 退院しました。術後膵瘻、腹腔内感染、出血、門脈血栓症、脾梗塞などの術後合併症は認められませんでした。具体的な詳細は 表1に示します。病理学的診断は血管腫でした。2ヵ月後のフォローアップ腹部CTでは、残存脾臓の血液供給が良好で、再発は認められなかった。
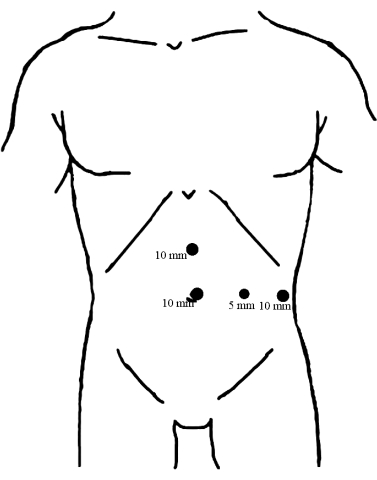
図1:トロカールの分布。 観察ポートとして、臍の下に10mmのトロカールを置きます。他の2つの10mmトロカールは、臍帯と剣状突起の中間点に、もう1つは臍に平行な左前方腋窩線に挿入され、どちらも主要な手術ポートとして機能します。次に、5 mm のトロカールを左鎖骨の正中線に沿って臍の高さで挿入しました。 この図の拡大版を表示するには、ここをクリックしてください。
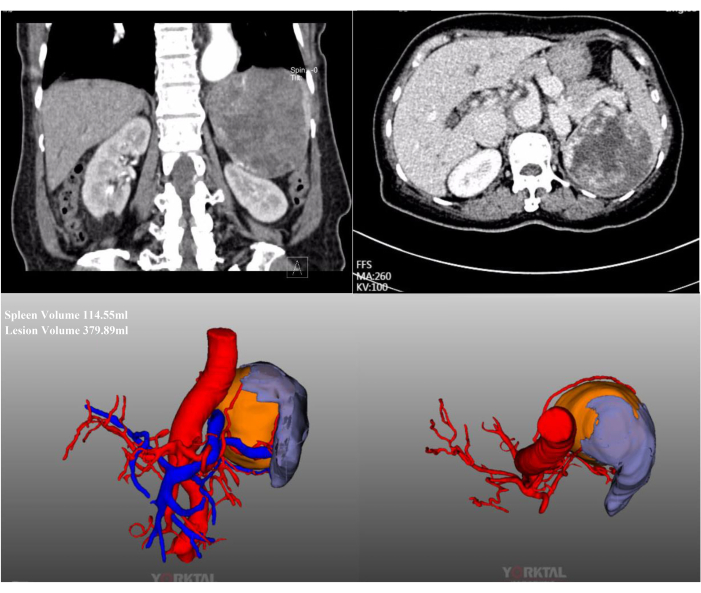
図2:造影CTおよびCT-3D再構成。 腹部造影CTおよびCT-3D再構成では、脾臓の上部中央極に位置する巨大な病変が見られます。 この図の拡大版を表示するには、ここをクリックしてください。
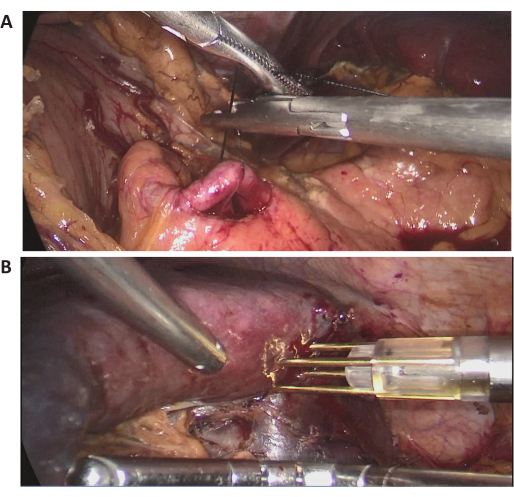
図3:術中腹腔鏡画像。 (A,B)外科的処置の代表的な術中腹腔鏡画像。この図の拡大版を表示するには、ここをクリックしてください。
| 項目 | 結果 |
| 手術時間(分) | 102 |
| 術中失血(mL) | 30 |
| 開腹術への転換 | いいえ |
| 術中輸血 | いいえ |
| 術後入院日数 | 7 |
| 術後合併症 | いいえ |
表 1: LPS の手術および術後の詳細。
ディスカッション
長年にわたり、脾臓全摘出術は、脾臓腫瘍、脾腫、および血液疾患の主要な治療法でした。しかし、広範な症例の追跡調査により、感染性合併症や血栓塞栓性合併症など、脾臓全摘出術後の合併症が徐々に注目を集めるようになった8。圧倒的な脾臓摘出術後の感染症 (OPSI) は、脾臓摘出術後の最も重篤な合併症であり、死亡率が約 50% の急速な疾患進行を特徴としています9。脾臓摘出患者における細菌感染のこの高いリスクは、カプセル化された細菌10,11を除去するために重要な脾臓の辺縁帯におけるIgMメモリーB細胞の役割に起因している。さらに、門脈血栓症、大静脈系血栓症、肺塞栓症などの術後合併症に注意する必要があります。脾臓摘出術を受けた肝硬変の患者は、門脈血栓症の発生率が高くなっています12、これはおそらく凝固亢進状態13に関連しています。PSは、脾臓の機能を維持しながら治療効果を得ることができます。したがって、適格な患者にとって、PSは好ましい代替手段となっています。腹腔鏡手術は、外傷が少なく、審美的な結果が得られ、術後の滞在期間が短いなどの利点を提供し、近年PSで広く使用されています。
LPSは、1995年にプーリンによって最初に報告されました14。LPSは、特定の脾臓セグメントの選択的血管閉塞と、それに続く境界線に沿った切除を伴います。通常、脾臓動脈の末端枝は、異なる脾臓セグメントに入る前に2〜3の枝に分かれます。各セグメントは、比較的無血管領域15によって分離されている。しかし、LPSの適用は、制御されていない術中出血のために困難です。レナートは、1960年から2017年7月の間に行われたLPS手術の344例をレビューし、平均術中失血が0〜1200ccの範囲であることを示しました。このうち、6.4%(22/344例)が開腹術への転換を必要とし、14例が術中出血により脾臓全摘出術を受けた16。私たちの経験に基づくと、主な理由は次のとおりです:(i)脾臓は豊富な血液供給を持っており、その繊細な質感は手術中に怪我をしやすく、止血を困難にします。(ii)脾臓周囲靭帯解剖が不十分な場合、脾臓の動員が複雑になり、脾臓実質裂傷が生じます。(iii)脾動脈の枝を解剖することは重大な困難を提起し、隣接する腹部構造を損傷する潜在的なリスクを伴います。
多くの研究が、LPS 中の術中出血を減らす方法を報告しています。主に3つの方法があります:脾臓の血液供給の閉塞、高周波デバイスの使用、およびロボット支援。Borie は、LPS17 中の術中出血を制御するためにループ クランプを使用して脾動脈が一時的に閉塞したことを報告しました。Peng氏の研究18では、46人の患者が脾動脈の一時的な閉塞を伴うLPSを受けました。彼らは、脾臓動脈の対応する枝を解剖する前に、ブルドッグクリップで主脾動脈を一時的に塞ぎました。私たちとは異なり、この研究には脾臓の上極と下極に位置する腫瘍のみが含まれ、脾臓のサイズは20cm未満でした。LPS19,20 の出血を制御するために、術前の血管塞栓術も試みられており、満足のいく臨床結果を示しています。Catalin et al.21 は、LPS と比較して術中出血が少なく、術後滞在が短かったロボット支援 PS の 10 例をレビューしました。ただし、その高いコストにより、その広範な使用が制限されます。当センターは、脾臓摘出術22に高周波デバイスHabibi4Xを最初に適用しました。それは高周波によって凝固性壊死領域を作り出し、無血脾臓摘出術を可能にします。これは、一貫した臨床効果を持つセンターで標準化された方法になっています。
上記の方法の限界と当センターのユニークな経験を考慮して、脾臓動脈と椎弓の一時的な閉塞にブルドッグクリップを使用し、完全な脾臓虚血の下でLPSを行うことを試みました。この研究では、主脾動脈幹の95%が膵臓の上端で走っていると報告されました23。術中のローカリゼーションと分離後のブルドッグクリップを使用した一時的な閉塞は簡単に実現できます。ただし、脾門の解剖にはかなりの腹腔鏡手術経験が必要であることを強調することが重要です。この手順の複雑さは、BMIが高い、脾臓の門の近くに位置している病変、病変量が多い、腹部手術の病歴などの要因の影響を受けます。膵臓尾部や短い胃管の損傷を防ぐためには、精密な手術技術が必要です。脾臓の血流を完全に遮断することで、特に異なる血管の症例を扱う場合に、望ましい脾虚血効果を確保できます。
無線周波デバイスは、止血において優れた性能を示します24,25。私たちは日常的に高周波デバイスを使用して、凝固のために事前にカットされたエッジに沿って脾臓実質に挿入し、凝固性壊死領域を形成します。その後、超音波メスを使用して脾臓実質を解剖し、無血の部分的な脾臓摘出術を実現します。本研究では、高周波補助による大脾病変切除を行った。術中出血は30mL、術時間は102分で、開腹手術への転換はなかった。患者は術後合併症なしに手術後7日で退院し、これは他のほとんどの研究よりも有意に優れていました16,26。術後2ヶ月後の上腹部CTでは血栓症は認められず、残存する脾臓の血液供給も良好で、良好な治療効果が認められました。
Tepermanらは、ヒトの脾臓の安全で暖かい虚血時間は1時間27分であることを示しています。豊富な手術経験に基づき、安全な時間内に脾実質の解剖を完了することができます。また、術後の腹部CTスキャンでは、血栓症や脾梗塞は一貫して認められていません。これにより、脾臓の完全血流閉塞下でのLPSの安全性が確認されています。ただし、最初の学習曲線では、BMIが25 kg /m²>、腹部手術の既往歴があり、特大または脾臓に近い陰部病変のある症例など、困難な症例を避けて、脾臓機能を損傷する可能性のある虚血時間の長期化を防ぐことをお勧めします。この研究で説明されている方法は、脾臓の門に位置する病変には適用できません。術後モニタリングも、潜在的な有害事象を検出するためにも同様に重要です。
脾臓全摘出術と比較して、PSは脾臓の生理機能を維持しながら治療効果を達成し、長期的な合併症率を減らすという利点があります2。一般に、脾臓の機能を効果的に維持するために、残りの脾臓の容積は25%を超えることが推奨されます。残存脾臓の容積を評価するために、術前のCT-3D再建技術を採用しています。大規模な脾臓病変を伴う場合、対応する脾動脈枝を特定して閉塞する従来のアプローチは、十分な脾実質を保存する上で課題をもたらします。本研究では、術前CT-3D再構成と術中超音波評価を組み合わせることで、LPSへのアプローチを最適化し、正常な脾臓組織の保存を最大化しました。脾臓の約65%が切除され、治療目標と脾臓機能の維持の両方を達成することができます。
この方法の安全性を確保するために、術前に腹部CTスキャンを行い、病変、脾臓血管、重要な腹部構造との関係、および異なる血管の存在を明らかにすることをお勧めします。可能であれば、CT-3D再構成により、術前評価をさらに強化することができます。この方法は、脾臓の片側に限定された外傷の患者に適しており、生命を脅かす外傷性脾臓破裂の場合や血液疾患の患者にこの方法を採用することはお勧めしません。前者は、不必要な脾臓の保存が死に至るリスクをもたらす可能性があります。血液疾患によりPSを施行した患者では、長期の経過観察により、再発およびその後の脾臓全摘出術への転換リスクが高いことが示されています2。この方法の理想的な適応症は、脾臓の良性病変です。この方法は脾動脈枝の解剖を必要としないため、LPSの学習曲線がいくらか単純化されます。ただし、最初の学習段階で患者を選択する際には注意が必要です。
結論として、脾臓血流全閉塞下でのLPSは、安全で実現可能で再現性のある方法であり、満足のいく結果が得られます。しかし、その安全性と有効性を包括的に評価するためには、さらに広範な研究が必要です。
開示事項
何一つ
謝辞
何一つ
資料
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable trocar | Kangji Medical | 101Y.307,101Y.311 | |
| Endo bag | Medtronic | https://www.medtronic.com/covidien/en-us/search.html#q=endo%20bag | specimen bag |
| Jaw sealer/divider | Covidien Medical | LF1737 | |
| Laparoscopic radiofrequency device | AngioDynamics, Inc | Rita 700-103659 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | |
| LigaSure | Medtronic | https://www.medtronic.com/covidien/en-us/products/vessel-sealing/ligasure-technology.html | vessel sealing system |
| Ligation clips (Hem-o-lok) | Teleflex Medical | 544240,544230,544220 | |
| Ultrasonic scalpel | ETHICON Medical | HAR36 |
参考文献
- Lewis, S. M., Williams, A., Eisenbarth, S. C. Structure and function of the immune system in the spleen. Sci Immunol. 4 (33), eaau6085 (2019).
- Kristinsson, S. Y., Gridley, G., Hoover, R. N., Check, D., Landgren, O. Long-term risks after splenectomy among 8,149 cancer-free American veterans: a cohort study with up to 27 years follow-up. Haematologica. 99 (2), 392-398 (2014).
- Guizzetti, L. Total versus partial splenectomy in pediatric hereditary spherocytosis: A systematic review and meta-analysis. Pediatr Blood Cancer. 63 (10), 1713-1722 (2016).
- Bronte, V., Pittet, M. J. The spleen in local and systemic regulation of immunity. Immunity. 39 (5), 806-818 (2013).
- Christo, M. C. Partial regulated splenectomies. Preliminary note on the first 3 cases operated on. Hospital (Rio J). 56, 645-650 (1959).
- Redmond, H. P., Redmond, J. M., Rooney, B. P., Duignan, J. P., Bouchier-Hayes, D. J. Surgical anatomy of the human spleen. Br J Surg. 76 (2), 198-201 (2005).
- Romboli, A., et al. Laparoscopic partial splenectomy: A critical appraisal of an emerging technique. A review of the first 457 published cases. J Laparoendosc Adv Surg Tech A. 31 (10), 1130-1142 (2021).
- Buzelé, R., Barbier, L., Sauvanet, A., Fantin, B. Medical complications following splenectomy. J Visc Surg. 153 (4), 277-286 (2016).
- Bisharat, N., Omari, H., Lavi, I., Raz, R. Risk of infection and death among post-splenectomy patients. J Infect. 43 (3), 182-186 (2001).
- Kruetzmann, S., et al. Human immunoglobulin M memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J Exp Med. 197 (7), 939-945 (2003).
- Leone, G., Pizzigallo, E. Bacterial infections following splenectomy for malignant and nonmalignant hematologic diseases. Mediterr J Hematol Infect Dis. 7 (1), e2015057 (2015).
- Romano, F., et al. Thrombosis of the splenoportal axis after splenectomy. Langenbecks Arch Surg. 391 (5), 483-488 (2006).
- Watters, J. M., et al. Splenectomy leads to a persistent hypercoagulable state after trauma. Am J Surg. 199 (5), 646-651 (2010).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report. Surg Laparosc Endosc. 5 (4), 306-310 (1995).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surg Radiol Anat. 27 (1), 15-18 (2005).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Borie, F. Laparoscopic partial splenectomy: Surgical technique. J Visc Surg. 153 (5), 371-376 (2016).
- Ouyang, G., et al. Laparoscopic partial splenectomy with temporary occlusion of the trunk of the splenic artery in fifty-one cases: experience at a single center. Surg Endosc. 35 (1), 367-373 (2021).
- Mignon, F., et al. Preoperative selective embolization allowing a partial splenectomy for splenic hamartoma. Ann Chir. 128 (2), 112-116 (2003).
- Zheng, L., et al. Treatment of hemangioma of the spleen by preoperative partial splenic embolization plus laparoscopic partial splenectomy: A case report. Medicine (Baltimore). 97 (17), e0498 (2018).
- Vasilescu, C., Stanciulea, O., Tudor, S. Laparoscopic versus robotic subtotal splenectomy in hereditary spherocytosis. Potential advantages and limits of an expensive approach. Surg Endosc. 26 (10), 2802-2809 (2012).
- Wang, W. -. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World J Gastroenterol. 21 (11), 3420-3424 (2015).
- Liu, D. L., et al. Anatomy of vasculature of 850 spleen specimens and its application in partial splenectomy. Surgery. 119 (1), 27-33 (1996).
- Habib, N. A. How we do a bloodless partial splenectomy. Am J Surg. 186 (2), 164-166 (2003).
- Gumbs, A. A., Bouhanna, P., Bar-Zakai, B., Briennon, X., Gayet, B. Laparoscopic partial splenectomy using radiofrequency ablation. J Laparoendosc Adv Surg Tech A. 18 (4), 611-613 (2008).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World J Surg. 43 (6), 1505-1518 (2019).
- Teperman, S. H., et al. Bloodless splenic surgery: The safe warm-ischemic time. J Pediatr Surg. 29 (1), 88-92 (1994).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved