Method Article
Application de la splénectomie partielle laparoscopique avec occlusion du flux sanguin total dans les lésions spléniques bénignes
Dans cet article
Résumé
Dans cette étude, nous décrivons une technique de contrôle de l’hémorragie peropératoire pour la splénectomie partielle laparoscopique, améliorant ainsi la sécurité et la précision de la résection de la rate.
Résumé
La splénectomie partielle laparoscopique (LPS) devient progressivement la méthode privilégiée pour traiter les lésions spléniques bénignes. Cependant, en raison de l’apport sanguin abondant et de la texture de ses tissus mous et fragiles, en particulier lorsque la lésion est située près du hile splénique ou est particulièrement grande, la réalisation d’une splénectomie partielle (PS) dans la pratique clinique est extrêmement difficile. Par conséquent, nous avons continuellement exploré et optimisé les méthodes de contrôle de l’hémorragie pendant la PS, et nous proposons ici une méthode pour effectuer une LPS avec occlusion complète du flux sanguin de la rate.
Cette étude décrit une approche optimisée pour contrôler l’hémorragie peropératoire au cours du LPS. Tout d’abord, il s’agit d’une dissection complète des ligaments spléniques et d’une séparation minutieuse de la queue pancréatique de la rate. Avec une exposition complète au hile splénique, nous obstruons temporairement toute l’approvisionnement en sang de la rate à l’aide d’une pince bouledogue laparoscopique. Par la suite, nous utilisons l’échographie peropératoire pour identifier la limite de la lésion et réséquer la partie correspondante de la rate sous contrôle complet du flux sanguin. Cette approche incarne l’essence de la « préservation de la rate » grâce à un contrôle efficace des hémorragies et à une résection précise. Il est particulièrement adapté à la chirurgie laparoscopique et mérite une promotion clinique supplémentaire.
Introduction
Grâce à une compréhension approfondie des fonctions physiologiques de la rate, la recherche souligne son rôle central dans la réponse immunitaire de l’organisme, l’hématopoïèse et l’élimination des globules rouges1. Les complications après une splénectomie, telles que les infections post-splénectomie accablantes (OPSI), l’hypertension pulmonaire et la thromboembolie, influencent de manière significative le choix des méthodes chirurgicales dans la pratique clinique 2,3. Selon la littérature, les patients après une splénectomie totale présentent une capacité réduite à éliminer les globules rouges parasités par le paludisme et un risque plus élevé de développer une méningite et une septicémie à la suite d’infections à Streptococcus pneumoniae, Neisseria meningitidis et Haemophilus influenzae de type B4. Le PS préserve la fonction splénique tout en assurant l’efficacité du traitement, ce qui le rend largement appliqué dans la pratique clinique.
En 1959, le premier PS réussi a été signalé par Cristo5. La rate est un organe fragile composé de segments spléniques bien définis, chacun ayant son approvisionnement artériel et veineux distinctif, délimité par des régions relativement avasculaires6. Ces facteurs établissent collectivement la base anatomique de la SP. Cependant, la chirurgie ouverte conventionnelle comporte des inconvénients inhérents, notamment des traumatismes importants, des inconvénients esthétiques et des douleurs postopératoires. Ces dernières années, parallèlement à la maturation des instruments et des techniques laparoscopique, le LPS est apparu comme la modalité thérapeutique privilégiée pour les lésions spléniques bénignes. Néanmoins, en raison de la richesse de l’apport sanguin de la rate, une hémorragie peropératoire importante pendant la laparoscopie peut entraîner une conversion en chirurgie ouverte. Romboli et al. ont examiné 457 cas de LPS, révélant une durée opératoire moyenne d’environ 128 ± 43,7 min, et ont démontré qu’environ 3,9 % des patients nécessitaient une conversion en raison d’une hémorragie, et que le séjour postopératoire moyen est de 4,9 ± 3,8 jours7. Une connaissance approfondie de l’anatomie splénique et des compétences chirurgicales méticuleuses ont entravé l’application clinique à grande échelle du LPS.
Pour atténuer le risque d’hémorragie peropératoire et accélérer la courbe d’apprentissage, nous essayons d’effectuer une LPS avec une occlusion complète du flux sanguin. Dans cette étude, nous présentons une patiente de 72 ans atteinte d’une tumeur vasculaire splénique massive située dans le pôle moyen supérieur de la rate et adjacente au hile splénique. Cette nouvelle technique excelle dans le contrôle efficace des hémorragies et garantit l’innocuité, l’efficacité et un haut niveau de reproductibilité.
Protocole
Cette étude suit les directives du comité d’éthique de l’hôpital Shunde de la Southern Medical University. Le consentement éclairé du patient a été obtenu avant l’opération pour les données et la vidéo.
1. Sélection des patients
- Appliquer cette méthode chirurgicale dans les cas suivants :
- Inclure les patients souffrant de douleurs abdominales ou d’inconfort, couplés à des examens radiologiques confirmant la présence de lésions bénignes.
- N’imposez pas de restrictions spécifiques sur la taille de la tumeur, mais maintenez un volume résiduel de rate supérieur à 25 %.
- S’assurer que les patients présentent des taux normaux d’AFP, de CEA et de CA-199 ou confirmer l’absence de malignité.
- Considérez l’obésité, qui entraîne une augmentation de la graisse viscérale affectant potentiellement l’anatomie peropératoire, mais ne la considère pas comme une limitation absolue.
- Exclure les patients de cette chirurgie dans les conditions suivantes :
- Exclure si le patient est fortement suspecté de métastases spléniques dues à des tumeurs malignes.
- Exclure les patients atteints de splénomégalie résultant de maladies hématologiques ou d’un lymphome.
- Exclure les patients atteints de splénomégalie secondaire à une cirrhose du foie.
- Exclure les patients présentant une rupture traumatique de la rate mettant en jeu le pronostic vital.
- Exclure les patients dont l’état de santé général est médiocre et qui sont incapables de résister à la chirurgie.
2. Technique chirurgicale
- Préparation de l’opération.
- Placez le patient sous anesthésie générale dans une posture de Trendelenburg inversée, le côté gauche du corps étant incliné d’environ 10 à 30°.
REMARQUE : Effectuez des ajustements de position au besoin tout au long de l’intervention chirurgicale. - Positionnez le premier chirurgien et l’assistant avec le laparoscope sur le côté droit du patient et le premier assistant sur le côté gauche du patient.
- Établir et maintenir le pneumopéritoine à 12-14 mmHg.
- Installez quatre orifices sur la paroi abdominale à l’aide de la visualisation laparoscopique, comme illustré à la figure 1.
- Placez le patient sous anesthésie générale dans une posture de Trendelenburg inversée, le côté gauche du corps étant incliné d’environ 10 à 30°.
- Examiner la cavité péritonéale sous laparoscopie pour confirmer l’absence de tumeurs malignes.
- Effectuer une occlusion temporaire de l’artère splénique.
- Utilisez un système de scellement des vaisseaux pour disséquer le ligament gastro-splénique le long de la plus grande courbure de l’estomac, en entrant dans le petit sac.
- Saisissez l’estomac et déplacez-le vers le haut à droite pour une meilleure exposition au champ chirurgical.
- Disséquez méticuleusement le tronc principal de l’artère splénique sur le bord supérieur du pancréas et occlusez-le temporairement avec une pince bouledogue.
REMARQUE : Suite à l’occlusion du flux sanguin, la rate présente une diminution de volume et une texture plus douce, ce qui fournira un espace chirurgical adéquat.
- Disséquez les ligaments périspléniques, y compris les ligaments splénocoliques, splénérénaux et splénophréniques.
REMARQUE : Des précautions doivent être prises lors de la séparation de la queue pancréatique de la rate, en particulier en cas de splénomégalie ou de lésions spléniques massives, afin de prévenir une hémorragie incontrôlée et la survenue d’une fistule pancréatique postopératoire (POPF). - Effectuer une occlusion temporaire du hile splénique.
- Exposez le hile splénique en réséquant les attaches qui l’entourent avec un scalpel à ultrasons, puis mettez en œuvre une occlusion temporaire du hile splénique avec une pince bouledogue.
REMARQUE : Dans les cas de variations dans les vaisseaux sanguins spléniques, le simple fait d’occlure l’artère splénique peut ne pas obtenir les changements ischémiques spléniques souhaités. - Après cette étape, effectuez une réévaluation approfondie de la couleur, de la taille et de la texture de la rate.
- Exposez le hile splénique en réséquant les attaches qui l’entourent avec un scalpel à ultrasons, puis mettez en œuvre une occlusion temporaire du hile splénique avec une pince bouledogue.
- Effectuer une échographie peropératoire pour l’identification des limites de la lésion.
- Utilisez l’échographie peropératoire pour identifier la limite de la lésion pendant la chirurgie.
- Appliquer l’électrocautérisation pour marquer la ligne de démarcation à au moins 1 cm de la limite de la lésion.
- Effectuer une dissection du parenchyme de la rate.
- Insérez un dispositif de radiofréquence bipolaire dans le parenchyme splénique le long de la ligne de démarcation pour la coagulation et l’ablation, en réglant l’énergie radiofréquence à 80 W.
- À l’aide d’un scalpel à ultrasons, disséquez le parenchyme splénique dans la zone de coagulation nécrotique.
- Fixez solidement les canaux épais à l’aide de clips vasculaires Hem-o-lok, puis coupez-les soigneusement, assurant une résection sûre de la rate supérieure contenant la lésion.
REMARQUE : Les vaisseaux alimentant la partie retirée de la rate doivent être soigneusement ligaturés et transectés
- Retirez l’échantillon.
- Relâchez le clip du bouledogue, en vous assurant qu’il n’y a pas de saignement du bord coupé de la rate, et confirmez qu’un apport sanguin adéquat à la rate restante est suffisante.
- Utilisez l’électrocautérisation bipolaire pour cautériser le bord coupé splénique et appliquez des agents hémostatiques résorbables dessus.
- Placez un tube de drainage dans la fosse splénique.
- Placez l’échantillon dans un sac à échantillons, fragmentez-le avec une pince ovale et retirez-le par l’orifice agrandi.
- Libérez le pneumopéritoine et suturez les plaies perforantes.
3. Détails postopératoires
- Effectuer une électrocardiographie continue pendant 24 h en postopératoire. Surveillez les signes essentiels, notamment la fréquence cardiaque, la pression artérielle, la respiration, la saturation en oxygène, la pression veineuse centrale, la réponse pupillaire et le niveau de conscience, afin de détecter les complications postopératoires précoces en temps opportun.
- Administrer régulièrement des antibiotiques (céfuroxime sodique, 1,5 g toutes les 12 h) et des inhibiteurs de la pompe à protons après la chirurgie.
- Retirez la sonde gastrique le deuxième jour postopératoire et laissez le patient suivre un régime liquide complet.
- Retirer le tube de drainage abdominal lorsque le débit de drainage est inférieur à 100 mL/24 h.
- Planifiez une tomodensitométrie abdominale de suivi 2 mois après la chirurgie pour évaluer l’état abdominal.
Résultats
Dans ce cas, une patiente de 72 ans a été admise pour une lésion splénique massive découverte lors d’un examen de routine dans un hôpital local. Elle avait déjà subi une chirurgie abdominale. Ses antécédents médicaux n’avaient rien de remarquable et son IMC était normal (20,1 kg/m2). La TDM abdominale avec contraste a montré une lésion massive située dans le pôle médian supérieur de la rate, d’un diamètre d’environ 15 cm (Figure 2). Les évaluations préopératoires n’ont révélé aucun signe de malignité. En raison de la grande taille de la lésion, après une discussion complète, une LPS avec occlusion complète du flux sanguin de la rate a été tentée. Des images laparoscopique peropératoires représentatives sont présentées à la figure 3.
La durée de l’opération a été de 102 min, avec une perte de sang peropératoire de 30 ml, et environ 65 % de la rate a été réséquée. Aucune complication peropératoire n’est survenue et il n’y a pas eu de conversion en laparotomie. La transfusion sanguine peropératoire n’a pas été nécessaire. Le drain abdominal a été retiré 4 jours après l’opération, et le patient est sorti le 7ème jour après l’opération. Il n’y a pas eu de complications postopératoires, y compris une fistule pancréatique postopératoire, une infection intrapéritonéale, une hémorragie, une thrombose portale ou un infarctus splénique. Des détails précis sont présentés dans le tableau 1. Le diagnostic pathologique était un hémangiome. La tomodensitométrie abdominale de suivi après 2 mois a montré que la rate restante avait une bonne irrigation sanguine et qu’aucune récidive n’a été observée.
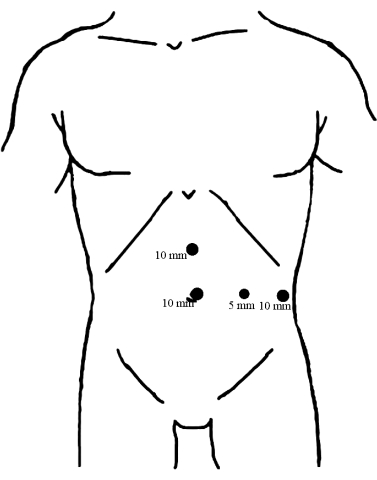
Figure 1 : Répartition des trocarts. Placez un trocart de 10 mm sous l’ombilic comme port d’observation. Les deux autres trocarts de 10 mm sont insérés, l’un au point médian entre l’ombilic et l’apophyse xiphoïde et l’autre sur la ligne axillaire antérieure gauche, parallèlement à l’ombilic, les deux servant de principaux ports opératoires. Ensuite, le trocart de 5 mm a été inséré le long de la ligne médiane de la clavicule gauche au niveau de l’ombilic comme port d’opération assisté. Veuillez cliquer ici pour voir une version agrandie de cette figure.
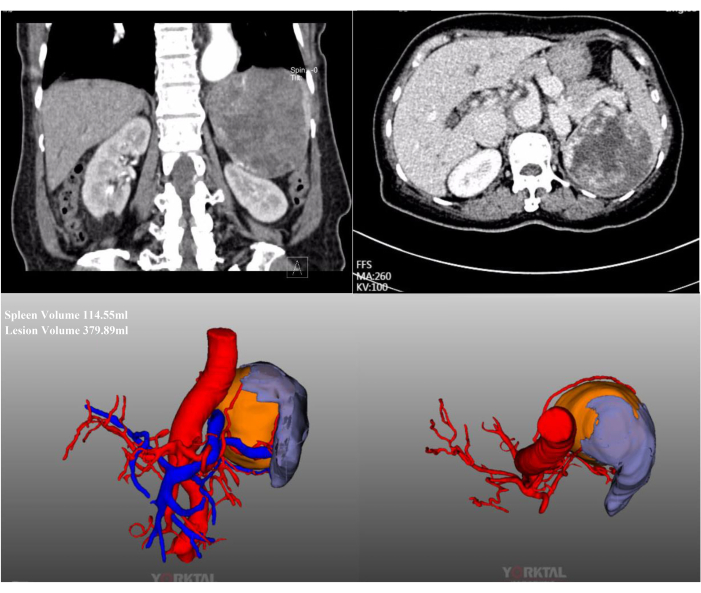
Figure 2 : Reconstruction CT et CT-3D avec contraste. La tomodensitométrie abdominale avec contraste abdominal et la reconstruction CT-3D montrent une lésion massive située dans le pôle moyen supérieur de la rate. Veuillez cliquer ici pour voir une version agrandie de cette figure.
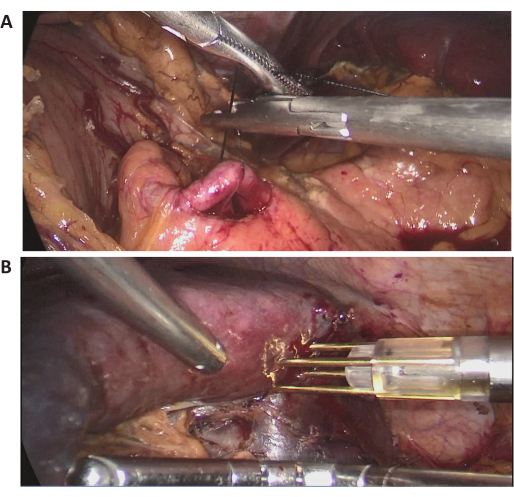
Figure 3 : Images laparoscopique peropératoires. (A,B) Images laparoscopique peropératoires représentatives de l’intervention chirurgicale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Articles | Résultat |
| Temps de fonctionnement (min) | 102 |
| Perte de sang peropératoire (mL) | 30 |
| Conversion à la laparotomie | Non |
| Transfusion sanguine peropératoire | Non |
| Séjour postopératoire à l’hôpital (jours) | 7 |
| Complications postopératoires | Non |
Tableau 1 : Détails opératoires et postopératoires du LPS.
Discussion
Pendant des années, la splénectomie totale a été le traitement principal des tumeurs spléniques, de la splénomégalie et des troubles hématologiques. Cependant, avec un suivi de nombreux cas, les complications après une splénectomie totale, y compris les complications infectieuses et les complications thromboemboliques, ont progressivement suscité l’attention8. Les infections post-splénectomie accablantes (OPSI) sont la complication la plus grave après une splénectomie, caractérisée par une progression rapide de la maladie avec un taux de mortalité d’environ 50 %9. Ce risque accru d’infections bactériennes chez les patients splénectomisés est attribué au rôle des lymphocytes B mémoires IgM dans la zone marginale de la rate, ce qui est crucial pour éliminer les bactéries encapsulées10,11. De plus, les complications postopératoires telles que la thrombose portale, la thrombose du système cave et l’embolie pulmonaire doivent être notées. Les patients atteints de cirrhose qui subissent une splénectomie ont une incidence plus élevée de thrombose portale12, peut-être liée à un état d’hypercoagulabilité13. La PS peut avoir des effets thérapeutiques tout en préservant la fonction de la rate. Par conséquent, pour les patients éligibles, la PS est devenue une alternative privilégiée. La chirurgie laparoscopique, offrant des avantages tels qu’un traumatisme minimal, des résultats esthétiques et des séjours postopératoires plus courts, a été largement utilisée dans la SP ces dernières années.
Le LPS a été signalé pour la première fois par Poulin en 199514. Le LPS implique une occlusion vasculaire sélective de segments spécifiques de la rate, suivie d’une résection le long de la ligne de démarcation. En règle générale, les branches terminales de l’artère splénique se divisent en 2-3 branches avant d’entrer dans des segments distincts de la rate. Chaque segment est séparé par des régions relativement avasculaires15. Cependant, l’application du LPS est difficile en raison d’une hémorragie peropératoire non contrôlée. Renato a examiné 344 cas de chirurgie LPS réalisée entre 1960 et juillet 2017, indiquant que la perte de sang peropératoire moyenne variait de 0 à 1200 cc. Parmi les cas, 6,4 % (22/344) ont nécessité une conversion en laparotomie, et 14 cas ont subi une splénectomie totale en raison d’une hémorragie peropératoire16. D’après notre expérience, les principales raisons sont les suivantes : (i) La rate possède un apport sanguin riche et sa texture délicate la rend sujette aux blessures pendant la chirurgie, ce qui rend l’hémostase difficile. (ii) Une dissection insuffisante du ligament périsplénique complique la mobilisation de la rate, entraînant des déchirures du parenchyme splénique. (iii) La dissection des branches de l’artère splénique pose des difficultés importantes et comporte un risque potentiel d’endommager les structures abdominales adjacentes.
De nombreuses études ont rapporté des méthodes pour réduire l’hémorragie peropératoire pendant le LPS. Il existe principalement trois méthodes principales : l’occlusion de l’approvisionnement en sang splénique, l’utilisation d’appareils à radiofréquence et l’assistance robotique. Borie a signalé l’occlusion temporaire de l’artère splénique à l’aide d’une pince à boucle pour contrôler l’hémorragie peropératoire au cours du LPS17. Dans l’étude de Peng18, 46 patients ont subi un LPS avec occlusion temporaire de l’artère splénique. Ils ont temporairement bloqué l’artère splénique principale avec une pince de bouledogue avant de disséquer les branches correspondantes de l’artère splénique. Contrairement à nous, cette étude n’a inclus que des tumeurs situées aux pôles supérieur et inférieur de la rate, avec des tailles de rate inférieures à 20 cm. Une embolisation vasculaire préopératoire a également été tentée pour contrôler l’hémorragie dans le LPS19,20, démontrant des résultats cliniques satisfaisants. Catalin et coll.21 ont examiné 10 cas de SP assistée par robot, qui présentaient moins d’hémorragies peropératoires et des séjours postopératoires plus courts par rapport au LPS. Cependant, son coût élevé limite son utilisation généralisée. Notre centre a été le premier à appliquer le dispositif de radiofréquence Habibi4X pour la splénectomie22. Il crée une zone nécrotique coagulative par radiofréquence, permettant une splénectomie sans effusion de sang. C’est devenu une méthode standardisée au centre avec une efficacité clinique constante.
Compte tenu des limites des méthodes ci-dessus et de l’expérience unique de notre centre, nous avons tenté d’utiliser un clip de bouledogue pour l’occlusion temporaire de l’artère splénique et du hile, en effectuant une LPS sous ischémie splénique complète. L’étude a rapporté que 95 % du tronc de l’artère splénique principale passe sur le bord supérieur du pancréas23. L’occlusion temporaire à l’aide d’une pince bouledogue après localisation et isolement peropératoires est facilement réalisable. Cependant, il est essentiel de souligner que la dissection du hile splénique nécessite une expérience considérable de la chirurgie laparoscopique. La complexité de cette procédure est influencée par des facteurs tels qu’un IMC élevé, une lésion située près du hile splénique, un volume de lésion important et des antécédents de chirurgie abdominale. Une technique chirurgicale précise est nécessaire pour prévenir les blessures à la queue pancréatique et aux vaisseaux gastriques courts. Un blocage complet du flux sanguin splénique peut assurer l’effet ischémique splénique souhaité, en particulier lorsqu’il s’agit de cas de vaisseaux sanguins variants.
Les appareils à radiofréquence démontrent d’excellentes performances en hémostase24,25. Nous utilisons régulièrement des appareils à radiofréquence pour les insérer dans le parenchyme splénique le long du bord prédécoupé pour la coagulation, formant une zone nécrotique coagulative. Par la suite, nous utilisons un scalpel à ultrasons pour disséquer le parenchyme splénique, obtenant une splénectomie partielle sans effusion de sang. Dans cette étude, nous avons réalisé une résection d’une lésion splénique importante assistée par radiofréquence. La perte de sang peropératoire était de 30 ml et le temps opératoire était de 102 min, sans conversion en chirurgie ouverte. Le patient a reçu son congé 7 jours après l’opération sans complications postopératoires, ce qui était significativement meilleur que la plupart des autres études16,26. Le suivi par tomodensitométrie abdominale supérieure 2 mois après l’opération n’a montré aucune thrombose, et la rate restante avait une bonne irrigation sanguine, démontrant un effet thérapeutique satisfaisant.
Teperman et al. indiquent que le temps ischémique chaud et sans danger pour la rate humaine est de 1 h27. Sur la base d’une vaste expérience chirurgicale, nous pouvons terminer la dissection du parenchyme splénique dans un délai sûr. De plus, les tomodensitogrammes abdominaux postopératoires n’ont toujours montré aucune thrombose ou infarctus de la rate. Cela confirme l’innocuité du LPS en cas d’occlusion complète du flux sanguin splénique. Cependant, nous recommandons d’éviter les cas difficiles au cours de la courbe d’apprentissage initiale, y compris ceux dont l’IMC est > de 25 kg/m², des antécédents de chirurgie abdominale et des lésions du hile surdimensionnées ou proches de la rate, afin de prévenir un temps ischémique prolongé qui peut endommager la fonction splénique. La méthode décrite dans cette étude n’est pas applicable aux lésions situées au niveau de la hile splénique. La surveillance postopératoire est également importante pour détecter les événements indésirables potentiels.
Par rapport à la splénectomie totale, la PS offre l’avantage de préserver la fonction physiologique de la rate tout en obtenant une efficacité thérapeutique et en réduisant les taux de complications à long terme2. Il est généralement recommandé que le volume restant de la rate dépasse 25 % pour préserver efficacement la fonction splénique. Pour évaluer le volume résiduel de la rate, nous utilisons la technologie de reconstruction CT-3D préopératoire. Dans les cas impliquant des lésions spléniques massives, l’approche conventionnelle consistant à identifier et à occlure les branches de l’artère splénique correspondantes pose des défis pour préserver un parenchyme splénique suffisant. Dans cette étude, en combinant la reconstruction CT-3D préopératoire et l’évaluation échographique peropératoire, nous avons optimisé l’approche du LPS pour maximiser la préservation du tissu normal de la rate. Environ 65 % de la rate a été réséquée, ce qui peut atteindre à la fois des objectifs thérapeutiques et maintenir la fonction splénique.
Afin d’assurer la sécurité de cette méthode, nous recommandons d’effectuer des tomodensitogrammes abdominaux préopératoires pour clarifier la relation entre la lésion, les vaisseaux spléniques et les structures abdominales importantes, ainsi que la présence de différents vaisseaux sanguins. Si possible, la reconstruction CT-3D peut améliorer encore l’évaluation préopératoire. Il est important de noter que cette méthode convient aux patients souffrant d’un traumatisme confiné à un côté de la rate, et nous déconseillons l’utilisation de cette méthode en cas de rupture traumatique de la rate potentiellement mortelle ou pour les patients atteints de troubles hématologiques. Le premier peut présenter un risque de préservation inutile de la rate entraînant la mort. Pour les patients subissant une SP due à des troubles hématologiques, le suivi à long terme a montré un risque élevé de récidive et de conversion ultérieure en splénectomie totale2. L’indication idéale pour cette méthode est les lésions bénignes de la rate. Cette méthode ne nécessite pas la dissection des branches de l’artère splénique, ce qui simplifie quelque peu la courbe d’apprentissage du LPS. Cependant, il faut faire preuve de prudence lors de la sélection des patients lors de la phase d’apprentissage initiale.
En conclusion, la LPS sous occlusion totale du flux sanguin splénique est une méthode sûre, réalisable et reproductible qui donne des résultats satisfaisants. Cependant, d’autres recherches approfondies sont encore nécessaires pour évaluer son innocuité et son efficacité de manière exhaustive.
Déclarations de divulgation
Aucun
Remerciements
Aucun
matériels
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable trocar | Kangji Medical | 101Y.307,101Y.311 | |
| Endo bag | Medtronic | https://www.medtronic.com/covidien/en-us/search.html#q=endo%20bag | specimen bag |
| Jaw sealer/divider | Covidien Medical | LF1737 | |
| Laparoscopic radiofrequency device | AngioDynamics, Inc | Rita 700-103659 | |
| Laparoscopic system | Olympus | WM-NP2 L-RECORDOR-01 | |
| LigaSure | Medtronic | https://www.medtronic.com/covidien/en-us/products/vessel-sealing/ligasure-technology.html | vessel sealing system |
| Ligation clips (Hem-o-lok) | Teleflex Medical | 544240,544230,544220 | |
| Ultrasonic scalpel | ETHICON Medical | HAR36 |
Références
- Lewis, S. M., Williams, A., Eisenbarth, S. C. Structure and function of the immune system in the spleen. Sci Immunol. 4 (33), eaau6085 (2019).
- Kristinsson, S. Y., Gridley, G., Hoover, R. N., Check, D., Landgren, O. Long-term risks after splenectomy among 8,149 cancer-free American veterans: a cohort study with up to 27 years follow-up. Haematologica. 99 (2), 392-398 (2014).
- Guizzetti, L. Total versus partial splenectomy in pediatric hereditary spherocytosis: A systematic review and meta-analysis. Pediatr Blood Cancer. 63 (10), 1713-1722 (2016).
- Bronte, V., Pittet, M. J. The spleen in local and systemic regulation of immunity. Immunity. 39 (5), 806-818 (2013).
- Christo, M. C. Partial regulated splenectomies. Preliminary note on the first 3 cases operated on. Hospital (Rio J). 56, 645-650 (1959).
- Redmond, H. P., Redmond, J. M., Rooney, B. P., Duignan, J. P., Bouchier-Hayes, D. J. Surgical anatomy of the human spleen. Br J Surg. 76 (2), 198-201 (2005).
- Romboli, A., et al. Laparoscopic partial splenectomy: A critical appraisal of an emerging technique. A review of the first 457 published cases. J Laparoendosc Adv Surg Tech A. 31 (10), 1130-1142 (2021).
- Buzelé, R., Barbier, L., Sauvanet, A., Fantin, B. Medical complications following splenectomy. J Visc Surg. 153 (4), 277-286 (2016).
- Bisharat, N., Omari, H., Lavi, I., Raz, R. Risk of infection and death among post-splenectomy patients. J Infect. 43 (3), 182-186 (2001).
- Kruetzmann, S., et al. Human immunoglobulin M memory B cells controlling Streptococcus pneumoniae infections are generated in the spleen. J Exp Med. 197 (7), 939-945 (2003).
- Leone, G., Pizzigallo, E. Bacterial infections following splenectomy for malignant and nonmalignant hematologic diseases. Mediterr J Hematol Infect Dis. 7 (1), e2015057 (2015).
- Romano, F., et al. Thrombosis of the splenoportal axis after splenectomy. Langenbecks Arch Surg. 391 (5), 483-488 (2006).
- Watters, J. M., et al. Splenectomy leads to a persistent hypercoagulable state after trauma. Am J Surg. 199 (5), 646-651 (2010).
- Poulin, E. C., Thibault, C., DesCôteaux, J. G., Côté, G. Partial laparoscopic splenectomy for trauma: technique and case report. Surg Laparosc Endosc. 5 (4), 306-310 (1995).
- Ignjatovic, D., Stimec, B., Zivanovic, V. The basis for splenic segmental dearterialization: a post-mortem study. Surg Radiol Anat. 27 (1), 15-18 (2005).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Borie, F. Laparoscopic partial splenectomy: Surgical technique. J Visc Surg. 153 (5), 371-376 (2016).
- Ouyang, G., et al. Laparoscopic partial splenectomy with temporary occlusion of the trunk of the splenic artery in fifty-one cases: experience at a single center. Surg Endosc. 35 (1), 367-373 (2021).
- Mignon, F., et al. Preoperative selective embolization allowing a partial splenectomy for splenic hamartoma. Ann Chir. 128 (2), 112-116 (2003).
- Zheng, L., et al. Treatment of hemangioma of the spleen by preoperative partial splenic embolization plus laparoscopic partial splenectomy: A case report. Medicine (Baltimore). 97 (17), e0498 (2018).
- Vasilescu, C., Stanciulea, O., Tudor, S. Laparoscopic versus robotic subtotal splenectomy in hereditary spherocytosis. Potential advantages and limits of an expensive approach. Surg Endosc. 26 (10), 2802-2809 (2012).
- Wang, W. -. D., et al. Partial splenectomy using a laparoscopic bipolar radiofrequency device: a case report. World J Gastroenterol. 21 (11), 3420-3424 (2015).
- Liu, D. L., et al. Anatomy of vasculature of 850 spleen specimens and its application in partial splenectomy. Surgery. 119 (1), 27-33 (1996).
- Habib, N. A. How we do a bloodless partial splenectomy. Am J Surg. 186 (2), 164-166 (2003).
- Gumbs, A. A., Bouhanna, P., Bar-Zakai, B., Briennon, X., Gayet, B. Laparoscopic partial splenectomy using radiofrequency ablation. J Laparoendosc Adv Surg Tech A. 18 (4), 611-613 (2008).
- Liu, G., Fan, Y. Feasibility and safety of laparoscopic partial splenectomy: A systematic review. World J Surg. 43 (6), 1505-1518 (2019).
- Teperman, S. H., et al. Bloodless splenic surgery: The safe warm-ischemic time. J Pediatr Surg. 29 (1), 88-92 (1994).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon