Method Article
Внеклеточно выявления моторных нейронов для бассейна мышц Motor в
В этой статье
Резюме
У животных с большими определены нейронов ( Например, Моллюски), анализ двигатель бассейнов осуществляется с помощью внутриклеточных методы 1,2,3,4. Недавно мы разработали методику, чтобы стимулировать внеклеточно и записывать отдельные нейроны в Aplysia саЩогтса 5. Опишем протокол для использования этого метода, чтобы однозначно определить и охарактеризовать моторных нейронов в бассейне двигателя.
Аннотация
In animals with large identified neurons (e.g. mollusks), analysis of motor pools is done using intracellular techniques1,2,3,4. Recently, we developed a technique to extracellularly stimulate and record individual neurons in Aplysia californica5. We now describe a protocol for using this technique to uniquely identify and characterize motor neurons within a motor pool.
This extracellular technique has advantages. First, extracellular electrodes can stimulate and record neurons through the sheath5, so it does not need to be removed. Thus, neurons will be healthier in extracellular experiments than in intracellular ones. Second, if ganglia are rotated by appropriate pinning of the sheath, extracellular electrodes can access neurons on both sides of the ganglion, which makes it easier and more efficient to identify multiple neurons in the same preparation. Third, extracellular electrodes do not need to penetrate cells, and thus can be easily moved back and forth among neurons, causing less damage to them. This is especially useful when one tries to record multiple neurons during repeating motor patterns that may only persist for minutes. Fourth, extracellular electrodes are more flexible than intracellular ones during muscle movements. Intracellular electrodes may pull out and damage neurons during muscle contractions. In contrast, since extracellular electrodes are gently pressed onto the sheath above neurons, they usually stay above the same neuron during muscle contractions, and thus can be used in more intact preparations.
To uniquely identify motor neurons for a motor pool (in particular, the I1/I3 muscle in Aplysia) using extracellular electrodes, one can use features that do not require intracellular measurements as criteria: soma size and location, axonal projection, and muscle innervation4,6,7. For the particular motor pool used to illustrate the technique, we recorded from buccal nerves 2 and 3 to measure axonal projections, and measured the contraction forces of the I1/I3 muscle to determine the pattern of muscle innervation for the individual motor neurons.
We demonstrate the complete process of first identifying motor neurons using muscle innervation, then characterizing their timing during motor patterns, creating a simplified diagnostic method for rapid identification. The simplified and more rapid diagnostic method is superior for more intact preparations, e.g. in the suspended buccal mass preparation8 or in vivo9. This process can also be applied in other motor pools10,11,12 in Aplysia or in other animal systems2,3,13,14.
протокол
1. Подготовка Запись Dish
- В ходе экспериментов датчик силы, щечной ганглиев, мозгового ганглия, и щечной массу помещают в круглом блюде Pyrex, который специализируется на силы исследованиях.
- Для стимулирования ingestive-подобных моделей в экспериментах, мы должны применить, не гидролизуемых холинергических карбахола агониста головного ганглия 15. Чтобы избежать прямого контакта с карбахола на щечной ганглиев и щечной массы, отдельные камеры необходимо, чтобы изолировать церебральный ганглий с щечной ганглиев и щечной массы (рис. 1).
- С щечной масса намного толще, чем ротовой ганглиев, они не будут размещены на том же уровне. Таким образом, это блюдо должно иметь резервную камеру для церебральный ганглий (область на рисунке 1), средней платформой для ротовой ганглиев (область C на рис 1), а гораздо глубже, передняя камера для ротовой массы (область D в рис. 1).
- Для создания этого блюда, начинается с круглым 100x15 Pyrex блюда (15 мм в высоту, 100 мм в диаметре). Строительство блюда потребуется несколько льется из Sylgard. Следуйте инструкциям, поставляемые вместе с продуктом Sylgard. Sylgard должно быть разрешено устанавливать между различными льет.
- Первый застывания является создание высокого уровня Sylgard в блюдо (область B на рисунке 1), которая является стеной между средней платформе и задняя камера.
- Используйте две подложки пластилина, чтобы изолировать область для Sylgard стены (область B на рисунке 1). Пальто пластилин подложки полиэтиленовой пленкой, где они будут обращаться в Sylgard для облегчения удаления. Убедитесь герметичности по краям, где пластилин свяжется с блюдом, чтобы свести к минимуму утечки.
- Залить Sylgard в часть между двумя подложками пластилин почти до верхней части блюда. Пусть Sylgard полностью установлена на ночь. Ведение блюдо в теплом месте будет вызыватьбыстрой настройки. Снимите подложки пластилина и очистить любую глину остаток на Sylgard.
- Далее, задняя камера (область на рисунке 1) и средней платформе (область C на рисунке 1) следует вылить.
- Поместите поддержку пластилина около 5 мм от передней поверхности Sylgard для части среднего платформа (область C).
- Залить Sylgard в разделах для задней камеры (область) и средней платформе (область C) до высоты примерно 3-5 мм ниже верхнего уровня первого Sylgard стены (зона В). Sylgard поверхности задней камеры должна быть немного ниже, чем в среднем платформу, чтобы избежать утечки из задней камеры, содержащей карбахола к середине платформы. Опять же, пусть Sylgard полностью установлена в течение ночи, а затем удалить поддержку пластилин.
- Последним шагом является сокращение выемку в середине Sylgard стены, чтобы обеспечить канал для церебрального-щечной связок (CBCS), чтобы перейтипутем между средним платформы и задней камерой. Ширина этой выемки должна быть примерно 3-4 мм, что является достаточно широкой для CBCS. В нижней части надреза не должна быть ниже, чем Sylgard поверхности середине платформы для предотвращения утечки. Скальпель может быть использован, чтобы сократить качеством.
2. Электрод подготовка
- Потяните внеклеточной стеклянные электроды из одноствольный капиллярной стекло с помощью Flaming-Brown микропипетки съемник как описано МакМанус и соавт. 8 в разделе 3.1. С FT345B нити в съемника, наших типичных настройках программы Тепло 480, тяги 50, скорость 13, а время 20, но отметим, что параметры будут различными для разных нитей. Эта программа создает электродов в односторонней с огня не полировки этапе. Размер конец электрода должен быть меньше, чем размер ячейки органов. Для моторных нейронов в диапазоне от 50 мкм до 400 мкм сома диаметр, внутренний diameteRS внеклеточных электродов стекло должно быть около 40 мкм, а их сопротивление должно быть около 0,1 Мом, когда они наполнены Aplysia физиологическим раствором.
- Вытяните всасывающий электроды из полиэтиленовых труб использованием газовой горелки. Вырежьте кусок полиэтиленовой трубки длиной около 10 см. Держа трубку на обоих концах и поместите его очень близко к пламени, производимое горелкой Бунзена при вращении трубки пока он не станет мягким от жары. Протяните трубу тщательно вдоль его длины при перемещении его от пламени. В средней части трубки будет удлиненные и узкие, как трубы тянут.
- Отрежьте трубку пополам, чтобы сформировать два электрода всасывания. Всасывание электроды, как правило, применяется к обрезанными концами нервов или мышц, хотя иногда они могут быть применены мимоходом.
- Создайте крючком электроды для нервов записи после протоколу, описанному МакМанус и др. 8 в разделах 3.2-3.13. Эти электроды especiсоюз полезно, когда нерв или мышцу не вырезано.
3. Вложение Hook электродов
- Препарировать животное и удалить щечной массы после протоколу, описанному в МакМанус и др. 8. Раздел 4.
- Для записи и стимуляции, крючок электроды могут быть присоединены к ряду различных нервов.
- Для характеристики моделей как это было сделано в естественных условиях на Cullins и Chiel 9, записи должны быть получены из I2 нервов и мышц, что указывает на затягивание фазы кормления 16, радулы нерва (RN), что указывает на закрытие пищи хапуга 17, щечной нерва 2 (BN2) и щечной нерва 3 (BN3), которые указывают на втягивание фазе 17,18. Крепление крючка электроды следует процедуре, аналогичной описанной на МакМанус и др. 8, раздел 5.
- Расположение этих нервов относятся к схеме аппарата кормления Aplysia показано наРисунок 2 из МакМанус и др. 8. Обратите внимание, что BN2 trifurcates в филиалах A, B, и C, прежде чем под I1 мышцы на боковой паз. Филиал является первой ветви отделить от основного ствола, и примыкает к BN3.
- Номенклатура отраслей A, B, и C был использован Warman и Chiel 18. Филиалы A, B, и C соответствуют ветви 3, 2 и 1, соответственно, в номенклатуру используемых Nargeot и соавт. 19. Кроме того, RN, BN1, BN2, и BN3 соответствуют нервам 1, 6, 5 и 4, соответственно, в номенклатуру используемых Кандель 20 и Scott и др. 21.
- Для изучения иннервации мышц I1/I3 мышцы, все нервы, кроме щечные нервы 2 будет отделена от ротовой массы во время экспериментов. Таким образом, мы использовали крючок электродов для записи с BN2.
- Поскольку I2 нерва и RN не будет прикреплен к ротовой масса, и они очень трудно получить доступ с помощью крюка электроды, предпочтительнее применять всасывающие электроды для записи с их вместо этого. Мы опишем применения всасывающих электродов в разделе 7.
- Используйте либо электрод крючок или всасывающих электродов для записи с BN3, потому что это легко получить доступ с использованием либо вид электрода. Мы решили использовать крюк электродов для записи BN3 свести к минимуму количество манипуляторов для проведения всасывающих электродов, и, чтобы сэкономить место для других манипуляторов и оборудования.
- Прикрепите крючок электрода на ветку из BN2 (BN2-а) инициировать отказ подобные модели в процессе экспериментов. Это полезно приложить дополнительный электрод крюк в BN2-на другую сторону, потому что некоторые нейроны реагируют по-разному в ипсилатеральной по сравнению с контралатеральной BN2-стимуляцию.
- Чтобы помочь отличить нейронов с односторонним против двусторонних прогнозам, онаТакже полезно прикрепить крючок электродов BN2 и BN3 на другой стороне ротовой ганглиев.
4. Ганглиев и мышечный препарат
- Щечной ганглиев, мозгового ганглия и щечной масса будет подготовлена для экспериментов датчик силы, в которых церебральный ганглий прикреплен к щечной ганглиев через CBCS и щечной масса прикреплена к щечной ганглиев через BN2s только.
- После крепления крюка электродов, сократить щечные нервы 1 (BN1) и пищевода нерва (EN) в двустороннем, резка в точке крепления к щечной массы.
- Потяните церебральный ганглий вперед, чтобы переместить его из способов I2 мышцы. Сделайте надрез в I2 мышцы над радулы мешка, расширить разрез сбоку и спереди в обоих направлениях, и вытащить лоскут I2 мышцы вперед, чтобы разоблачить радулы нерва. Вырежьте два RN филиалов и убедитесь, что ветви достаточно долго для всасывания вложений электрода.
- Cоказанию в I2 сокращение широкий круг вокруг ротовой ганглиев, соблюдая осторожность, чтобы не порезать BN2s или BN3s, пока щечной ганглиев и пристроенной части I2 мышца может быть полностью отделена от ротовой массы. Вырезать двусторонних BN3s в точке крепления к щечной массы, за привязанность электрод крючком.
- Нанесите тонким слоем вакуумной смазки на выемку в записи блюдо описано выше, который соединяет заднюю камеру и среднего платформу, с помощью пипетки, чтобы поднять шарик вакуумной смазкой и распростерла его над качеством.
- Нанесите тонкий слой геля Быстрый супер клей для стекла нижней части передней камеры, где щечной массы будут размещены, только в передней части базы Sylgard средней платформе.
- Тщательно передачи головного ганглия, щечной ганглиев и щечной массы к записи блюдо (рис. 1), описанные в разделе 2, убедившись, что ни один из крюка электроды туго натянута, которые могут привести к повреждению нервов.
- Аккуратно положите щечной массы на клей в передней камере записи блюдо, чтобы его вентральной поверхности приклеивается к нижней части блюда. Будьте уверены, чтобы сохранить ганглиев и электроды от прикосновения к клею. Добавить Aplysia солевой 8 (460 мм NaCl, 10 мМ KCl, 22 мМ MgCl 2, 33 мМ MgSO 4, 10 мМ CaCl 2, 10 мМ глюкозы, 10 мМ MOPS, рН 7,4-7,5) к блюду, которое будет вызывать клей для установки.
- Если блюдо должно быть передано другому микроскоп для подготовки ротовой ганглиях внеклеточной записи сомы, быть очень осторожным с крюком электродов. Группа электродов на одной стороне ротовой массы вместе, а также группу электродов на другой стороне ротовой массы вместе. Осторожно держать электроды, держа в лаборатории ленту, которая охватывает разъема, снова убедившись, что ни один из электродов туго натянута.
- Когда блюдо расположена под микроскопом, электроды должны быть задрапированы мягко по сторонам блюдо и отдых на платформе рядом с блюдом.
- В перерывах между этапами эксперимента, аэрации раствора в ротовую камеры массового использования аквариума распылитель.
- Используйте пинцет, чтобы захватить оболочки головного ганглия и вытащить его в спину камеры, гарантируя, что CBCS запустить через вырез. Pin церебральный ганглий использованием нервов, кроме CBCS, чтобы избежать повреждения нетронутыми CBCS.
- Применить более вакуумной смазки на CBCS, а затем добавить еще Aplysia физиологическим раствором для обеих палатах блюдо, так что ганглиев они полностью погружены. Убедитесь, что в верхней части вакуумной смазки немного выше, чем Sylgard стене так, чтобы не происходило утечки будут происходить между камерами.
- Для стабилизации щечной ганглиев, первый контакт концов BN3s, то BN1s и ENs на Sylgard базе средней платформе (рис. 2). С BN3s будет записан при помощи крюка электродас, контакты должны быть помещены более дистально, чем точек крепления крюка электродов.
- Используйте два штифта, наклонилась на 90 градусов, как крюки, чтобы растянуть и закрепить CBCS, так что CBCS не будет повреждена (рис. 2).
- Придавить RN ветви между задней камеры и щечной ганглиев. Тогда I2 мышца будет на вершине RNs. Чтобы разоблачить I2 нерва, используйте щипцы, чтобы захватить I2 мышцы и потянуть его на щечной ганглиев. Pin двух углах I2 мышцы, чтобы избежать повреждения I2 нерва.
- Север I2 нерва дистальнее точки, в которой его две ветви сливаются в I2 мышцы. Убедитесь, что мышцы все еще иннервируются быть сопоставимы с записями в естественных условиях. Срежьте остальные I2 мышц и перевернуть I2 нерва спину и придавить это между двумя ветвями RN (рис. 2, вставка).
- Отрегулируйте расположение контактов, чтобы растянуть и добавить напряженности, если нерв слишком свободно или снять напряжение, если нервове слишком туго. Для дальнейшей стабилизации щечной ганглиев, добавить больше контактов на оболочке между нервами.
- С щечной ганглии расположены хвостовые стороной вверх, поворот щечной ганглии, если нейроны интерес представляют на ростральной стороны. Чтобы повернуть одну из двух щечной ганглиев, использовать тонкий пинцет, чтобы захватить некоторый избыток оболочки CBC, где он находится рядом с щечной ганглиев и придавить это между BN2 и BN3. В некоторых ганглиях, он может быть более удобным придавить это между CBC и BN3.
- Добавить дополнительный вывод на оболочке ротовой ганглия на стороне ближе к передней камеры, чтобы минимизировать движение ротовой ганглия.
- Чтобы обрезать оболочкой, покрывающей щечной ганглиев, использовать тонкий пинцет, чтобы захватить оболочка на стороне ближе к задней камеры, а затем срезать избыток оболочку с мелкими ножницами, не подвергая клетку тела. Для того, чтобы свести к минимуму ущерб, только удалить минимальное количество оболочку необходимо видеть клеточных тел.
- После тОн оболочки ротовой ганглиев обрезается, потяните I2 нерва и RNs за ротовой ганглиев и прикрепить их вниз между щечной ганглиев и передняя камера для дальнейшего поворота щечной ганглиев. (См. Рисунок 2).
- Чтобы смыть оставшийся хлорид магния 8, который был использован для анестезии животных до рассечения, заменить солевые Aplysia в блюдо со свежим солевым Aplysia.
5. Электрического соединения Hook Электроды
- После ганглиев и мышцы готовы, обязательно передать блюдо к столу виброизоляции для экспериментов.
- Приложите все контакты электрода к их гнездам BNC кабелей, которые подключаются к усилителям (AM системы модели 1700 усилитель). Опять же, убедитесь, что электроды не туго натянута, делая это. Убедитесь, что электроды правильно, связанных с их соответствующими кабелями и что полярность правильная.
6. Настройка внеклеточной стеклянные электроды для записи Сома
- Заполнить электрод с Aplysia раствора, используя шприц прилагается к части полиэтиленовых труб составляет около 15-20 см. Прикрепите свободный конец полиэтиленовой трубки к концу стеклянного электрода. Отойдите назад на поршень шприца, чтобы заполнить электрод с Aplysia физиологическим раствором.
- Поместите заполненные внеклеточных электродов стекло в паз держателя на манипуляторе. Используйте манипулятор для размещения электрода в солевой Aplysia содержащие щечной ганглиев.
- Вставьте серебра / хлорида серебра провода припаять к мужской контактный разъем золота в электрод в качестве записи проволоки. Поместите другой серебра / хлорида серебра провода припаять к мужской контактный разъем золото непосредственно в солевой Aplysia в разделе Запись блюдо с щечной ганглиев в качестве опорного провода. Подключите оба йЗапись е и ссылки провода к BNC кабель, который подключается к усилителю.
- Если есть достаточно места для более манипуляторы, дополнительные внеклеточной стеклянные электроды могут быть добавлены к записи нескольких нейронов одновременно.
7. Настройка всасывания Электроды для нервов Recordings
- Обрежьте узкий конец всасывающего электрода в соответствии с диаметром нерва. Внутренний диаметр электрода должна быть аналогичной или немного меньше, чем диаметр нерва обеспечить плотный всасывания.
- Поскольку I2 нерва и RN очень близко друг к другу, их электроды могут быть проведены одним и тем же манипулятором для экономии места. Поместите двумя электродами в две ступени одного и того же владельца. Поворот двумя электродами и убедиться, что их советы близки друг к другу. Выберите один из них для I2 нерва записи, другой для записи RN.
- Поместите кончик электрода в солевой Aplysia в Recordinг блюдо с щечной ганглиев. Прикрепите свободный конец полиэтиленовой трубки на шприц с всасывающим электродом. Используйте шприц, чтобы заполнить электрод с Aplysia физиологическим раствором. Перемещение электрода близко к концу целевой нерва, т.е. I2 нерв, и с помощью шприца сосать нерва в электроде. Длина нерв внутри электрода должна быть около 0,5-1,0 мм для обеспечения герметичности.
- Повторите всасывания электрод, который будет прикреплен к RN.
- Подключите электроды к соответствующим BNC кабелей, как описано в разделе 6.3.
8. Настройка датчик силы для измерения I1/I3 сокращения мышц
- Для подключения датчиков силы в мышцах, использовать шелковые нити. Согните изогнутой иглой каждого шва, и связать нить в силу преобразователя. Аккуратно возьмите и поднимите небольшое количество мышц пинцетом и, держа иглу в другой набор щипцов, вставьтеиглу в мышцу до изогнутой точку в иглу (рис. 1).
- Преобразователи могут быть прикреплены либо сверху или сбоку на I1/I3 мышцы. Спинной вложений позволяет измерять сокращений вызвана активацией левой или правой стороны мышц. Боковое крепление покажет сильные силы для большинства нейронов, но только позволит измерения сокращения на стороне к которой крепится датчик.
- Чтобы определить нейроны, которые могут активировать переднего, заднего или обоих регионах I1/I3, прикрепить датчик силы в задней части мышц, только впереди глотки ткани и приложите еще один датчик силы к передней части мышцы, на челюсти (рис. 1, к сведению крючков).
- Поднимите датчиков силы, пока швы натянуть, но не затягивать. Чтобы проверить это, просмотрите измерения с датчиком силы, когда шов имеет некоторую слабину ят, а затем поднимите преобразователь до измерения находится чуть выше этого базового уровня.
9. Определение моторных нейронов в пределах бассейна Motor
- Этот протокол описывает процесс внеклеточно выявления моторных нейронов в бассейне двигателя. Мы использовали AxoGraph программное обеспечение для мониторинга активности отдельных нейронов, несколько нервов и мышц (ЭМГ сигнала или сокращения сил). В этом протоколе, мы использовали сокращение силы мышц в качестве иллюстрации к процессу выявления моторных нейронов, в других экспериментах мы использовали EMG, а также и настройки для таких экспериментов очень похожи (см. Обсуждение).
- Чтобы найти кандидата нейрона, использовать манипулятор аккуратно нажмите кончиком внеклеточной стеклянный электрод вниз на оболочку над центром нейрона Сома 5 (рис. 3), который является лучшим местом для стимуляции и записи селективности 5. Так как пороговый ток Fили активации нейронов увеличивается линейно с электродом к сому расстояние 5, стимулирование селективности станет еще хуже, когда электрод отошел от центра мишени нейрона к соседнему нейрону.
- Чтобы определить двигательный нейрон, сначала непосредственно стимулирует нейрон помощью внеклеточных электродов стекла, чтобы гарантировать, что только этот нейрон стреляет, и рассмотреть ли он иннервирует мышцы. Тогда, внеклеточно запись из этого нейрона создать один-к-одному между внеклеточной записи сомы и нервов записей, которые также важны для идентификации нейронов.
- Так как большинство внеклеточной усилителей не позволяет одновременную стимуляцию и запись в канал, установить канал используется для стимуляции и записи сомы (сомы канал) на стимуляцию режима и применять краткую анодного тока (например, 6 мс для нейронов Aplysia 5) к сомы (рис. 4А, 5А; записке стрелки 1 яп обе цифры), начиная с малых токов (например, 200 мкА), и постепенно увеличивая ток до нейрона очередями.
- После активации нейрона к разрыву, следует немедленно выключить сома канала от стимуляции режима в режим записи (рис. 4А, 5А; записке стрелки 2 на обоих рисунках). Тем не менее, все еще будет задержка между стимуляцией сомы и записи из-за человеческой задержки ответа.
- Если нейрон пожаров в течение разумного периода времени, она должна быть возможность наблюдать один-к-одному соответствующие потенциалы действия от сомы записи и на нерв (ы), через которые нейрон проектов (рис. 4б, 5б, к сведению пунктирной линией ), а также сил, возникающих при нейрона (рис. 4А, 5А; записке синие). Если нейрон прекращает стрельбу перед записью сома начинается, увеличения текущей чтобы активировать его в течение длительного времени.
- Отношение сигнал-шум внеклеточногозаписи зависит от расположения электродов и сомы размером. Внеклеточной записи будет становиться все больше, как увеличение размеров сома и электрода к сому расстояние уменьшается. Так как только шум колеблется в узком диапазоне, сигнал-шум будет также увеличиваться по мере увеличения размеров сома и электрода к сому расстояние уменьшается. Наиболее распространенный диапазон сигнал-шум составляет от 4:1 до 8:1.
- Моторные нейроны могут быть определены на основе их характеристик, таких как сомы месте, нервов и мышц проекции иннервации 4,6,7. Поскольку только два BN2s крепятся к щечной массы, путем мониторинга деятельности на BN2s, можно убедиться, что силы сокращения мышц вызывает лишь нейрон активируется внеклеточной стимуляции.
- Например, B3 представляет собой большой двигательный нейрон для I1/I3 мышц (300-400 мкм в диаметре сома на животных весом от 200 до 350 граммов), расположенный на ростральной части щечной ганглии (рис. 3 ). Это только проекты через ипсилатерального BN2, и иннервирует как в передней и задней частях I1/I3 мышцы. Большую часть времени, активация он генерирует большую, чем передние задние силу (8 из 9 опытов).
- После нейрона определяется, ее деятельность может быть записана в различных кормления типа поведения с помощью внеклеточных стеклянный электрод (рис. 4 и 5), которая может быть вызвана как описано ниже. Внеклеточной записи на сома будет гораздо более конкретными, чем нерв записей, которые включают в себя деятельность различных нейронов.
- Для стимулирования egestive подобных программ двигателя, стимулируют BN2-с 1-2 мин импульсов 19 (2 Гц, каждого импульса составляет 1 мс). Эта стимуляция надежно генерирует egestive моделей в этой обстановке. При наличии достаточного тока (например, 300 мкА), модели могут сохраняться в течение всего срока стимуляции. Иногда там будет еще одна модель, которая происходит вскоре послестимуляция заканчивается.
- Для стимулирования ingestive подобных программ двигателя, поместите несколько кристаллов твердых карбахола непосредственно на оболочку головного ганглия 15. Если кто-то хочет, чтобы контролировать уровень воздействия карбахола, используют решения от 1 до 10 мМ карбахола в Aplysia физиологическим раствором. Более высокие концентрации, более вероятно, чтобы вызвать ответ. Повторяющиеся модели обычно начинаются в течение пяти минут, и может длиться в течение примерно десяти до пятнадцати минут до начала стекать.
- После вымывания карбахола несколько раз и ждут, по крайней мере 30 минут, последующее применение карбахола могут быть добавлены к коре головного ганглия, чтобы вызвать более ingestive-подобных моделей двигателя.
- После нескольких моторных нейронов для конкретного бассейна двигателя были идентифицированы и охарактеризованы в двигатель программы, можно развить значительно упрощает диагностический метод, который требует минимальной информацией для быстрого выявления этих нейронов в будущей работе (рис. 6 </ STRONG>), например, в подвешенном щечной подготовки массы или в естественных условиях. Эти критерии могут включать размер и расположение сомы, нервные проекции, размер блока на нервы, и время активности во время двигатель модели.
Результаты
На рисунках 4 и 5 показаны типичные результаты используются для определения двух I1/I3 моторных нейронов. Рисунок 4 показывает сома записи больших моторных нейронов, B3, во время egestive-как и ingestive-подобных моделей (рис. 4C, 4D). Один к одному соответствующие шипы на канале сомы и ипсилатерального канала BN2 (рис. 4E) показывают, что специфика записи B3 сома сохранялось в течение моделей. B3 пожары в середине-конце отвода фазы моделей. На рисунке 4 и другие результаты (не показан), мы обнаружили, что BN2 единицы B3 всегда крупнейших BN2 устройства. Таким образом, оно также может быть обнаружено непосредственно с BN2 записи.
На рисунке 5 показана сома записи небольших нейронов, B43, во время egestive-как и ingestive-подобных моделей (рис. 5C, 5D). Один к одному соответствующие шипы на канал сомаи ипсилатерального канала BN2 (Рис. 5E) также показывают, что специфика B43 записи сома сохранялось в течение моделей. Нейрон B43 всплески в конце отвода фазы при моделей. С BN2 единицы B43 мало, было бы трудно определить его из BN2 записи без записи сомы, однако, поскольку он стреляет наиболее интенсивно в конце BN2 картины двигателя, в конце взрыв B43 все еще может быть идентифицирована от BN2 записей в покое.
На рисунке 6 показан оптимизированный диагностическое дерево, не требуют мышечной иннервации в качестве критерия, что делает его гораздо легче внеклеточно определить I1/I3 моторных нейронов в подвешенном щечной подготовки массы или в естественных условиях. Диагностического дерева была разработана, однако, с помощью мер применения силы и ЭМГ, и таким образом показывает, как методы в этом протоколе может привести к обтекаемой двигательного нейрона идентификации.

Рисунок 1. Схема общей установки и блюдо для силы исследованиях. Верхнее изображение показывает вид сверху. Нижний рисунок показывает вид сбоку (соответствующий пунктирной линии в середине вид сверху). Церебральный ганглий прижат к Sylgard в задней камеры (область). Щечной ганглии прижат к Sylgard на середине платформы (зона С). В камере взад и среднего платформы разделены повышенной Sylgard стены (зона В). Церебральный-щечной связок (CBCS) проходит через выемку в стене Sylgard, запечатанный с вакуумной смазкой. Щечной масса приклеивается к стеклу нижней части передней камеры (область D). Щечные нервы 2 (BN2s) прикреплены к щечной массы. Два крючка прикреплены к шелковой нити вставляется в переднюю и заднюю регионов I1/I3 мышцы. TОн шелковые нити, то привязаны к силе преобразователя. На рисунке используется темно-серый, светло-серый и белый для обозначения поверхности областей A, B, C, и D. Чем темнее цвет, тем выше соответствующей поверхности. На рисунке используются, B, C, D и указывают на важные размеры блюдо. Длина 3-4 мм, ширина выреза, который соединяет заднюю камеру и среднего платформы. Длина B составляет около 3-5 мм, разница в высоте между поверхностями середине платформы (зона С) и Sylgard стены (зона В). Длина С указывает на длину надреза, что составляет около 5 мм. Длина D показывает ширину середине платформы (зона С), что составляет около 5 мм.

Рисунок 2. Схема щечной ганглиеви электроды установки. рисунке показано расположение ключевых нервов, в том числе щечные нервы 1, 2 и 3 (BN1, BN2, и BN3), пищевода нерва (EN), радулы нерва (RN), I2 нервов и мышц и головного щечной соединительной (CBC). Обратите внимание, что BN2s крепятся к щечной массы (см. Рисунок 1). CBCS прикреплены к коре головного ганглия, проходящие через прорезь Sylgard стены и запечатаны с вакуумной смазкой (см. Рисунок 1). RN и I2 нервы и мышцы тянутся над ганглиев и возлагали проксимальнее щечной массы (передние направлении). Синие линии указывают на расположение контактов. Два изогнутых штифтов (красные линии помечены 1) используются для закрепления CBCS. Обратите внимание, что лоскут оболочки приграничного сотрудничества на левой стороне складывается и скованы между BN2 и BN3, чтобы повернуть левой щечной ганглий (красные линии, обозначенной 2). В некоторых ганглиях, он может быть более удобным, чтобы прикрепить оболочку вниз между CBC и BN3. Дополнительный контакт добавлен тØ стороне ганглия, который проксимальнее EN (красные линии, обозначенной 3) для дальнейшего вращения и стабилизации. Внеклеточной стеклянный электрод помещается в верхней части оболочки над сома за внеклеточной стимуляции и записи. Крючок электроды крепятся к BN3s и булавки проведения этих нервов в месте должны быть размещены более чем дистальнее места прикрепления этих крюк электродов. Два электрода всасывающие крепятся к RN и I2 нервов и мышц (см. вставку для более четкого представления о I2 нервов и мышц). Нажмите, чтобы увеличить показатель .

Рисунок 3. Фотография и схема карта нейрон для внеклеточных идентификации I1/I3 двигателянейронов в Aplysia щечной ганглия. верхнем снимке показана правая сторона щечной ганглий, возлагали хвостовой вверх. Чтобы повернуть щечной ганглиев, RN и I2 нерв / мышцу потянул над щечной ганглиев и возлагали проксимальном в сторону EN. Лоскут CBC оболочка также сложить и возлагали на вращение (см. Рисунок 2), так что нейроны в ростральной стороны или на хвостовом / ростральной границе можно увидеть. В нижней схеме составляется на основе верхнем снимке. Картинки и схемы вместе указывают на местах I1/I3 моторных нейронов B3, B6, B9, B10, B38, B39, B43 и B82 6,7 22,23, а также некоторых других нейронов. Нейроны B8a и B8b несут ответственность за крупнейшее подразделение на RN, и иннервируют мышцы I4 управления хапуга 6,17. Нейроны B4 и B5 несут ответственность за крупнейшее подразделение на BN3 18. Несмотря на размеры и расположение I1/I3 моторные нейроны являются переменными от животного тО животных, относительно размера и местоположения являются достаточно надежными для большинства нейронов: B3, B6, B9, B38, B43, B82 и. См. обсуждение для более подробной информации о I1/I3 моторных нейронов, особенно некоторые трудности уникальной идентификации B10 и B39.
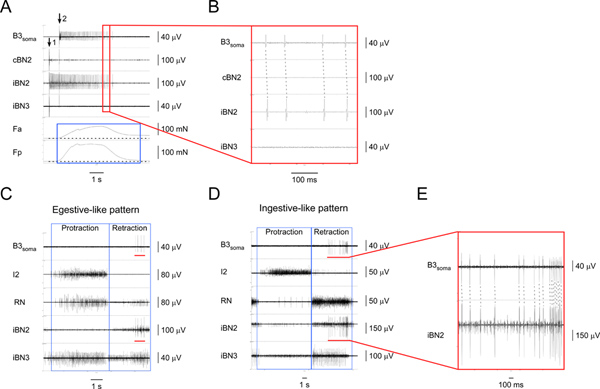
Рисунок 4. Выявление и характеризующие I1/I3 двигательного нейрона В3.) Внеклеточной стимуляции B3 (на стрелка 1) и запись с B3 сомы (начиная стрелка 2), а также от соответствующих нервы и мышцы регионов. Сверху донизу, каналов записи с B3 сома, контралатеральной BN2, ипсилатерального BN2, ипсилатерального BN3, сокращение силы передней части I1/I3 мышцы, и сокращение силу задним области I1/I3 мышцы.синяя коробка подчеркивает продолжительность силы в передней и задней регионов I1/I3 мышцы. В данном конкретном случае, задняя сила больше, чем передняя силу. B) Расширенное вид на окрестности, изложенные в красном поле в A1. Один к одному соответствующие потенциалы действия в B3 сомы и iBN2 каналов показывают, что B3 только проекты на ипсилатеральной BN2. C) внеклеточной записи с B3 сомы и нервов в egestive типа двигателя шаблону. D) внеклеточной записи с B3 сомы и нервов в ingestive типа двигателя шаблону. В C и D, сверху донизу, каналов записи с B3 сома, I2 нерва, RN, ипсилатерального BN2, и ипсилатерального BN3. Синие указывают на затягивание и отвода фаз моделей. Красные полосы в канале В3 сома в обоих C и D выделите действий банкадифференциалов, записанных с B3 сомы. Красный бар в iBN2 канал в обоих C и D указывают на соответствующие сроки, когда B3 стреляет в ипсилатеральной BN2 во время кормления модели двигателя. Е) Расширенное зрения B3 сомы и iBN2 каналы отмечены красным баров. Пунктирные линии показывают один-к-одному между потенциалами действия в B3 сомы и iBN2 каналов. Обратите внимание, что BN2 единицы B3 является самым крупным из всех подразделений. Таким образом, мы можем также обнаружить BN2 единиц B3 непосредственно из BN2 записи без записи сомы. Нажмите, чтобы увеличить показатель .

Рисунок 5. Выявление ихарактеризующие I1/I3 двигательных нейронов, B43.) внеклеточной стимуляции B43 (на стрелка 1) и запись из своего сома (начиная стрелка 2), а также от соответствующих нервы и мышцы регионов. Сверху донизу, каналов записи с B43 сома, контралатеральной BN2, ипсилатерального BN2, ипсилатерального BN3, сокращение силы передней части I1/I3 мышцы, и сокращение силу задним области I1/I3 мышцы. Синяя коробка подчеркивает силу измерений I1/I3 мышц во время B43 деятельности. Активация B43 генерирует небольшой задний силы, но не переднего силу. B) Расширенное вид на окрестности, изложенные в красном поле в. Пунктирные линии показывают один-к-одному между потенциалами действия в B43 сомы и iBN2 каналов, которые показывают, что B43 проектов на ипсилатеральной BN2 только. C) внеклеточной записиот B43 сомы и нервов в egestive типа двигателя шаблону. D) внеклеточной записи с B43 сомы и нервов в ingestive типа двигателя шаблону. В C и D, сверху донизу, каналов записи с B43 сома, I2 нерва, RN, ипсилатерального BN2, и ипсилатерального BN3. Синие указывают на затягивание и отвода фаз моделей. Красный бар в B43 сома канала в обоих C и D выделить потенциалы действия, записанных с B43 сомы. Красный бар в iBN2 канал в обоих C и D указывают на соответствующие сроки, когда B43 стреляет в ипсилатеральной BN2 в этих структурах. Е) расширенное представление B43 сомы и iBN2 каналы отмечены красным бар в D. Пунктирные линии показывают один-к-одному между потенциалами действия в B43 сомы А iBN2 каналов. Обратите внимание, что BN2 единиц B43 являются небольшими и очень трудно обнаружить без сомы записи, но огонь последовательно в конце программы BN2 двигателя, обеспечивая еще один способ идентифицировать их. Отметим также, что чем больше блок, показанный на нижней панели E является столкновение B43 сома блок с другим внеклеточной устройства. Нажмите, чтобы увеличить показатель .

Рисунок 6. Оптимизированный диагностического дерева для идентификации некоторых из I1/I3 моторных нейронов использовании внеклеточных сомы и нервных записей. Этот диагностический метод требует минимальной информации для идентификации I1/I3 моторных нейронов, что делает его гораздо легче идентиFY моторных нейронов в подвешенном щечной подготовки массы или в естественных условиях. B3 имеет самый большой BN2 единицы среди идентифицированных I1/I3 моторных нейронов. В остальных моторных нейронов, B6 и B9 являются единственными двумя нейронами, что проект по обе BN2 и BN3. B9 больше, чем боковые B6. Остальная часть нейронов проектирование только на BN2 также могут быть разделены на две группы. Одна группа нейронов проектов двусторонней через BN2s, которая включает в себя B10 и B39, а некоторые неизвестные нейронов. Другая группа нейронов проекты ипсилатерально на BN2 только, который включает в себя B38, B43, B82 и. B38 рядом B3 и B9. B82 рядом B8 (см. Рисунок 3). B43 рядом B6. Его BN2 устройство малого и всплески в конце кормления моделей.

Рисунок 7. Сравнение показателей успешного нейронов яdentification в силу экспериментов либо с помощью внеклеточных техники или внутриклеточная техники. Что же установки датчика силы, мы сделали 35 экспериментов с использованием внеклеточного техники (маленькие точки синяя) и 27 экспериментов с использованием обычных внутриклеточных техника (большая фиолетовые точки), чтобы определить I1/I3 моторных нейронов. На оси Х указывается наименьшее количество моторных нейронов для I1/I3 мышц, которые были выявлены в каждом типе эксперимента. Y-ось указывает процентную ставку успех каждого типа эксперимента. Например, в 19 из 35 (54%) внеклеточной эксперименты, мы смогли выделить по крайней мере пять различных I1/I3 моторных нейронов. Только 1 из 27 (4%) внутриклеточного экспериментов, мы смогли выявить по меньшей мере пять I1/I3 моторных нейронов. Понятно, что степень успеха в выявлении нейронов намного выше, для любого заданного числа нейронов помощью внеклеточных техники.
Обсуждение
У животных с большими определены нейронов, таких как моллюски (например, Lymnaea, Helix, и Aplysia), анализ двигатель бассейны, как правило, осуществляется с помощью внутриклеточной регистрации 1,2,3,4. В этом протоколе, мы опишем процесс для уникальной идентификации моторных нейронов для двигателя бассейна с помощью внеклеточных техники. Мы использовали силу измерений В качестве иллюстрации этого процесса. Можно также использовать для измерения ЭМГ мышц иннервации. Короче говоря, сделать так, протокол должен быть изменен, чтобы прикрепить крючок электроды в различные регионы I1/I3 мышцы для записи EMG.
Внеклеточной метод имеет определенные преимущества по сравнению с внутриклеточной методов, некоторые из которых уже были описаны выше. Во-первых, внеклеточный техника требует меньше времени и усилий, чтобы подготовить ганглиях для экспериментов и вызовет меньше повреждений нейронов. Как правило, это займет 20-30 минут для подготовки BUCкал ганглиях для внеклеточных экспериментов и примерно 1,5 часа для подготовки ротовой ганглиев, которые прикреплены к щечной массы для внутриклеточных экспериментов. Так как мышцы становятся менее активными, как проходит время, разница во времени между ганглиями подготовке к внеклеточной экспериментов и внутриклеточных из них могут иметь решающее значение для успеха эксперимента. 7 показано сравнение процент успеха для выявления двигательных нейронов для I1 / I3 мышцы с использованием внеклеточных или внутриклеточных технику в силу исследованиях. Во всех 35 экспериментах внеклеточной силы (100%), мы были в состоянии идентифицировать по крайней мере один двигательный нейрон для I1/I3 мышцы. В 31 из 35 (89%) внеклеточной экспериментов, мы смогли выявить по меньшей мере три I1/I3 моторных нейронов. В 19 из 35 (54%) внеклеточной эксперименты, мы смогли выделить по крайней мере пять различных I1/I3 моторных нейронов. В противоположность этому, процент успеха внутриклеточных эксперименты с Сэмомэлектронной датчик силы установки были ниже. В 23 из 27 (85%) внутриклеточные экспериментов, мы смогли идентифицировать по крайней мере один I1/I3 двигательного нейрона. В 8 из 27 (30%) внутриклеточные экспериментов, мы смогли выявить по меньшей мере три I1/I3 моторных нейронов. Только 1 из 27 (4%) внутриклеточные экспериментов, мы смогли выделить пять I1/I3 моторных нейронов. Таким образом, вероятность выявления нескольких нейронов в той же ганглий выше при использовании внеклеточных методы, в отличие от внутриклеточного техники.
Кроме того, внеклеточный методика может получить доступ ко многим нейроны с обеих сторон ганглиев в тот же эксперимент. Как правило, после desheathing, внутриклеточные электроды могут получить доступ только к нейронам на стороне ганглия, который был desheathed. Например, когда одна из двух щечной ганглиев (например, hemiganglion слева) закреплен хвостовой стороной вверх, это будет легко для внутриклеточных электродов для доступа к нейронам на чтостороны ганглий, B6, например, B9, B10, B39, B43 и, но трудно получить доступ к нейронам на ростральной части ганглия, таких как B4, B5, B8a, B8b, B38 и B82. В отличие от внеклеточных электродов может получить доступ многих нейронов на обеих сторонах одного и того же щечной ганглий с соответствующим вращением ганглия. Угол поворота регулируется и обратимыми. Это также увеличивает вероятность выявления нескольких нейронов в той же ганглия.
С внеклеточных электродов нежно прижимается к оболочкой, покрывающей нейронов, эти электроды не будут выведены из нейронов, которые могут создавать большие отверстия в мембране и причинить вред, как это происходит с внутриклеточными электродами во время движения мышц. Сигнал размер будет меняться в ганглиях движения во время движения мышц. Обратите внимание, что иногда во время большого движения мышц, внеклеточные сигналы записи сома будет уменьшена или даже потеряны. Тем не менее, мы можем легко моментовве внеклеточной задний электрод на нейрон и восстановить исходный сигнал. Это делает возможным применение внеклеточной техника приостановлено щечной подготовки массы 8 для поведенческих исследований, в ходе которых мышцы генерировать большие сокращения, как подготовка генерирует различные поведенческие реакции. Например, в 47 из 48 приостановлены щечной экспериментах масса (98%), мы были в состоянии идентифицировать по крайней мере один двигательный нейрон для I1/I3 мышцы. В 23 из 48 (48%) приостановлено щечной экспериментов массы, мы смогли выявить по меньшей мере три I1/I3 моторных нейронов. В 11 из 48 (23%) приостановила щечной экспериментов массы, мы смогли выявить по меньшей мере пять моторных нейронов для I1/I3 мышц и запись из них во время двигатель модели как щечной масса выступала питания типа поведения. Внеклеточной техника применима и к другим, более сложным полу-нетронутыми препараты, такие как изолированные голову кормления препараты, которые включают тОн щупальца, губ, челюстей, щечной массы, щечной ганглиев, и церебрального ганглия 12,24,25,26. Так как сенсорные сигналы очень важны для выявления кормления поведения в таких препаратах, внеклеточный техники будет особенно полезна благодаря своей простоте и менее разрушительные возможности. Предыдущие исследования также показывают, что это возможно для выявления и хронически записи B4/B5 в естественных условиях 18. В этих ранних экспериментов, исследователи использовали низкий ток (10-20 мкА) BN2-стимуляции избирательно активируют B4/B5 и клееного короткую трубку полиэтилена в оболочке выше B4/B5 для записи, в которые были вставлены пара витых проволоки из нержавеющей стали. Таким образом, можно также по выявлению и учету от моторных нейронов в естественных помощью электродов полиэтиленовых труб, которые наклеиваются на оболочкой, покрывающей ганглиев (Chestek и Chiel, неопубликованные результаты).
Внеклеточной техники также имеет некоторые limitatионы. Во-первых, это будет трудно для внеклеточных электродов для стимуляции или записывать нейронов, которые слишком малы или слишком глубоко внутри ганглия. Обратите внимание, что все еще можно активировать нейроны, которые находятся не на поверхности с помощью внеклеточной стимуляции. Тем не менее, наша модель 5 показал, что стимуляция может привести к потере специфичности, когда цель нейрона глубже, чем соседние нейроны. Когда нейрон глубже, электрод к сому расстояние будет больше и выше, ток будет необходимо для активации этого нейрона, которая может быть достаточно высокой, чтобы активировать другими нейронами поверхностью поблизости. Во-вторых, если нейрон возбуждается внеклеточно со слишком большой ток, он может быть поврежден и больше не отвечает; намного меньше токи используются в внутриклеточного стимуляции, хотя слишком большой ток внутриклеточно может также повредить нейроны. Иногда сомы запись будет включать в себя несколько блоков как от нейрона цели и соседних нейронов, которые менее специфичен, чем intracellular записи. Кроме того, это может быть трудно точно контролировать и следить за стрельбу частоты отдельных нейронов помощью внеклеточных, а не внутриклеточное технику, потому что внеклеточный электрод не может стимулировать и записывать тот же нейрон одновременно. Кроме того, внеклеточный техника не сможет записать синаптической вход от премоторной нейронов. Кроме того, это может быть трудно применить нейротрансмиттеров iontophoretically на конкретный нейрон, если ганглий desheathed, хотя мы показали, что это возможно, чтобы стимулировать ганглий использованием карбахола без удаления оболочки 27.
Ограничения внеклеточной методы идентификации сделаны некоторые нейроны в бассейне двигателя трудно идентифицировать. В этом конкретном примере, внеклеточный техника надежно идентифицированы большинство моторных нейронов для I1/I3 мышцы в Aplysia: B3, B6, B9, B38, B43, B82 и, основываясь оп сома размера и расположения, нервные проекции, и мышечной иннервации. Тем не менее, мы не смогли надежно идентифицировать B10 и B39. Предыдущая работа внутриклеточных 6,7 показал, что B10 и B39 являются двумя соседними нейронами на хвостовой части щечной ганглиев, между B4/B5 региона и B6 региона. Оба нейронов проект двустороннем на BN2s. B10 иннервирует среднюю и заднюю области I1/I3 мышцы, в то время как B39 иннервирует переднюю область I1/I3 мышцы. На основании расположения сомы и критерии нерва проекции, мы обнаружили более двух моторных нейронов, что проект двустороннем на BN2s в четырех различных экспериментов. С момента своего сома местах, мышечные иннервации, и сроки деятельности в течение двигатель модели были переменных от животного к животному, мы не были уверены, что это были те же нейроны. Таким образом, мы были не в состоянии надежно идентифицировать B10 и B39 помощью внеклеточных техники из-за отсутствия согласованности. Чтобы однозначно идентифицировать их,мы должны сделать более тщательное обследование нейронов в ротовой ганглиев, и могут потребоваться дополнительные критерии, такие как синаптической вход от премоторной нейронов B4/B5, и ответы на передатчики, которые требуют внутриклеточных техники.
С соответствующими изменениями, этот метод также применим к другим бассейны двигателя, например, I5 мышцы 10, I2 мышцы 11, и I4 мышцы 12 в Aplysia или с другими системами, например, прудовика 2, Виноградная улитка 3, таракан 13, и У рыбок данио 14. Например, если человек хочет применить эту технику для моторных нейронов для I5 мышц (также известный как аксессуар радулы ближе мышц или ARC 10,28) в Aplysia, следует иметь BN3s прикреплены к щечной массы вместо BN2s , потому что I5 моторных нейронов B15 и B16 проекта на ипсилатеральной BN3 6,7. Тогда тОн щечной массы должны быть готовы подвергать I5 для мышц EMG или силой исследований. После того, как нейроны были надежно определены в сокращенном подготовки, оптимизированный метод диагностики также могут быть созданы для будущих поведенческих исследований.
Техника мы описали выгодно отличается от других внеклеточных методы, такие как мульти-электрод массивов и напряжения чувствительных красителей. Напряжение чувствительных красителей 29 методика используется только для записи, в то время как наши внеклеточных электродов и мульти-массивы электродов 30 может быть использован как для стимуляции и записи. И многоэлектродной массив 29 и напряжение чувствительных красителей 30 может записывать сигналы от многих нейронов одновременно. Хотя одно внеклеточных электродов может записывать только с одним или двумя нейронами в зависимости от его размера наконечника и электрода места, это, безусловно, можно расположить на нескольких ганглиев одновременно, и мы сделалиэто успешно. Стандарт в пробирке многоэлектродной массива 8 х 8 или 6 х 10 электродов 29. Так как электроды равномерно распределяются в массиве, часто сложно определить личность основных нейронов, из которых получаются записи, так как нейроны распределены не равномерно, а значительная пост-обработки сигналов, некоторые из которых все еще Руководство, должно быть сделано для решения этой двусмысленности. В противоположность этому, потому что внеклеточные электроды расположены по одной somata, личность основных нейронных ясно. Таким образом, кажется, что многоэлектродной массивов и напряжения чувствительных красителей может быть более эффективным для нескольких одновременных записей. Тем не менее, наши внеклеточных электродов техника может обеспечить лучшую избирательность как для стимуляции и записи.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Это исследование было поддержано грантом NS047073 NIH и NSF гранта DMS1010434.
Материалы
| Name | Company | Catalog Number | Comments |
| Имя | Компания | Номер в каталоге | Комментарии |
| Хлористый натрий | Fisher Scientific | S671 | Биологическая, сертифицированный |
| Хлористый калий | Fisher Scientific | P217 | Сертифицированный ACS |
| Гексагидрат Хлорид магния | Acros Organics | 19753 | 99% |
| Гептагидрата Магния сульфат | Fisher Scientific | M63 | Сертифицированный ACS |
| Дигидрата хлорида кальция | Фишер Scientifc | C79 | Сертифицированный ACS |
| Глюкоза (декстроза) | Sigma-Aldrich | G7528 | BioXtra |
| MOPS Buffeг | Acros Organics | 17263 | 99% |
| Карбахола | Acros Organics | 10824 | 99% |
| Едкий натр | Fisher Scientific | SS255 | Сертифицированный |
| Соляная кислота | Fisher Scientific | SA49 | Сертифицированный |
| Одноствольный капиллярные стеклянные | AM системы | 6150 | |
| Flaming-Brown микропипетки съемник модели P-80/PC | Sutter Instruments | Накаливания используется: FT345B | |
| Эмаль покрытием проволоки из нержавеющей стали | Калифорния тонкой проволоки | 0.001D, покрытие ч | |
| Бытовая II силиконовый клей | GE | ||
| Duro быстрого гель суперклея | Henkel Corp. | ||
| AM системы модели 1700 усилителю | AM системы | Настройки фильтра: 10-500 Гц для I2 нерв / мышцу; 300-500 Гц для всех других нервов | |
| Pulsemaster Multi-Channel стимулятор | Инструменты Всемирной Precision | A300 | |
| Стимул изолятор | Инструменты Всемирной Precision | A360 | |
| AxoGraph X | AxoGraph Научные | Программное обеспечение для записи | |
| Золото контактный разъем | Bulgin | SA3148 / 1 | |
| Золотой разъем Sockets | Bulgin | SA3149 / 1 | |
| Sylgard 184 Силиконовый эластомер | Dow Corning | ||
| 100 х 15 мм Crystalizing Dish | Пирекс | ||
| Высокая смазка вакуумная | Dow Corning | ||
| Внесите Советы | Fisher Scientific | 21-375Д | |
| Minutien Pins | Средства изобразительных наук | 26002-10 | |
| Пластилин | Сарджент искусства | 22-4400 | |
| Шепот Воздушный насос | Tetra | 77849 | |
| Аквариум трубы | Eheim | 7783 | 12/16 мм |
| Elite Распылитель | Hagen | A962 | |
| Vannas Весна Ножницы | Средства изобразительных наук | 15000-08 | |
| Дюмон # 5 Fine щипцы | Изобразительное Sciencе Инструменты | 11254-20 | |
| Kimwipes | Kimberly-Clark | 34155 |
Ссылки
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены