Method Article
Extracelularmente Identificar os neurônios motores de um pool do motor muscular em
Neste Artigo
Resumo
Em animais com grandes neurônios identificados ( Por exemplo Moluscos), análise de piscinas do motor é feita usando técnicas intracelulares 1,2,3,4. Recentemente, desenvolveu uma técnica para extracelularmente estimular e registrar neurônios individuais em Aplysia californica 5. Vamos agora descrever um protocolo para usar esta técnica para identificar e caracterizar os neurônios motores dentro de um pool do motor.
Resumo
Em animais com grandes neurónios identificados (por exemplo, os moluscos), análise de pools de motor é feita utilizando técnicas intracelulares 1,2,3,4. Recentemente, desenvolveu uma técnica para extracelularmente estimular e registrar os neurônios individuais em Aplysia californica 5. Vamos agora descrever um protocolo para usar esta técnica para identificar e caracterizar os neurônios motores dentro de um pool do motor.
Esta técnica tem as vantagens extracelular. Em primeiro lugar, os eléctrodos extracelulares pode estimular e registrar os neurónios através da bainha 5, de modo que não necessita de ser removido. Assim, os neurônios será mais saudável em experimentos extracelulares que nas intracelulares. Em segundo lugar, se os gânglios são girados por fixação adequada da bainha, eléctrodos extracelulares pode acessar neurónios em ambos os lados do gânglio, o que torna mais fácil e mais eficiente para identificar neurónios múltiplos na mesma preparação. Em terceiro lugar, extracelularlar eléctrodos não precisam de penetrar nas células e, portanto, pode ser facilmente deslocado para trás e para a frente entre os neurónios, causando menor dano a eles. Isto é especialmente útil quando se tenta gravar neurônios múltiplos durante repetindo padrões motores que só podem persistir por minutos. Em quarto lugar, os eléctrodos extracelulares são mais flexíveis do que os intracelulares durante os movimentos musculares. Eletrodos intracelulares pode tirar e danificar neurônios durante as contrações musculares. Em contraste, uma vez que os eléctrodos extracelulares são suavemente pressionada contra a bainha acima neurónios, que normalmente ficam acima do mesmo neurónio durante as contracções musculares, e assim pode ser usado em preparações mais intactos.
Para identificar os neurônios motores de um pool do motor (em particular, o músculo I1/I3 em Aplysia) através de eletrodos extracelulares, pode-se usar recursos que não requerem medições intracelulares como critérios: soma de tamanho e localização, projeção axonal, e inervação muscular 4, 6,7. Para o conjunto de motor em particular utilizados para ilustrar a técnica, a partir dos nervos bucais gravado 2 e 3 para medir projecções axonais e mediram as forças de contracção do músculo I1/I3 para determinar o padrão de inervação do músculo para os neurónios motores individuais.
Demonstramos o processo completo de primeiro identificação de neurónios motores que utilizam a inervação do músculo, em seguida, caracterizando a sua temporização durante padrões motores, a criação de um método simplificado de diagnóstico para a identificação rápida. O método simplificado e mais rápido para o diagnóstico é superior para as preparações mais intactas, por exemplo, na preparação de massa suspensa bucal 8 ou 9, in vivo. Este processo também pode ser aplicado em conjuntos de motor que, em Aplysia 10,11,12 ou em outros sistemas animais 2,3,13,14.
Protocolo
1. Preparação do prato de gravação
- Durante as experiências de transdutores de força, o gânglio vestibular, gânglio cerebral, e de massa bucal são colocados num prato de Pyrex redonda que é especializado para estudos da força.
- Para induzir ingestivo-como padrões nos experimentos, é preciso aplicar a não-hidrolisável carbacol agonista colinérgico para o gânglio cerebral 15. Para evitar o contacto directo do carbachol para o gânglio vestibular e massa bucal, câmaras separadas são necessários para isolar o gânglio cerebral do gânglio vestibular e a massa bucal (Figura 1).
- Uma vez que a massa bucal é muito mais espessa do que o gânglio vestibular, eles não podem ser colocados no mesmo nível. Portanto, este prato deve ter uma câmara de volta para o gânglio cerebral (zona A na Figura 1), uma plataforma do meio para o gânglio vestibular (C área na Figura 1), e uma câmara muito mais profundo da frente para a massa bucal (zona D, em Figura 1).
- Para criar este prato, comece com uma rodada de 100x15 Pyrex prato (15 mm de altura, 100 mm de diâmetro). Construção do prato vai exigir várias derrama de Sylgard. Siga as instruções fornecidas com o produto Sylgard. Sylgard devem ser autorizados a estabelecer entre derrama diferente.
- A primeira é de fluidez para criar o nível mais elevado de Sylgard no prato (zona B na Figura 1), que é a parede entre a plataforma do meio e traseira da câmara.
- Utilizar dois suportes de argila de modelagem para isolar a área de parede Sylgard (zona B na Figura 1). Cubra os backings de modelagem de argila com filme plástico, onde entrará em contato com o Sylgard para facilitar a remoção. Garantir selos apertados nas bordas, onde entrará em contato com massa de modelar o prato, para minimizar as fugas.
- Despeje Sylgard na porção entre as duas bases de revestimento de argila de modelagem quase até ao topo do prato. Deixe o Sylgard totalmente configurado durante a noite. Mantendo o prato em um lugar quente induziráconfiguração mais rápida. Retire os backings massa de modelar e limpar qualquer resíduo de argila no Sylgard.
- Em seguida, a câmara traseira (área A na Figura 1) e a plataforma do meio (zona C na figura 1) deve ser vazada.
- Colocar um suporte de massa de modelar a cerca de 5 mm de distância da superfície frontal do Sylgard para a secção da plataforma central (área C).
- Despeje Sylgard nas secções para a câmara traseira (área A) e da plataforma central (área C) até uma altura de, aproximadamente, 3-5 mm abaixo do nível superior da primeira parede Sylgard (zona B). A superfície Sylgard da câmara posterior deverá ser ligeiramente mais baixa do que a da plataforma do meio, para evitar fugas a partir da câmara traseira contendo carbacol para a plataforma do meio. Mais uma vez, deixe o Sylgard totalmente configurado durante a noite e, em seguida, retire o apoio massa de modelar.
- A etapa final é cortar um entalhe no meio da parede Sylgard para fornecer um canal para os conectivos cerebral-bucais (CBCs) para irpor entre a plataforma do meio e câmara traseira. A largura desta ranhura deve ser de aproximadamente 3-4 milímetros, que é amplo o suficiente para os CBCs. O fundo do entalhe não deve ser mais baixa do que a superfície da plataforma de Sylgard meio para evitar fugas. Uma lâmina de bisturi pode ser usado para cortar o entalhe.
2. Preparação do eletrodo
- Puxe eletrodos de vidro extracelulares a partir de um único cano capilar de vidro usando um Flaming-Brown micropipeta extrator como descrito por McManus et al. 8 na seção 3.1. Com o filamento FT345B no extrator, nossas definições do programa de calor típicas são 480, Pull 50, velocidade 13, ea Hora 20, mas note que as configurações serão diferentes para filamentos diferentes. Este programa cria os eletrodos em um único puxão sem fase de polimento fogo. O tamanho da ponta do eléctrodo deve ser menor do que o tamanho dos corpos celulares. Para os neurónios motores que variam de 50 um a 400 um de diâmetro do soma, o interior diameters dos eléctrodos de vidro extracelular deve ser de cerca de 40 um e as suas resistências devem ser cerca de 0,1 MQ quando são enchidos com salina Aplysia.
- Puxar eléctrodos de sucção a partir de tubos de polietileno usando um bico de Bunsen. Cortar um pedaço de tubo de polietileno de cerca de 10 cm de comprimento. Segurar o tubo em ambas as extremidades e colocá-lo muito perto da chama gerada pelo queimador de Bunsen durante a rotação do tubo até que se torna macio e do calor. Estique o tubo cuidadosamente ao longo de seu comprimento, enquanto movê-lo para longe da chama. A parte média da tubagem irá alongar e estreitar vez que o tubo é puxado.
- Cortar o tubo ao meio para formar dois eléctrodos de sucção. Eletrodos de sucção são geralmente aplicadas nas extremidades do corte de nervos ou músculos, embora às vezes pode ser aplicada en passant.
- Criar eletrodos gancho para gravações nervosas seguindo o protocolo descrito por McManus et al 8 em seções 3,2-3,13. Estes eletrodos são especialiar útil quando um nervo ou do músculo não é cortado.
3. Anexo Eletrodo de gancho
- Dissecar o animal e remover a massa bucal, seguindo o protocolo descrito em McManus et al. 8 da secção 4.
- Para gravação e estimulação, os eléctrodos de gancho pode ser ligada a um certo número de diferentes nervos.
- Para caracterizar o padrão de como foi feito in vivo por Cullins Chiel e 9, as gravações devem ser obtidos a partir do nervo e do músculo I2 que indica a fase de prolongamento de alimentação 16, o nervo radular (RN), que indica o fecho da pinça de alimentos 17, bucal nervo 2 (BN2) e bucal do nervo 3 (BN3) que indicam a fase de retração 17,18. Ligação dos eléctrodos de gancho segue um procedimento semelhante ao descrito por McManus et al 8, secção 5.
- Os locais destes nervos referem-se ao esquema do aparelho de alimentação mostrado na AplysiaA Figura 2 de McManus et al 8. Note-se que os BN2 trifurcates em ramificações a, b, c e antes de ir para baixo do músculo I1 na ranhura lateral. Ramificar a é o primeiro ramo de separar a partir do tronco principal, e é adjacente ao BN3.
- A nomenclatura dos ramos a, b, c e foi usada por Warman e Chiel 18. Ramos a, b, e c correspondem aos ramos 3, 2 e 1, respectivamente, na nomenclatura utilizada por Nargeot et al. 19. Além disso, a RN, o BN1, o BN2 eo BN3 correspondem aos nervos 1, 6, 5 e 4, respectivamente, na nomenclatura utilizada por Kandel 20 e Scott et al 21.
- Para estudar a inervação do músculo do músculo I1/I3, todos os nervos excepto nervos bucais 2 vai ser cortada a partir da massa bucal durante as experiências. Assim, foi utilizado um eletrodo de gancho para gravar a partir do BN2.
- Uma vez que o nervo I2 e o RN não vai ser ligado à massa bucal, e são muito difíceis de aceder utilizando eléctrodos de gancho, é preferível aplicar os eléctrodos de sucção de gravar a partir deles, em vez. Vamos descrever a aplicação de eletrodos de sucção na seção 7.
- Use um eletrodo de um gancho ou um eletrodo de sucção para gravar a partir do BN3, porque é fácil de acessar usando qualquer tipo de eletrodo. Optamos por utilizar um eletrodo de gancho para as gravações BN3 para minimizar o número de manipuladores para a realização dos eletrodos de sucção, e para economizar espaço para outros manipuladores ou equipamentos.
- Anexar um eletrodo de gancho para um ramo da BN2 (BN2-a) a iniciar-rejeição como padrões durante as experiências. É útil para ligar um eléctrodo adicional ao gancho BN2-a do outro lado, porque alguns neurónios respondem de forma diferente ao ipsilateral vs contralateral BN2-a estimulação.
- Para ajudar a distinguir neurônios com projeções unilaterais contra bilateral,é também útil para ligar os eléctrodos ao gancho BN2 eo BN3 no outro lado do gânglio vestibular.
4. Gânglios e Preparação muscular
- O gânglio vestibular, gânglio cerebral e massa bucal será preparada para as experiências de transdutores de força, em que o gânglio cerebral está ligado ao gânglio vestibular via os CBCs e a massa bucal é presa no gânglio vestibular através dos BN2s somente.
- Depois de prender os eletrodos de gancho, corta um nervo bucal (BN1) e do nervo esôfago (PT) bilateralmente, o corte no ponto de fixação para a massa bucal.
- Puxar o gânglio cerebral para a frente para a mover para fora do caminho do músculo I2. Faça um corte no músculo I2 sobre o saco radular, estender o corte lateralmente e anteriormente em ambos os sentidos, e puxar a aba do músculo I2 frente para expor o nervo radular. Corte os dois ramos do RN e certifique-se que os ramos são longos o suficiente para fixação do eletrodo de sucção.
- Continue o corte I2 num amplo círculo em torno do gânglio vestibular, tomando cuidado para não cortar as BN2s ou os BN3s, até que o gânglio vestibular e a parte anexa do músculo I2 pode ser completamente separada da massa bucal. Corte as BN3s bilaterais no ponto de fixação para a massa bucal, além da fixação do eletrodo gancho.
- Aplique uma fina camada de graxa de vácuo para o entalhe no prato gravação descrita acima que liga a câmara de trás e plataforma do meio, usando uma ponta de pipeta para pegar uma bola de graxa de vácuo e espalhe sobre o entalhe.
- Aplicar uma camada fina de Quick-Gel super-cola ao fundo do vidro da câmara da frente, onde a massa bucal será colocado, em frente da base da plataforma de Sylgard meio.
- Transferir cuidadosamente o gânglio cerebral, gânglios bucal e massa bucal para o prato de gravação (Figura 1) descrito na seção 2, certificando-se de que nenhum dos eletrodos de gancho são puxados, o que poderia danificar os nervos.
- Coloque cuidadosamente a massa bucal em que a cola na câmara frontal do prato de gravação, para assegurar que a sua superfície ventral é colada à parte inferior do prato. Certifique-se de manter os gânglios e eletrodos de tocar a cola. Adicionar Aplysia 8 salina (460 mM NaCl, 10 mM KCl, 22 mM MgCl2, 33 mM de MgSO 4, 10 mM de CaCl2, 10 mM de glucose, 10 mM de MOPS, pH 7,4-7,5) para o prato, o que irá provocar a cola para definir.
- Se o prato deve ser transferida para um outro microscópio para preparar o gânglio bucal para as gravações soma extracelulares, ter muito cuidado com os eletrodos de gancho. Grupo dos eléctrodos de um lado da massa bucal juntos, e também do grupo dos eléctrodos do outro lado da massa de juntas bucal. Cuidadosamente segurar os eletrodos, segurando a fita laboratório que cobre os pinos do conector, novamente certificando-se de que nenhum dos eletrodos são puxados com força.
- Quando o prato está posicionado sob o microscópio, o eléctrodos devem ser cobertas suavemente ao longo dos lados do prato e repousam sobre a plataforma ao lado do prato.
- Durante os intervalos e entre as fases do experimento, arejar a solução salina na câmara de massa bucal utilizando uma pedra porosa aquário.
- Use uma pinça para agarrar a bainha do gânglio cerebral e puxá-lo para trás para dentro da câmara, assegurando que os CBCs executado através do entalhe. Pin do gânglio cerebral utilizando outros nervos do que os CBCs para evitar danos nos CBCs intactas.
- Aplique massa mais vácuo sobre os CBCs e em seguida adicionar mais solução salina Aplysia para ambas as câmaras do prato, de modo que os gânglios são completamente submerso. Certifique-se de que a parte superior da massa de vácuo é um pouco maior do que a parede de modo que não Sylgard vazamento irá ocorrer entre as câmaras.
- Para estabilizar o gânglio vestibular, em primeiro lugar o pino das extremidades dos BN3s, então os BN1s ea ENS sobre a base de Sylgard da plataforma central (Figura 2). Desde os BN3s será gravada usando o eletrodo de ganchos, os pinos devem ser colocados mais distalmente do que os pontos de fixação dos eléctrodos de gancho.
- Usar dois pinos, dobrados a 90 graus, como ganchos para esticar e ancorar os CBCs, de modo que os CBCs não será danificado (Figura 2).
- Imobilizar os ramos RN entre a câmara volta e os gânglios bucal. Em seguida, o músculo I2 estará no topo do RNs. Para expor o nervo I2, utilize uma pinça para agarrar o músculo I2 e puxe-o sobre o gânglio bucal. Pin dois cantos do músculo I2 para evitar dano ao nervo I2.
- Cortar o nervo I2 distal ao ponto em que os seus ramos dois fundir no músculo I2. Certifique-se o músculo é inervado ainda para ser comparável à de gravações in vivo. Corte o resto do músculo I2 e virar o nervo I2 para trás e fixá-lo entre os dois ramos do RN (ver Figura 2, inserção).
- Ajustar as posições dos pinos de esticar e adicionar a tensão, se um nervo é muito solto, ou para libertar a tensão, se a nerve é muito apertado. Para estabilizar ainda mais o gânglio bucal, adicionar mais pinos na bainha entre os nervos.
- Uma vez que o gânglio vestibular são colocados lado caudal para cima, girar o gânglio vestibular se os neurónios são de interesse no lado rostral. Para girar um dos gânglios dois bucal, use uma pinça fina para pegar algumas bainha excesso da CBC, onde ele está próximo para os gânglios bucal e fixá-lo entre o BN2 eo BN3. Em alguns gânglios, pode ser mais conveniente para fixá-lo entre CBC e BN3.
- Adicionar um pino adicional sobre a bainha do gânglio vestibular, no lado próximo da câmara anterior para minimizar o movimento do gânglio vestibular.
- Para cortar a bainha que cobre a gânglios bucal, use uma pinça fina para pegar a bainha no lado próximo à câmara de trás, e então cortar a bainha excesso com tesoura fina, sem expor os corpos celulares. A fim de minimizar os danos, apenas remover uma quantidade mínima de revestimento necessária para ver os corpos celulares.
- Depois de tele bainha dos gânglios bucal é aparado, puxe o nervo I2 e enfermeiros sobre os gânglios bucal e fixá-los para baixo entre os gânglios bucal e câmara frontal para continuar a rodar o gânglio bucal. (Ver Figura 2).
- Para lavar qualquer cloreto de magnésio remanescente 8 que foi utilizada para anestesiar os animais antes da dissecação, substituir a solução salina Aplysia no prato com soro fisiológico Aplysia fresco.
5. Eletricamente Conexão Eletrodos gancho
- Após o músculo e gânglios são preparados, transferir cuidadosamente o prato para a mesa de isolamento de vibrações para os experimentos.
- Anexar todos os pinos de eletrodos para suas bases nos cabos BNC que conectam aos amplificadores (AM Sistemas amplificador modelo 1700). Mais uma vez, certifique-se de que os eletrodos não são puxados com força ao fazer isto. Certifique-se de que os eletrodos estão corretamente ligados aos seus cabos apropriados e que as polaridades estão corretas.
6. Configuração dos eletrodos de vidro extracelulares para gravações de Soma
- Encher o eléctrodo com Aplysia salina utilizando uma seringa ligada a um pedaço de tubo de polietileno de cerca de 15-20 cm. Prender a extremidade livre do tubo de polietileno para a extremidade do eléctrodo de vidro. Puxar para trás o êmbolo da seringa para encher o eléctrodo com Aplysia salina.
- Coloque o eletrodo de vidro cheia extracelular no entalhe do titular do manipulador. Use o manipulador para colocar a ponta do eletrodo na solução salina contendo Aplysia gânglios bucal.
- Inserir um fio de prata / cloreto de prata soldada a um pino macho ouro conector para o eléctrodo para servir de fio de gravação. Coloque um outro fio de prata / cloreto de prata soldada a um pino macho ouro conector directamente na solução salina Aplysia dentro da secção do prato de gravação contendo o gânglio vestibular para agir como o fio de referência. Conectar tanto ªe gravação e fios de referência para o cabo que liga BNC para o amplificador.
- Se há espaço suficiente para manipuladores mais, eléctrodos de vidro adicionais extracelulares podem ser adicionados para gravar simultaneamente vários neurónios.
7. Configuração dos eletrodos de sucção para as gravações nervosas
- Aparar a extremidade mais estreita da ponta do eléctrodo de sucção para coincidir com o diâmetro do nervo. O diâmetro interior da ponta do eléctrodo deve ser similar ou ligeiramente menor do que o diâmetro do nervo, para assegurar sucção apertado.
- Uma vez que o nervo I2 e RN são muito próximos uns dos outros, os seus eléctrodos pode ser realizada pelo mesmo manipulador para poupar espaço. Coloque dois eletrodos em dois pontos do mesmo titular. Gire os dois eletrodos e assegurar que suas dicas são perto de um outro. Escolher um deles para a gravação do nervo I2, o outro para a gravação RN.
- Coloque a ponta do eletrodo na solução salina Aplysia dentro do recording prato contendo o gânglio vestibular. Prender a extremidade livre do tubo de polietileno na seringa para o eléctrodo de sucção. Use a seringa para encher o eletrodo com Aplysia salina. Mover a ponta do eléctrodo próximo da extremidade do nervo alvo, ou seja, o nervo I2, e utilizar a seringa para aspirar o nervo para o eléctrodo. O comprimento do nervo no interior do eléctrodo deve ser de cerca de 0,5-1,0 mm para garantir uma vedação estanque.
- Repita a sucção para o eléctrodo que vai ser ligada ao RN.
- Conectar os eletrodos para os cabos correspondentes BNC como descrito na seção 6.3.
8. Configurando o transdutor de força para medir a contração muscular I1/I3
- Para fixar os transdutores de força para o músculo, use fio de seda. Dobre a agulha curva de cada sutura, e amarre o fio de sutura para o transdutor de força. Agarrar e levantar suavemente uma pequena quantidade de músculo com uma pinça e, segurando a agulha no outro conjunto de pinças, inserira agulha através do músculo até o ponto em que a agulha dobrada (Figura 1).
- Os transdutores podem ser anexados ou dorsalmente ou lateralmente sobre o músculo I1/I3. Fixação dorsal permite a medição das contrações evocadas pela ativação de ambos os lados esquerdo ou direito do músculo. Fixação lateral irá mostrar forças mais fortes para a maioria dos neurónios, mas só irá permitir a medição da contracção do lado para o qual o transdutor está ligado.
- Para ajudar a identificar neurônios que podem ativar regiões anterior, posterior, ou ambos de I1/I3, anexar um transdutor de força para a parte posterior do músculo, apenas anterior ao tecido da faringe, e anexar um outro transdutor de força para a parte anterior do muscular, as maxilas (Figura 1; ganchos de notas).
- Levante os transdutores de força até que as suturas são esticadas, mas não exagerado. Para verificar isso, ver a medida do transdutor de força quando a sutura tem alguma folga na it, em seguida, levante o transdutor até que a medida é um pouco acima deste nível de base.
9. Identificar neurônios motores dentro de uma piscina Motor
- Este protocolo descreve um processo para a identificação de neurónios motores extracelularmente dentro de um pool de motor. Nós usamos software AxoGraph para monitorar a atividade de neurônios individuais, os nervos múltiplos, eo músculo (EMG sinal ou forças de contração). Neste protocolo, usamos as forças de contração do músculo como uma ilustração para o processo de identificação de neurônios motores, em outros experimentos, utilizamos EMG bem, ea instalação de tais experiências é muito semelhante (ver Discussão).
- Para localizar um neurónio candidato, usar o manipulador para premir suavemente a ponta do eléctrodo de vidro extracelular para baixo sobre a bainha ao longo do centro do soma neuronal 5 (Figura 3), que é o melhor local para a estimulação e de selectividade de gravação 5. Uma vez que a corrente de limiar fou a activação de um neurónio aumenta linearmente com o eléctrodo-a-soma distância 5, a estimulação da selectividade irá tornar-se pior quando o eléctrodo é deslocado para longe do centro do neurónio-alvo para um neurónio vizinho.
- Para identificar um neurônio motor, primeiro estimular diretamente o neurônio usando o eletrodo de vidro extracelular para garantir que apenas este neurônio está disparando, e analisará a inerva o músculo. Então, extracelularmente registro deste neurônio para estabelecer um um-para-um entre a gravação soma extracelular e as gravações nervosas, o que também é fundamental para a identificação dos neurônios.
- Uma vez que a maioria dos amplificadores extracelulares não permitem a estimulação simultânea e gravação de um canal, definir o canal utilizado para estimular e registrar a soma (o canal de soma) para o modo de estimulação e aplicar uma breve corrente anódica (por exemplo, 6 mseg para Aplysia neurónios 5) para o soma (Figuras 4A, 5A; setas nota 1 in ambas as figuras), a partir de uma corrente baixa (por exemplo, 200 mA), e, gradualmente, aumentar a corrente até ao rebentamento de neurónios.
- Uma vez que o neurônio é ativado para explodir, deve-se imediatamente mudar de canal soma do modo de estimulação para o modo de gravação (Figuras 4A, 5A; setas nota 2 em ambas as figuras). No entanto, ainda haverá atrasos entre a estimulação soma e gravação por causa de atrasos na resposta humana.
- Se os fogos de neurónios de uma quantidade razoável de tempo, deve ser possível observar um-para-um dos potenciais de acção correspondentes a partir da gravação de soma e no nervo (s) através dos quais os projectos de neurónios (Figuras 4B, 5B, linhas tracejadas nota ), bem como as forças geradas quando o neurónio (Figuras 4A, 5A; caixas de nota azuis). Se o disparo neuronal pára antes da gravação soma começa, aumentar a corrente para o activar por um longo tempo.
- A razão sinal-para-ruído da extracelulargravações depende da localização e tamanho do eletrodo soma. A gravação extracelular vai se tornar maior que o aumento do tamanho soma e diminui-eletrodo a soma distância. Uma vez que o ruído varia apenas numa faixa estreita, a relação sinal-para-ruído também irá aumentar com o aumento do tamanho do soma e da distância do eléctrodo-a-soma diminui. A gama mais comum da razão sinal-para-ruído é de 4:1 a 8:1.
- Os neurônios motores podem ser identificados com base em suas características, tais como soma localização, a projeção do nervo e inervação do músculo 4,6,7. Uma vez que apenas as duas BN2s estão ligados à massa bucal, através da monitorização da actividade sobre os BN2s, pode-se assegurar que a força de contracção do músculo é apenas causada pelo neurónio activada pela estimulação extracelular.
- Por exemplo, B3 é um neurónio motor grande para o músculo I1/I3 (300-400 um de diâmetro soma em animais pesando 200-350 gramas), localizado no lado rostral do gânglio vestibular (Figura 3 ). Ele só projetos através do BN2 ipsilateral e inerva ambas as partes anterior e posterior do músculo I1/I3. Na maioria das vezes, a activação gera um maior do que a força anterior posterior (8 de 9 experiências).
- Depois de um neurónio é identificado, a sua actividade pode ser gravado em diferentes comportamentos semelhantes a alimentação através do eléctrodo de vidro extracelular (Figuras 4 e 5), que pode ser atingida, como descrito abaixo. A gravação extracelular sobre a soma será muito mais específica do que as gravações nervosas, que incluem a actividade de muitos neurónios diferentes.
- Para induzir programas egestive-como motor, estimular BN2-um com 1-2 min de pulsos de 19 (2 Hz, cada impulso é 1 mseg). Esta estimulação confiável gera padrões egestive neste cenário. Com corrente suficiente (por exemplo, 300 mA), os padrões podem persistir durante a duração do estímulo. Às vezes, haverá mais um padrão que ocorre logo após aa estimulação termina.
- Para induzir programas ingestivo-como motor, colocar alguns cristais de carbacol sólida directamente na bainha do gânglio cerebral 15. Se se quer controlar o nível de exposição ao carbacol, usar uma solução de 1 a 10 mM de carbacol em Aplysia salina. Concentrações mais elevadas são mais propensos a induzir respostas. Padrões repetitivos geralmente começam dentro de cinco minutos, e pode durar cerca de dez a quinze minutos antes de começar a descer.
- Após lavagem várias vezes carbacol e esperando pelo menos 30 minutos, a aplicação subsequente de carbacol pode ser adicionado ao gânglio cerebral para induzir padrões mais ingestivo tipo de motor.
- Depois de neurónios motores múltiplos para o pool do motor particular, têm sido identificadas e caracterizadas durante programas motores, pode-se desenvolver um método de diagnóstico muito simplificada que requer o mínimo de informação para identificar rapidamente essas neurónios no futuro trabalho (Figura 6 </ Strong>), por exemplo, nas preparações de massas suspensas bucais ou in vivo. Os critérios podem incluir tamanho soma e localização, a projeção do nervo, o tamanho da unidade sobre os nervos, e tempo de atividade durante padrões motores.
Resultados
As Figuras 4 e 5 mostram os resultados típicos usados para identificar duas I1/I3 neurónios motores. Figura 4 mostra os registos soma de um grande motor neuron, B3, durante egestive padrões semelhantes e ingestivo-like (Figuras 4C, 4D). A um-para-um picos correspondentes do canal soma e do canal BN2 ipsilateral (Figura 4E), mostram que a especificidade do B3 gravação soma foi mantida durante padrões. B3 dispara durante a fase de retração do meio-de-final dos padrões. A partir da Figura 4, e outros resultados (não apresentados), observou-se que a unidade de BN2 B3 é sempre maior do BN2 unidade. Assim, ele pode também ser detectada directamente a partir BN2 gravações.
A Figura 5 mostra as gravações soma de um neurónio pequeno, B43, durante egestive padrões semelhantes e ingestivo-like (Figuras 5C, 5D). A um-para-um picos correspondentes no canal de somae o canal BN2 ipsilateral (Figura 5E) também mostram que a especificidade de gravação soma B43 foi mantida durante padrões. Neuron B43 rajadas no final da fase de retracção durante a padrões. Uma vez que a unidade BN2 de B43 é pequeno, seria difícil identificá-la a partir dos BN2 gravações sem a gravação de soma, no entanto, porque ele dispara mais intensamente na extremidade do padrão motor BN2, o fim da rajada B43 pode ainda ser identificada BN2 de gravações sozinho.
A Figura 6 mostra uma árvore optimizado diagnóstico que não requer a inervação do músculo como um critério, o que o torna muito mais fácil de identificar as extracelularmente I1/I3 neurónios motores na preparação de massa suspensa bucal ou in vivo. A árvore de diagnóstico foi desenvolvido, no entanto, através da utilização de medidas de força e de EMG, e, assim, ilustra o modo como as técnicas neste protocolo simplificado pode conduzir a motor neuron identificação.

Figura 1. Esquemática de configuração global e o prato para os estudos de força. A imagem de cima mostra uma vista de cima. A imagem inferior mostra uma vista lateral (correspondente à linha a tracejado no meio de uma vista de topo). O gânglio cerebral é preso ao Sylgard na câmara traseira (área A). Os gânglios bucal são fixadas para Sylgard na plataforma do meio (área C). A câmara de trás e plataforma do meio são separadas por uma parede elevada Sylgard (zona B). Os conectivos cerebral-vestibular (CBCS) passar por uma fenda na parede Sylgard, selado com graxa de vácuo. A massa bucal é colada à parte inferior da câmara de vidro dianteira (área D). Os nervos bucais 2 (BN2s) estão ligados à massa bucal. Dois ganchos ligados a sutura de seda são inseridos nas regiões anterior e posterior do músculo I1/I3. Tele suturas de seda são, então, ligado ao transdutor de força. A figura usa cinzento escuro, cinzento claro, e branco para indicar as superfícies das zonas A, B, C, e D. Quanto mais escura a cor, maior a superfície correspondente. A figura usa a, b, c, e d para indicar as dimensões importantes do prato. Comprimento a é 3-4 mm, a largura do entalhe, que liga a câmara de trás e plataforma do meio. B comprimento é de cerca de 3-5 mm, a diferença de altura entre as superfícies da plataforma central (área C) e a parede Sylgard (zona B). C comprimento indica o comprimento do entalhe, que é de cerca de 5 mm. Comprimento d mostra a largura da plataforma central (área C), que é de cerca de 5 mm.

Figura 2. Esquema do gânglio vestibulare eletrodos de configuração. A figura mostra a localização dos nervos principais, incluindo nervos vestibulares 1, 2 e 3 (BN1, BN2 e BN3), o nervo esôfago (PT), o nervo radular (RN), o nervo eo músculo I2 , eo conjuntivo cerebral bucal (CBC). Note-se que os BN2s estão ligados à massa bucal (ver Figura 1). Os CBCs são anexados ao gânglio cerebral, passando através do entalhe da parede Sylgard e são selados com graxa de vácuo (ver Figura 1). O RN e do nervo e músculo I2 são puxados acima dos gânglios e preso proximal à massa bucal (direção frontal). As linhas azuis indicam a localização dos pinos. Dois pinos dobrados (linhas vermelhas rotulado 1) são utilizados para ancorar os CBCs. Note-se que a aba da bainha do CBC no lado esquerdo é dobrado e preso entre BN2 e BN3 para girar o gânglio vestibular esquerda (linha vermelha marcada 2). Em alguns gânglios, pode ser mais conveniente para fixar a bainha para baixo entre CBC e BN3. Um pino adicional é adicionado to o lado do gânglio e proximal do PT (linha vermelha marcada 3) para uma rotação adicional e estabilização. O eléctrodo de vidro extracelular é colocada por cima da bainha acima da soma para a estimulação extracelular e gravação. Os eléctrodos de gancho estão ligados às BN3s e os pinos que prendem os nervos no lugar deve ser colocado mais distalmente do que os pontos de fixação destes eléctrodos de gancho. Dois eletrodos de sucção estão ligados ao RN e do nervo e músculo I2 (ver inset para uma visão mais clara do nervo e músculo I2). Clique aqui para ver maior figura .

Figura 3. A imagem e esquema do mapa neuronal para a identificação extracelular do motor I1/I3neurônios do gânglio vestibular. Aplysia A imagem de cima mostra um gânglio lado direito bucal, preso lado caudal-se. Para girar o gânglio vestibular, o RN e o nervo I2 / músculo são puxados por cima do gânglio vestibular e preso ao lado proximal da PT. A aba da bainha de CBC também é dobrado e fixado para rotação (ver Figura 2), de modo que os neurónios no lado rostral ou na fronteira caudal / rostral pode ser visto. O esquema de fundo é desenhado com base na imagem de cima. A figura esquemática e em conjunto indicam os locais do motor I1/I3 neurónios B3, B6, B9, B10, B38, B39, B43 e B82 22,23 6,7, bem como alguns outros neurónios. Neurónios B8a e B8B são responsáveis pela maior unidade na RN, e inervam o músculo I4 controlar a pinça 6,17. Neurónios B4 e B5 são responsáveis pela maior unidade no BN3 18. Embora os tamanhos e os locais dos I1/I3 neurônios motores são variáveis de animais to animal, os tamanhos relativos e locais são bastante confiável para a maioria dos neurônios: B3, B6, B9, B38, B43, B82 e. Veja a discussão para mais detalhes sobre os I1/I3 neurônios motores, especialmente algumas das dificuldades de identificação exclusiva de B10 e B39.
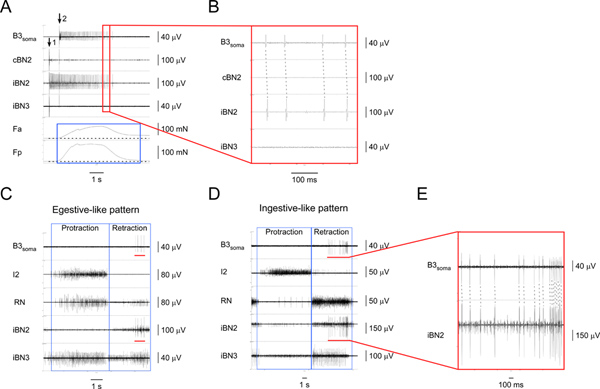
Figura 4. Identificar e caracterizar a I1/I3 motor neuron B3. A estimulação) Extracelular de B3 (a seta 1) e de gravação a partir da soma B3 (a partir de seta 2), bem como a partir dos nervos correspondentes e regiões musculares. De cima para baixo, os canais são gravações da soma B3, o BN2 contralateral, o BN2 ipsilateral, o BN3 ipsilateral, a força de contracção da região anterior do músculo I1/I3, e a força de contracção da região posterior do I1/I3 muscular. Ocaixa azul destaca a duração de forças nas regiões anterior e posterior do músculo I1/I3. Neste caso particular, a força posterior é maior do que a força anterior. B) vista expandida da área delineada pela caixa vermelha em A1. A um-para-um potencial de ação correspondentes na soma B3 e os iBN2 canais mostram que os projetos B3 apenas no BN2 ipsilateral. Gravação C) Extracelular do soma B3 e os nervos em um padrão motor egestive-like. D) A gravação de Extracelular a soma B3 e os nervos em um padrão motor ingestivo-like. Em C e D, a partir de cima para baixo, os canais são gravações da soma B3, o nervo I2, o RN, o BN2 ipsilateral, eo BN3 ipsilateral. As caixas azuis indicam o prolongamento e fases de retração dos padrões. As barras vermelhas no canal B3 soma em C e D destacar o pote açãoentials gravado a partir da soma B3. As barras vermelhas no canal iBN2 em C e D indicam o tempo correspondente, quando está a disparar B3 no BN2 ipsilateral durante os padrões motores que alimentam. E) vista expandida do soma B3 e os canais iBN2 marcadas pelas barras vermelhas. As linhas tracejadas mostram o um-para-um entre os potenciais de ação no soma B3 e os iBN2 canais. Note-se que a unidade de BN2 B3 é a maior de todas as unidades. Assim, podemos também detectar as unidades de BN2 B3 diretamente dos BN2 gravações sem gravações Soma. Clique aqui para ver maior figura .

Figura 5. Identificação ecaracterizando a I1/I3 neurónio motor, B43. A estimulação) Extracelular de B43 (a seta 1) e de gravação a partir da sua soma (a partir de seta 2), bem como a partir dos nervos correspondentes e regiões musculares. De cima para baixo, os canais são gravações da soma B43, o BN2 contralateral, o BN2 ipsilateral, o BN3 ipsilateral, a força de contracção da região anterior do músculo I1/I3, e a força de contracção da região posterior do I1/I3 muscular. A caixa azul destaca as medidas de força do músculo I1/I3 durante B43 atividade. Ativando B43 gera uma pequena força posterior, mas nenhuma força anterior. B) visão expandida da área delineada pela caixa vermelha em um. As linhas tracejadas mostram o um-para-um entre os potenciais de ação no soma B43 e os iBN2 canais, o que indica que a gravação B43 projectos no BN2 ipsilateral apenas. C) Extracelulara partir da soma B43 e os nervos em um padrão motor egestive-like. D) extracelular gravação do soma B43 e os nervos em um padrão motor ingestivo-like. Em C e D, de cima para baixo, os canais são gravações da soma B43, o nervo I2, o RN, o BN2 ipsilateral, eo BN3 ipsilateral. As caixas azuis indicam o prolongamento e fases de retração dos padrões. As barras vermelhas no canal soma B43 em C e D destacar os potenciais de ação registrados da soma B43. As barras vermelhas no canal iBN2 em C e D indicam o tempo correspondente ao B43 está disparando na BN2 ipsilateral nesses padrões. E) visão expandida da soma B43 e os iBN2 canais marcados pela barra vermelha no D. As linhas tracejadas mostram a relação de um para um entre os potenciais de ação na soma B43 e os iBN2 canais. Note-se que as unidades de BN2 B43 são pequenos e muito difíceis de detectar sem gravações soma, mas o fogo de forma consistente, no final do programa motor BN2, proporcionando uma outra forma a identificá-los. Note também que a maior unidade mostrado no painel inferior em E é uma colisão de uma unidade soma B43 com outra unidade extracelular. Clique aqui para ver maior figura .

Figura 6. A árvore otimizado de diagnóstico para identificação de alguns dos I1/I3 neurônios motores usando soma extracelular e gravações nervosas. Este método de diagnóstico requer o mínimo de informação para identificar os I1/I3 neurônios motores, o que torna muito mais fácil a identificaçãofy neurónios motores na preparação de massa suspensa bucal ou in vivo. B3 tem o maior BN2 unidade entre os identificados I1/I3 neurônios motores. No resto dos neurônios motores, B6 e B9 são os únicos dois neurônios que projetam em ambos BN2 e BN3. B9 é mais lateral do que B6. O resto dos neurónios projectam apenas em BN2 também podem ser divididos em dois grupos. Um grupo de projectos bilateralmente neurónios através dos BN2s, que inclui B10 e B39 e alguns neurónios desconhecidos. O outro grupo de neurónios projecta ipsilateralmente em BN2 única, que inclui B38, B43, e B82. B38 está próximo B3 e B9. B82 está próximo B8 (ver Figura 3). B43 está próximo B6. Sua unidade BN2 é pequeno e rajadas no final de padrões de alimentação.

Figura 7. Comparação de taxas de sucesso de neurônio iDENTIFICAÇÃO durante as experiências de força, usando qualquer técnica extracelular ou intracelular da técnica. Com a mesma configuração transdutor de força, que fez 35 experiências utilizando a técnica de extra-celular (pequenos pontos azuis) e de 27 experiências com a técnica convencional intracelular (grandes pontos roxos) para identificar o I1/I3 neurônios motores. O eixo dos x indica o menor número de neurónios motores para o músculo I1/I3 que foram identificados em cada tipo de experiência. O eixo dos y indica a percentagem de sucesso de cada tipo de experiência. Por exemplo, em 19 dos 35 (54%) dos experimentos extracelulares, pudemos identificar pelo menos cinco diferentes I1/I3 neurónios motores. Em apenas 1 de 27 (4%) dos experimentos intracelulares, fomos capazes de identificar pelo menos cinco I1/I3 neurónios motores. É evidente que a taxa de sucesso na identificação de neurónios é muito mais elevada para um determinado número de neurónios que utilizam a técnica de extra-celular.
Discussão
Em animais com grandes neurónios identificados, tais como moluscos (por exemplo, Lymnaea, Helix e Aplysia), análise de piscinas do motor é geralmente feita usando gravação intracelular 1,2,3,4. Neste protocolo, descrevemos um processo para identificar individualmente os neurônios motores de um pool do motor utilizando uma técnica extracelular. Usamos as medidas de força como uma ilustração desse processo. Pode-se também usar EMG para medir inervações musculares. Resumidamente, para fazer isso, o protocolo deve ser modificado para prender os eléctrodos de gancho para diferentes regiões do músculo I1/I3 para registos EMG.
A técnica extracelular tem certas vantagens sobre as técnicas intracelulares, alguns dos quais já foram descritas acima. Em primeiro lugar, a técnica extracelular requer menos tempo e esforço para preparar núcleos de experiências e irá causar menos danos para os neurónios. Geralmente, serão necessários 20-30 minutos para preparar a bucgânglios cal para experiências extracelulares e cerca de 1,5 horas para preparar o gânglio vestibular, que estão ligados à massa bucal para experiências intracelulares. Desde músculos vão se tornar menos ativos como o tempo passa, a diferença de tempo entre os preparativos para experiências gânglios extracelulares e entes intracelulares pode ser fundamental para o sucesso de experimentos. Figura 7 mostra a comparação das taxas de sucesso para identificar os neurônios motores para a / I1 I3 músculo usando a técnica extracelular ou intracelular em estudos de força. Em todos os 35 experimentos força extracelulares (100%), fomos capazes de identificar pelo menos um neurônio motor para o músculo I1/I3. Em 31 dos 35 (89%) experimentos extracelulares, fomos capazes de identificar pelo menos três I1/I3 neurônios motores. Em 19 dos 35 (54%) experimentos extracelulares, pudemos identificar pelo menos cinco diferentes I1/I3 neurônios motores. Em contraste, as taxas de sucesso das experiências intracelulares com o same configuração de transdutor de força foram menores. Em 23 dos 27 (85%) experimentos intracelulares, fomos capazes de identificar pelo menos um I1/I3 neurônio motor. Em 8 dos 27 (30%) experimentos intracelulares, fomos capazes de identificar pelo menos três I1/I3 neurônios motores. Em apenas um dos 27 (4%) experimentos intracelulares, fomos capazes de identificar cinco I1/I3 neurônios motores. Assim, a probabilidade de identificação de neurónios do gânglio múltiplas mesma é mais elevada utilizando técnicas extracelulares, em contraste com as técnicas intracelulares.
Além disso, a técnica extracelular pode acessar muitos neurónios dos dois lados do gânglio durante o mesmo experimento. Normalmente, depois de desheathing, eléctrodos intracelulares pode acessar apenas os neurónios no lado do gânglio que foi desheathed. Por exemplo, quando um dos dois núcleos da bucal (por exemplo, o hemiganglion do lado esquerdo) é fixado do lado caudal acima, será fácil para os eléctrodos intracelulares para aceder aos neurónios em quelado do gânglio, por exemplo B6, B9, B10, B39, e B43, mas difícil de aceder aos neurónios do lado rostral do gânglio, como B4, B5, B8a, B8B, B38 e B82. Em contraste, os eléctrodos extracelulares pode acessar muitos neurónios de ambos os lados do gânglio vestibular mesmo com a rotação apropriada do gânglio. O grau de rotação é ajustável e reversível. Isso também aumenta a probabilidade de identificar múltiplas neurónios do gânglio mesmo.
Uma vez que os eléctrodos extracelulares são suavemente pressionada contra a bainha que cobre os neurónios, estes eléctrodos não serão puxados para fora dos neurónios, o que pode criar grandes orifícios na membrana e provocar danos, como ocorre com os eléctrodos intracelulares durante os movimentos musculares. O tamanho do sinal variará conforme o movimento gânglios durante os movimentos musculares. Note-se que, por vezes, durante os movimentos musculares grandes, os sinais de gravação extracelulares soma será diminuída ou até mesmo perdido. No entanto, podemos facilmente move a volta eletrodo extracelular para o neurônio e recuperar os sinais originais. Isto faz com que seja possível aplicar a técnica extracelular para a preparação de massa suspensa bucal 8, para estudos de comportamento, durante a qual as contracções dos músculos geram grandes como a preparação gera diferentes respostas comportamentais. Por exemplo, em 47 de 48 experiências de massas suspensas bucais (98%), que foram capazes de identificar pelo menos um neurónio motor para o músculo I1/I3. Em 23 dos 48 (48%) suspensos experimentos massa bucais, fomos capazes de identificar pelo menos três I1/I3 neurônios motores. Em 11 dos 48 (23%) suspensos experimentos massa bucais, fomos capazes de identificar pelo menos cinco neurônios motores para o músculo I1/I3 e registro deles durante padrões motores como a massa bucal estava realizando-alimentação como comportamentos. A técnica de extra-celular é também aplicável a outras mais complicadas preparações semi-intactas, tais como as preparações isoladas de cabeça de alimentação que incluem tele tentáculos, lábios, mandíbula, massa bucal, gânglios bucal e, gânglio cerebral 12,24,25,26. Uma vez que a entrada sensorial é muito importante para induzir comportamentos alimentares em tais preparações, a técnica extracelular será particularmente útil devido à sua simplicidade e características menos prejudiciais. Estudos anteriores também mostram que é possível identificar e cronicamente gravar B4/B5 in vivo 18. Nestas experiências anteriores, os investigadores utilizaram corrente baixa (10-20 mA) BN2-a estimulação para activar selectivamente B4/B5 e colados um tubo de polietileno para a bainha curta acima B4/B5 para a gravação, no qual foi inserido um par de torcidos fios de aço inoxidável. Assim, também é possível identificar e gravar a partir de neurónios motores in vivo, usando o eléctrodo de tubo de polietileno que é colada sobre a bainha que cobre os gânglios (Chestek e Chiel, resultados não publicados).
A técnica também tem alguns extracelular limitatiões. Em primeiro lugar, será difícil para eléctrodos extracelulares para estimular ou gravar os neurónios que são demasiado pequenas ou demasiado profundamente dentro do gânglio. Note-se que ainda é possível ativar neurônios que não estão na superfície através da estimulação extracelular. No entanto, o nosso modelo de 5 mostrou que a estimulação pode perder especificidade quando o neurônio alvo é mais profundo do que os neurônios vizinhos. Quando o neurónio é mais profunda, a distância do eléctrodo-a-soma será maior e corrente mais alta será necessária para activar este neurónio, que pode ser elevada o suficiente para activar os neurónios de outra superfície próxima. Em segundo lugar, se um neurónio é estimulado extracelularmente com demasiada corrente, pode ser danificada e deixar de responder; correntes muito menores são usados na estimulação intracelular, embora muito actual intracelularmente também pode danificar os neurónios. Por vezes, a soma de gravação inclui unidades múltiplas, tanto do alvo neurónio e neurónios adjacentes, o que é menos do que intracelular específicogravação intracelular. Além disso, pode ser mais difícil de controlar com precisão e controlar a frequência de disparo do neurónio de um indivíduo que utiliza o extracelular em vez da técnica intracelular, porque o eléctrodo de extracelular não pode estimular e registrar o mesmo neurónio simultaneamente. Além disso, a técnica de extracelular não vai ser capaz de gravar a entrada sináptica dos neurónios pré-motoras. Além disso, poderá ser difícil de aplicar neurotransmissores iontoforeticamente para um neurónio particular, a menos que o gânglio é desheathed, embora tenhamos mostrado que é possível estimular uma gânglio usando carbacol sem remover a bainha 27.
As limitações das técnicas de identificação extracelulares feitos alguns neurónios no conjunto do motor difíceis de identificar. Neste exemplo em particular, a técnica mais extracelular fiabilidade da identificação dos neurónios motores do músculo I1/I3 em Aplysia: B3, B6, B9, B38, B43, e B82, com base on tamanho soma e localização, a projeção do nervo, e inervação muscular. No entanto, não foram capazes de identificar com segurança B10 e B39. Intracelular trabalho anterior mostrou que 6,7 B10 e B39 são dois neurônios adjacentes no lado caudal dos gânglios vestibular, entre a região e a região B4/B5 B6. Ambos os neurónios projectar bilateralmente para as BN2s. B10 inerva a região média e posterior do músculo I1/I3, enquanto B39 inerva a região anterior do músculo I1/I3. Com base na localização soma e critérios de projeção nervosas, encontramos mais de dois neurônios motores que projeto bilateral para os BN2s em quatro diferentes experimentos. Desde seus locais de Soma, inervações musculares, e tempo de atividade durante padrões motores foram variável de animal para animal, não tinham certeza se eles eram os mesmos neurônios. Assim, não foram capazes de identificar com segurança as B10 e B39 com a técnica extracelular, devido à falta de consistência. Exclusivamente para identificá-los,nós precisamos fazer uma pesquisa mais aprofundada dos neurônios do gânglio vestibular, e pode precisar de critérios adicionais, tais como a entrada sináptica de neurônios pré-motor B4/B5, e as respostas aos transmissores, que exigem técnicas intracelulares.
Com modificações apropriadas, esta técnica é também aplicável para outros grupos de motor, por exemplo, o músculo I5 10, o músculo I2 11, e o músculo I4 12 em Aplysia ou a outros sistemas, por exemplo, Lymnaea stagnalis 2, Helix pomatia 3, barata 13, e Zebrafish 14. Por exemplo, se alguém quiser aplicar esta técnica para os neurónios motores do músculo I5 (também conhecido como o músculo mais próximo radular acessório ou ARC 10,28), em Aplysia, deve-se manter as BN3s ligados à massa, em vez de os bucal BN2s , porque os neurônios motores I5 B15 e B16 do projeto no ipsilateral BN3 6,7. Então tEle massa bucal deve estar preparado para expor o músculo I5 para EMG ou estudos de força. Após os neurónios foram identificados de forma confiável na preparação reduzida, um método optimizado de diagnóstico podem também ser criados para futuros estudos comportamentais.
A técnica que se descreveu se compara favoravelmente com outras técnicas, tais como eléctrodos extracelulares múltiplas matrizes e corantes sensíveis à voltagem. A tensão de corante 29 sensível ao técnica só é utilizado para a gravação, enquanto que os nossos eléctrodos extracelulares e eléctrodo multi-matrizes 30 pode ser utilizado tanto para a estimulação e gravação. Tanto a matriz multi-eletrodo 29 e sensíveis à tensão corantes 30 pode gravar sinais de muitos neurônios simultaneamente. Embora um único eletrodo extracelular só pode gravar a partir de um ou dois neurônios, dependendo de seu tamanho e da localização da ponta do eletrodo, é certamente possível para posicionar vários em um gânglio simultaneamente, e temos feitoisso com sucesso. O padrão in vitro conjunto de eléctrodos múltiplos tem 8 x 8 ou 6 x 10 eléctrodos 29. Uma vez que os eléctrodos estão uniformemente distribuídas na matriz, que é muitas vezes um desafio para determinar a identidade dos neurônios subjacentes a partir da qual as gravações são obtidos, uma vez que os neurónios não são uniformemente distribuídos e significativos de pós-processamento de sinais, alguns dos quais ainda manual, deve ser feito para resolver essa ambigüidade. Em contraste, porque os eléctrodos extracelulares são posicionados sobre somata único, a identidade do neurónio subjacente é clara. Assim, parece que os eléctrodos de várias matrizes e corantes sensíveis à voltagem pode ser mais eficiente para várias gravações simultâneas. No entanto, a nossa técnica eletrodo extracelular pode proporcionar uma melhor seletividade, tanto para estimulação e gravação.
Divulgações
Não temos nada a revelar.
Agradecimentos
Esta pesquisa foi apoiada pelo NIH concessão NS047073 e concessão do NSF DMS1010434.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome | Companhia | Número de catálogo | Comentários |
| Cloreto de sódio | Fisher Scientific | S671 | Biológica, Certified |
| Cloreto de potássio | Fisher Scientific | P217 | Certificado ACS |
| Hexa-hidrato de cloreto de magnésio | Acros Organics | 19753 | 99% |
| Hepta-hidrato de sulfato de magnésio | Fisher Scientific | M63 | Certificado ACS |
| Di-hidrato de cloreto de cálcio | Fisher Scientifc | C79 | Certificado ACS |
| Glucose (dextrose) | Sigma-Aldrich | G7528 | BioXtra |
| MOPS Buffer | Acros Organics | 17263 | 99% |
| Carbacol | Acros Organics | 10824 | 99% |
| De hidróxido de sódio | Fisher Scientific | SS255 | Certificado |
| Ácido clorídrico | Fisher Scientific | SA49 | Certificado |
| Único de cano de vidro capilar | Sistemas AM | 6150 | |
| Flaming-Brown micropipeta extrator modelo P-80/PC | Sutter Instruments | Incandescência utilizada: FT345B | |
| Fio de aço inoxidável revestido com esmalte | Califórnia fio fino | 0.001D, revestimento h | |
| Casa de silicone II Glue | GE | ||
| Duro Quick-Gel supercola | Henkel Corp. | ||
| AM Sistemas amplificador modelo 1700 | Sistemas AM | Configurações de filtro: 10-500 Hz para o nervo I2 / muscular; 300-500 Hz para todos os outros nervos | |
| Pulsemaster Multi-Canal Estimulador | Instrumentos de Precisão mundo | A300 | |
| Isolador de estímulo | Instrumentos de Precisão mundo | A360 | |
| AxoGraph X | AxoGraph Científico | Software para gravações | |
| Ouro pinos | Bulgin | SA3148 / 1 | |
| Conector Ouro Sockets | Bulgin | SA3149 / 1 | |
| Sylgard Elastômero de Silicone 184 | Dow Corning | ||
| 100 x 15 mm Prato cristalizadas | Pyrex | ||
| Graxa de alto vácuo | Dow Corning | ||
| Dicas de pipeta | Fisher Scientific | 21-375D | |
| Pinos Minutien | Belas Science Tools | 26002-10 | |
| Massa de modelar | Sargent Arte | 22-4400 | |
| Sussurre bomba de ar | Tetra | 77849 | |
| Tubulação de aquário | Eheim | 7783 | 12/16 mm |
| Elite airstone | Hagen | A962 | |
| Vannas Primavera Tesoura | Belas Science Tools | 15000-08 | |
| Dumont n º 5 pinça fina | Scienc finaFerramentas E | 11254-20 | |
| Kimwipes | Kimberly-Clark | 34155 |
Referências
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados