Method Article
体外における筋モータープールのために運動ニューロンの識別
要約
大同定ニューロン(と動物では例えば軟体動物)、モータープールの分析は、細胞内の技術を使用して行われ 1,2,3,4。最近、我々は細胞外で個々の神経細胞を刺激し、記録する技術を開発アメフラシカリフォルニ 5。我々は今、一意に識別してモータープール内の運動ニューロンを特徴づけるためにこの手法を使用するためのプロトコルを記述します。
要約
大同定ニューロン( 例えば軟体動物)、モータープールの分析と動物では細胞内のテクニックに1,2,3,4を使用して行われます。最近、我々は細胞外にアメフラシカリフォルニ 5で個々の神経細胞を刺激し、記録する技術を開発しました。我々は今、一意に識別してモータープール内の運動ニューロンを特徴づけるためにこの手法を使用するためのプロトコルを記述します。
この細胞外手法には利点があります。まず、細胞外電極は刺激し、記録ニューロンをシース5を通っているので、削除する必要はありませんすることができます。このように、神経細胞は、細胞内のものに比べて、細胞外の実験でより健康になります。ガングリオンは、シースのピンニング適切により回転される場合、第二に、細胞外電極は、より容易かつ効率的に同じ準備で複数のニューロンを識別できるようになり神経節、両側の神経細胞にアクセスすることができます。第三に、extracelluLAR電極が細胞に侵入する必要はありません、したがって、容易にそれらにあまりダメージを与え、ニューロン間で前後に移動することができます。一つはわずか数分持続することがある運動パターンを繰り返す中に複数のニューロンを記録しようとするときに特に便利です。第四に、細胞外電極は、筋肉の動きの間に細胞内のものよりもはるかに柔軟です。細胞内電極引き出し、筋肉の収縮時に神経細胞を損傷することがあります。細胞外電極は優しくニューロン上記シースに押し付けているのでこれとは対照的に、彼らは通常、筋肉の収縮時には、同じニューロン上に滞在し、したがってよりそのまま調剤で使用することができます。
ソーマのサイズや位置、軸索投射し、筋肉の神経支配4:一意細胞外電極を使用してモータープール(特に、 アメフラシでI1/I3筋肉)の運動ニューロンを同定するためには、基準のような細胞内の測定を必要としない機能を使用することができます、6,7。手法を説明するために使用される特定のモータープールのために、我々は軸索突起物を測定するために頬神経から2と3を記録し、個々の運動ニューロンのための筋の神経支配のパターンを決定するI1/I3筋肉の収縮力を測定した。
我々は、迅速な同定のために簡略化された診断法を作成し、運動パターンの間にそれらのタイミングを特徴付ける、筋の神経支配を用いた第1の識別運動神経の完全なプロセスを示しています。簡略化され、より迅速な診断方法は、一時停止頬マス準備8 または in vivo で 9 例より完全な準備のために優れています。このプロセスは、2,3,13,14 アメフラシや他の動物系で10,11,12他のモータープールに適用することができます。
プロトコル
1。録音皿の調製
- 力変換器の実験中に、頬神経、脳神経節、頬質量は力の研究に特化していますラウンドパイレックス皿に入れています。
- 実験でingestiveのようなパターンを誘導するために、我々は脳の神経節15に非加水分解性コリン作動性アゴニストのカルバコールを適用する必要があります。頬神経と頬マス上にカルバコールからの直接の接触を回避するには、別のチャンバは頬と頬神経塊( 図1)から脳の神経節を分離するために必要とされている。
- 頬の質量が頬神経節よりもはるかに厚いので、それらは同じレベルに配置されません。したがって、この皿は脳神経節( 図1の面積)、頬側神経節( 図1の領域C)、および頬質量(エリアDのためのより深い前室用の中間のプラットフォーム用のバックチャンバーを持つべき図1)。
- この料理を作成するには、ラウンド100x15パイレックス皿(高15ミリメートル、直径100mm)で始まります。皿の建設がいくつかはシルガードを注ぐ必要があります。シルガード製品で提供される指示に従ってください。シルガードは異なる注ぐ間に設定することを許可しなければなりません。
- 第一流動は、中間プラットフォームとバックチャンバーとの間の壁である皿( 図1の領域B)におけるシルガードの最高レベルを作成することです。
- シルガード壁( 図1の領域B)の領域を分離するために2つの粘土のバッキングを使用しています。彼らは容易に除去するためのシルガード連絡を差し上げますラップでコート粘土バッキング。粘土は、漏れを最小限に抑えるために、皿をご連絡いたしエッジでタイトなシールを確認してください。
- ほぼアップ皿の上部には2つの粘土バッキングの間の部分にシルガードを注ぐ。シルガードが完全に一晩設定してみましょう。暖かい場所で皿にしておくと誘導する速く設定。粘土バッキングを取り外し、シルガード上の任意の粘土の残留物をクリーンアップします。
- 次に、真ん中のプラットフォーム( 図1の領域C)をバックチャンバー( 図1の領域)と注がれるべきである。
- 離れて真ん中のプラットフォーム(領域C)のセクションのシルガードの表面から約5mm粘土バッキングを置きます。
- アップ第一シルガード壁(エリアB)のトップレベルより約3〜5mmの高さに戻し室(面積)と中央プラットフォーム(領域C)のセクションにシルガードを注ぐ。バックチャンバーのシルガード表面は、中間プラットフォームにカルバコールを含むバックチャンバーからの漏れを回避するための中間プラットフォームに比べてわずかに低くする必要があります。再び、シルガードが完全に一晩設定でき、その後粘土バッキングを取り外します。
- 最後のステップは、行き脳頬側接続詞(CBCS)のためのチャネルを提供するために、シルガードの壁の中央にノッチをカットすることです真ん中のプラットフォームとバックチャンバーの間から。このノッチの幅がCBCSための十分な広さ約3-4 mmでなければなりません。ノッチの底部は、漏れを防ぐために、中央のプラットフォームのシルガード表面よりも低くすべきではない。メスの刃、ノッチをカットするために使用することができます。
2。電極の作製
- セクション3.1でマクマナスらによって記載フレイミング·ブラウンマイクロピペットプラー8を用いて 、単銃身のガラスキャピラリーから外ガラス電極を引き出します。プラーでFT345Bフィラメントにより、当社の代表的なプログラムの設定は、ヒート480、プル50、速度13、時間20であるが、設定が異なるフィラメントに対して異なるであろうことに注意してください。このプログラムではありません火研磨ステージとシングルプルで電極を作成します。電極チップの大きさは細胞体のサイズよりも小さくなければならない。 50μmからソーマ直径、インナーdiameteでは400μmまでの運動ニューロンのために外ガラス電極のrsは約40μmであるべきであり、それらはアメフラシの生理食塩水で満たされているときに彼らの抵抗は約0.1MΩでなければなりません。
- ブンゼンバーナーを用いてポリエチレンチューブから吸引電極を引き出します。約10cm長いポリエチレンチューブの部分を切り取ります。両端にチューブを保持し、それが熱から柔らかくなるまでチューブを回転させながら非常にブンゼンバーナーで生成された火炎の近くに置きます。炎から離して移動させながら、その長さに沿って慎重にチューブを伸ばす。チューブの中央部分が細長いチューブが引っ張られるように狭くなります。
- 2つの吸引電極を形成するために半分にチューブをカットします。彼らは時々 パッサントの途中適用することができますが、吸引電極は、一般的には、神経や筋肉の切断端部に適用されます。
- セクション3.2から3.13にマクマナスら 8で記述されたプロトコルに従って神経録音用フック電極を作成します。これらの電極はespeciアール神経や筋肉が切断されない場合に便利同盟。
3。フック電極アタッチメント
- 動物を解剖し、マクマナスらに記載プロトコルに従って口腔内腫瘤を取り除く。8節4。
- 記録と刺激のために、フック電極は異なる神経の番号に接続することができます。
- Cullinsとチール9 によって in vivo で行われていたようなパターンを特徴づけるために、録音が16を供給する長期化相、食品グラスパー17、頬の閉鎖を示しradular神経(RN)を示しているI2の神経や筋肉から得なければなりませんトラクション段階17,18を示 す神経2(BN2)と頬神経3(BN3)。フック電極の添付ファイルは、マクマナスら 8、セクション5で説明したのと同様の手順に従います。
- これらの神経の位置はに示すアメフラシ送り装置の概略を参照してください。マクマナスら 8の図2。横溝でI1は筋肉の下に行く前に支店、B、CにBN2 trifurcatesことに注意してください。枝は幹から分離するための最初の分岐であり、BN3に隣接しています。
- 枝の命名法は、a、b、およびcは戦士とチール18で使用されていました。枝はa、b、cの Nargeot らによって使用される命名法において、それぞれ枝3,2、および1に対応しています19。さらに、RNは、BN1、BN2、BN3とはカンデル20とスコットらによって使用される命名法において、それぞれの神経1、6、5、4に対応しています21
- I1/I3筋の筋神経支配を研究するために、頬神経を除くすべての神経が2回の実験中に頬の塊から切断されます。したがって、私たちは、BN2から録音するフック電極を使用していました。
- I2の神経とRNが頬部に取り付けられ、彼らはフック電極を使用してアクセスすることが非常に困難であることはありませんので、代わりにそれらから録音する吸引電極を適用するのが好ましい。私たちは、セクション7で吸引電極のアプリケーションについて説明します。
- それは電極のいずれかの種類を使用してアクセスすることが容易であるため、BN3から録音するフック電極または吸引電極のいずれかを使用します。我々は吸引電極を保持するためのマニピュレーターの数を最小限に抑え、他のマニピュレータや機器のためのスペースを節約するためにBN3録音用フック電極を使用することにしました。
- 実験中に拒絶反応のようなパターンを開始するためにBN2(BN2-)の枝にフック電極を取り付けます。いくつかのニューロンは同側の対反対BN2刺激に対して異なる反応ので、それは、もう一方の側のBN2-への追加フック電極を添付すると便利です。
- 一方的な対二国間の突起を有するニューロンを区別しやすくするため、それ頬神経の反対側にBN2とBN3にフック電極を接続するためにも有用である。
4。神経と筋肉の準備
- 頬神経、脳神経節と頬質量は脳神経節のみBN2s経由CBCSおよび頬質量は頬神経に接続されている経由頬神経に装着された、力変換器の実験のために準備されます。
- フック電極を取り付けた後、頬に大量付着点で切断、頬神経1(BN1)と両側性食道神経(EN)をカット。
- I2は筋肉の道の外に移動を楽しみにし脳神経節を引き出します。 radular嚢以上I2の筋肉にカットして、両方の方向に横方向と前方カットを拡張し、radular神経を露出させるために前方にI2の筋肉のフラップを引っ張る。 2 RNの枝を切って、枝が吸引電極の付着のために十分な長さであることを確認してください。
- C言語頬神経とI2の筋肉の付着部分が完全に頬の塊から分離することができるようになるまで、またはBN2s BN3sを切らないように注意して、頬神経の周りに大きな円を描いてI2のカットをontinue。フック電極アタッチメントを超えて、頬に大量付着点で二国間BN3sをカット。
- 真空グリースのglobをピックアップし、ノッチの上にそれを広めるためにピペットチップを用いて、バックチャンバーとミドルプラットフォームを接続する上記の記録皿のノッチに真空グリースの薄い層を適用します。
- ちょうど真ん中のプラットフォームのシルガードベースの前に、頬マスが配置される前室のガラス底にクイック·ゲルスーパー接着剤の薄い層を適用します。
- 慎重にフック電極のいずれも神経を損傷する恐れがあり、これきつく引っ張られていないことを確認しながら、第2節で説明した記録ディッシュ( 図1)脳神経節、頬と頬神経塊を転送します。
- 慎重にその腹面が皿の底に接着されたことを確実にするために、記録の皿の前室に糊で頬の塊を配置します。接着剤に触れ神経と電極を必ず保管してください。接着剤が誘発される皿にアメフラシ生理食塩水8(460 mMのNaCl、10mMのKCl、22 mMのMgCl 2、33 mMののMgSO 4、10mMのCaCl 2、10mMグルコース、10mMのMOPS、pHが7.4から7.5)を追加設定します。
- 皿が細胞外ソーマ録画の頬神経を調製するための別の顕微鏡へ転送しなければならない場合は、フック電極には充分に注意してください。グループが一緒に頬の質量の1側の電極、またグループ一緒に頬の塊の向こう側にある電極。慎重に再び電極のいずれもしっかりと引っ張られていないことを確認し、コネクタのピンをカバーラボテープを把握することによって電極を保持。
- 皿は、顕微鏡、電極の下に配置されている場合sは皿の横のプラットフォーム上皿と残りの辺の上に優しく覆われなければならない。
- 休憩時間に、実験の段階の間に、水槽のairstoneを使って頬マスチャンバー内に生理食塩水を通気する。
- 脳の神経の鞘をつかむとCBCSはノッチを通して実行することを保証し、バックチャンバーにそれを引っ張るためにピンセットを使用しています。無傷CBCSへの損傷を避けるためにCBCS以外の神経を使って脳の神経をピン。
- CBCSより細かく真空グリースを塗布し、その後、神経が完全に水没されるように、皿の両院にもっとアメフラシ生理食塩水を追加します。漏れがチャンバー間発生しないように真空グリースの上部がシルガード壁よりも若干高くなっていることを確認します。
- 頬神経を安定させるために、まず、中間プラットフォーム( 図2)のシルガードベース上BN1sとENSをBN3sの両端をピン。 BN3sは、フック電極を用いて記録されますので、sは、ピンがフック電極の付着点よりも遠位に配置する必要があります。
- フックはCBCSを伸ばし、固定するように( 図2)CBCSが破損されないように、90度曲がって、2つのピンを使用します。
- バックチャンバーと頬神経節間のRNの枝を突き止める。次に、I2筋肉は、RNSの上になります。 I2は神経を公開するには、I2は筋肉をつかむと頬神経の上にそれを引っ張って鉗子を使用しています。 I2は神経への損傷を避けるために、I2筋肉の2つの角をピン。
- その二つの枝がI2筋に合流する地点に遠I2は神経を断つ。筋肉がまだ生体録音に匹敵するように支配していることを確認します。 I2は筋肉の残りの部分を切り取るとI2神経をバックフリップと2 RNの枝の間にそれを突き止める(挿入図2を参照)。
- 神経があまりにも緩んでいる場合は、ストレッチや緊張を追加するには、ピンの位置を調整したり、ネルフなら緊張を解放するeはきつすぎる。さらに頬神経を安定させるために、神経間のシースに複数のピンを追加します。
- 頬神経が尾側を上にして置かれているので興味のあるニューロンは吻側側にある場合は、頬神経を回転させます。 2頬神経節の1を回転させるには、それが頬神経の近くにあるCBCのいくつかの余分な鞘をつかむとBN2とBN3間でそれを突き止めるために細かい鉗子を使用しています。いくつかの節では、CBCとBN3間でそれを突き止める方が便利でしょう。
- 頬神経の動きを最小限に抑えるための前室に近い側の頬神経の鞘に追加のピンを追加します。
- 頬神経を覆うシースをトリミングするには、バックチャンバーに近い側に鞘をつかむために細かい鉗子を使用し、細胞体をさらすことなく、細かいハサミで余分なシースを切り取った。被害を最小限にするために、唯一の細胞体を参照するために必要なシースの最小量を削除します。
- t後頬神経の鞘がトリミングされています彼は、頬神経を介して、I2神経と看護師を引っ張って、さらに頬神経を回転させるために頬神経節と前室の間にそれらを突き止める。 ( 図2を参照)。
- 解剖前に動物を麻酔するために使用された残りの塩化マグネシウム8を洗い流すために、新鮮なアメフラシ食塩水で皿にアメフラシ生理食塩水を交換してください。
5。電気フック電極を接続
- 神経や筋肉の準備が完了した後、慎重に実験用防振テーブルに皿を移す。
- アンプ(AMシステムズモデル1700アンプ)に接続するBNCケーブル上のソケットにすべての電極ピンを取り付けます。繰り返しますが、これをしている間に電極がきつく引っ張られないことを確認してください。電極が正しく、適切なケーブルに取り付けられており、極性が正しいことをしていることを確認します。
6。相馬録音のための細胞外ガラス電極のセットアップ
- 周りに15〜20センチメートルのポリエチレンチューブの部分に取り付けられたシリンジを用いてアメフラシ生理食塩水で電極を埋める。ガラス電極の端部にポリエチレン管の自由端を取り付けます。 アメフラシ生理食塩水で電極を埋めるために、シリンジのプランジャーを引き戻し。
- マニピュレータ上のホルダーの切り欠きに満ちた外のガラス電極を配置します。頬神経節を含むアメフラシ食塩水中に電極チップを配置するマニピュレータを使用しています。
- 記録線として機能する電極にオス金コネクターピンにハンダ付け、銀/塩化銀線を挿入します。基準線として機能するように頬神経節を含む記録皿のセクション内アメフラシの生理食塩水に直接オス金コネクターピンにハンダ付けし、別の銀/塩化銀線を配置します。目の両方を接続するアンプに接続するBNCケーブルへの電子記録と基準線。
- もっとマニピュレータのための十分なスペースがある場合は、追加の外ガラス電極は、同時に複数のニューロンを記録するために追加することができます。
7。神経録音用サクション電極のセットアップ
- 神経の直径と一致するように先端吸引電極の狭い方の端をトリミングします。電極先端の内径は、次のようなタイトなまたは吸引を確保するための神経の直径よりも僅かに小さくする必要があります。
- I2は神経とRNは互いに非常に接近しているので、それらの電極は、スペースを節約するため、同じマニピュレータで保持することができます。同じホルダーの2つのノッチに二つの電極を配置します。二つの電極を回転させて、その先端が1近接していることを確認してください。 I2は神経記録のためにそれらの1つは、RN録音のためのいずれかを選択します。
- recordin内アメフラシ食塩水に電極チップを置きます頬神経節を含むグラム皿。吸引電極にシリンジにポリエチレン管の自由端を取り付けます。 アメフラシ生理食塩水で電極を埋めるために注射器を使用しています。近い標的神経の端に電極チップを移動し、I2の神経すなわち 、電極に神経を吸うために注射器を使用しています。電極内の神経の長さは、タイトなシールを確実にするために0.5から1.0 mm程度である必要があります。
- RNに添付される電極のための吸引を繰り返します。
- セクション6.3で説明されるように対応するBNCケーブルに電極を接続してください。
8。 I1/I3筋収縮を測定するためにフォーストランスデューサのセットアップ
- 筋肉に力変換器を接続するには、絹縫合糸を使用しています。各縫合糸の湾曲針を曲げて、力変換器に縫合糸を結ぶ。そっとつかみ、持ち上げて筋肉量が少ないと鉗子では、鉗子の別のセットに針を保持し、挿入アップ針で屈曲点( 図1)に筋を通して針。
- トランスデューサはI1/I3筋肉のいずれか背部または横方向に取り付けることができます。背部アタッチメントは、筋肉の左右どちらかの側の活性化により誘発される収縮の測定を可能にする。横アタッチメントは、ニューロンの大多数の強い力が表示されますが、変換器が接続されている側の収縮の測定のみを許可します。
- I1/I3の前方、後方、または両方の領域を活性化することができる神経細胞を識別するのに役立つ、咽頭組織直前で、筋肉の後部に力変換器を取り付け、前部に別の力変換器を取り付ける筋肉、顎( 図1;音符フック)であった。
- 縫合糸がぴんと引っ張られているが、伸び過ぎないまで力変換器を持ち上げます。縫合糸は、iに多少の余裕があるときにこれを確認するには、力変換器からの測定値を表示その後、t、および測定はわずかにこのベースラインレベルを超えるまでトランスデューサーを持ち上げます。
9。モータープール内の運動ニューロンを同定する
- このプロトコルは、細胞外にモータープール内での運動ニューロンを同定するためのプロセスについて説明します。我々は個々のニューロンは、複数の神経、筋(EMG信号または収縮力)の活動を監視するためにAxoGraphソフトウェアを使用しました。 (説明を参照)、他の実験では、我々としてもEMGを使用し、そのような実験のセットアップは非常によく似ていますが、このプロトコルでは、運動ニューロンを同定するプロセスのための実例として、筋肉の収縮力を使用していました。
- 候補ニューロンを見つけるには、優しく刺激と記録5選択のための最高の場所であるニューロンソーマ5( 図3)の中心上にシース外ガラス電極の先端を下に押すようにマニピュレータを使用しています。以来、しきい値電流F電極は、隣接するニューロンに向かって標的ニューロンの中心から離れる方向に移動されたとき、またはニューロンを活性化すること電極対相馬距離5とともに直線的に増加し、刺激選択性が悪くなるでしょう。
- 運動ニューロンを同定するために、最初に直接のみこのニューロンが発火していることを確認し、細胞外ガラス電極を用いた神経細胞を刺激し、それが筋肉を神経支配するかどうかを調べる。また、ニューロンの識別に重要である細胞外のソーマの記録と神経の録音の間に1対1の関係を確立するために、このニューロンから次に、細胞外記録。
- 最も外のアンプはチャネル内の同時刺激と記録が許されていませんので、刺激し、記録ソーマ(SOMAチャネル)を刺激モードにし、( アメフラシニューロン5の例えば 6ミリ秒)簡単なアノード電流を適用するために使用するチャンネルを設定ソーマ( 図4A、5A、音符の矢印1のInの両方の数字)、( 例えば 200μA)、低電流から開始し、徐々に神経細胞のバーストまで電流を増加させる。
- ニューロンがバーストに活性化されると、人はすぐに刺激モードから録画モード(;音符の矢印2両図において、図4A、5A)にソーマチャンネルを切り替える必要があります。しかし、それでも人間の応答遅れのため相馬刺激と記録の間に遅延があるでしょう。
- 妥当な時間のためのニューロンが起動するときは、それはソーマの記録から、神経上の1対1の対応する活動電位を観察することが可能でなければなりません(S)を介してニューロンプロジェクト( 図4B、5B、注破線)だけでなく、神経細胞( 図4A、5Aにより発生する力;音符青箱)。ニューロンは、相馬の記録が開始される前に発射を停止した場合、長い時間のためにそれをアクティブにするために電流を増加させる。
- 細胞外の信号対雑音比録音は電極の位置とソーマのサイズによって異なります。細胞外記録がソーマサイズの増加と電極 - ソーマの距離が小さくなるほど大きくなるだろう。ノイズだけ狭い範囲で変化するので、信号対雑音比もソーマのサイズが大きくなると、電極 - ソーマの距離が減少するにつれて増加します。信号対雑音比の最も一般的な範囲は4:1〜8:1である。
- 運動ニューロンは、細胞体の位置、神経突起や筋肉の神経支配4,6,7としての特性に基づいて識別することができます。 2つだけBN2sがBN2s上の活動を監視することにより、頬部に取り付けられているので、1は、筋肉の収縮力が唯一の細胞外刺激により活性化ニューロンによって引き起こされていることを確認することができます。
- 例えば、B3は頬神経( 図3の吻側側に位置し、I1/I3筋(200〜350グラムの重量を量る動物におけるソーマの直径300から400μm)のための大規模な運動ニューロンである)。それが唯一の同側のBN2を通じてプロジェクト、およびI1/I3筋の前部と後部の両方の部分を神経支配する。ほとんどの時間、それをアクティブにすると、後方力(9実験のうち8)より大きい前歯を生成します。
- ニューロンが特定された後、その活性は、後述するように誘発することができる細胞外ガラス電極( 図4、図5)を介して別の摂食のような行動に記録することができます。ソーマで細胞外記録では、さまざまなニューロンの活動を含む神経録音よりもはるかに特定されます。
- egestiveような運動プログラムを誘導するために、パルス19の1から2分(2Hzの、各パルスは1ミリ秒です)BN2-刺激する。この刺激は確実にこの設定でegestiveパターンを生成します。十分な電流で( 例えば 300μA)、パターンは、刺激の持続時間のために持続することがある。時には直後に発生した複数のパターンがあるだろう刺激が終了します。
- ingestiveような運動プログラムを誘導するために、直接脳の神経節15のシース上に固体カルバコールの少ない結晶を配置します。一つはカルバコール露出のレベルを制御したい場合には、 アメフラシ生理食塩水に1〜10 mMのカルバコールのソリューションを使用しています。濃度が高いほど反応を誘発する可能性が高くなります。反復的なパターンは、一般的に5分以内に開始され、ダウンを実行するために開始する前に、約10〜15分続くかもしれない。
- カルバコール数回洗浄し、少なくとも30分間待機した後、カルバコール、その後のアプリケーションは、よりingestiveような運動パターンを誘発する脳の神経節に追加することができます。
- 特定のモータープールで複数の運動ニューロンが識別され、モーターのプログラム中に特徴付けられてきた後、1つはすぐに将来の仕事でこれらのニューロン( 図6を識別するための最小限の情報を必要とする非常に単純化された診断法を開発することがあります</ strong>)を、 例えば中断頬量産準備または in vivo インチ基準はソーマのサイズと位置、神経突起、神経のユニットサイズ、および運動パターン間に活動のタイミングを含むことができる。
結果
図4および図5は、2 I1/I3運動ニューロンを識別するために使用される代表的な結果を示している。 図4は egestive様およびingestive状のパターン( 図4C、4D)の間に大規模な運動ニューロン、B3のソーマの記録を示しています。 B3ソーマ記録の特異性はパターンの間に維持されたことソーマ·チャネル上の1対1対応するスパイクと同側のBN2チャネル( 図4E)ショー。 B3は、パターンの途中から後半トラクション段階に発光します。 図4およびその他の結果(図示せず)から、我々は、B3のBN2ユニットは常に最大のBN2ユニットであることがわかった。したがって、それはまた、BN2録音から直接検出することができます。
図5は egestive様およびingestive状のパターン( 図5C、5D)の間に、B43、小さなニューロンの細胞体の記録を示しています。ソーマチャネル上の1対1対応するスパイクと同側のBN2チャネル( 図5E)もB43ソーマ記録の特異性はパターンの間に維持されたことを示している。パターン中に後退期の終わりのニューロンはB43バースト。 B43のBN2ユニットが小さいので、ソーマ記録なしBN2録音から、それを識別するのは難しいだろう、それはBN2運動パターンの終わりに最も強く発生しますので、しかし、B43のバーストの終わりがまだ識別することができます独りBN2録音から。
図6は、細胞外に中断頬量産準備または in vivo で I1/I3運動ニューロンを同定することがはるかに容易になります基準として筋の神経支配を必要としない最適化された診断ツリーを示しています。診断ツリーは力と筋電図の測定値を使用することによって、しかし、開発し、そして、その結果、このプロトコルの技術は合理化された運動ニューロンの同定につながることができる方法を示した。

図1。全体的なセットアップと力研究のための皿の回路図上の画像は、平面図を示している。下の画像は、側面図(上面図の真ん中の破線に相当)を示しています。脳の神経節は、バックチャンバー(エリア)にシルガードに固定されます。頬神経は、中間プラットフォーム(領域C)にシルガードに固定されます。バックチャンバーとミドルプラットフォームは高架シルガード壁(エリアB)で区切られています。脳頬側接続詞(CBCS)は真空グリースで密封し、シルガード壁の切り欠きを通過します。頬の質量は、前室(エリアD)のガラス底に接着される。頬神経2(BN2s)頬部に取り付けられている。絹縫合糸に取り付けられた2つのフックがI1/I3筋の前部と後部領域に挿入されています。 T彼絹縫合糸は、その後力変換器に接続されています。図は、領域A、B、C、Dの色が濃く、より高い対応する表面の表面を示すために、ダークグレー、ライトグレー、ホワイトを使用しています。図は、皿の重要な寸法を示すためにA、B、C、およびDを使用しています。長さ3-4 mmのバックチャンバーとミドルプラットフォームを接続するノッチの幅です。 長さb は 3-5 mm程度、ミドルプラットフォーム(領域C)およびシルガード壁(エリアB)の表面の高低差です。長さcは約5mmであるノッチの長さを示します。長さdは約5mmである真ん中のプラットフォーム(領域C)の幅を示しています。

図2。頬神経の概略と電極セットアップ図は頬神経1,2、および3(BN1、BN2、BN3と)、食道神経(JA)、radular神経(RN)、I2は神経と筋肉を含む主要な神経の位置を示しています、脳頬結合(CBC)。 BN2sます( 図1を参照してください)頬部に取り付けられていることに注意してください。 CBCSはシルガード壁の切り欠きを通過、脳神経節に取り付けられており( 図1を参照)真空グリースで封止されている。 RNおよびI2は神経と筋肉は神経上に引き上げ、頬質量(正面方向)に近位固定されます。青線は、ピンの位置を示しています。二つのピンが曲がっています(赤線はラベル1)CBCSを固定するために使用されます。左側にCBCのシースのフラップが左頬神経節(2のラベルの付いた赤色のライン)を回転させるように折り畳まれBN2とBN3間に釘付けにされることに注意してください。いくつかの節では、CBCとBN3間にシースを突き止める方が便利でしょう。追加のピンはtを追加されますOさらに回転と安定化のために、EN(赤い線が3のラベルが付いている)に近接する神経節の側。外ガラス電極は、細胞外刺激および記録のためソーマ上記シースの上に配置されます。フック電極がBN3sに取り付けられており、代わりにそれらの神経を保持ピンは、これらのフック電極の付着点よりも遠位に配置する必要があります。 2つの吸引電極はRNとI2は神経と筋肉(I2神経と筋肉のより明確なビューに対して挿入図参照)に添付されています。 拡大図を表示するには、ここをクリックしてください 。

図3。 I1/I3モータの外 識別のためのニューロン地図の画像と回路図アメフラシ頬神経節のニューロン。上の写真は、右側頬神経節を示し尾側を上にして固定。頬神経を回転させるには、RNとI2神経/筋肉が頬神経上に引き上げられており、ENの側の近位に固定。 CBCのシースのフラップも吻側側または尾/吻側国境でニューロンが見られるように、折り畳まれています( 図2を参照)に回転するように固定されます。下の回路図は、上の写真に基づいて描かれています。写真と回路図は一緒I1/I3運動ニューロンB3、B6、B9、B10、B38、B39、B43及びB82 6,7 22,23だけでなく、いくつかの他のニューロンの位置を示す。ニューロンB8aとB8BはRN上の最大の単位のための責任があり、把持6,17を制御する筋肉I4を支配する。 B4とB5のニューロンがBN3 18上の最大の単位のための責任を負うものとします。 I1/I3運動ニューロンのサイズと場所は、動物トンから可変ですがO動物、相対的なサイズおよび位置は、ほとんどのニューロンについてきわめて信頼性の高いものです:B3、B6、B9、B38、B43、B82と。特にI1/I3運動ニューロン、一義的B10とB39を識別することの難しさのいくつかの詳細についての説明を参照してください。
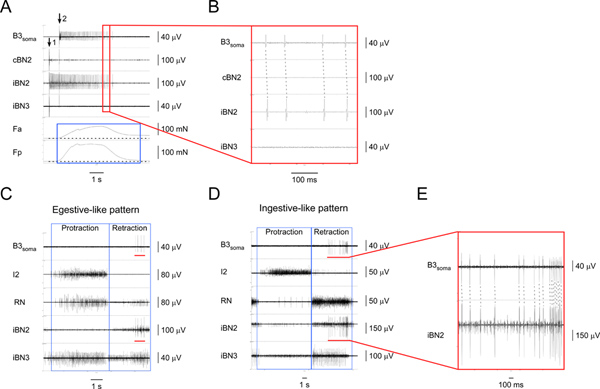
図4。 I1/I3運動ニューロンB3を同定し、特徴付ける。)外B3の刺激(矢印1時)とB3ソーマ(矢印2から始まる)からだけでなく、対応する神経や筋肉の地域からの記録。上から下へ、チャネルは、B3ソーマ、対BN2、同側のBN2、同側のBN3、I1/I3筋肉の前方領域の収縮力、との後方部の収縮力からの録音であるI1/I3筋肉。ザ青いボックスがI1/I3筋の前部と後部の地域で力の持続を強調しています。この特定のケースでは、後部力が前方力よりも大きい。A1の赤いボックスで概説エリアのB)の拡大図。 B3のソーマとiBN2チャンネルで1対1対応する活動電位は同側BN2でそのB3プロジェクトのみが表示されます。C)B3ソーマとegestiveような運動パターンにおける神経から細胞外記録。からD)の細胞外記録B3のソーマとingestiveような運動パターンの神経。 CとDに、上から下へ、チャネルは、B3ソーマ、I2、神経、RNは、同側のBN2、および同側BN3からの録音である。青い箱は、パターンの長期化および後退のフェーズを示しています。 CとDの両方のB3 相馬チャンネルで赤いバーは、アクションポットを強調entialsはB3ソーマから記録。 B3は送り運動パターンの間に同側のBN2で焼成すると、CとDの両方でiBN2チャンネルで赤いバーは、対応するタイミングを示していますE)B3 ソーマと赤のバーでマークiBN2チャネルの拡大図。破線はB3 ソーマとiBN2チャネルの活動電位の間に1対1の関係を示します。 B3のBN2ユニットはすべてのユニットの最大であることに注意してください。したがって、我々はまた、ソーマの録音なしBN2録音から直接B3のBN2ユニットを検出することができます。 拡大図を表示するにはここをクリック 。

図5。識別とI1/I3運動ニューロン、B43を特徴付ける。B43の)細胞外刺激(矢印1)を調べ、それソーマから録音(矢印2から始まる)と同様に対応する神経や筋肉の地域からは。上から下へ、チャンネルがB43 ソーマ 、対BN2、同側のBN2、同側のBN3、I1/I3筋肉の前方領域の収縮力、との後方部の収縮力からの録音であるI1/I3筋肉。青いボックスはB43活動中I1/I3筋肉の力の測定値が強調表示されます。活性B43は小さい後部力を発生させるが、ない前歯力。B)の領域の拡大図での赤いボックスで概説。破線が示す1対1のその同側のBN2のみ、C上のB43プロジェクト)は、細胞外記録を示しB43 ソーマの活動電位とiBN2チャネルとの関係egestiveような運動パターンにおけるB43ソーマと神経から。B43ソーマとingestiveような運動パターンにおける神経からD)を細胞外記録。 CとDに、上から下へ、チャンネルがB43ソーマ、I2、神経、RNは、同側のBN2、および同側BN3からの録音である。青い箱は、パターンの長期化および後退のフェーズを示しています。 CとDの両方でB43 ソーマチャネル内の赤いバーはB43ソーマから記録された活動電位をハイライトします。 B43は、これらのパターンで同側のBN2で焼成すると、CとDの両方でiBN2チャンネルで赤いバーは、対応するタイミングを示していますE)B43 ソーマとDに赤いバーでマークiBN2チャネルの拡大図。破線はB43 ソーマの活動電位の間に1対1の関係を示しとiBN2チャンネル。 B43のBN2ユニットは、それらを識別するための別の方法を提供し、相馬の録音せずに検出するために小さく、非常に難しいのですが、BN2モータプログラムの終了時に、一貫して火災に注意してください。 Eで一番下のパネルに示す大きいユニットが別のユニットと外B43 ソーマユニットの衝突であることにも注意してください。 拡大図を表示するには、ここをクリックしてください 。

図6。外ソーマや神経の録音を使用してI1/I3運動ニューロンのいくつかを特定するための最適化された診断ツリー。この診断法は、識別子にそれをはるかに簡単に、I1/I3運動ニューロンを同定するための最小限の情報を必要とする懸濁した頬側マス調製物におけるまたは in vivo で fyの運動ニューロン。 B3はは、識別されたI1/I3運動ニューロンの中で最大のBN2ユニットを持っています。運動ニューロンの残りの部分では、B6およびB9はBN2とBN3両方の上の唯一の2つのニューロン、そのプロジェクトアール。 B9はB6よりもそれ以上の横方向のである。のみBN2上で投射ニューロンの残りの部分はまた、2つののグループに分けることができます。 B10およびB39及びいくつかの未知のニューロンを含まれていますBN2s経由して両側性にニューロンプロジェクトの一つグループ、。 B38、B43、及びB82が含まれていますのみBN2上の同側ニューロンプロジェクトの他のグループ、。 B38はB3およびB9の近くにあります。 B82は、( 図3を参照)B8にの近くにあります。 B43はB6の近くにあります。そのBN2ユニットは吸血パターンの端にある小さな、バーストとバーストである。

図7。ニューロンiの成功率の比較細胞外の技法または細胞内技法のどちらかを使用して力実験中の生歯。同じ力変換器·セットアップにより、我々は識別するために従来型の細胞内のテクニックを(大紫色のドット)を使用して、細胞外の技法(小さ な青いドット)および27実験を使用して35実験をやったI1/I3運動ニューロン。 x-軸は、実験の各タイプで同定されたI1/I3筋肉するためのモータニューロンのうち少なくとも数を示します。 y軸は実験の各タイプのパーセンテージ·成功率を示しています。たとえば、細胞外のの実験の35のうち19(54%)では、我々は、少なくとも5つの異なるI1/I3運動ニューロンを識別することができました。のみのうち1細胞内のの実験の27(4%)のでは、我々は、少なくとも5つのI1/I3運動ニューロンを識別することができた。それは、ニューロンを同定する際にれる成功率は実際の成功率細胞外の技法を使用してニューロンの任意の所与の数ためのはるかに高いであることは明らかである。
ディスカッション
そのような軟体動物(例えば、Lymnaea、らせん 、とアメフラシ )、モータープールの分析などの大型同定ニューロンを持つ動物では、通常、細胞内記録1,2,3,4を使用して行われます。このプロトコルでは、我々は独自に外技術を使用してモータープールのための運動ニューロンを同定する方法を説明します。我々は、このプロセスの実例として力の測定値を使用していました。一つは、筋肉の神経支配を測定する筋電図を使用することができます。簡単に言えば、これを行うには、プロトコルは、EMGのレコーディングにI1/I3筋肉の異なる領域にフック電極を取り付けるように変更する必要があります。
細胞外の技術は既に上述してきたそのうちのいくつかは細胞内の技術上のいくつかの利点があります。まず、細胞外の手法は、実験のために神経を準備するより少ない時間と労力を必要とし、ニューロンへのダメージが少なくなります。通常、それはBUCを準備するために20〜30分かかります外実験や細胞内の実験のために頬のマスに接続されている頬神経を準備するには、約1.5時間のためにCAL節。時間が経過するにつれて筋肉があまりアクティブになるので、神経節細胞実験の準備と細胞内のものとの間の時間差は、実験の成功のために重要である場合があります。 図7は I1 /のための運動ニューロンを同定するための成功率の比較を示しI3の筋肉は力の研究で細胞外または細胞内の技術を使用しています。全35外力実験(100%)で、我々はI1/I3筋肉のための少なくとも一つの運動ニューロンを同定することができた。 35のうち31(89%)は、細胞外実験では、少なくとも3 I1/I3運動ニューロンを同定することができた。 35のうち19(54%)は、細胞外実験では、少なくとも5つの異なるI1/I3運動ニューロンを同定することができました。対照的に、細胞内の実験の成功率はSAMとeの力変換器のセットアップが低かった。 27(85%)は、細胞内の実験のうち23で、我々は少なくとも1 I1/I3運動ニューロンを同定することができた。 27(30%)は、細胞内の実験のうち、8では、我々は、少なくとも3つのI1/I3運動ニューロンを同定することができた。唯一うち1 27(4%)は、細胞内の実験では、5 I1/I3運動ニューロンを同定することができた。したがって、同一の神経節内に複数のニューロンを特定する可能性が高い細胞技術とは対照的に、細胞外の技術を使用しています。
さらに、細胞外的な手法は同じ実験中に神経の両側に多くのニューロンにアクセスすることができます。通常、desheathingした後、細胞内電極のみdesheathedされた神経節の神経細胞側にアクセスすることができます。細胞内電極はその上のニューロンにアクセスするために例えば、2頬神経節(左側hemiganglion など )のいずれかが尾側を上にして固定されている場合、それは簡単になりますガングリオンの側面、 例えば 、B6、B9、B10、B39、B43と、そのようなB4、B5、B8a、B8B、B38とB82など神経節の吻側側のニューロンを、アクセスが困難。これとは対照的に、細胞外電極は神経節の適切な回転と同じ頬神経節の両側に多くのニューロンにアクセスすることができます。回転の角度は調節可能と可逆的である。これは、同じ神経節内に複数のニューロンを同定する可能性が高くなります。
細胞外電極は優しく神経細胞を覆うシースに押し付けているので、これらの電極は、膜中に大きな穴を作成し、被害を引き起こす可能性があり、神経細胞の中から引き出されることはありません、などの筋肉の動きの間に細胞内電極で発生します。信号の大きさは、筋肉の運動中の神経の動きに応じて変化します。時には大きな筋肉の動きの間に、細胞外のソーマ記録信号が減少される、あるいは失われたことに注意してください。しかし、我々は簡単にできますMOバックニューロン上に細胞外電極をVeと元の信号を復元。これは、準備が異なる行動応答を生成すると、筋肉が大きい収縮を発生させる、その間の行動研究、のために中断頬量産準備8に細胞外の手法を適用することが可能になります。たとえば、48中断頬マス実験のうち47(98%)で、我々はI1/I3筋肉のための少なくとも一つの運動ニューロンを同定することができた。 48(48%)が中断頬大量の実験のうち23で、我々は、少なくとも3つのI1/I3運動ニューロンを同定することができた。 48(23%)が中断頬大量の実験のうち11で、私たちは頬質量は摂食のような行動を行っていたとして、運動パターンの間にそれらからI1/I3筋肉や記録のために、少なくとも5つの運動ニューロンを同定することができた。細胞外の技術はまた、そのようなtを含む単離されたヘッド送り製剤など他のより複雑な半無傷の準備にも適用可能である彼触手、唇、あご、頬、質量、頬神経、脳神経節12,24,25,26。感覚入力はこのような製剤で摂食行動を引き出すために非常に重要であるので、細胞外の技術は、そのシンプルさと少ない有害機能の特に有用であろう。これまでの研究ではまた、識別し、慢性的に生体 18 に B4/B5を記録することが可能であることを示している。これらの以前の実験では、研究者が選択的にB4/B5をアクティブにするには、低電流(10〜20μA)BN2刺激を使用し、記録するためのB4/B5上記シースに短いポリエチレンチューブを接着し、その中にツイストのペアを挿入したステンレス鋼線。したがって、識別し、神経を覆うシース(Chestekとチール、未発表の結果)に接着されたポリエチレン管の電極を用いたin vivoでの運動ニューロンから記録することも可能である。
細胞外の技術はまた、いくつかのlimitatを持ってイオン。細胞外電極は小さすぎる、または神経節内であまりに深いニューロンを刺激するか、または記録するために、最初に、それは難しいだろう。それが細胞外刺激を介して表面ではありませんニューロンを活性化することはまだ可能であることに注意してください。しかし、我々のモデルは5ターゲットニューロンが隣接するニューロンよりも深いとき刺激が特異性を失う可能性があることを示しています。ニューロンが深くなると、電極対ソーマ距離は現在は近くの他の表面の神経細胞を活性化するのに十分な高さであり、このニューロンを活性化するために必要とされる以上と高くなります。ニューロンがあまりにも多くの電流で細胞外に刺激された場合第二に、それが破損していて、もはや反応しない;はるかに小さい電流が細胞内刺激で使用されている、けれどもあまりに多くの電流は、細胞内にも神経細胞を損傷することがあります。たまにソーマの記録はintracel未満の特定であるターゲットニューロンと隣接するニューロンの両方から複数のユニットが含まれていますlular記録。細胞外電極が同時に同じニューロンを刺激し、記録することはできませんので、また、それは、正確ではなく細胞内のテクニックよりも外を使用して、個々のニューロンの発火頻度を制御および監視するより難しいかもしれません。さらに、細胞外の手法は、運動前野ニューロンからのシナプス入力を記録することができません。また、我々はそれがシース27を除去せずにカルバコールを使用して神経を刺激することが可能であることを示してきましたが神経節が、desheathedされていない限り、特定のニューロンにイオン泳動の神経伝達物質を適用するのは難しいかもしれません。
細胞外の識別技術の限界を特定するのは困難なモータープールでいくつかのニューロンを作りました。 OベースのB3、B6、B9、B38、B43、B82と、この特定の例では、細胞外の技術は確実にアメフラシでI1/I3筋肉の運動ニューロンの大部分を同定nはソーマのサイズと位置、神経突起、筋肉の神経支配。しかし、我々はB10とB39を確実に識別することができませんでした。前の細胞内作業6,7 B10とB39はB4/B5地域とB6の領域との間頬核の尾側の2つの隣接するニューロンであることを示した。両方のニューロンはBN2sに両側性に投影します。 B10はB39神経支配I1/I3筋の前方領域に対し、I1/I3筋肉の真ん中と後方領域を神経支配する。ソーマの場所と神経突起の基準に基づいて、我々は、二国間で4つの異なる実験でBN2s上にそのプロジェクトつ以上の運動ニューロンを発見した。彼らのソーマの位置、筋肉の神経支配、そして運動パターン間に活動のタイミングが動物から動物にばらつきがあったので、我々は、彼らが同じニューロンであったかどうかわからなかった。したがって、我々は、理由の一貫性の欠如の細胞外技術を用いて、B10とB39を確実に識別することができませんでした。を一意に識別するには、私たちは、頬神経節ニューロンのより徹底的な調査を行う必要があり、そのような運動前野ニューロンB4/B5からシナプス入力し、細胞内の技術を必要とする送信機、への応答としての条件を追加する必要があるかもしれません。
適切な修正を加え、この技術は、 例えば I5筋肉10、またアメフラシのI2筋肉11、I4の筋肉12他のモータープールにも適用可能であるか、他のシステムに、 例えばLymnaea stagnalis 2は、Helix pomatia 3、ゴキブリ13、ゼブラフィッシュ14。一つはアメフラシでI5の筋肉の運動ニューロン(またアクセサリーradular閉筋またはARC 10,28として知られている)にこの手法を適用したい場合例えば、1つはBN3s代わりにBN2sの頬部に取り付けておく必要がありなぜなら、I5運動ニューロンB15及び同側BN3 6,7上のB16のプロジェクト。その後トン彼頬質量はEMGや力研究のI5の筋肉を露出させるために準備されるべきである。ニューロンは確実に減少準備で同定された後、最適化された診断方法はまた、将来の行動の研究のために作成することができます。
我々が説明した技術は、このようなマルチ電極アレイと電位感受性色素などの他の細胞外のテクニックと好意的に比較します。私たちの細胞外電極とマルチ電極アレイ30が刺激と記録の両方に使用することができるのに対し、電位感受性色素29テクニックは唯一、記録のために使用されます。マルチ電極アレイ29および電位感受性色素30の両方は同時に多くのニューロンからの信号を記録することができます。一つの細胞外電極のみをその先端の大きさと電極の位置に応じて1つまたは2つのニューロンから記録することがありますが、それは同時に神経節にいくつかを配置することは確かに可能であり、我々が行っているこれが正常。 体外多電極アレイ内の標準は8×8または6×10個の電極29を有する。電極が均等に配列で配布されていますので、頻繁に神経細胞が均等に分散されていないため、録音が取得される基礎となる神経細胞の同一性を決定するために挑戦して、信号の後処理重要、まだそのうちのいくつかされている本書は、この曖昧さを解決するために行わなければなりません。細胞外電極は単一の細胞体の上に配置されているため、これとは対照的に、基礎となるニューロンの身元は明らかである。したがって、多電極アレイと電位感受性色素は、複数の同時録音のためのより効率的かもしれないと思われます。しかし、我々の細胞外電極技術は、刺激と記録の両方のためのより良い選択を提供することがあります。
開示事項
我々は、開示することは何もない。
謝辞
この研究は、NIHの助成金NS047073とNSFの助成DMS1010434によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 名前 | 会社 | カタログ番号 | 注釈 |
| 塩化ナトリウム | フィッシャー·サイエンティフィック | S671 | 生物学、認定 |
| 塩化カリウム | フィッシャー·サイエンティフィック | P217 | 認定のACS |
| 塩化マグネシウム六水和物 | アクロスオーガニック | 19753 | 99パーセント |
| 硫酸マグネシウム·7水和物 | フィッシャー·サイエンティフィック | M63 | 認定のACS |
| 塩化カルシウム二水和物 | フィッシャーScientifc | C79 | 認定のACS |
| グルコース(ブドウ糖) | シグマアルドリッチ | G7528 | BioXtra |
| MOPSはbuffeR | アクロスオーガニック | 17263 | 99パーセント |
| カルバコール | アクロスオーガニック | 10824 | 99パーセント |
| 水酸化ナトリウム | フィッシャー·サイエンティフィック | SS255 | 認定された |
| 塩酸 | フィッシャー·サイエンティフィック | SA49 | 認定された |
| 単銃身のガラスキャピラリー | AMシステム | 6150 | |
| フレイミング·ブラウンマイクロピペットプラーモデルP-80/PC | サターインスツルメンツ | フィラメント使用:FT345B | |
| エナメルコーティングされたステンレス鋼線 | カリフォルニアファインワイヤー | 0.001D、コーティング時間 | |
| 家庭用シリコーン二グルー | GE | ||
| デュロクイックジェル瞬間接着剤 | ヘンケル社。 | ||
| AMのシステムモデル1700アンプ | AMシステム | フィルタ設定:I2神経/筋肉のための10から500 Hzであり、他のすべての神経のための300から500 Hzの | |
| Pulsemasterマルチチャンネルミュレータ | ワールド·精密機器 | A300 | |
| 刺激アイソレータ | ワールド·精密機器 | A360 | |
| AxoGraph X | AxoGraph科学 | 録音用のソフトウェア | |
| 金色のコネクタピン | 丸型 | SA3148 / 1 | |
| ゴールドコネクタソケット | 丸型 | SA3149 / 1 | |
| シルガード184シリコーンエラストマー | ダウコーニング | ||
| 100×15ミリメートルCrystalizingディッシュ | パイレックス | ||
| 高真空用グリース | ダウコーニング | ||
| ピペットチップ | フィッシャー·サイエンティフィック | 21-375D | |
| Minutienピン | ファイン科学ツール | 26002から10 | |
| モデリングクレイ | サージェントアート | 22から4400 | |
| エアーポンプをささやく | テトラ | 77849 | |
| 水族館チューブ | EHEIM | 7783 | 12月16日mm |
| エリートAirstone | ハーゲン | A962 | |
| Vannas春はさみ | ファイン科学ツール | 15000から08 | |
| デュモン5位ファイン鉗子 | ファイン医学工学総合研究電子ツール | 11254から20 | |
| キムワイプ | キンバリークラーク | 34155 |
参考文献
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved