Method Article
تحديد الخلايا العصبية الحركية خارج الخلية لعضلة حمام سباحة للسيارات في
In This Article
Summary
في الحيوانات الكبيرة مع الخلايا العصبية التي تم تحديدها ( على سبيل المثال الرخويات)، ويتم تحليل حمامات السيارات باستخدام تقنيات الخلايا 1،2،3،4. مؤخرا، قمنا بتطوير تقنية لتحفيز الخلايا العصبية خارج الخلية وتسجيل الأفراد في Aplysia californica 5. وصفنا الآن على بروتوكول لاستخدام هذه التقنية لتحديد وتوصيف فريد الخلايا العصبية الحركية داخل حوض المحرك.
Abstract
في الحيوانات الكبيرة مع الخلايا العصبية التي تم تحديدها (مثل الرخويات)، وتحليل حمامات السيارات ويتم باستخدام تقنيات الخلايا 1،2،3،4. مؤخرا، قمنا بتطوير تقنية لتحفيز الخلايا العصبية خارج الخلية وتسجيل الأفراد في californica Aplysia 5. وصفنا الآن على بروتوكول لاستخدام هذه التقنية لتحديد وتوصيف فريد الخلايا العصبية الحركية داخل حوض المحرك.
هذه التقنية خارج الخلية من المزايا. أولا، يمكن تحفيز كهربائي خارج الخلية والخلايا العصبية من خلال تسجيل غمد 5، لذلك لا بد من إزالتها. وهكذا، سوف تكون أكثر صحة الخلايا العصبية في التجارب خارج الخلية مما كان عليه في تلك الخلايا. ثانيا، إذا العقد يتم تناوب المناسبة من قبل تعلق من غمد، يمكن الوصول إلى الخلايا العصبية خارج الخلية أقطاب على جانبي العقدة، مما يجعل من أسهل وأكثر كفاءة لتحديد الخلايا العصبية متعددة في إعداد نفسه. الثالث، extracelluلار الأقطاب لا تحتاج إلى اختراق الخلايا، وبالتالي يمكن نقلها بسهولة ذهابا وإيابا بين الخلايا العصبية، مما تسبب في أضرار أقل لهم. هذا هو مفيدة بشكل خاص عند واحد يحاول تسجيل متعددة الخلايا العصبية خلال تكرار أنماط الحركية التي قد تستمر لدقائق فقط. الرابعة، أقطاب خارج الخلية هي أكثر مرونة من تلك الخلايا خلال حركات العضلات. قد الأقطاب الكهربائية بين الخلايا وتلف سحب الخلايا العصبية خلال تقلصات العضلات. في المقابل، يتم الضغط بلطف منذ الأقطاب خارج الخلية إلى الخلايا العصبية وغمد أعلاه، فإنها عادة البقاء فوق الخلايا العصبية ذاتها خلال تقلصات العضلات، وبالتالي يمكن استخدامها في الأعمال التحضيرية أكثر سليمة.
لتحديد الخلايا العصبية الحركية بشكل فريد لمجموعة السيارات (وخاصة العضلات I1/I3 في Aplysia) باستخدام أقطاب خارج الخلية، يمكن للمرء استخدام الميزات التي لا تتطلب قياسات داخل الخلايا كمعايير: سوما الحجم والموقع، الإسقاط محور عصبي، وتعصيب العضلات 4، 6،7. لتجمع السيارات المستعملة خاصة لتوضيح هذه التقنية، سجلنا من الأعصاب الشدق 2 و 3 لقياس التوقعات محور عصبي، وقياس قوات تقلص العضلات I1/I3 لتحديد نمط تعصيب العضلات لالخلايا العصبية الحركية الفردية.
علينا أن نبرهن العملية الكاملة لأول الخلايا العصبية الحركية باستخدام تحديد تعصيب العضلات، ثم تميز توقيتها خلال أنماط السيارات، وخلق طريقة مبسطة لتحديد التشخيص السريع. طريقة مبسطة وسريعة أكثر التشخيص متفوقة للتحضير أكثر سليمة، على سبيل المثال في إعداد الشامل الشدق علقت 8 أو في الجسم الحي 9. ويمكن أيضا أن تطبق هذه العملية في أحواض السيارات الأخرى في 10،11،12 Aplysia أو في النظم الحيوانية الأخرى 2،3،13،14.
Protocol
1. إعداد طبق تسجيل
- وخلال التجارب محول القوة، يتم وضع العقد الشدق، العقدة المخية، والشدق الشامل في طبق بيركس الجولة والمتخصصة للدراسات القوة.
- للحث على ابتلاعي مثل الأنماط في التجارب، ونحن بحاجة إلى تطبيق غير hydrolyzable كرباكول ناهض الكولينية إلى العقدة المخية 15. لتجنب الاتصال المباشر من كرباكول على العقد والشدق والشدق الشامل، وهناك حاجة إلى غرف منفصلة لعزل العقدة المخية من العقد الشدق والشدق كتلة (الشكل 1).
- منذ كتلة الشدق هو أكثر سمكا بكثير من العقد الشدق، فلن يتم وضعها على نفس المستوى. ولذلك، ينبغي أن يكون هذا الطبق يعود لدائرة العقدة المخية (منطقة A في الشكل 1)، وهو منصة الأوسط للالشدق العقد (C منطقة في الشكل 1)، وغرفة أعمق بكثير اجهة لكتلة الشدق (منطقة D في الشكل 1).
- لإنشاء هذا الطبق، وتبدأ مع طبق بيركس 100x15 الجولة (15 ملم عالية، 100 مم في القطر). وبناء الطبق تتطلب عدة يصب من Sylgard. اتبع الإرشادات المتوفرة مع المنتج Sylgard. ويجب أن يسمح لتعيين Sylgard بين يصب مختلفة.
- وبور الأول هو لإنشاء أعلى مستوى من Sylgard في الصحن (B منطقة في الشكل 1)، وهو الجدار الفاصل بين المنصة والقاعة الأوسط مرة أخرى.
- استخدام اثنين من الصلصال المساند لعزل المنطقة عن الجدار Sylgard (منطقة B في الشكل 1). معطف من الطين النمذجة المساند مع غلاف بلاستيكي حيث سيتصل Sylgard لتسهيل إزالتها. ضمان الاختام مشددة على الحواف، حيث الطين النمذجة سوف اتصل الطبق، للحد من التسرب.
- صب Sylgard في الجزء بين المساند النمذجة الطين ما يقرب من 2 إلى أعلى الطبق. السماح للSylgard تعيين بالكامل بين عشية وضحاها. والحفاظ على الطبق في مكان دافئ لحثأسرع الإعداد. إزالة الطين النمذجة المساند وتنظيف أي بقايا الطين على Sylgard.
- المقبل، يجب سكب الدائرة مرة أخرى (منطقة A في الشكل 1) ومنهاج الأوسط (C منطقة في الشكل 1).
- وضع حامل الطين النمذجة حوالي 5 ملم بعيدا عن السطح الأمامي للSylgard للقسم الأوسط من منصة (منطقة C).
- صب Sylgard إلى المقاطع مرة أخرى لدائرة (منطقة A) والمتوسطة منصة (منطقة C) حتى ارتفاع حوالي 3-5 ملم تحت مستوى أعلى الجدار Sylgard الأولى (منطقة B). ينبغي السطح Sylgard للغرفة مرة أخرى تكون أقل بقليل من النظام الأساسي لتجنب تسرب الأوسط من غرفة تحتوي على العودة إلى منصة كرباكول الأوسط. مرة أخرى، والسماح للSylgard تعيين بالكامل بين عشية وضحاها ومن ثم إزالة الطين دعم النمذجة.
- والخطوة الأخيرة هي لقطع الشق في وسط الجدار Sylgard لتوفير قناة لحروف العطف المخي الشدق (CBCs) للذهابمن خلال منصة بين المتوسطة وغرفة الظهر. يجب عرض هذا الشق يكون حوالي 3-4 ملم، وهو ما يكفي لCBCs واسعة. ينبغي الجزء السفلي من الشق لا يكون أقل من سطح Sylgard من منصة الأوسط لمنع التسرب. ويمكن استخدام شفرة مشرط لقطع الشق.
2. القطب إعداد
- سحب أسلاك الزجاج من خارج الخلية واحد الماسورة الشعرية الزجاجية باستخدام المشتعلة براون micropipette مجتذب كما وصفها مكمانوس وآخرون 8 في القسم 3.1. مع خيوط FT345B في مجتذب، وإعدادات برنامجنا الحرارة النموذجية هي 480، سحب 50، سرعة 13، والوقت 20، ولكن لاحظ أن إعدادات ستكون مختلفة عن خيوط مختلفة. هذا البرنامج يخلق الأقطاب في سحب واحد مع عدم وجود مرحلة تلميع النار. يجب أن حجم رأس القطب يكون أصغر من حجم أجسام الخلايا. لالخلايا العصبية الحركية تتراوح بين 50 إلى 400 ميكرومتر ميكرومتر في القطر سوما، وdiamete الداخليةيجب RS من الأقطاب الزجاج خارج الخلية تكون حوالي 40 ميكرومتر والمقاومة ينبغي أن يكون لها حوالي 0.1 MΩ عندما أنها مليئة المالحة Aplysia.
- سحب أسلاك من أنابيب البولي اثيلين شفط باستخدام موقد بنزن. قطع قطعة من أنابيب البولي اثيلين حوالي 10 سنتيمترا. عقد أنابيب على طرفي ووضعه قريبة جدا من اللهب الناتجة عن الموقد بنسن في حين تناوب الأنبوب حتى يصبح لينة من الحرارة. تمتد على طول الأنبوب بعناية طوله بينما تتحرك بعيدا عن اللهب. فإن الجزء الأوسط من أنابيب استطال وتضييق كما يتم سحبها أنابيب.
- قطع الأنابيب في النصف لتشكيل أقطاب شفط اثنين. عموما يتم تطبيق الشفط الأقطاب إلى أقاصي قطع الأعصاب أو العضلات، على الرغم من أنها في بعض الأحيان يمكن أن تطبق عابرة.
- خلق أقطاب هوك للتسجيلات العصبية بعد بروتوكول صفها مكمانوس وآخرون 8 في أقسام 3،2-3،13. هذه الأقطاب هي especiحليفا مفيدا عندما لا يتم قطع الأعصاب أو العضلات.
3. ربط الكهربائي مرفق
- تشريح الحيوان وإزالة كتلة الشدق بعد بروتوكول الموصوفة في مكمانوس وآخرون .. 8 الباب 4.
- للتسجيل والتحفيز، يمكن إرفاق أقطاب هوك لعدد من الأعصاب المختلفة.
- لتوصيف أنماط كما حدث في الجسم الحي من قبل كولينس وChiel 9، يجب الحصول على تسجيلات من العصب والعضلات I2 الذي يشير إلى المرحلة مطل على إطعام 16، العصب radular (RN) الذي يشير إلى إغلاق الطعام الممسك 17، الشدق العصب 2 (BN2) والشدق العصب 3 (BN3) التي تشير إلى مرحلة التراجع 17،18. المرفقات من الأقطاب الكهربائية هوك التالي إجراء مماثل لتلك التي وصفها آخرون مكمانوس 8، الباب 5.
- مواقع هذه الأعصاب الرجوع إلى التخطيطي لجهاز التغذية Aplysia هو مبين فيالرقم 2 من مكمانوس وآخرون 8. نلاحظ أن trifurcates BN2 إلى فروع أ، ب، ج وقبل الذهاب تحت العضلات I1 في الأخدود الأفقي. فرع هو أول فرع لفصل من الجذع الرئيسي، والمجاور لBN3.
- تم استخدام تسمية الفروع أ، ب، ج وقبل Warman وChiel 18. فروع أ، ب، ج وتتوافق مع الفروع 3، 2، و 1، على التوالي، في التسميات المستخدمة من قبل Nargeot وآخرون 19. علاوة على ذلك، RN، BN1، وBN2، وBN3 لتتوافق مع الأعصاب 1 و 6 و 5 و 4 على التوالي، في التسميات المستخدمة من قبل كاندل 20 و سكوت وآخرون 21
- لدراسة تعصيب العضلات عضلة I1/I3، وجميع ما عدا الأعصاب الأعصاب الشدق 2 سوف تكون قطعت من كتلة الشدق خلال التجارب. وهكذا، كنا قطب هوك لتسجيل من BN2. <لى> ومنذ لن العصب I2 وRN وضمها الى كتلة الشدق، وأنها صعبة جدا للوصول باستخدام أقطاب هوك، فمن الأفضل لتطبيق أقطاب الشفط لتسجيل من لهم بدلا من ذلك. سنقوم بشرح تطبيق أقطاب شفط في الباب 7.
- إما استخدام القطب الكهربائي أو ربط شفط لتسجيل من BN3، لأنه من السهل للوصول باستخدام أي نوع من القطب. اخترنا لاستخدام الخطاف لقطب تسجيلات BN3 للحد من عدد من المتلاعبين لعقد الأقطاب الشفط، وتوفير مساحة للالمتلاعبين أخرى أو المعدات.
- إرفاق الكهربائي لربط فرع من BN2 (BN2-A) لبدء رفض مثل أنماط أثناء التجارب. من المفيد ربط الكهربائي إرفاق إضافية إلى BN2-وعلى الجانب الآخر، وذلك لأن بعض الخلايا العصبية تستجيب بشكل مختلف لالمماثل مقابل المقابل BN2 A-التحفيز.
- للمساعدة في التمييز بين الخلايا العصبية مع توقعات من جانب واحد مقابل الثنائية، فإنهمفيد أيضا لإرفاق أقطاب هوك لBN2 وBN3 وعلى الجانب الآخر من العقد الشدق.
4. العقد وإعداد العضلات
- وسيتم إعداد العقد الشدق، العقدة المخية والشامل للتجارب الشدق محول القوة، التي يتم إرفاق العقدة المخية إلى العقد عن طريق الشدق CBCs ويتم إرفاق الشامل الشدق إلى العقد عن طريق الشدق BN2s فقط.
- بعد ربط الأقطاب هوك، وقطع العصب الدهليزي 1 (BN1) والعصب المريء (EN) ثنائي، وقطع في نقطة التعلق كتلة الشدق.
- سحب العقدة المخية إلى الأمام لنقلها للخروج من الطريق من العضلات I2. اجراء خفض في عضلة I2 على كيس radular، تمديد خفض أفقيا والأمامية في كلا الاتجاهين، وسحب رفرف من العضلات I2 إلى الأمام لفضح العصب radular. قطع فرعين RN والتأكد من أن فروع هي فترة كافية لمرفق القطب الشفط.
- Continue خفض I2 في دائرة واسعة حول العقد الشدق، والحرص على عدم قطع أو BN2s BN3s، وحتى يمكن أن العقد الشدق والجزء من عضلة المرفق I2 يفصل تماما من كتلة الشدق. قطع BN3s الثنائية عند نقطة التعلق كتلة الشدق، وراء ربط الكهربائي المرفق.
- تطبيق طبقة رقيقة من الشحوم فراغ إلى الشق في طبق تسجيل المذكورة أعلاه التي تربط الغرفة ذهابا ومنصة الأوسط، وذلك باستخدام معلومات سرية ماصة لالتقاط الكرة من الشحوم فراغ وانتشر أكثر من الشق.
- تطبيق طبقة رقيقة من الغراء السريع جل سوبر لأسفل الزجاج الأمامي للغرفة حيث سيتم وضع كتلة الشدق، عادل امام قاعدة Sylgard من منصة الأوسط.
- نقل بعناية العقدة المخية، والشدق العقد الشامل الشدق إلى الطبق تسجيل (الشكل 1) وصفها في القسم 2، والتأكد من أن يتم سحبها أي من أقطاب ربط بإحكام، والتي يمكن أن تلحق الضرر الأعصاب.
- وضع بعناية الشامل الشدق على الغراء في قاعة أمام الطبق التسجيل، لضمان أن يتم لصقها سطحه البطني في الجزء السفلي من الطبق. تأكد من الحفاظ على العقد وأقطاب من لمس الغراء. إضافة Aplysia المالحة 8 (460 مم كلوريد الصوديوم، و 10 ملي بوكل، 22 ملم MgCl 2، 33 مم MgSO 4 و 10 ملي CaCl 2، 10 الجلوكوز مم، 10 مم اجتماعات الأطراف، ودرجة الحموضة 7،4-7،5) إلى الطبق، والتي من شأنها أن تحفز الغراء لتعيين.
- إذا يجب أن يتم نقل الطبق إلى آخر المجهر لإعداد العقد الشدق للتسجيلات سوما خارج الخلية، تكون حذرة للغاية مع الأقطاب هوك. مجموعة الأقطاب الكهربائية على جانب واحد من كتلة الشدق معا، وأيضا مجموعة من الأقطاب الكهربائية على الجانب الآخر من كتلة الشدق معا. عقد بعناية من قبل الأقطاب استيعاب الشريط المختبر الذي يغطي أسنان في الموصل، مما يجعل مرة أخرى من أن يتم سحب أي من الأقطاب الكهربائية بإحكام.
- عندما يتم وضع صحن تحت المجهر، القطبوينبغي رايات ق بلطف على جانبي الصحن والباقي على المنصة بجوار الطبق.
- وأثناء فترات الراحة بين مراحل التجربة، تهوية المياه المالحة في قاعة الشامل الشدق باستخدام airstone الحوض.
- استخدام ملقط للاستيلاء على غمد من العقدة المخية وتسحبه مرة أخرى إلى غرفة، وضمان أن CBCs تشغيل من خلال الشق. دبوس العقدة الدماغية باستخدام الأعصاب غير CBCs لتجنب الأضرار التي لحقت CBCs سليمة.
- تطبيق أكثر الشحوم فراغ على CBCs، ثم قم بإضافة أكثر المالحة Aplysia لمجلسي الطبق، بحيث يتم المغمورة تماما العقد. تأكد من أن الجزء العلوي من الشحوم فراغ هو أعلى قليلا من الجدار Sylgard بحيث لا تسرب سيحدث بين الدوائر.
- لتحقيق الاستقرار في العقد الشدق، دبوس لأول مرة ينتهي من BN3s، ثم BN1s وENS وعلى قاعدة من منصة Sylgard الأوسط (الشكل 2). ومنذ أن سجلت BN3s باستخدام القطب هوكق، يجب وضع دبابيس أكثر من النقاط بشكل أقصى المرفقات من الأقطاب الكهربائية هوك.
- استخدام اثنين من الدبابيس، عازمة 90 درجة، والسنانير لتمتد وترسيخ CBCs، بحيث لن يكون معطوبا CBCs (الشكل 2).
- انخفاض الرقم فروع RN بين غرفة الظهر والعقد الشدق. ثم سوف تكون العضلات I2 على رأس RNS. لفضح العصب I2، استخدم ملقط للاستيلاء على العضلات I2 وتسحبه خلال العقد الشدق. دبوس ركنين من العضلات I2 لتجنب تلف في العصب I2.
- قطع العصب I2 البعيدة إلى النقطة التي دمج فرعيها في عضلة I2. تأكد من معصب لا تزال العضلات لتكون قابلة للمقارنة إلى التسجيلات في الجسم الحي. قطع بعيدا بقية العضلات I2 والوجه العصب I2 العودة ويعلقون عليه بين السلطتين RN اثنين (انظر الشكل 2، الشكل).
- ضبط مواقع الاوتاد لتمتد والتوتر إضافة إلى العصبية إذا هو فضفاض جدا، أو أن يفرج عنه إذا كان التوتر NERVه هو ضيق جدا. لزيادة استقرار العقد الشدق، إضافة المزيد من دبابيس على غمد بين الأعصاب.
- منذ يتم وضع العقد الشدق الجانب الذيلية حتى، تدوير العقد الشدق إذا الخلايا العصبية ذات الاهتمام على الجانب منقاري. لتدوير واحدة من العقد 2 الشدق، استخدم ملقط غرامة لانتزاع بعض الزيادة في غمد CBC حيث تقع بالقرب من العقد الشدق ويعلقون عليه بين BN2 وBN3 و. في بعض العقد، قد يكون أكثر ملاءمة لحفظ عليه بين CBC وBN3.
- إضافة دبوس إضافية على غمد من العقدة الشدق على الجانب بالقرب من غرفة الاستقبال للحد من حركة العقدة الشدق.
- لخفض غمد يغطي العقد الشدق، استخدم ملقط غرامة للاستيلاء على غمد على إغلاق الجانب إلى الدائرة مرة أخرى، ومن ثم قطع غمد الزائدة مع مقص غرامة دون تعريض الهيئات الخلية. من أجل تقليل الضرر، وإزالة فقط الحد الأدنى من غمد اللازمة لرؤية أجسام الخلايا.
- بعد ريتم قطع غمد انه من العقد الشدق، وسحب العصب وI2 RNS على مدى العقد الشدق ويعلقون عليهم بين العقد والشدق غرفة الاستقبال لتدوير زيادة العقد الشدق. (انظر الشكل 2).
- لتغسل أي كلوريد المغنيسيوم المتبقية 8 التي تم استخدامها لتخدير الحيوان قبل التشريح، استبدال المالحة Aplysia في الطبق مع المالحة Aplysia الطازجة.
5. ربط كهربائيا أقطاب هوك
- بعد إعداد العقد والعضلات، ونقل الطبق بعناية إلى الاهتزاز العزلة الجدول للتجارب.
- إرفاق جميع دبابيس الكهربائي لمآخذ على الكابلات BNC التي تتصل مضخمات (AM 1700 نموذج مكبر للصوت أنظمة). مرة أخرى، تأكد من أن لا يتم سحب الأقطاب بإحكام أثناء القيام بذلك. تأكد من أن يتم بشكل صحيح تعلق الأقطاب إلى الكابلات على النحو المناسب وأن أقطاب صحيحة.
6. إنشاء أقطاب الزجاج خارج الخلية لتسجيلات سوما
- ملء مع القطب المالحة Aplysia باستخدام حقنة تعلق على قطعة من أنابيب البولي اثيلين من 15-20 سم حولها. نعلق نهاية خالية من أنابيب البولي اثيلين إلى نهاية القطب الزجاج. التراجع على المكبس من المحاقن لتملأ بمحلول ملحي Aplysia القطب.
- وضع الزجاج مملوءة الكهربائي خارج الخلية في الشق لصاحب تتلاعب على. استخدام مناور لوضع القطب الكهربائي في تلميح المالحة التي تحتوي على العقد Aplysia الشدق.
- إدراج سلك كلوريد الفضة / فضية دبوس ملحوم على الذهب موصل ذكر في القطب لتكون بمثابة السلك التسجيل. وضع سلك آخر كلوريد الفضة / فضية دبوس ملحوم على الذهب موصل ذكر المالحة مباشرة في Aplysia داخل القسم من الطبق الذي يحتوي على تسجيل العقد الشدق ليكون بمثابة مرجع السلك. ربط كل التسجيل البريد وأسلاك الإشارة إلى كابل BNC الذي يتصل مكبر للصوت.
- إذا كان هناك مساحة كافية لمزيد من المتلاعبين، يمكن إضافة أقطاب إضافية الزجاج خارج الخلية لتسجيل الخلايا العصبية متعددة في نفس الوقت.
7. إنشاء أقطاب شفط للتسجيلات العصب
- تقليم نهاية ضيقة من القطب الشفط تلميح لمباراة قطر العصب. ينبغي أن القطر الداخلي للطرف القطب تكون مشابهة لأو أصغر قليلا من قطر العصب لضمان شفط مشددة.
- منذ العصب I2 وRN وقريبة جدا من بعضها البعض، ويمكن عقد من قبل أقطاب تتلاعب نفس لتوفير مساحة. وضع قطبين في درجتين من نفس المالك. تدوير القطبين وضمان النصائح هي قريبة من الآخر. اختيار واحد منهم لتسجيل العصب I2، والآخر لتسجيل RN.
- مكان غيض الكهربائي في محلول ملحي Aplysia داخل recordinز الطبق الذي يحتوي على العقد الشدق. نعلق نهاية خالية من أنابيب البولي إيثيلين على حقنة لشفط القطب. استخدام حقنة لملء مع القطب المالحة Aplysia. نقل معلومات سرية على مقربة من القطب نهاية العصب المستهدف، أي العصب I2، واستخدام المحاقن لامتصاص العصب في القطب. وينبغي أن طول العصب داخل القطب يكون حول 0،5-1،0 مم لضمان ختم ضيقة.
- تكرار الشفط الكهربائي لأن تعلق على RN.
- توصيل الأقطاب الكهربائية إلى كابلات BNC المقابلة كما هو موضح في القسم 6.3.
8. إنشاء محول لقياس قوة انقباض العضلات I1/I3
- لإرفاق محولات القوة لعضلة، استخدم خيوط الحرير. ثني الإبرة منحني كل غرزة، وربط الخيط إلى محول القوة. الاستيلاء بلطف ورفع كمية صغيرة من العضلات مع ملقط و، وعقد إبرة في مجموعة أخرى من الملقط، إدراجالإبرة من خلال العضلات إلى نقطة عازمة في الإبرة (الشكل 1).
- يمكن تركيبها محولات إما أفقيا أو ظهريا على العضلات I1/I3. مرفق ظهري يسمح قياس تقلصات التي حركها تفعيل الجانب إما إلى اليسار أو اليمين من العضلات. سوف تظهر المرفقات الوحشي أقوى قوات لغالبية الخلايا العصبية، ولكن سوف لا تسمح قياس انكماش على الجانب الذي يتم إرفاق محول.
- للمساعدة في تحديد الخلايا العصبية التي قد تفعيل المناطق الأمامية، الخلفية، أو كليهما I1/I3، إرفاق محول القوة إلى الجزء الخلفي من عضلة، فقط الأمامي للأنسجة البلعوم، وإرفاق آخر محول القوة إلى الجزء الأمامي لل العضلات، في الفكين (الشكل 1؛ السنانير علما).
- محولات رفع المفعول الى حين سحب خيوط مشدود، ولكن لا الإطالة الزائدة لا. للتحقق من ذلك، عرض قياس قوة من محول عندما خياطة لديه بعض الركود في الاولر، ثم ارفع حتى محول القياس هو أعلى قليلا من مستوى خط الأساس هذا.
9. تحديد الخلايا العصبية الحركية داخل حمام سباحة للسيارات
- يصف هذا البروتوكول عملية لتحديد الخلايا العصبية الحركية خارج الخلية داخل حوض المحرك. استخدمنا برنامج مسجل المحاور لرصد نشاط الخلايا العصبية الفردية والأعصاب المتعددة، والعضلات (EMG إشارة أو قوات الانكماش). في هذا البروتوكول، كنا القوات تقلص العضلات وكمثال لعملية تحديد الخلايا العصبية الحركية، وفي تجارب أخرى، كنا EMG أيضا، والإعداد لمثل هذه التجارب هي مشابهة جدا (انظر المناقشة).
- لتحديد موقع الخلايا العصبية مرشح، استخدم مناور للضغط بلطف غيض من القطب الزجاج خارج الخلية أسفل على غلاف أكثر من مركز الخلايا العصبية سوما 5 (الشكل 3)، والذي هو أفضل مكان لتحفيز والانتقائية تسجيل 5. منذ عتبة و الحاليةأو تنشيط الخلايا العصبية يزيد خطيا مع المسافة الكهربائي إلى سوما 5، فإن الانتقائية التحفيز تصبح أسوأ عندما يتم نقل القطب بعيدا عن وسط الخلايا العصبية المستهدفة نحو الخلايا العصبية المجاورة.
- لتحديد الخلايا العصبية الحركية، أولا تحفيز الخلايا العصبية مباشرة باستخدام الزجاج الكهربائي خارج الخلية لضمان أن هذه الخلايا العصبية فقط وإطلاق النار، ودراسة ما إذا كان يعصب العضلات. ثم، خارج الخلية العصبية من هذا السجل لإنشاء واحد مقابل واحد العلاقة بين خارج الخلية وتسجيل سوما التسجيلات العصبية، التي هي أيضا حاسمة لتحديد الخلايا العصبية.
- منذ مكبرات الصوت خارج الخلية أكثر لا تسمح التحفيز في وقت واحد وتسجيل قناة في، تعيين قناة تستخدم لتنشيط وتسجيل سوما (القناة سوما) إلى وضع التحفيز وتطبيق موجز انوديك الحالية (على سبيل المثال 6 ميللي ثانية لالخلايا العصبية Aplysia 5) إلى سوما (أرقام 4A، 5A، السهام ملاحظة 1 طن كلا الرقمين)، بدءا من تيار منخفض (مثل 200 ميكروأمبير)، وزيادة تدريجيا الحالي حتى رشقات نارية الخلايا العصبية.
- مرة واحدة يتم تنشيط الخلايا العصبية للانفجار، ينبغي للمرء التبديل على الفور القناة سوما من وضع التحفيز لوضع التسجيل (أرقام 4A، 5A، السهام الملاحظة 2 في كل من الأرقام). ومع ذلك، ستظل هناك تأخير بين التحفيز وتسجيل سوما بسبب تأخر استجابة الإنسان.
- إذا كانت الخلايا العصبية حرائق لفترة معقولة من الزمن، وينبغي أن يكون من الممكن لمراقبة واحد مقابل واحد إمكانات العمل المقابلة من تسجيل سوما وعلى العصب (ق) من خلال المشاريع التي العصبون (أرقام 4B، 5B، علما خطوط متقطع )، فضلا عن القوات التي تولدها الخلايا العصبية (أرقام 4A، 5A، علما صناديق زرقاء). إذا توقف إطلاق الخلايا العصبية قبل تسجيل سوما يبدأ، وزيادة الحالية لتنشيطه لفترة أطول.
- نسبة الإشارة إلى الضوضاء من خارج الخليةتسجيلات يعتمد على موقع وحجم سوما القطب. سوف تكبر تسجيل خارج الخلية وزيادة حجم سوما والنقصان مسافة القطب إلى سوما. منذ الضوضاء تختلف فقط في نطاق ضيق، فإن نسبة الإشارة إلى الضوضاء تزيد أيضا كما يزيد حجم سوما والمسافة الكهربائي إلى سوما النقصان. مجموعة الأكثر شيوعا من نسبة الإشارة إلى الضوضاء هو 4:01 حتي 08:01.
- ويمكن التعرف على الخلايا العصبية الحركية استنادا إلى خصائصها، مثل الموقع سوما، الإسقاط العصبية والغدد العرقية العضلات 4،6،7. منذ المرفقة فقط BN2s اثنين إلى كتلة الشدق، من خلال رصد النشاط على BN2s، يمكن للمرء التأكد من أن يحدث فقط قوة تقلص العضلات من الخلايا العصبية تفعيلها من خلال تحفيز خارج الخلية.
- على سبيل المثال، B3 هي الخلايا العصبية الحركية الكبيرة للعضلة I1/I3 (300-400 ميكرون في القطر سوما في الحيوانات وزنها 200 حتي 350 غرام)، وتقع على الجانب منقاري من العقدة الشدق (الشكل 3 ). مشروعات تكنولوجيا المعلومات إلا من خلال BN2 المماثل، ويعصب كل الأجزاء الأمامية والخلفية من العضلات I1/I3. معظم الوقت، وتفعيل فإنه ينشئ أكبر من قوة الأمامي الخلفي (8 من أصل 9 تجارب).
- بعد تبين وجود الخلايا العصبية، يمكن تسجيل النشاط في السلوكيات مثل الرضاعة مختلفة عبر القطب الزجاج خارج الخلية (أرقام 4 و 5)، والتي يمكن استخلاصها على النحو المبين أدناه. فإن تسجيل خارج الخلية على سوما يكون أكثر تحديدا بكثير من التسجيلات العصبية، والتي تشمل نشاط الخلايا العصبية عديدة ومختلفة.
- للحث على برامج مثل السيارات egestive، وتحفيز BN2 واحد مع 1-2 دقيقة من البقول 19 (2Hz، كل نبضة هي 1 ميللي ثانية). هذا التحفيز يولد موثوق أنماط egestive في هذا الإعداد. مع الحالية كافية (على سبيل المثال 300 ميكروأمبير)، قد تستمر لأنماط مدة التحفيز. في بعض الأحيان سوف يكون هناك واحد أكثر النمط الذي يحدث بعد فترة وجيزةتحفيز ينتهي.
- للحث على برامج مثل السيارات ابتلاعي، وضع بلورات قليلة من كرباكول الصلبة مباشرة على غمد من العقدة المخية 15. إذا كان أحد يريد أن تحكم في مستوى التعرض كرباكول، استخدم محلول كرباكول مم 1 إلى 10 في Aplysia المالحة. تركيزات أعلى من المرجح أن تحفز الاستجابات. أنماط متكررة تبدأ عادة خلال خمس دقائق، ويمكن أن تستمر لنحو عشرة الى خمس عشرة دقيقة قبل البدء في الجري.
- بعد الغسيل عدة مرات كرباكول وانتظار ما لا يقل عن 30 دقيقة، يمكن إضافة تطبيق لاحقة من كرباكول إلى العقدة المخية للحث على مزيد من الأنماط الحركية مثل ابتلاعي.
- بعد أن تم التعرف على الخلايا العصبية الحركية متعددة لتجمع السيارات خاصة، وتميزت خلال البرامج الحركية، يمكن للمرء وضع طريقة مبسطة إلى حد كبير التشخيص التي تتطلب الحد الأدنى من المعلومات لتحديد هذه الخلايا العصبية بسرعة في العمل في المستقبل (الشكل 6 </ STRONG>)، على سبيل المثال في الأعمال التحضيرية الشامل الشدق مع وقف التنفيذ أو في الجسم الحي. قد تشمل معايير حجم سوما والموقع، الإسقاط العصبية، حجم وحدة على الأعصاب، وتوقيت النشاط خلال أنماط الحركية.
النتائج
أرقام 4 و 5 اظهار النتائج المعتادة المستخدمة لتحديد اثنين من الخلايا العصبية الحركية I1/I3. ويبين الشكل 4 التسجيلات سوما من الخلايا العصبية الحركية الكبيرة، B3، خلال أنماط egestive مثل ومثل ابتلاعي-(أرقام 4C، 4D). واحد مقابل واحد المسامير المقابلة على قناة سوما وقناة BN2 المماثل (4E الشكل) أن تمت المحافظة على خصوصية التسجيل سوما B3 خلال الأنماط. B3 حرائق خلال مرحلة التراجع في منتصف إلى أواخر الأنماط. من الشكل 4 والنتائج الأخرى (لا يظهر)، وجدنا أن وحدة من BN2 B3 دائما أكبر BN2 حدة. وبالتالي، فإنه يمكن أيضا يتم الكشف عن تسجيلات مباشرة من BN2.
ويبين الشكل 5 التسجيلات سوما من الخلايا العصبية الصغيرة، B43، خلال أنماط egestive مثل ومثل ابتلاعي-(أرقام 5C، 5D). واحد مقابل واحد المسامير المقابلة على قناة سوما وقناة BN2 المماثل (الشكل 5E) تظهر أيضا أن الحفاظ على خصوصية التسجيل سوما B43 خلال الأنماط. B43 الخلايا العصبية رشقات نارية في نهاية المرحلة تراجع خلال الأنماط. منذ حدة BN2 من B43 صغير، قد يكون من الصعب التعرف عليه من التسجيلات BN2 دون تسجيل سوما، ولكن لأنه معظم حرائق بشكل مكثف في نهاية نمط المحرك BN2، لا يزال نهاية انفجار B43 في تحديد من BN2 التسجيلات وحدها.
ويبين الشكل 6 شجرة الأمثل التشخيصية التي لا تتطلب تعصيب العضلات كمعيار، مما يجعل من الاسهل بكثير لتحديد خارج الخلية في الخلايا العصبية الحركية في إعداد I1/I3 الشامل الشدق مع وقف التنفيذ أو في الجسم الحي. وقد وضعت الشجرة التشخيص، ومع ذلك، باستخدام القوة والتدابير EMG، وبالتالي يوضح كيف أن التقنيات في هذا البروتوكول يمكن أن يؤدي إلى تبسيط تحديد الخلايا العصبية الحركية.
: المحافظة على together.within صفحة = "دائما"> 
الشكل 1. التخطيطي من الإعداد العام وطبق لدراسات القوة. صورة العلوي يظهر العرض من أعلى. صورة تظهر أسفل الجانب الشخصي (الموافق خط متقطع في منتصف العرض من أعلى). ويعلق العقدة المخية إلى Sylgard في قاعة عودة (منطقة A). معلقة على العقد الشدق إلى Sylgard على منصة الأوسط (منطقة C). يتم فصل الدائرة مرة أخرى ومنهاج الأوسط من خلال جدار Sylgard مرتفعة (منطقة B). وحروف العطف المخي الشدق (CBCs) تمر من خلال الشق في الجدار Sylgard، ممهورة الشحوم فراغ. يتم لصقها كتلة الشدق إلى أسفل الزجاج الأمامي للغرفة (منطقة D). وترد الأعصاب الشدق 2 (BN2s) إلى كتلة الشدق. يتم إدراج اثنين من السنانير خيوط الحرير تعلق على مناطق في الأمامي والخلفي من عضلة I1/I3. Tوترتبط خيوط الحرير ثم إلى محول القوة. يستخدم هذا الرقم الرمادي الداكن، الرمادي الفاتح، والأبيض للإشارة إلى أسطح مناطق A، B، C، D. وأكثر قتامة في اللون، وارتفاع سطح المقابلة. يستخدم الرقم أ، ب، ج، د وتشير إلى أبعاد هامة للطبق. طول لهو مم 3-4، عرض الشق الذي يربط غرفة ذهابا ومنصة الأوسط. ب طولها حوالي 3-5 مم، ارتفاع الفرق بين السطوح من منصة الأوسط (منطقة C) والجدار Sylgard (منطقة B). ج طول يشير طول الشق، وهي عبارة عن 5 مم. د طول يظهر العرض من منصة الأوسط (منطقة C)، وهي عبارة عن 5 مم.

الشكل 2. التخطيطي للالعقد الشدقوأقطاب الإعداد. ويوضح الشكل المواقع من الأعصاب الرئيسية، بما في ذلك الأعصاب الشدق 1، 2، و 3 (BN1، BN2، وBN3)، والعصب المريء (EN)، والعصب radular (RN)، والعصب والعضلات I2 والشدق الضام الدماغي (CBC). لاحظ أنه يتم إرفاق BN2s إلى كتلة الشدق (انظر الشكل 1). وترد في CBCs إلى العقدة المخية، ويمر من خلال الشق الجدار Sylgard ومختومة مع الشحوم فراغ (انظر الشكل 1). وسحبت RN والعصب والعضلات I2 فوق العقد ودبس الأقرب إلى كتلة الشدق (الاتجاه الأمامي). الخطوط الزرقاء تشير إلى موقع الدبابيس. وتستخدم اثنين أسنان مثنية (الخطوط الحمراء المسمى 1) لترسيخ CBCs. لاحظ أن يتم طي رفرف من غمد من CBC على الجانب الأيسر وتمركزها بين BN2 وBN3 لتدوير العقدة اليسرى الشدق (خط أحمر المسمى 2). في بعض العقد، قد يكون أكثر ملاءمة لحفظ غمد أسفل بين CBC وBN3. يتم إضافة دبوس إضافية ريا جانب من العقدة التي هي الأقرب إلى EN (خط أحمر المسمى 3) لمزيد من الدوران وتحقيق الاستقرار. يتم وضع قطب كهربائي خارج الخلية الزجاج على رأس غمد فوق سوما لتحفيز خارج الخلية والتسجيل. وترد الأقطاب هوك إلى BN3s ويجب وضع دبابيس عقد تلك الأعصاب في مكان أكثر من النقاط بشكل أقصى مرفق من هذه الأقطاب هوك. وترد أقطاب شفط اثنين إلى RN والعصب والعضلات I2 (انظر الشكل أكثر وضوحا بالنظر إلى العصب والعضلات I2). اضغط هنا لمشاهدتها بشكل اكبر شخصية .

الشكل 3. صورة والتخطيطي لخريطة الخلايا العصبية خارج الخلية لتحديد للمحرك I1/I3يشبك الخلايا العصبية في العقدة Aplysia الشدق. الصورة يظهر أعلى الجانب الأيمن العقدة الشدق، جنبا الذيلية حتى. لتدوير العقد الشدق، RN والعصب I2 / العضلات يتم سحبها فوق العقد الشدق ودبس الأقرب إلى جانب EN. يتم طي رفرف أيضا من غمد CBC وشبك للتناوب (انظر الشكل 2)، بحيث يمكن أن ينظر إلى الخلايا العصبية في الجانب منقاري أو على الحدود الذيلية / منقاري. ويوجه التخطيطي أسفل استنادا إلى صور أفضل. الصورة والتخطيطي تشير معا مواقع B3 I1/I3 الخلايا العصبية الحركية، B6، B9، B10، B38، B39، B43 B82 و6،7 22،23، وكذلك بعض الخلايا العصبية الأخرى. والخلايا العصبية B8a B8b هي المسؤولة عن أكبر وحدة على RN، ويعصب على I4 السيطرة على العضلات الممسك 6،17. والخلايا العصبية B4 B5 هي المسؤولة عن أكبر وحدة في ال 18 BN3. على الرغم من أن أحجام ومواقع الخلايا العصبية الحركية I1/I3 متغيرة من الحيوانات ريا حيوان، الأحجام النسبية ومواقع موثوقة جدا بالنسبة لمعظم الخلايا العصبية: B3، B6، B9، B38، B43، B82 و. انظر المناقشة لمزيد من التفاصيل حول الخلايا العصبية الحركية I1/I3، وخاصة بعض الصعوبات في تحديد فريد B10 B39 و.
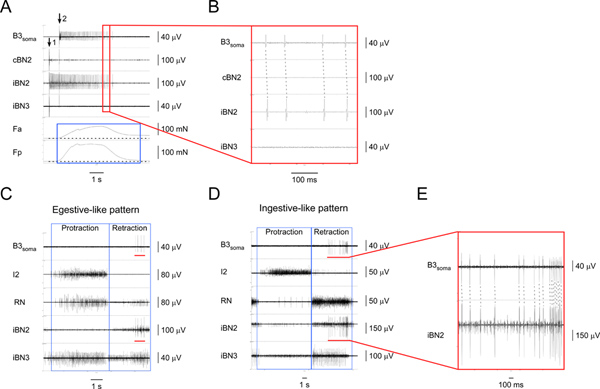
الشكل 4. تحديد وتوصيف محرك الخلايا العصبيه I1/I3 B3. A التحفيز) خارج الخلية من B3 (في سهم 1) وتسجيل من سوما B3 (ابتداء من الساعة سهم 2) وكذلك من الأعصاب المقابلة والمناطق العضلات. من أعلى إلى أسفل، والقنوات التسجيلات من سوما B3، وBN2 المقابل، وBN2 المماثل، وBN3 المماثل، وقوة انقباض المنطقة الأمامية للعضلة I1/I3، وقوة تقلص المنطقة الخلفية لل I1/I3 العضلات. الالمربع الأزرق يسلط الضوء على مدة القوات في المناطق الأمامية والخلفية من العضلات I1/I3. في هذه الحالة بالذات، القوة الخلفي أكبر من القوة الأمامية. B) عرض الموسع للمنطقة التي حددتها في مربع أحمر A1. واحد مقابل واحد إمكانات العمل في المقابلة سوما B3 والقنوات iBN2 تبين أن المشاريع B3 فقط على BN2 المماثل. C) خارج الخلية من تسجيل سوما B3 والأعصاب الحركية في نمط egestive مثل. D) تسجيل خارج الخلية من وسوما B3 والأعصاب الحركية في نمط ابتلاعي مثل. في C و D، من أعلى إلى أسفل، والقنوات التسجيلات من سوما B3، I2 العصب، وRN، وBN2 المماثل، وBN3 المماثل. المربعات الزرقاء تشير إلى تراجع ومراحل مطل من الأنماط. أشرطة حمراء في القناة سوما B3 في كل من C و D تسليط الضوء على وعاء العملسجلت entials من سوما B3. أشرطة حمراء في القناة iBN2 في كل من C و D تشير إلى توقيت المقابلة عند B3 ويطلقون النار في BN2 المماثل خلال أنماط التغذية السيارات. E) مشاهدة الموسع للB3 سوما والقنوات iBN2 والتي تمثلت في الحانات الحمراء. وتبين الخطوط المتقطعة واحد مقابل واحد العلاقة بين إمكانات العمل في سوما B3 والقنوات iBN2. لاحظ أن وحدة من BN2 B3 هي أكبر من جميع الوحدات. وهكذا، يمكننا أيضا الكشف عن وحدات من BN2 B3 مباشرة من دون BN2 التسجيلات تسجيلات سوما. اضغط هنا لمشاهدتها بشكل اكبر شخصية .

الشكل 5. وتحديدتميز الخلايا العصبية الحركية I1/I3، B43. A التحفيز) خارج الخلية B43 من (سهم في 1) وتسجيل من سوما والخمسين (ابتداء من الساعة سهم 2) وكذلك من الأعصاب المقابلة والمناطق العضلات. من أعلى إلى أسفل، والقنوات التسجيلات من سوما B43، وBN2 المقابل، وBN2 المماثل، وBN3 المماثل، وقوة انقباض المنطقة الأمامية للعضلة I1/I3، وقوة تقلص المنطقة الخلفية لل I1/I3 العضلات. المربع الأزرق يسلط الضوء على قياسات القوة العضلية للI1/I3 خلال B43 النشاط. تفعيل B43 يولد قوة صغيرة الخلفي، ولكن لا توجد قوة الأمامية. B) عرض الموسع للمنطقة التي حددتها في مربع أحمر A. وتبين الخطوط المتقطعة واحد مقابل واحد العلاقة بين إمكانات العمل في سوما B43 والقنوات iBN2، مما يدل على أن المشاريع B43 على BN2 المماثل فقط. C) خارج الخلية تسجيلمن سوما B43 والأعصاب الحركية في نمط egestive مثل. D) تسجيل خارج الخلية B43 من سوما والأعصاب الحركية في نمط ابتلاعي مثل. في C و D، من أعلى إلى أسفل، والقنوات التسجيلات من سوما B43، I2 العصب، وRN، وBN2 المماثل، وBN3 المماثل. المربعات الزرقاء تشير إلى تراجع ومراحل مطل من الأنماط. أشرطة حمراء في القناة سوما B43 في كل من C و D تسليط الضوء على إمكانات العمل المسجلة من سوما B43. أشرطة حمراء في القناة iBN2 في كل من C و D تشير إلى توقيت المقابلة عندما B43 ويطلقون النار في BN2 المماثل في هذه الأنماط. E) مشاهدة الموسع للسوما B43 والقنوات iBN2 والتي تمثلت في شريط أحمر في D. وتبين الخطوط المتقطعة علاقة واحد مقابل واحد بين إمكانات العمل في سوما B43 والقنوات iBN2. علما ان وحدات من BN2 B43 صغيرة وصعبة للغاية للكشف عن التسجيلات دون سوما، ولكن النار باستمرار في نهاية البرنامج BN2 السيارات، وتوفير وسيلة أخرى لتحديد وضعهم. نلاحظ أيضا أن أكبر وحدة هو موضح في اللوحة السفلية في E هو اصطدام وحدة سوما B43 مع وحدة أخرى خارج الخلية. اضغط هنا لمشاهدتها بشكل اكبر شخصية .

الشكل 6. الشجرة الأمثل لتشخيص وتحديد بعض الخلايا العصبية الحركية باستخدام I1/I3 سوما خارج الخلية العصبية والتسجيلات، وهذا الأسلوب يتطلب التشخيص الحد الأدنى من المعلومات للتعرف على الخلايا العصبية الحركية I1/I3، مما يجعل من الاسهل بكثير ان identiالسنة المالية الخلايا العصبية الحركية في إعداد الشامل الشدق مع وقف التنفيذ أو في الجسم الحي. B3 ديها أكبر BN2 حدة بين الخلايا العصبية التي تم تحديدها للسيارات I1/I3. في بقية الخلايا العصبية الحركية، B6 و B9 هي اثنين فقط من الخلايا العصبية على كل من هذا المشروع BN2 وBN3. B9 الجانبي هو أكثر من B6. ويمكن أيضا بقية الخلايا العصبية فقط على إسقاط BN2 يمكن تقسيمها إلى مجموعتين. مجموعة واحدة من الخلايا العصبية مشاريع ثنائية من خلال BN2s، والذي يتضمن B10 B39 وبعض الخلايا العصبية وغير معروف. المجموعة الأخرى من الخلايا العصبية مشاريع ipsilaterally على BN2 فقط، والذي يتضمن B38، B43، B82 و. B38 بالقرب B3 وB9. B82 بالقرب B8 (انظر الشكل 3). B43 بالقرب B6. وحدة BN2 صغيرة وانفجارات في نهاية أنماط التغذية.

الشكل 7. مقارنة بين معدلات نجاح ط الخلايا العصبيةتلون العاج خلال التجارب باستخدام القوة التقنية خارج الخلية أو تقنية الخلايا. مع قوة الإعداد محول نفسه، فعلنا التجارب باستخدام 35 تقنية خارج الخلية (صغير النقاط الزرقاء) والتجارب باستخدام تقنية 27 بين الخلايا التقليدية (نقطة الأرجواني كبيرة) لتحديد I1/I3 الخلايا العصبية الحركية. المحور س يدل على أقل عدد من الخلايا العصبية الحركية للعضلة I1/I3 التي تم تحديدها في كل نوع من التجربة. ذ محور يشير إلى معدل نجاح النسبة المئوية لكل نوع من التجربة. على سبيل المثال، في 19 من أصل 35 (54٪) من التجارب خارج الخلية، تمكنا تحديد خمسة على الاقل مختلفة الخلايا العصبية الحركية I1/I3. فقط في 1 من أصل 27 (4٪) من التجارب داخل الخلايا، تمكنا من تحديد الخلايا العصبية الحركية لا يقل عن خمسة I1/I3. من الواضح أن نسبة النجاح في تحديد الخلايا العصبية أعلى بكثير عن أي عدد معين من الخلايا العصبية باستخدام تقنية خارج الخلية.
Discussion
في الحيوانات الكبيرة مع الخلايا العصبية التي تم تحديدها، مثل الرخويات (على سبيل المثال، المنقعية، اللولب، وAplysia)، وتحليل حمامات السيارات يتم عادة باستخدام الخلايا تسجيل 1،2،3،4. في هذا البروتوكول، ونحن تصف عملية لتحديد الخلايا العصبية الحركية بشكل فريد لمجموعة السيارات باستخدام تقنية خارج الخلية. استخدمنا القوة القياسات وكمثال على هذه العملية. يمكن للمرء أيضا استخدام EMG لقياس innervations العضلات. لفترة وجيزة، أن تفعل ذلك، وبروتوكول يحتاج إلى تعديل لإرفاق أقطاب هوك إلى مناطق مختلفة من العضلات EMG I1/I3 للتسجيلات.
هذه التقنية خارج الخلية لديه بعض المزايا أكثر من تقنيات الخلايا، والبعض منها قد تم بالفعل المذكورة أعلاه. أولا، تقنية خارج الخلية أقل يتطلب الوقت والجهد لإعداد العقد للتجارب، وسوف تسبب أقل ضرر الخلايا العصبية. عادة، سوف يستغرق 20-30 دقيقة لإعداد BUCكال العقد للتجارب خارج الخلية وحوالي 1.5 ساعة لإعداد العقد الشدق التي تعلق على كتلة الشدق للتجارب داخل الخلايا. منذ العضلات سوف تصبح أقل نشاطا حيث أن الوقت يمر، قد فارق التوقيت بين الاستعدادات لاجراء تجارب العقد خارج الخلية وبين الخلايا منها ستكون حاسمة لنجاح التجارب. الشكل 7 يبين مقارنة بين معدلات النجاح لتحديد الخلايا العصبية الحركية لل/ I1 العضلات خارج الخلية I3 باستخدام تقنية الخلايا أو في الدراسات القوة. في جميع التجارب 35 قوة خارج الخلية (100٪)، تمكنا من تحديد واحد على الأقل العصبون الحركي للعضلة I1/I3. في 31 من أصل 35 (89٪) خارج الخلية التجارب، تمكنا من تحديد الخلايا العصبية الحركية لا يقل عن ثلاثة I1/I3. في 19 من أصل 35 (54٪) خارج الخلية التجارب، تمكنا تحديد خمسة على الاقل مختلفة الخلايا العصبية الحركية I1/I3. في المقابل، فإن معدلات نجاح تجارب الخلايا مع ساموكانت قوة محول ه الإعداد أقل. في 23 من أصل 27 (85٪) بين الخلايا التجارب، تمكنا من تحديد واحد على الأقل الخلايا العصبية الحركية I1/I3. في 8 من أصل 27 (30٪) بين الخلايا التجارب، تمكنا من تحديد الخلايا العصبية الحركية لا يقل عن ثلاثة I1/I3. فقط في 1 من أصل 27 (4٪) بين الخلايا التجارب، تمكنا من تحديد خمس الخلايا العصبية الحركية I1/I3. وهكذا، فإن احتمال تحديد الخلايا العصبية متعددة في نفس العقدة وأعلى باستخدام تقنيات خارج الخلية وعلى النقيض من التقنيات داخل الخلايا.
وبالإضافة إلى ذلك، يمكن لهذه التقنية خارج الخلية العصبية وصول كثيرة على جانبي العقد خلال نفس التجربة. عادة، بعد desheathing، يمكن فقط الوصول إلى داخل الخلايا الأقطاب الخلايا العصبية على جانب العقدة التي تم desheathed. على سبيل المثال، عندما يتم شبك واحدة من العقد 2 الشدق (مثل hemiganglion على الجانب الأيسر) الجانب الذيلية، وسوف يكون من السهل على الأقطاب الكهربائية بين الخلايا للوصول إلى الخلايا العصبية على ذلكجانب من العقدة، على سبيل المثال B6، B9، B10، B39، B43 و، ولكن من الصعب للوصول إلى الخلايا العصبية في الجانب منقاري من العقدة، مثل B5، B4، B8a، B8b، B38 B82 و. في المقابل، يمكن الوصول إلى الخلايا العصبية خارج الخلية أقطاب كثيرة على جانبي العقدة في نفس الشدق مع التناوب المناسبة من العقدة. درجة الاستدارة هو قابل للتعديل وقابلة للانتكاس. هذا يزيد أيضا من احتمال تحديد الخلايا العصبية متعددة في نفس العقدة.
يتم الضغط بلطف منذ الأقطاب خارج الخلية على غمد تغطي الخلايا العصبية، هذه الأقطاب لن يتم سحب الخلايا العصبية، والتي قد تخلق ثقوبا كبيرة في الغشاء وتسبب ضررا، كما يحدث مع الأقطاب الكهربائية بين الخلايا أثناء حركات العضلات. سيكون حجم إشارة تختلف عن هذه الخطوة خلال العقد الحركات العضلية. ملاحظة أنه في بعض الأحيان أثناء حركات العضلات الكبيرة، أن يتم تخفيض تسجيل سوما خارج الخلية إشارات أو تضيع حتى. ومع ذلك، يمكننا بسهولة موهاء الجزء الخلفي الكهربائي خارج الخلية إلى الخلايا العصبية واستعادة اشارات الأصلي. هذا يجعل من الممكن تطبيق هذه التقنية خارج الخلية في إعداد الشامل الشدق علقت 8 لدراسات سلوكية خلالها توليد العضلات تقلصات كبيرة مثل إعداد يولد استجابات سلوكية مختلفة. على سبيل المثال، في 47 من أصل 48 تعليق التجارب الشامل الشدق (98٪)، تمكنا من تحديد واحد على الأقل الخلايا العصبية الحركية للعضلة I1/I3. في 23 من أصل 48 (48٪) علقت التجارب الشامل الشدق، تمكنا من تحديد الخلايا العصبية الحركية لا يقل عن ثلاثة I1/I3. في 11 من أصل 48 (23٪) علقت التجارب الشامل الشدق، تمكنا من تحديد الخلايا العصبية الحركية لا يقل عن خمسة لI1/I3 العضلات وسجل منها خلال أنماط السيارات وكتلة الشدق كان أداء الرضاعة مثل السلوكيات. هذه التقنية خارج الخلية ينطبق أيضا على الأعمال التحضيرية الأخرى شبه سليمة أكثر تعقيدا، مثل رئيس الاستعدادات التي تشمل التغذية معزولة رانه مخالب، والشفتين والفكين والكتلة الشدق، الشدق العقد، والعقدة المخية 12،24،25،26. منذ المدخلات الحسية من المهم جدا لانتزاع السلوكيات التغذية في هذه الأعمال التحضيرية، فإن تقنية خارج الخلية تكون مفيدة بشكل خاص بسبب بساطته وميزات أقل ضررا. وتشير الدراسات السابقة أيضا أنه من الممكن تحديد وتسجيل مزمنة في الجسم الحي B4/B5 18. في وقت سابق من هذه التجارب، والتي يستخدمها الباحثون الحالية المنخفضة (10-20 ميكروأمبير) BN2-A التحفيز لتفعيل انتقائي B4/B5 ولصقها أنبوب البولي ايثيلين قصيرة إلى غمد فوق B4/B5 للتسجيل، التي أدرجت في زوج من الملتوية أسلاك الفولاذ المقاوم للصدأ. وبالتالي، فمن الممكن أيضا لتحديد وتسجيل من الخلايا العصبية الحركية في الجسم الحي باستخدام القطب أنابيب المصنوعة من البوليثيلين التي يتم لصقها على غمد يغطي العقد (Chestek وChiel، نتائج غير منشورة).
هذه التقنية خارج الخلية أيضا بعض limitatالأيونات. أولا، سيكون من الصعب على أقطاب الخلية لتنشيط أو تسجيل الخلايا العصبية التي هي صغيرة جدا أو عميقة جدا داخل العقدة. لاحظ أنه لا يزال من الممكن لتنشيط الخلايا العصبية التي ليست على السطح عن طريق التحفيز خارج الخلية. ومع ذلك، لدينا 5 نموذج قد أظهر أن التحفيز قد تفقد خصوصية عندما الخلايا العصبية الهدف هو أعمق من الخلايا العصبية المجاورة. عندما الخلايا العصبية هو أعمق، فإن المسافة الكهربائي إلى سوما تكون أكبر وأعلى وستكون هناك حاجة الحالي لتفعيل هذه الخلايا العصبية، والتي قد تكون مرتفعة بما يكفي لتنشيط الخلايا العصبية الأخرى القريبة سطح. ثانيا، إذا هو حفز الخلايا العصبيه خارج الخلية مع الحالية أكثر من اللازم، قد يتعرض للتلف والرد لم يعد، وتستخدم التيارات أصغر بكثير في تحفيز الخلايا، على الرغم من الكثير من الحالية يمكن أن تلحق الضرر أيضا داخل خلوي الخلايا العصبية. في بعض الأحيان سوف تشمل تسجيل سوما وحدات متعددة من الخلايا العصبية المستهدفة على حد سواء والخلايا العصبية المجاورة، والتي هي أقل تحديدا من intracellular التسجيل. وبالإضافة إلى ذلك، فإنه قد يكون من الصعب التحكم بدقة ورصد الترددات إطلاق خلية عصبية الفردية خارج الخلية باستخدام هذه التقنية بدلا من الخلايا، وذلك لأن القطب خارج الخلية لا يمكن تحفيز الخلايا العصبية وتسجيل نفسه في وقت واحد. وعلاوة على ذلك، فإن تقنية خارج الخلية لن تكون قادرة على تسجيل المدخلات متشابك من الخلايا العصبية أمام الحركية. وبالإضافة إلى ذلك، قد يكون من الصعب تطبيق الناقلات العصبية إلى الخلايا العصبية iontophoretically محددة ما لم يتم desheathed العقدة، على الرغم من أننا قد أظهرت أنه من الممكن لحفز العقدة باستخدام كرباكول دون إزالة غمد 27.
جعل القيود المفروضة على تقنيات تحديد بعض الخلايا العصبية خارج الخلية في تجمع للسيارات الصعب تحديد. في هذا المثال خاص، تقنية التعرف خارج الخلية الأكثر اعتمادية من الخلايا العصبية الحركية للعضلة I1/I3 في Aplysia: B3، B6، B9، B38، B43، B82 و، استنادا يان سوما حجم وموقع، الإسقاط العصبية، وتعصيب العضلات. ومع ذلك، لم نكن قادرين على تحديد موثوق B10 B39 و. وأظهرت العمل داخل الخلايا السابقة التي B10 6،7 B39 وهما الخلايا العصبية المجاورة على الجانب الذيلية من العقد الشدق، بين منطقة ومنطقة B4/B5 B6. كل الخلايا العصبية في المشروع الثنائي على BN2s. B10 يعصب المنطقة الوسطى والخلفي من عضلة I1/I3، في حين B39 يعصب المنطقة الأمامية للعضلة I1/I3. استنادا إلى موقع سوما ومعايير الإسقاط العصبية، وجدنا الخلايا العصبية الحركية أكثر من عقدين من هذا المشروع على الصعيد الثنائي وBN2s في أربع تجارب مختلفة. منذ سوما المواقع الخاصة بهم، innervations العضلات، وتوقيت النشاط خلال أنماط السيارات ومتغير من الحيوان الى الحيوان، كنا لا ندري ما اذا كانت الخلايا العصبية نفسها. وهكذا، لم نكن قادرين على تحديد موثوق B10 B39 وخارج الخلية باستخدام تقنية بسبب عدم الاتساق. لتحديد فريد لهم،نحن بحاجة إلى القيام بمسح شامل أكثر من الخلايا العصبية في العقد الشدق، قد تحتاج ومعايير إضافية، مثل إدخال متشابك من الخلايا العصبية أمام الحركية B4/B5، والردود على الإرسال، والتي تتطلب تقنيات الخلايا.
مع إدخال التعديلات المناسبة، هذه التقنية ينطبق أيضا على حمامات السيارات الأخرى، مثل العضلات I5 10، عضلة I2 11، والعضلات I4 12 في Aplysia أو إلى أنظمة أخرى، مثل المنقعية الراكدة 2، اللولب pomatia 3، صرصور 13، و الزرد 14. على سبيل المثال، إذا كان أحد يريد تطبيق هذه التقنية إلى الخلايا العصبية الحركية للعضلة I5 (المعروف أيضا باسم radular التبعي أقرب العضلات أو ARC 10،28) في Aplysia، ينبغي للمرء الحفاظ على BN3s تعلق على الشدق الشامل بدلا من BN2s ، وذلك لأن الخلايا العصبية الحركية I5 B15 B16 والمشروع على 6،7 BN3 المماثل. ثم ريجب أن يكون مستعدا الشامل الشدق لفضح العضلات EMG أو I5 لدراسات القوة. بعد أن تم التعرف على الخلايا العصبية بشكل موثوق في إعداد انخفاض، يمكن أيضا وسيلة التشخيص الأمثل أن تنشأ عن الدراسات السلوكية في المستقبل.
هذه التقنية التي وصفناها يقارن ايجابيا مع تقنيات أخرى خارج الخلية مثل صفائف متعددة القطب والأصباغ الجهد الأحرف. يستخدم فقط الجهد حساسة صبغة تقنية لتسجيل 29، في حين يمكن استخدام الأقطاب الكهربائية لدينا خارج الخلية ومتعددة القطب صفائف 30 لكلا التحفيز والتسجيل. يمكن كل من مجموعة متعددة القطب 29 و الأصباغ الجهد الحساسة 30 تسجيل إشارات من الخلايا العصبية عديدة في وقت واحد. رغم أن واحدة خارج الخلية الكهربائي واحدة فقط من تسجيل قد احد أو اثنين من الخلايا العصبية تبعا لحجم طرفها وموقع القطب، فمن المؤكد أنها من الممكن وضع العديد من العقدة على وقت واحد، ولقد فعلناهذا بنجاح. المعيار في القطب متعدد مجموعة المختبر يحتوي على 8 × 8 أو 6 × 10 أقطاب 29. منذ توزع بالتساوي الأقطاب في الصفيف، فإنه يمثل تحديا في كثير من الأحيان لتحديد هوية الخلايا العصبية الأساسية التي يتم الحصول عليها من التسجيلات، لأن الخلايا العصبية لا توزع بالتساوي، وكبيرة بعد معالجة الإشارات، والبعض منها لا يزال ويجب أن يتم يدويا، لحل هذا الغموض. في المقابل، لأن يتم وضع الأقطاب خارج الخلية أكثر من somata واحدة، هوية الخلايا العصبية الأساسية واضحة. وهكذا، يبدو أن موضوع متعدد القطب المصفوفات والأصباغ الجهد حساسة قد تكون أكثر كفاءة للتسجيلات المتزامنة متعددة. ومع ذلك، قد أسلوبنا الكهربائي خارج الخلية توفير أفضل الانتقائية لكل من التحفيز والتسجيل.
Disclosures
ليس لدينا شيء في الكشف عنها.
Acknowledgements
وأيد هذا البحث من قبل المعاهد الوطنية للصحة منح NS047073 وNSF DMS1010434 المنحة.
Materials
| Name | Company | Catalog Number | Comments |
| اسم | شركة | كتالوج رقم | تعليقات |
| كلوريد الصوديوم | فيشر العلمية | S671 | البيولوجية، وشهادة |
| البوتاسيوم كلوريد | فيشر العلمية | P217 | شهادة ACS |
| المغنيسيوم كلوريد هيدرات | العضوية أكروس | 19753 | 99٪ |
| كبريتات المغنيسيوم امائية | فيشر العلمية | M63 | شهادة ACS |
| كلوريد الكالسيوم ثنائي الماء | فيشر Scientifc | C79 | شهادة ACS |
| الجلوكوز (سكر العنب) | سيغما الدريخ | G7528 | BioXtra |
| اجتماعات الأطراف عازلةص | العضوية أكروس | 17263 | 99٪ |
| كرباكول | العضوية أكروس | 10824 | 99٪ |
| هيدروكسيد الصوديوم | فيشر العلمية | SS255 | موثق |
| حامض الهيدروكلوريك | فيشر العلمية | SA49 | موثق |
| واحد الماسورة الشعرية الزجاجية | نظم AM | 6150 | |
| براون المشتعلة micropipette مجتذب نموذج P-80/PC | سوتر الآلات | خيوط المستخدمة: FT345B | |
| المينا المغلفة أسلاك الفولاذ المقاوم للصدأ | كاليفورنيا الأسلاك الجميلة | 0.001D، طلاء ح | |
| II الغراء سيليكون المنزلية | GE | ||
| دورو السريعة جل superglue | هنكل كورب. | ||
| نظم AM مكبر للصوت نموذج 1700 | نظم AM | تصفية إعدادات: 10-500 هرتز لالعصب I2 / العضلات، الأعصاب 300-500 هرتز لسائر | |
| Pulsemaster موضوع متعدد قناة محفز | أدوات الدقة العالم | A300 | |
| المعزل التحفيز | أدوات الدقة العالم | A360 | |
| مسجل المحاور X | مسجل المحاور العلمية | البرنامج للحصول على التسجيلات | |
| دبابيس رابط الذهب | BULGIN | SA3148 / 1 | |
| الذهب موصل المقابس | BULGIN | SA3149 / 1 | |
| Sylgard إلاستومر سيليكون 184 | داو كورنينج | ||
| 100 × 15 مم طبق بلورة | بيركس | ||
| ارتفاع الشحوم فراغ | داو كورنينج | ||
| نصائح الماصة | فيشر العلمية | 21-375D | |
| دبابيس Minutien | أدوات العلوم الجميلة | 26002-10 | |
| النمذجة كلاي | سارجنت الفن | 22-4400 | |
| تهمس مضخة الهواء | تترا | 77849 | |
| الحوض الأنابيب | Eheim | 7783 | 12/16 مم |
| النخبة Airstone | هاغن | A962 | |
| Vannas ربيع مقص | أدوات العلوم الجميلة | 15000-08 | |
| دومون # 5 الملقط الجميلة | غرامة Sciencه أدوات | 11254-20 | |
| Kimwipes | كيمبرلي كلارك | 34155 |
References
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved