Method Article
Extracelularmente Identificar las neuronas motoras de un músculo en la piscina Motor
En este artículo
Resumen
En los animales con grandes neuronas identificadas ( Por ejemplo, Moluscos), el análisis de los conjuntos motores se realiza utilizando técnicas intracelulares 1,2,3,4. Recientemente, hemos desarrollado una técnica para estimular extracelularmente y registrar las neuronas individuales en Aplysia californica 5. Describimos ahora un protocolo para el uso de esta técnica para identificar de forma única y caracterizar las neuronas motoras dentro de un grupo motor.
Resumen
En los animales con grandes neuronas identificadas (por ejemplo, moluscos), el análisis de los conjuntos motores se realiza utilizando técnicas intracelulares 1,2,3,4. Recientemente, hemos desarrollado una técnica para estimular extracelularmente y registrar las neuronas individuales en Aplysia californica 5. Describimos ahora un protocolo para el uso de esta técnica para identificar de forma única y caracterizar las neuronas motoras dentro de un grupo motor.
Esta técnica tiene ventajas extracelular. Primeros electrodos extracelulares, puede estimular y registrar las neuronas a través de la vaina 5, por lo que no necesitan ser removidos. Así, las neuronas serán más saludables en los experimentos extracelulares que en los intracelulares. En segundo lugar, si los ganglios son girados por adecuada fijación de la vaina, electrodos extracelulares pueden acceder a las neuronas en ambos lados del ganglio, que hace que sea más fácil y eficiente para identificar múltiples neuronas en la misma preparación. En tercer lugar, extracelulareslar electrodos no necesitan penetrar en las células, y por lo tanto puede ser fácilmente movido hacia atrás y adelante entre las neuronas, se produce menos daño a ellos. Esto es especialmente útil cuando se intenta grabar múltiples neuronas durante repitiendo los patrones motores que sólo pueden persistir por minuto. Cuarto, los electrodos extracelulares son más flexibles que los intracelulares durante los movimientos musculares. Electrodos intracelulares pueden sacar y dañar las neuronas durante las contracciones musculares. En contraste, desde electrodos extracelulares se presiona suavemente sobre la vaina anterior neuronas, por lo general permanecer por encima de la misma neurona durante las contracciones musculares, y por lo tanto se pueden utilizar en preparaciones más intactas.
Para identificar las neuronas motoras para una piscina motor (en particular, el músculo I1/I3 en Aplysia) utilizando electrodos extracelulares, se pueden utilizar las funciones que no requieren mediciones intracelulares como criterios: tamaño soma y ubicación, proyección axonal, y la inervación del músculo 4, 6,7. Para el grupo de motor particular utilizado para ilustrar la técnica, se registraron a partir de nervios bucales 2 y 3 para medir las proyecciones axonales, y se midieron las fuerzas de contracción del músculo I1/I3 para determinar el patrón de inervación del músculo para las neuronas motoras individuales.
Se demuestra el proceso completo de la primera neuronas motoras que identifican utilizando la inervación del músculo, a continuación, la caracterización de su tiempo durante los patrones motores, la creación de un método simplificado de diagnóstico para la identificación rápida. El método de diagnóstico simplificada y más rápida es superior para las preparaciones más intactas, por ejemplo, en la preparación de la masa suspendida bucal 8 o 9 in vivo. Este proceso también se puede aplicar en otros conjuntos motores 10,11,12 en Aplysia o en otros sistemas de animales 2,3,13,14.
Protocolo
1. Preparación del plato de grabación
- Durante los experimentos de fuerza del transductor, los ganglios bucal, ganglio cerebral, y la masa bucal se colocan en un plato redondo Pyrex que está especializada para los estudios de fuerza.
- Para inducir ingestivo similares a los patrones de los experimentos, se necesita aplicar el carbacol no hidrolizable agonista colinérgico al ganglio cerebral 15. Para evitar el contacto directo de carbacol en los ganglios de la bucal y la masa bucal, cámaras separadas se requiere para aislar el ganglio cerebral de los ganglios de la bucal y la masa bucal (Figura 1).
- Puesto que la masa bucal es mucho más gruesa que los ganglios bucal, que no se colocará en el mismo nivel. Por lo tanto, este plato debe tener una cámara posterior para el ganglio cerebral (área A en la Figura 1), una plataforma para el medio ganglios bucal (zona C en la Figura 1), y una cámara mucho más profunda delante de la masa bucal (zona D en Figura 1).
- Para crear este plato, comenzar con una ronda plato 100x15 Pyrex (15 mm de altura, 100 mm de diámetro). Construcción del plato se requieren varios vierte de Sylgard. Siga las instrucciones proporcionadas con el producto Sylgard. Sylgard se debe permitir establecer entre vierte diferente.
- El primer vertido es crear el mayor nivel de Sylgard en el plato (área B en la Figura 1), que es la pared entre la plataforma intermedia y la cámara posterior.
- Utilice dos soportes de arcilla de modelar para aislar el área de Sylgard pared (área B en la Figura 1). Cubra los soportes de modelado de arcilla con una envoltura de plástico donde se pondrá en contacto con el Sylgard para facilitar su retiro. Asegúrese de cierres herméticos en los bordes, donde plastilina pondrá en contacto con el plato, para reducir al mínimo las fugas.
- Verter Sylgard en la parte situada entre los dos soportes de arcilla de modelar casi hasta la parte superior del plato. Que el Sylgard plenamente establecido durante la noche. Mantener el recipiente en un lugar cálido inducirárápido ajuste. Retire los soportes de arcilla de modelado y limpiar cualquier residuo de arcilla en el Sylgard.
- A continuación, la cámara posterior (área A en la Figura 1) y la plataforma media (zona C en la Figura 1) debe ser vertido.
- Colocar un soporte de arcilla de modelar sobre 5 mm de distancia de la superficie frontal de la Sylgard para la sección de la plataforma media (zona C).
- Verter Sylgard en las secciones de la cámara posterior (zona A) y la plataforma intermedia (zona C) hasta una altura de aproximadamente 3-5 mm por debajo del nivel superior de la primera pared Sylgard (zona B). La superficie Sylgard de la cámara de retorno debe ser un poco menor que la de la plataforma del medio para evitar las fugas desde la cámara posterior que contiene carbacol a la plataforma intermedia. Una vez más, vamos a la Sylgard plenamente establecido durante la noche y luego retire el respaldo plastilina.
- El paso final consiste en cortar una muesca en el centro de la pared Sylgard para proporcionar un canal para los conectivos cerebral-vestibulares (CBC) para irpor entre la plataforma intermedia y la cámara trasera. El ancho de esta muesca debe ser de aproximadamente 3-4 mm, que es lo suficientemente amplia como para los CBC. La parte inferior de la muesca no debe ser inferior a la superficie de la plataforma Sylgard medio para evitar fugas. Una cuchilla de bisturí puede ser usado para cortar la muesca.
2. Preparación del electrodo
- Tire de electrodos extracelulares de vidrio de un solo cañón capilar de vidrio con un llameante-Brown micropipeta extractor como se describe por McManus et al. 8 en la sección 3.1. Con el filamento FT345B en el extractor, nuestros ajustes de programa típicos son de calor 480, Pull 50, velocidad 13, y la hora 20, pero cuenta que la configuración será diferente para los diferentes filamentos. Este programa crea los electrodos en un solo tirón con ninguna de las etapas de pulido de fuego. El tamaño de la punta del electrodo debe ser más pequeño que el tamaño de los cuerpos celulares. Para las neuronas motoras que van desde 50 micras a 400 micras en diámetro soma, el interior diameters de los electrodos de vidrio extracelulares debe ser de aproximadamente 40 micras y sus resistencias debe ser de aproximadamente 0,1 mW cuando se llenan con solución salina Aplysia.
- Tire de electrodos de succión de la tubería de polietileno con un mechero Bunsen. Corte un pedazo de tubo de polietileno de unos 10 cm de largo. Mantenga el tubo en ambos extremos y colocarla muy cerca de la llama generada por el quemador Bunsen mientras gira el tubo hasta que se ablande con el calor. Estirar el tubo con cuidado a lo largo de su longitud mientras se mueve lejos de la llama. La parte media del tubo se alargadas y estrechas que el tubo se estira.
- Cortar el tubo en un medio para formar dos electrodos de succión. Electrodos de succión se aplica generalmente a los extremos cortados de los nervios o los músculos, aunque a veces se puede aplicar al paso.
- Crear electrodos de gancho para las grabaciones nerviosas siguiendo el protocolo descrito por McManus et al 8 en las secciones 3.2-3.13. Estos electrodos son especialiado útil cuando un nervio o músculo no se corta.
3. Gancho de fijación del electrodo
- Diseccionar el animal y eliminar la masa bucal siguiendo el protocolo descrito en McManus et al. 8 sección 4.
- Para la grabación y la estimulación, los electrodos de gancho se puede unir a un número de diferentes nervios.
- Para caracterizar los patrones como se ha hecho in vivo por Cullins y Chiel 9, las grabaciones se debe obtener de la I2 nervio y músculo que indica la fase de prolongación de alimentación 16, el nervio radular (RN) que indica el cierre de la pinza de agarre de alimentos 17, bucal nervio 2 (BN2) y bucal del nervio 3 (BN3) que indican la fase de retracción 17,18. La unión de los electrodos de gancho sigue un procedimiento similar al descrito por McManus et al 8, sección 5.
- Las localizaciones de estos nervios se refieren a este esquema de un aparato de alimentación de Aplysia se muestra en laFigura 2 de McManus et al 8. Tenga en cuenta que los BN2 trifurcates en ramas a, b, c y antes de ir por debajo del músculo I1 en la ranura lateral. Una rama de una primera rama es la de separar del tronco principal, y es adyacente a la BN3.
- La nomenclatura de las ramas a, b, y c se utilizó por Warman y Chiel 18. Ramas a, b, y c se corresponden con ramas 3, 2, y 1, respectivamente, en la nomenclatura utilizada por Nargeot et al. 19. Además, la RN, BN1 el, BN2, y BN3 la corresponden a los nervios 1, 6, 5, y 4, respectivamente, en la nomenclatura utilizada por Kandel 20 y Scott et al. 21
- Para estudiar la inervación muscular del músculo I1/I3, todos los nervios, excepto nervios bucales 2 será separada de la masa bucal durante los experimentos. Por lo tanto, se utilizó un electrodo de gancho para grabar desde la BN2.
- Puesto que el nervio I2 y la RN no se adjunta a la masa bucal, y son muy difíciles de acceder con electrodos de gancho, es preferible aplicar electrodos de succión para grabar en lugar de ellos. Vamos a describir la aplicación de electrodos de aspiración en la sección 7.
- Utilizar un electrodo de gancho o un electrodo de succión para grabar desde la BN3, debido a que es de fácil acceso mediante uno u otro tipo de electrodo. Hemos elegido utilizar un electrodo de gancho para los BN3 grabaciones para minimizar el número de manipuladores para la celebración de los electrodos de succión, y para ahorrar espacio para manipuladores de otros productos o equipos.
- Conecte un electrodo de gancho a la rama de un BN2 (BN2-a) para iniciar rechazo-como los patrones durante los experimentos. Es útil para conectar un electrodo de gancho adicional a la BN2-una en el otro lado, debido a que algunas neuronas responden de manera diferente a la ipsilateral vs contralateral BN2-una estimulación.
- Para ayudar a distinguir las neuronas con proyecciones unilaterales vs bilateral,también es útil para unir electrodos de gancho para BN2 y BN3 la del otro lado de los ganglios bucal.
4. Ganglios y preparación muscular
- Los ganglios bucal, ganglio cerebral y masa bucal será preparado para los experimentos de fuerza del transductor, en el que el ganglio cerebral está unido a los ganglios bucal a través de los CBCs y la masa bucal se encuentra junto a los ganglios bucal a través de los BN2s solamente.
- Después de fijar los electrodos de gancho, corte nervio bucal 1 (BN1) y el nervio esofágico (ES) bilateralmente, el corte en el punto de unión a la masa bucal.
- Tire del ganglio cerebral hacia adelante para sacarlo del camino del músculo I2. Haga un corte en el músculo I2 sobre el saco radular, extender el corte lateralmente y hacia delante en ambos sentidos, y tire de la solapa del músculo I2 adelante para exponer el nervio radular. Corte las dos ramas de RN y asegurarse de que las ramas son lo suficientemente largas para la fijación de electrodos de aspiración.
- Continuar el corte I2 en un amplio círculo alrededor de los ganglios vestibular, teniendo cuidado de no cortar las BN2s o BN3s, hasta el ganglio vestibular y la parte adjunta del músculo I2 puede estar completamente separado de la masa bucal. Cortar las BN3s bilaterales en el punto de unión a la masa bucal, más allá de la fijación del electrodo de gancho.
- Aplicar una capa fina de grasa de vacío a la muesca en el plato de grabación descrito anteriormente que conecta la cámara posterior y la plataforma intermedia, utilizando una punta de pipeta para recoger un pegote de grasa de vacío y la extendió sobre la muesca.
- Aplique una capa delgada de Quick-Gel pegamento a la parte inferior de cristal de la cámara anterior en la que se coloca la masa bucal, justo en frente de la base Sylgard de la plataforma intermedia.
- Transfiera cuidadosamente el ganglio cerebral, ganglios vestibular y bucal masa al plato de grabación (Figura 1) se describe en la sección 2, asegurándose de que ninguno de los electrodos de gancho se tira con fuerza, lo que podría dañar los nervios.
- Colocar con cuidado la masa bucal en el pegamento en la cámara frontal del plato de grabación, para asegurar que su superficie ventral está pegado a la parte inferior del plato. Asegúrese de mantener los ganglios y los electrodos de contacto con el pegamento. Añadir Aplysia salina 8 (460 mM NaCl, 10 mM KCl, 22 mM de MgCl 2, 33 mM MgSO 4, 10 mM CaCl 2, 10 mM de glucosa, 10 mM MOPS, pH 7.4 a 7.5) para el plato, que inducirá el pegamento establecer.
- Si el plato debe ser transferido a otro microscopio para la preparación de los ganglios bucal para las grabaciones de soma extracelulares, tener mucho cuidado con los electrodos de gancho. Grupo de los electrodos sobre un lado de la masa bucal juntos, y también el grupo de los electrodos en el otro lado de la masa bucal juntos. Cuidadosamente sostener los electrodos agarrando la cinta de laboratorio que cubre los contactos del conector, de nuevo asegurándose de que ninguno de los electrodos se tira con fuerza.
- Cuando el plato se coloca bajo el microscopio, el electrodos debe usarse para cubrir suavemente sobre las paredes de la cápsula y el resto en la plataforma al lado del plato.
- Durante las pausas y entre las etapas del experimento, airear la solución salina en la cámara de masa bucal utilizando una piedra de aire acuario.
- Use pinzas para agarrar la vaina del ganglio cerebral y tire de ella en la cámara posterior, asegurando que los CBCs ejecutar a través de la muesca. Pin el ganglio cerebral utilizando otros nervios de los CBCs para evitar daños a los CBCs intactas.
- Aplique más grasa de vacío en los CBC, y luego añadir más solución salina Aplysia a ambas cámaras del plato, para que los ganglios están completamente sumergidos. Asegúrese de que la parte superior de la grasa de vacío es ligeramente superior a la pared Sylgard de manera que no se producirán fugas entre las cámaras.
- Para estabilizar los ganglios bucal, primero fijar los extremos de los BN3s, entonces los BN1s y la ENS sobre la base Sylgard de la plataforma intermedia (Figura 2). Desde los BN3s se grabará con electrodo de ganchos, los pasadores deben ser colocados más distalmente que los puntos de fijación de los electrodos de gancho.
- Use dos pins, doblado 90 grados, como ganchos para estirar y anclar los CBCs, de modo que los CBCs no será dañado (Figura 2).
- Precisar las ramas de RN entre la cámara posterior y los ganglios vestibular. A continuación, el músculo I2 estará en el tope de la RN. Para exponer el nervio I2, use pinzas para agarrar el músculo I2 y tire de ella a través de los ganglios vestibular. Pin dos esquinas del músculo I2 para evitar el daño al nervio I2.
- Cortar el nervio I2 distal al punto en el que sus dos ramas se funden en el músculo I2. Asegúrese de que el músculo está inervado todavía a ser comparable a la de las grabaciones in vivo. Corte el resto del músculo I2 y darle la vuelta al nervio I2 atrás y fijarlo abajo entre las dos ramas de RN (véase la figura 2, cuadro).
- Ajuste las posiciones de los pines para estirar y añadir tensión si un nervio está demasiado floja, o para liberar la tensión si un nerve es muy apretado. Para estabilizar los ganglios vestibular, agregue más patillas de la vaina entre los nervios.
- Puesto que los ganglios bucal se colocan lado caudal hasta, rotar los ganglios bucal si las neuronas de interés están en el lado rostral. Para girar una de las dos ganglios bucal, use unas pinzas finas para tomar algo de vaina superior al CBC en el que está cerca de los ganglios vestibular y el pin hacia abajo entre la BN2 BN3 y el. En algunos ganglios, puede ser más conveniente para precisar entre CBC y BN3.
- Añadir un pin adicional en la vaina del ganglio vestibular en el lado cerca de la cámara frontal para reducir al mínimo el movimiento del ganglio vestibular.
- Para recortar la vaina que cubre el ganglio vestibular, utilice unas pinzas finas para agarrar la funda en el lado cercano a la cámara de nuevo, a continuación, cortar la vaina sobrante con tijeras finas sin exponer a los cuerpos de las células. Con el fin de minimizar el daño, sólo quitar la cantidad mínima de vaina necesario ver los cuerpos de las células.
- Después de tse funda en los ganglios vestibular se recorta, tire del nervio I2 y el RN en el ganglio vestibular y fijarlas entre el ganglio vestibular y cámara frontal para girar aún más el ganglio vestibular. (Ver Figura 2).
- Para lavar cualquier cloruro de magnesio restante 8 que se utiliza para anestesiar al animal antes de la disección, reemplazar la solución salina Aplysia en el plato fresco con solución salina Aplysia.
5. Conectar eléctricamente los electrodos de gancho
- Después de los ganglios y el músculo se preparan, transferir cuidadosamente el plato a la mesa de aislamiento de vibraciones para los experimentos.
- Conecte todas las clavijas de electrodos para las clavijas de los cables BNC que se conectan a los amplificadores (AM Sistemas de amplificador modelo 1700). Una vez más, asegúrese de que los electrodos no se tira con fuerza mientras hace esto. Asegúrese de que los electrodos estén conectados correctamente a sus cables adecuados y que las polaridades son correctas.
6. Configuración de los electrodos de vidrio para las grabaciones extracelulares Soma
- Llenar el electrodo con Aplysia salina utilizando una jeringa unida a un pedazo de tubo de polietileno de alrededor de 15-20 cm. Una el extremo libre del tubo de polietileno al extremo del electrodo de vidrio. Tire del émbolo de la jeringa para llenar el electrodo con solución salina Aplysia.
- Coloque el electrodo de vidrio llenos extracelular en la muesca del soporte en el manipulador. Utilice el manipulador para colocar la punta del electrodo en la solución salina que contiene Aplysia los ganglios vestibular.
- Insertar un alambre de plata / cloruro de plata soldada a un alfiler de oro conector macho en el electrodo para servir como el alambre de grabación. Coloque otro alambre de plata / cloruro de plata soldada a un alfiler de oro conector macho directamente en la solución salina Aplysia dentro de la sección del plato de grabación que contiene el ganglio vestibular para actuar como el cable de referencia. Conecte ambos the grabación y cables de referencia para el cable BNC que se conecta al amplificador.
- Si no hay suficiente espacio para más manipuladores, adicionales electrodos de vidrio extracelulares se puede añadir a grabar múltiples neuronas simultáneamente.
7. Configuración de los electrodos de succión para las grabaciones del nervio
- Recorte el extremo estrecho de la punta de electrodo de succión para que coincida con el diámetro del nervio. El diámetro interior de la punta del electrodo debe ser similar a, o ligeramente menor que el diámetro del nervio para garantizar succión apretado.
- Puesto que el nervio I2 y la RN están muy cerca uno del otro, sus electrodos puede ser sostenido por el mismo manipulador para ahorrar espacio. Coloque dos electrodos en dos escalones del mismo titular. Gire los dos electrodos y asegurar que sus consejos son cerca de uno otro. Elija uno de ellos para la grabación nervio I2, el otro para la grabación de RN.
- Coloque la punta del electrodo en la solución salina dentro de la Aplysia recording plato que contiene los ganglios vestibular. Una el extremo libre del tubo de polietileno de la jeringa para el electrodo de succión. Utilice la jeringa para llenar el electrodo con solución salina Aplysia. Mover la punta del electrodo cerca del extremo del nervio objetivo, es decir el nervio I2, y usar la jeringa para aspirar el nervio en el electrodo. La longitud del nervio dentro del electrodo debería ser de aproximadamente 0.5-1.0 mm, para asegurar un sello hermético.
- Repetir la aspiración para el electrodo que se adjunta a la RN.
- Conecte los electrodos a los cables correspondientes BNC como se describe en la sección 6.3.
8. Configuración del transductor de fuerza para medir la contracción muscular I1/I3
- Para conectar los transductores de fuerza para el músculo, utilizar suturas de seda. Doblar la aguja curvada de cada sutura, y atar la sutura para el transductor de fuerza. Suavemente agarrar y levantar una pequeña cantidad de músculo con pinzas y, se mantiene la aguja en otro conjunto de pinzas, insertela aguja a través del músculo hasta el punto de doblado en la aguja (Figura 1).
- Transductores se pueden unir ya sea dorsal o lateralmente en el músculo I1/I3. Fijación dorsal permite la medición de las contracciones evocadas por la activación de cualquiera del lado izquierdo o derecho del músculo. Fijación lateral mostrará fuertes fuerzas para la mayoría de las neuronas, pero sólo permitirá la medición de la contracción en el lado al que está unido el transductor.
- Para ayudar a identificar las neuronas que pueden activar las regiones anterior, posterior o ambas de I1/I3, conectar un transductor de fuerza a la parte posterior del músculo, justo anterior al tejido faríngeo, y adjuntar otro transductor de fuerza a la parte anterior de la músculo, en las mordazas (Figura 1; ganchos de nota).
- Levante los transductores de fuerza hasta que las suturas se tensa, pero no se estire demasiado. Para comprobar esto, ver la medida del transductor de fuerza cuando la sutura tiene un poco de holgura en it, y luego levante el transductor hasta que la medición es ligeramente por encima de este nivel de referencia.
9. La identificación de las neuronas motoras en un Motor Pool
- Este protocolo describe un procedimiento para la identificación de las neuronas motoras extracelularmente dentro de una piscina de motor. Se utilizó el software AxoGraph para supervisar la actividad de las neuronas individuales, múltiples nervios y el músculo (señal EMG o las fuerzas de contracción). En este protocolo, se utilizaron las fuerzas de contracción del músculo como una ilustración para el proceso de identificación de las neuronas motoras, y en otros experimentos, se utilizó EMG también, y la configuración de estos experimentos es muy similar (ver Discusión).
- Para localizar una neurona candidato, usar el manipulador para presionar suavemente la punta del electrodo de vidrio extracelular hacia abajo sobre la vaina sobre el centro del soma neuronal 5 (Figura 3), que es la mejor ubicación para la estimulación y la selectividad de grabación 5. Puesto que el umbral f actualo la activación de una neurona aumenta linealmente con la distancia de los electrodos-a-soma 5, la selectividad estimulación llegará a ser peor cuando el electrodo se mueve lejos del centro de la neurona diana hacia una neurona vecina.
- Para identificar una neurona motora, primero estimulan directamente la neurona mediante el electrodo de vidrio extracelular para garantizar que sólo esta neurona está disparando, y examinar si inerva el músculo. Luego, extracelularmente registro de este neurona a establecer un uno-a-uno entre la grabación soma extracelular y las grabaciones nerviosas, lo cual es también crucial para la identificación de las neuronas.
- Como la mayoría de amplificadores extracelulares no permiten la estimulación simultánea y la grabación en un canal, ajustar el canal utilizado para estimular y registrar el soma (el canal soma) a modo de estimulación y aplicar una breve corriente anódica (por ejemplo, 6 ms para Aplysia neuronas 5) a la soma (Figuras 4A, 5A, flechas nota 1 in ambas figuras), a partir de una corriente baja (por ejemplo 200 mu A), y aumentando gradualmente la corriente hasta que las ráfagas de las neuronas.
- Una vez que la neurona se activa a punto de estallar, uno debe inmediatamente cambiar el canal de soma del modo de estimulación en el modo de grabación (Figuras 4A, 5A, flechas Nota 2 En ambas figuras). Sin embargo, todavía habrá retrasos entre el soma y la estimulación de grabación debido a los retrasos de respuesta humana.
- Si las neurona para una cantidad razonable de tiempo, debe ser posible para observar uno por uno los potenciales de acción correspondientes de la grabación soma y en el nervio (s) a través del cual los proyectos de neuronas (Figuras 4B, 5B, líneas discontinuas nota ), así como las fuerzas generadas por la neurona (Figuras 4A, 5A; cajas para notas azules). Si la neurona deja de disparar antes de la grabación soma comienza, aumentar la corriente para activarlo para un tiempo más largo.
- La relación señal-ruido de la extracelulargrabaciones depende de la ubicación y el tamaño de electrodo soma. El registro extracelular se convertirá en más grande como el aumento de tamaño soma y el electrodo a soma disminuye la distancia. Puesto que el ruido sólo varía en un rango estrecho, la relación señal a ruido también aumentará a medida que aumenta el tamaño del soma y de la distancia electrodo-a-soma disminuye. El intervalo más común de la relación de señal-a-ruido es de 4:1 a 8:1.
- Las neuronas motoras pueden ser identificados en función de sus características, tales como la ubicación soma, proyección nervio e inervación muscular 4,6,7. Ya que sólo los dos BN2s están unidos a la masa bucal, mediante la supervisión de la actividad en los BN2s, se puede asegurar que la fuerza de contracción muscular sólo es causada por la neurona activada por la estimulación extracelular.
- Por ejemplo, B3 es una neurona motora grande para el músculo I1/I3 (300-400 m de diámetro soma en animales que pesan 200 a 350 gramos), situado en el lado rostral del ganglio vestibular (Figura 3 ). Sólo se proyecta a través de la ipsilateral BN2, y ambos inerva las partes anterior y posterior del músculo I1/I3. La mayoría de las veces, se genera una activación anterior más grande que fuerza posterior (8 de 9 experimentos).
- Después de una neurona es identificado, su actividad se puede grabar en diferentes comportamientos como la alimentación-a través del electrodo de vidrio extracelular (Figuras 4 y 5), que puede ser obtenido como se describe a continuación. El registro extracelular en el soma será mucho más específicas que las grabaciones nerviosas, que incluyen la actividad de muchas neuronas diferentes.
- Para inducir egestive-como los programas de motor, estimular BN2-una con 1-2 min de pulsos 19 (2 Hz, cada pulso es de 1 mseg). Esta estimulación fiable genera patrones egestive en este contexto. Con suficiente corriente (por ejemplo, 300 mu A), los patrones pueden persistir durante la duración de la estimulación. A veces habrá uno más patrón que se produce poco después dela estimulación termina.
- Para inducir ingestivo-como los programas de motor, colocar unos pocos cristales de carbacol sólido directamente en la vaina del ganglio cerebral 15. Si se desea controlar el nivel de exposición carbacol, utilizar una solución de carbacol 1 a 10 mM en solución salina Aplysia. Concentraciones más altas son más propensos a inducir respuestas. Patrones repetitivos generalmente comienzan dentro de los cinco minutos, y puede durar unos diez o quince minutos antes de empezar a correr hacia abajo.
- Después de lavar carbachol varias veces y espera por lo menos 30 min, una solicitud posterior de carbacol se puede añadir a la ganglio cerebral para inducir a más ingestivo-como patrones motores.
- Después de múltiples neuronas de motor para el motor de la piscina particular, han sido identificados y caracterizados durante los programas de motor, se puede desarrollar un método simplificado en gran medida de diagnóstico que requiere información mínima para identificar rápidamente estas neuronas en el trabajo futuro (Figura 6 </ Strong>), por ejemplo, en la preparación de masas suspendidas bucales o in vivo. Los criterios pueden incluir el tamaño y la ubicación soma, la proyección del nervio, tamaño de la unidad de los nervios, y el tiempo de actividad durante los patrones motores.
Resultados
Las figuras 4 y 5 muestran los resultados típicos utilizados para identificar dos I1/I3 neuronas motoras. Figura 4 muestra las grabaciones de soma de una neurona motora grande, B3, durante patrones egestive-como y como ingestivo-(Figuras 4C, 4D). El uno por uno los picos correspondientes en el canal de soma y el canal BN2 ipsilateral (Figura 4E) muestran que la especificidad de B3 grabación soma se mantuvo durante los patrones. B3 dispara durante la fase de retracción media a finales de los patrones. De la Figura 4 y de otros resultados (no mostrados), se encontró que la unidad BN2 de B3 es siempre más grande del BN2 unidad. Por lo tanto, también se puede detectar directamente desde BN2 grabaciones.
La Figura 5 muestra las grabaciones de soma de una neurona pequeño, B43, durante patrones egestive-como y como ingestivo-(figuras 5C, 5D). El uno por uno los picos correspondientes en el canal somay el canal BN2 ipsilateral (Figura 5E) también muestran que la especificidad de B43 grabación soma se mantuvo durante patrones. Neuron B43 ráfagas en el final de la fase de retracción durante patrones. Dado que la unidad BN2 de B43 es pequeña, sería difícil identificar a partir de los BN2 grabaciones sin la grabación soma, sin embargo, debido a que dispara más intensamente en el extremo del patrón motor BN2, el extremo de la ráfaga B43 puede todavía ser identificado BN2 de grabaciones solamente.
La figura 6 muestra un árbol optimizado de diagnóstico que no requieren la inervación del músculo como un criterio, lo que hace mucho más fácil de identificar las extracelularmente I1/I3 neuronas motoras en la preparación de la masa suspendida bucal o in vivo. El árbol de diagnóstico fue desarrollado, sin embargo, mediante el uso de medidas de fuerza y EMG, y por lo tanto ilustra cómo las técnicas de este protocolo puede conducir a la identificación eficiente de la neurona motora.

Figura 1. Esquema de configuración general y el plato para los estudios de fuerza. La imagen superior muestra una vista superior. La imagen inferior muestra una vista lateral (que corresponde a la línea discontinua en el medio de la vista superior). El ganglio cerebral se fija en Sylgard en la cámara de nuevo (zona A). Los ganglios bucales están puestas a Sylgard en la plataforma media (zona C). La cámara posterior y la plataforma intermedia están separadas por una pared elevada Sylgard (zona B). Las conectivas cerebral-vestibulares (CBC) pasan a través de una muesca en la pared Sylgard, sellado con grasa de vacío. La masa bucal está pegado a la parte inferior de vidrio de la cámara delantera (zona D). Los nervios bucales 2 (BN2s) están unidos a la masa bucal. Dos ganchos sujetos a suturas de seda se insertan en las regiones anterior y posterior del músculo I1/I3. Tsuturas de seda que se atan entonces para el transductor de fuerza. La figura utiliza gris oscuro, gris claro, y negro para indicar las superficies de las áreas A, B, C, y D. La más oscuro es el color, mayor es la superficie correspondiente. La figura utiliza a, b, c, y d para indicar las dimensiones importantes de la antena. Longitud a es 3-4 mm, la anchura de la muesca que conecta la cámara posterior y la plataforma intermedia. B longitud es de aproximadamente 3-5 mm, la diferencia de altura entre las superficies de la plataforma intermedia (zona C) y la pared Sylgard (zona B). C Longitud indica la longitud de la muesca, la cual es de aproximadamente 5 mm. Longitud d muestra el ancho de la plataforma media (zona C), que es aproximadamente 5 mm.

Figura 2. Esquema de los ganglios bucaly los electrodos de configuración. La figura muestra la ubicación de los nervios principales, incluyendo los nervios vestibulares 1, 2, y 3 (BN1, BN2 y BN3), el nervio esofágico (EN), el nervio radular (RN), el nervio y el músculo I2 y el conectivo cerebral bucal (CBC). Tenga en cuenta que los BN2s están unidos a la masa bucal (ver Figura 1). Los CBCs se unen al ganglio cerebral, pasa a través de la muesca de la pared Sylgard y se sella con grasa de vacío (véase la Figura 1). El RN y el nervio y el músculo I2 se tiran encima de los ganglios y cubrió proximal a la masa bucal (dirección frontal). Las líneas azules indican la ubicación de los pins. Dos patillas dobladas (líneas rojas etiqueta 1) se utilizan para anclar los CBCs. Tenga en cuenta que una solapa de la funda de la CBC en el lado izquierdo se pliega y se inmovilizó entre BN2 y BN3 para girar el ganglio vestibular izquierdo (línea roja marcada 2). En algunos ganglios, puede ser más conveniente para fijar la funda hacia abajo entre CBC y BN3. Un pin adicional se agrega to el lado del ganglio que es proximal a la ES (línea roja etiquetada 3) para la rotación adicional y estabilización. El electrodo de vidrio extracelular se coloca en la parte superior de la funda por encima de la soma para la estimulación extracelular y grabación. Los electrodos de gancho están unidos a los BN3s y las clavijas de sujeción de los nervios en lugar debe colocarse más distalmente que los puntos de fijación de estos electrodos de gancho. Dos electrodos de succión se unen a la RN y el nervio y el músculo I2 (ver recuadro para una visión más clara del nervio y el músculo I2). Haga clic aquí para ampliar la cifra .

Figura 3. Una imagen y esquemática del mapa neurona para la identificación extracelular del motor I1/I3neuronas del ganglio vestibular. Aplysia La imagen superior muestra un ganglio vestibular lateral derecho, lateral caudal fijado para arriba. Para girar los ganglios bucal, el RN y el nervio I2 / músculo se apartan por encima de los ganglios vestibular y proximal fijado al lado de la ES. Una solapa de la funda CBC también está doblado y fijado para la rotación (véase la figura 2), de modo que las neuronas en el lado rostral o en el borde caudal / rostral puede ser visto. El esquema inferior se elaboraron a partir de la imagen de arriba. La imagen y el esquemática juntos indican las localizaciones de la I1/I3 motor neuronas B3, B6, B9, B10, B38, B39, B43 y B82 6,7 22,23, así como algunas otras neuronas. Las neuronas B8a y B8b son responsables de la mayor unidad en la RN, e inervan el músculo que controla el I4 pinza 6,17. Las neuronas B4 y B5 son responsables de la mayor unidad en el 18 BN3. Aunque el tamaño y la ubicación de las neuronas motoras I1/I3 son variables de los animales to animal, los tamaños relativos y las ubicaciones son bastante fiables para la mayoría de las neuronas: B3, B6, B9, B38, B43, y B82. Ver discusión para más detalles sobre los I1/I3 neuronas motoras, especialmente algunas de las dificultades de la identificación exclusiva de B10 y B39.
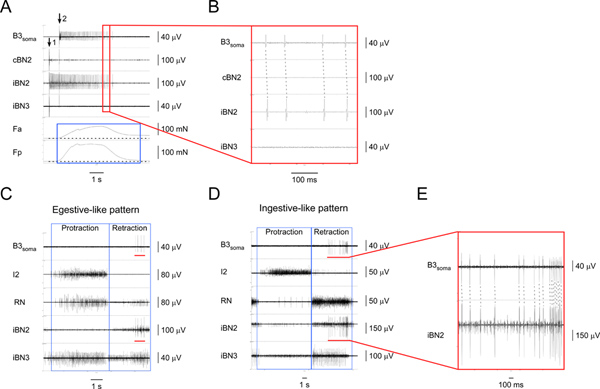
Figura 4. La identificación y la caracterización de la neurona motora I1/I3 B3. Una estimulación) extracelular de B3 (en flecha 1) y la grabación desde el soma B3 (a partir de la flecha 2), así como de los correspondientes nervios y regiones musculares. De arriba a abajo, los canales son las grabaciones de la soma B3, el contralateral BN2, la BN2 ipsilateral, la ipsilateral BN3, la fuerza de contracción de la región anterior del músculo I1/I3, y la fuerza de contracción de la región posterior de la I1/I3 muscular. Lacaja azul destaca la duración de las fuerzas en las regiones anterior y posterior del músculo I1/I3. En este caso particular, la fuerza posterior es mayor que la fuerza anterior. B) consideran que la ampliación del área delimitada por el recuadro rojo en A1. El uno por uno los potenciales de acción correspondientes en el soma B3 y los iBN2 canales muestran que los proyectos B3 sólo en el ipsilateral BN2. C) La grabación extracelular del soma B3 y nervios de un patrón motor egestive-like. D) el registro extracelular de el soma B3 y nervios de un patrón motor ingestivo-like. En C y D, de arriba a abajo, los canales son las grabaciones de la soma B3, el nervio I2, la RN, el ipsilateral BN2, y BN3 la ipsilateral. Los cuadros azules indican la protracción y retracción de las fases de los patrones. Las barras rojas en el canal B3 soma en C y D destacar la olla acciónciales grabado desde el soma B3. Las barras rojas en el canal iBN2 tanto en C y D indican la temporización correspondiente cuando B3 está disparando en la BN2 ipsilateral durante los patrones motores de alimentación. E) vista ampliada de la soma B3 y los iBN2 canales marcados por las barras rojas. Las líneas discontinuas muestran el uno-a-uno entre los potenciales de acción en el soma y B3 iBN2 los canales. Tenga en cuenta que la unidad de BN2 B3 es la más grande de todas las unidades. Por lo tanto, también podemos detectar las unidades de BN2 B3 directamente de las grabaciones sin BN2 grabaciones soma. Haga clic aquí para ampliar la cifra .

Figura 5. La identificación ycaracterización de la I1/I3 de la neurona motora, B43. Una estimulación) extracelular de B43 (con la flecha 1) y la grabación de su soma (a partir de la flecha 2), así como de los correspondientes nervios y regiones musculares. De arriba a abajo, los canales son las grabaciones de la soma B43, el contralateral BN2, la BN2 ipsilateral, la ipsilateral BN3, la fuerza de contracción de la región anterior del músculo I1/I3, y la fuerza de contracción de la región posterior de la I1/I3 muscular. El cuadro azul se destacan las medidas de fuerza del músculo I1/I3 durante B43 actividad. Activación B43 genera una fuerza posterior pequeña, pero no fuerza anterior. B) consideran que la ampliación de la zona de trazado por la caja roja en A. Las líneas discontinuas muestran el uno-a-uno entre los potenciales de acción en el soma B43 y los iBN2 canales, lo que indica que los proyectos en el B43 BN2 ipsilateral solamente. C) Registro extracelulardesde el soma B43 y los nervios en un patrón motor egestive-like. d) el registro extracelular del soma B43 y los nervios en un patrón similar al motor ingestivo. En C y D, de arriba a abajo, los canales son las grabaciones de la soma B43, el nervio I2, la RN, el ipsilateral BN2, y BN3 la ipsilateral. Los cuadros azules indican la protracción y retracción de las fases de los patrones. Las barras rojas en el canal de soma B43 en C y D de relieve los potenciales de acción registrados en el soma B43. Las barras rojas en el canal iBN2 en C y D indican el tiempo correspondiente al B43 está disparando en el BN2 ipsilateral en estos patrones. E) consideran que la ampliación de la soma B43 y los iBN2 canales marcados por la barra roja D. Las líneas de puntos muestran la relación uno-a-uno entre los potenciales de acción en el soma B43 y los iBN2 canales. Tenga en cuenta que las unidades de BN2 B43 son pequeñas y muy difícil de detectar sin grabaciones soma, pero el fuego consistente en el extremo del programa motor BN2, proporcionando otra manera de identificar. Tenga en cuenta también que la unidad más grande se muestra en el panel inferior en E es una colisión de una unidad soma B43 con otra unidad extracelular. Haga clic aquí para ampliar la cifra .

Figura 6. El árbol optimizado de diagnóstico para la identificación de algunos de los I1/I3 neuronas motoras usando soma extracelular y grabaciones nerviosas. Este método diagnóstico requiere el mínimo de información para la identificación de los I1/I3 neuronas motoras, lo que es mucho más fácil de identificarfy las neuronas motoras en la preparación de la masa suspendida bucal o in vivo. B3 tiene la mayor BN2 unidad entre las neuronas motoras identificados I1/I3. En el resto de las neuronas motoras, B6 y B9 son los únicos dos neuronas que proyectan tanto en BN2 y BN3. B9 es más lateral que B6. El resto de las neuronas que se proyectan sólo en BN2 también se pueden dividir en dos grupos. Un grupo de neuronas proyectos bilateralmente a través de BN2s, que incluye B10 y B39 y algunas neuronas desconocidos. El otro grupo de neuronas proyecta ipsilateralmente en BN2 sólo, que incluye B38, B43, y B82. B38 se encuentra cerca de B3 y B9. B82 es cerca de B8 (ver Figura 3). B43 se encuentra cerca de B6. Su unidad BN2 es pequeño y ráfagas al final de patrones de alimentación.

Figura 7. Comparación de las tasas de éxito de la neurona identificación durante experimentos de fuerza ya sea utilizando la técnica extracelular o intracelular de la técnica. Con la configuración de transductor de fuerza misma, hicimos 35 experimentos utilizando la técnica extracelular (pequeños puntos azules) y 27 experimentos utilizando la técnica convencional intracelular (grandes puntos púrpura) para identificar el I1/I3 neuronas motoras. El eje X indica el menor número de neuronas motoras para el músculo I1/I3 que se identificaron en cada tipo de experimento. El eje Y indica la tasa de porcentaje de éxito de cada tipo de experimento. Por ejemplo, en 19 de 35 (54%) de los experimentos extracelulares, hemos sido capaces de identificar al menos cinco diferentes I1/I3 neuronas motoras. En sólo 1 de 27 (4%) de los experimentos intracelulares, hemos sido capaces de identificar al menos cinco I1/I3 neuronas motoras. Es evidente que la tasa de éxito en la identificación de las neuronas es mucho mayor para cualquier número dado de neuronas usando la técnica extracelular.
Discusión
En los animales con grandes neuronas identificadas, tales como moluscos (por ejemplo, Lymnaea, Helix y Aplysia), el análisis de los conjuntos motores se realiza normalmente mediante registro intracelular 1,2,3,4. En este protocolo, se describe un procedimiento para la identificación exclusiva de las neuronas motoras para una piscina de motor usando una técnica extracelular. Se utilizaron las mediciones de la fuerza como una ilustración de este proceso. También se podría utilizar para medir EMG inervaciones musculares. Brevemente, para hacerlo, el protocolo debe ser modificada para conectar electrodos de gancho para diferentes regiones del músculo I1/I3 para registros de EMG.
La técnica extracelular tiene ciertas ventajas sobre las técnicas intracelulares, algunas de las cuales ya han sido descritas anteriormente. Primero, la técnica extracelular requiere menos tiempo y esfuerzo para preparar los ganglios para los experimentos y se causan menos daño a las neuronas. Por lo general, se llevará a 20-30 minutos para preparar el buclos ganglios de la cal para experimentos extracelulares y aproximadamente 1,5 hr para preparar los ganglios bucal que se adjuntan a la masa bucal para experimentos intracelulares. Dado que los músculos se vuelven menos activas conforme pasa el tiempo, la diferencia de tiempo entre los preparativos para experimentos ganglios extracelulares y seres intracelular podría ser crítico para el éxito de los experimentos. Figura 7 muestra la comparación de las tasas de éxito para la identificación de las neuronas motoras de la / I1 músculo I3 utilizando la técnica extracelular o intracelular en los estudios de fuerza. En los 35 experimentos de fuerza extracelulares (100%), hemos sido capaces de identificar al menos una neurona motora para el músculo I1/I3. En 31 de los 35 (89%), los experimentos extracelulares, hemos sido capaces de identificar al menos tres I1/I3 neuronas motoras. En 19 de 35 (54%), los experimentos extracelulares, hemos podido identificar al menos cinco diferentes I1/I3 neuronas motoras. En contraste, las tasas de éxito de los experimentos intracelulares con el samfuerza e instalación del transductor eran más bajos. En 23 de 27 (85%), los experimentos intracelulares, hemos sido capaces de identificar al menos un I1/I3 neurona motora. En 8 de los 27 (30%) experimentos intracelulares, hemos sido capaces de identificar al menos tres I1/I3 neuronas motoras. En sólo 1 de cada 27 (4%), los experimentos intracelulares, pudimos identificar cinco I1/I3 neuronas motoras. Por lo tanto, la probabilidad de identificar múltiples neuronas en el ganglio de la misma está más alto usando técnicas extracelulares en contraste con las técnicas intracelulares.
Además, la técnica extracelular puede acceder a muchas neuronas en ambos lados de los ganglios durante el mismo experimento. Por lo general, después de desheathing, electrodos intracelulares sólo puede acceder a las neuronas en el lado del ganglio que ha sido desheathed. Por ejemplo, cuando uno de los dos ganglios bucal (por ejemplo, el hemiganglion en el lado izquierdo) se fija lado caudal hasta, será fácil para los electrodos intracelulares para acceder a las neuronas sobre eselado del ganglio, por ejemplo, B6, B9, B10, B39, y B43, pero difícil acceder a las neuronas en el lado rostral del ganglio, tales como B4, B5, B8a, B8b, B38 y B82. En contraste, los electrodos extracelulares puede acceder a muchas neuronas en ambos lados de la misma ganglio vestibular con una rotación apropiada del ganglio. El grado de rotación es ajustable y reversible. Esto también aumenta la probabilidad de identificar múltiples neuronas en el ganglio de la misma.
Desde electrodos extracelulares se presiona suavemente sobre la vaina que cubre las neuronas, estos electrodos no se sacó de las neuronas, lo que puede crear grandes agujeros en la membrana y causar daños, como ocurre con los electrodos intracelulares durante los movimientos musculares. El tamaño de la señal variará como el movimiento ganglios durante los movimientos musculares. Tenga en cuenta que a veces, durante los movimientos musculares grandes, las señales extracelulares soma de grabación se reducirá o incluso se pierde. Sin embargo, podemos fácilmente moVE la parte posterior electrodo extracelular en la neurona y recuperar las señales originales. Esto hace que sea posible aplicar la técnica extracelular para la preparación de la masa suspendida bucal 8 para estudios de comportamiento, en el que los músculos generan contracciones grandes como la preparación genera diferentes respuestas de comportamiento. Por ejemplo, en 47 de los 48 experimentos de masas suspendidas bucales (98%), hemos sido capaces de identificar al menos una neurona motora para el músculo I1/I3. En 23 de 48 (48%) suspendidos experimentos masivos bucales, hemos sido capaces de identificar al menos tres I1/I3 neuronas motoras. En 11 de 48 (23%) suspendidos experimentos masivos bucales, hemos sido capaces de identificar al menos cinco neuronas motoras para el músculo I1/I3 y registro de los mismos en patrones motores como la masa bucal estaba actuando como la alimentación, comportamientos. La técnica extracelular es también aplicable a otros más complicados semi-intactas preparaciones, tales como las preparaciones de alimentación aislados de cabeza que incluyen tél tentáculos, labios, mandíbula, la masa bucal, ganglios vestibular, y el ganglio cerebral 12,24,25,26. Dado que la entrada sensorial es muy importante para la obtención de los comportamientos de alimentación en tales preparaciones, la técnica extracelular será particularmente útil debido a su simplicidad y características menos dañinas. Estudios anteriores también muestran que es posible identificar y registrar crónicamente B4/B5 in vivo 18. En estos experimentos anteriores, los investigadores utilizaron corriente baja (10-20 mu A)-BN2 un estímulo para activar selectivamente B4/B5 y pegado de un tubo de polietileno corto de la vaina anterior B4/B5 para la grabación, en la que se inserta un par de trenzado alambres de acero inoxidable. Así, es posible también identificar y registrar de neuronas motoras in vivo utilizando el electrodo de tubo de polietileno que está pegado sobre la funda que cubre los ganglios (Chestek y Chiel, resultados no publicados).
La técnica extracelular también tiene algunos limitationes. En primer lugar, será difícil para los electrodos extracelulares para estimular o grabar las neuronas que son demasiado pequeñas o demasiado profundo dentro del ganglio. Tenga en cuenta que todavía es posible para activar las neuronas que no están en la superficie a través de la estimulación extracelular. Sin embargo, nuestro modelo 5 ha demostrado que la estimulación puede perder especificidad cuando la neurona diana es más profunda que las neuronas vecinas. Cuando la neurona es más profunda, la distancia del electrodo-a-soma será mayor y una corriente más alta se necesita para activar esta neurona, que puede ser lo suficientemente alta para activar otras neuronas superficie cercana. En segundo lugar, si una neurona es estimulada extracelularmente con demasiada corriente, puede ser dañado y ya no responde; corrientes mucho más pequeñas se utilizan en la estimulación intracelular, aunque demasiada corriente intracelularmente también puede dañar las neuronas. A veces la grabación soma incluirá múltiples unidades tanto de la neurona diana y las neuronas adyacentes, que es menos específico que Intracellular grabación. Además, puede ser más difícil de controlar con precisión y controlar la frecuencia de disparo de una neurona individual, utilizando el extracelular en lugar de la técnica intracelular, debido a que el electrodo extracelular no puede estimular y registrar simultáneamente la misma neurona. Además, la técnica extracelular no será capaz de registrar la entrada sináptica de las neuronas premotora. Además, puede ser difícil de aplicar neurotransmisores iontoforética a una neurona específica a menos que el ganglio se desheathed, aunque se ha demostrado que es posible estimular un ganglio usando carbacol sin quitar la funda 27.
Las limitaciones de las técnicas de identificación extracelulares hecho algunas neuronas en la piscina motor difíciles de identificar. En este ejemplo particular, la técnica extracelular fiable identificado la mayoría de las neuronas motoras para el músculo I1/I3 en Aplysia: B3, B6, B9, B38, B43, y B82, o basadon soma tamaño y ubicación, proyección nervio, y la inervación muscular. Sin embargo, no hemos sido capaces de identificar de forma fiable B10 y B39. El trabajo previo intracelular 6,7 mostraron que B10 y B39 son dos neuronas adyacentes en el lado caudal de los ganglios bucal, entre la región y la región B4/B5 B6. Ambos neuronas se proyectan bilateralmente en los BN2s. B10 inerva la región media y posterior del músculo I1/I3, mientras que B39 inerva la región anterior del músculo I1/I3. Sobre la base de la ubicación soma y criterios nerviosas de proyección, encontramos más de dos neuronas motoras que se proyectan bilateralmente en el BN2s en cuatro experimentos diferentes. Desde su ubicación Soma, inervaciones musculares, y el calendario de la actividad durante los patrones motores fueron variables de animal a animal, no estábamos seguros de si eran las mismas neuronas. Por lo tanto, no fueron capaces de identificar de forma fiable B10 y B39 mediante la técnica extracelular debido a la falta de consistencia. Para su identificación única,tenemos que hacer un estudio más profundo de las neuronas de los ganglios bucal, y es posible que otros criterios, como la entrada sináptica de las neuronas B4/B5 premotora, y las respuestas a los transmisores, que requieren técnicas intracelulares.
Con las modificaciones apropiadas, esta técnica es también aplicable a otros conjuntos motores, por ejemplo, el músculo I5 10, el músculo 11 I2, I4 y el músculo 12 de Aplysia o a otros sistemas, por ejemplo, Lymnaea stagnalis 2, Helix pomatia 3, cucaracha 13, y pez cebra 14. Por ejemplo, si se quiere aplicar esta técnica a las neuronas motoras para el músculo I5 (también conocido como el accesorio más cerca radular músculo o ARC 10,28) en Aplysia, se debe mantener los BN3s unidos a la masa bucal en lugar de los BN2s , porque las neuronas motoras I5 B15 y B16 del proyecto en el ipsilateral BN3 6,7. Entonces tél masa bucal debe estar preparado para exponer el músculo I5 para EMG o estudios de fuerza. Después de que las neuronas han sido identificados con fiabilidad en la preparación reducida, un método de diagnóstico optimizado también se podría crear para los futuros estudios de comportamiento.
La técnica que hemos descrito se compara favorablemente con otras técnicas de matrices extracelulares tales como múltiples electrodos y colorantes sensibles al voltaje. El colorante sensible al voltaje 29 técnica sólo se utiliza para la grabación, mientras que nuestros electrodos extracelulares y múltiples electrodos matrices 30 puede ser utilizado tanto para estimulación y registro. Tanto la matriz multi-electrodo 29 y tintes sensibles al voltaje 30 puede grabar señales de muchas neuronas simultáneamente. Aunque un electrodo extracelular solo puede grabar desde una o dos neuronas dependiendo de su tamaño y la ubicación de la punta del electrodo, es ciertamente posible colocar varios en un ganglio simultáneamente, y hemos hechoesto con éxito. El estándar in vitro matriz multi-electrodo tiene 8 x 8 o de 6 x 10 electrodos 29. Dado que los electrodos se distribuyen uniformemente en la matriz, a menudo es difícil determinar la identidad de las neuronas subyacentes de grabaciones que se obtienen, ya que las neuronas no se distribuyen uniformemente, y significativos post-procesado de las señales, algunas de las cuales es todavía manual, se debe hacer para resolver esta ambigüedad. En contraste, debido a que los electrodos extracelulares se coloca sobre somata sola, la identidad de la neurona subyacente es clara. Por lo tanto, parece que varios electrodos matrices y colorantes sensibles al voltaje puede ser más eficiente para múltiples registros simultáneos. Sin embargo, nuestra técnica electrodo extracelular puede proporcionar una mejor selectividad, tanto para estimulación y registro.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Esta investigación fue financiada por el NIH subvención NS047073 y NSF subvención DMS1010434.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre | Empresa | Número de Catálogo | Comentarios |
| De cloruro de sodio | Fisher Scientific | S671 | Biológica Certificada |
| El cloruro de potasio | Fisher Scientific | P217 | Certificado ACS |
| Magnesio hexahidrato de cloruro | Acros Organics | 19753 | 99% |
| Magnesio heptahidrato de sulfato | Fisher Scientific | M63 | Certificado ACS |
| Cloruro de calcio dihidrato | Fisher científca | C79 | Certificado ACS |
| La glucosa (dextrosa) | Sigma-Aldrich | G7528 | BioXtra |
| MOPS Buffer | Acros Organics | 17263 | 99% |
| Carbachol | Acros Organics | 10824 | 99% |
| Hidróxido de sodio | Fisher Scientific | SS255 | Certificado |
| Ácido clorhídrico | Fisher Scientific | SA49 | Certificado |
| Un solo cañón capilar de vidrio | Sistemas AM | 6150 | |
| Flaming-Brown micropipeta extractor modelo P-80/PC | Sutter Instruments | Incandescencia utilizada: FT345B | |
| Esmalte de alambre recubierto de acero inoxidable | California alambre fino | 0.001D, recubrimiento h | |
| Hogar de silicona Pegamento II | GE | ||
| Duro Quick-Gel superglue | Henkel corp. | ||
| Sistemas de amplificador AM modelo 1700 | Sistemas AM | Configuración del filtro: 10-500 Hz para el nervio I2 / muscular, 300-500 Hz para todos los otros nervios | |
| Pulsemaster multicanal Estimulador | World Precision Instruments | A300 | |
| Estímulo Isolator | World Precision Instruments | A360 | |
| AxoGraph X | AxoGraph Científico | Software para grabaciones | |
| Alfileres de oro del conector | Bulgin | SA3148 / 1 | |
| Oro Conector Sockets | Bulgin | SA3149 / 1 | |
| Sylgard 184 de elastómero de silicona | Dow Corning | ||
| 100 x 15 mm crystalizing Dish | Pirex | ||
| Grasa de alto vacío | Dow Corning | ||
| Puntas de pipetas | Fisher Scientific | 21-375D | |
| Minutien Pines | Herramientas Artes Ciencias | 26002-10 | |
| Modelado de la arcilla | Sargent Art | 22-4400 | |
| Susurro Bomba de aire | Tetra | 77849 | |
| Acuario Tubing | Eheim | 7783 | 12/16 mm |
| Elite Difusor | Hagen | A962 | |
| Tijeras Vannas Primavera | Herramientas Artes Ciencias | 15000-08 | |
| Dumont # 5 pinzas finas | Fine SciencHerramientas electrónicas | 11254-20 | |
| Kimwipes | Kimberly-Clark | 34155 |
Referencias
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados