Method Article
Extracellularly의 근육 모터 풀에 모터 뉴런을 확인
요약
대형 식별 뉴런 (과 동물 예 mollusks), 모터 풀의 분석은 세포 기술을 사용하여 수행됩니다 1,2,3,4. 최근, 우리는 extracellularly에서 개별 뉴런을 자극하고 기록 할 수있는 기술을 개발 Aplysia californica 5. 이제 우리는 고유 식별하고 모터 수영장에서 모터 뉴런을 특성화하기 위해이 기술을 사용하기위한 프로토콜을 설명합니다.
초록
대형 식별 뉴런 (예 : mollusks), 모터 풀의 분석과 동물에서 세포 기술에게 1,2,3,4를 사용하여 수행됩니다. 최근, 우리는 extracellularly 자극하고 Aplysia californica 5 개별 뉴런을 기록 할 수있는 기술을 개발했습니다. 이제 우리는 고유 식별하고 모터 수영장에서 모터 뉴런을 특성화하기 위해이 기술을 사용하기위한 프로토콜을 설명합니다.
이 세포 기술은 장점이 있습니다. 첫째, 세포 전극은 자극하고 기록 뉴런을 피복 1-5하므로 제거 할 필요가 없습니다 수 있습니다. 따라서, 뉴런은 세포들보다 세포 실험에서 건강하게 될 것입니다. 둘째, 신경절 경우하면 집에 걸어주는 적절한하여 회전은, 세포 전극은 쉽고 효율적으로 같은 준비에서 여러 뉴런을 식별 할 수 신경절의 양쪽 뉴런에 액세스 할 수 있습니다. 셋째, extracellu고맙다 전극은 세포를 통과 할 필요가 없습니다, 그래서 쉽게 그들에게 더 적은 손상을 초래 뉴런 사이에 앞뒤로 이동할 수 있습니다. 하나가 단 몇 분 거리에 지속될 수 있습니다 모터 패턴을 반복하는 동안 여러 뉴런을 기록하려고 할 때 특히 유용합니다. 넷째, 세포 전극은 근육 운동 기간 동안 세포들보다 더 유연합니다. 세포 내 전극 꺼내 근육 수축 동안 뉴런가 손상 될 수 있습니다. 세포 전극이 부드럽게 뉴런 위의 집에 눌러되므로 대조적으로, 그들은 일반적으로 근육의 수축시 동일한 뉴런 위 유지, 따라서 더 많은 손상 준비에 사용할 수 있습니다.
소마 크기와 위치, axonal 프로젝션, 그리고 근육 innervation 4 : 고유 세포 전극을 사용하여 모터 풀 (특히, Aplysia의 I1/I3 근육)에 모터 뉴런을 식별하려면, 하나는 기준으로 세포 측정을 필요로하지 않는 기능을 사용할 수 있습니다, 6,7. 기술을 설명하는 데 사용되는 특정 모터 풀의 경우, 우리는 axonal 예측을 측정하기 위해 구강 신경에서 2, 3를 기록하고, 각각의 모터 뉴런에 근육 innervation의 패턴을 결정하기 위해 I1/I3 근육의 수축 힘을 측정.
우리는 빠른 식별을위한 단순화 된 진단 방법을 만들어, 모터 패턴 중에 타이밍을 특성화, 근육 innervation을 사용하여 첫번째 식별 모터 뉴런의 전체 과정을 보여줍니다. 간체 및 더 빠른 진단 방법은 정지 구강 대량 준비 8 또는 생체 9 예를 들어, 더 많은 손상 준비를위한 우수합니다. 이 과정은 2,3,13,14 Aplysia 또는 다른 동물 시스템에서 10,11,12 다른 모터 수영장에서 적용 할 수 있습니다.
프로토콜
1. 녹화 요리의 작성
- 힘 변환기 실험 기간 동안, 구강 신경절, 뇌성 신경절 및 구강 질량 힘 연구에 대한 전문되는 원형 Pyrex 요리에 배치되어 있습니다.
- 실험에 ingestive 같은 패턴을 유도하기 위해, 우리는 대뇌 신경 15 비 hydrolyzable cholinergic 작용제의 carbachol를 적용해야합니다. 구강 신경절 및 구강 대량 위에 carbachol의 직접 접촉을 방지하기 위해, 별도의 챔버는 구강 신경절 및 구강 질량 (그림 1)에서 대뇌 신경을 분리하기 위해 필요합니다.
- 구강 대량의 구강 신경절보다 훨씬 두꺼운이기 때문에, 그것들은 동일한 수준에 배치되지 않습니다. 따라서,이 요리는 (지역 D에 (지역 그림 1 A) 구강 신경절 (그림 1의 영역 C) 및 구강 대량의 더 깊은 프런트 챔버의 중앙 플랫폼을 대뇌 신경에 다시 챔버가 있어야합니다 그림 1).
- 이 요리를 만들려면, 원형 100x15 Pyrex 요리 (높은 15mm, 직경 100 ㎜)로 시작합니다. 요리의 건설은 몇 가지가 Sylgard의 따를 필요합니다. Sylgard 제품과 함께 제공된 지침을 따르십시오. Sylgard는 다른 쏟아 사이에 자리 잡고 할 수 있도록 허용하여야합니다.
- 첫 번째 뿌린는 중간 플랫폼 및 다시 챔버 사이의 벽 접시 (그림 1의 영역 B)에 Sylgard의 최고 수준을 생성하는 것입니다.
- Sylgard 벽 (그림 1의 영역 B)에 대한 영역을 분리하는 두 모델링 점토 backings을 사용합니다. 사람들이 쉽게 제거 Sylgard 연락을 드릴 것입니다 랩과 코팅 모델링 점토 backings. 모델링 점토는 누설을 최소화하기 위해, 요리 연락을드립니다 곳의 가장자리에 꼭 밀봉을 보장합니다.
- 거의 최대 접시의 상단에 두 개의 모델링 점토 backings 사이의 부분에 Sylgard 하거라. 완전히 밤새 설정 Sylgard합시다. 따뜻한 곳에서 요리를하는 것은 유도합니다빠른 설정. 모델링 점토 backings을 제거하고 Sylgard에 어떤 점토 잔류 물을 닦아주십시오.
- 다음, 다시 챔버 (지역 그림 1)과 중간 플랫폼 (그림 1 지역 C)를 부어해야합니다.
- 거리 중간 플랫폼의 섹션 (지역 C)에 대한 Sylgard의 앞 표면에서 5mm에 대한 모델링 점토로 속을 채우지를 놓습니다.
- 다시 챔버 (면적 A) 및 최대 최초의 Sylgard 벽 (지역 B)의 최상위 수준 아래 약 3-5mm의 높이에 중간 플랫폼 (지역 C)에 대한 부분으로 Sylgard 하거라. 다시 챔버의 Sylgard 표면은 중앙 플랫폼에 carbachol를 포함하는 다시 실에서 누수를 방지 할 수있는 중앙 플랫폼보다 약간 낮은해야합니다. 다시 말하지만, Sylgard 완전히 밤새 설정할 후 모델링 점토로 속을 채우지을 제거합니다.
- 마지막 단계는 가야 할 대뇌 - 구강 connectives을위한 채널 (CBCs)를 제공하는 Sylgard 벽의 중앙에 노치를 잘라하는 것입니다중간 플랫폼과 다시 챔버 사이를 통해. 이 노치의 폭 넓은 충분히 CBCs을위한 약 3~4밀리미터,해야합니다. 노치의 바닥은 유출을 방지하기 위해 중간 플랫폼의 Sylgard 표면보다 낮을 수 없습니다. 메스 블레이드는 노치를 잘라하는 데 사용할 수 있습니다.
2. 전극 준비
- 섹션 3.1에서와 같은 맥마 너스 외 의해 설명 불타는 브라운 micropipette 풀러. 8을 사용 단일 질주 모세관 유리 세포 유리 전극을 당겨. 풀러에서 FT345B 필라멘트로, 우리의 일반적인 프로그램 설정은 열 480 끌어 오기 50, 속도 13, 및 시간 20아르하지만, 설정이 다른 종류의 필라멘트에 대해 서로 다른 될 것입니다. 이 프로그램은 노 화재 연마 단계를 하나의 풀에 전극을 만듭니다. 전극 팁의 크기는 세포 기관의 크기보다 작아야합니다. 50 μm의 소마 직경, 내부 diamete 400 μm에 이르기까지 모터 뉴런에세포 유리 전극의 RS는 약 40 μm 있어야하고 그들이 Aplysia 식염수에 가득 할 때 자신의 저항은 MΩ 0.1에 대한 있어야합니다.
- 분젠 버너를 사용하여 폴리에틸렌 관에서 흡입 전극을 당겨. 약 10cm 길이 폴리에틸렌 관의 조각을 잘라 버릴거야. 양쪽에 튜브를 잡고하고 열에서 부드러운 될 때까지 관을 회전하면서 매우 분젠 버너에 의해 생성 된 불꽃에 가까이 가져 오십시오. 불꽃에서 멀리 이동하는 동안의 길이를 따라 조심스럽게 튜브를 스트레칭. 튜브의 중간 부분은 연장과 튜브가 당겨으로 범위를 좁힐 수 있습니다.
- 이 흡입 전극을 형성하기 위해 반으로 튜브를 잘라. 그들이 때때로 passant 욕실 적용 할 수 있지만 흡입 전극은 일반적으로, 신경이나 근육의 절단 종료에 적용됩니다.
- 섹션 3.2-3.13에 맥마 너스 외 (8)에 의해 설명 된 프로토콜에 따라 신경 레코딩을위한 후크 전극을 만듭니다. 이 전극은 especi 아르신경이나 근육을 중단하지 않을 때 유용 앨리.
3. 후크 전극 첨부 파일
- 동물을 해부하고 맥마 너스 외에 설명 된 프로토콜에 따라 구강 질량을 제거합니다. 8 절 4.
- 녹음 및 자극의 경우, 후크 전극은 다른 신경의 수에 첨부 할 수 있습니다.
- Cullins와 Chiel 9 생체에서 수행 된 같은 패턴을 특징하려면 녹음은 음식의 폐쇄 움켜 잡 기사 17 구강을 나타냅니다 16 먹이의 길게 끌기 단계, radular 신경 (RN)를 나타냅니다 I2 신경과 근육에서 얻을 수 있어야합니다 후퇴 단계 17,18를 나타냅니다 신경 2 (BN2) 및 구강 신경 3 (BN3). 후크 전극의 첨부 파일은 맥마 너스 외 8, 5 절에서 설명 된 것과 유사한 절차를 따릅니다.
- 이 신경의 위치에 표시된 Aplysia 먹이 장치의 개략도를 참조맥마 너스 외 8 그림 2. 참고로 가지 측면 홈에있는 I1 근육 아래에 가기 전에 A, B 및 C에 BN2 trifurcates. 가 주요 트렁크에서 분리 된 최초의 지점이며, BN3에 인접 해 있습니다 지점.
- 지점의 명칭, B 및 C는 Warman와 Chiel 18에 의해 사용되었다. 가지 A, B 및 C는 Nargeot 외 사용하는 명칭에 각각 지점 3, 2에 해당, 1. 19. 또한, RN, BN1, BN2, 그리고 BN3는 Kandel 20 스콧 외 사용하는 명칭에 각각 신경 1, 6, 5에 해당하고, 4. 21
- I1/I3 근육의 근육 innervation을 공부하는, 구강 신경을 제외한 모든 신경은 2 개의 실험을하는 동안 구강 대량의 끊깁니다. 따라서, 우리는 BN2에서 기록하는 후크 전극을 사용했습니다. <리> I2 신경과 RN이 구강 대량에 부착, 그리고 그들이 훅 전극을 사용하여 액세스 할 매우 어려운되지 않습니다 때문에, 대신 그들에게서 기록하는 흡입 전극을 적용하는 것이 바람직합니다. 우리는 섹션 7에서 흡입 전극의 응용 프로그램을 설명합니다.
- 이 전극 중 하나 종류를 사용하여 쉽게 액세스 할 수 있기 때문에, BN3에서 기록하는 후크 전극 또는 흡입 전극 중 하나를 사용하십시오. 우리는 흡입 전극을 쥐고 manipulators의 수를 최소화하기 위해, 다른 manipulators 또는 장비를위한 공간을 절약 할 수 BN3 녹음에 대한 후크 전극을 사용하기로 결정했습니다.
- BN2의 (BN2 -)는 실험 기간 동안 제거와 같은 패턴을 시작하는 지점으로 훅 전극을 연결합니다. 일부 뉴런이 ipsilateral 대 contralateral BN2 - 자극에 다르게 반응하기 때문에, 다른 편에있는 BN2-에 추가 후크 전극을 첨부 할 때 유용합니다.
- 일방적 대 양국 투영의 경우와 뉴런을 구분할 수 있도록하려면,구강 신경절의 다른 측면에 BN2하고 BN3에 훅 전극을 첨부하는 것도 유용합니다.
4. 신경절 및 근육 준비
- 구강 신경절, 뇌성 신경절 및 구강 질량은 대뇌 신경 만 BN2s를 통해 CBCs 및 구강 질량이 구강 신경절에 첨부를 통해 구강 신경절에 부착되는, 힘 변환기 실험 준비 될 것입니다.
- 후크 전극을 부착 한 후 구강 대량으로 부착 지점에서 절단, 구강 신경 1 (BN1)과 양자 식도 신경 (EN)을 잘라.
- I2 근육의 길을 옮기 앞으로 대뇌 신경을 당겨. radular 주머니를 통해 I2 근육에 상처를 만들어 두 방향으로 측면과 anteriorly 컷을 확장하고, radular 신경을 노출하기 위해 최선을 I2 근육의 플랩을 당긴다. 두 RN 가지를 잘라 나무 가지가 흡입 전극 첨부 파일에 대해 충분히 있는지 확인하십시오.
- C구강 신경절과 I2 근육의 첨부 된 부분이 완전히 구강 대량 분리 될 때까지 구강 신경절 주위에 넓은 원형의 I2 컷, BN2s 또는 BN3s을 건드리지 않게 조심 복지를, ontinue. 후크 전극 첨부 넘어, 구강 대량으로 부착 지점에서 양국 BN3s을 잘라 요.
- 진공 그리스의 글로브를 들고 노치 그 일을 전파하기 위해 피펫 팁을 사용하여 다시 챔버 및 중앙 플랫폼을 연결하는 그 위에서 설명한 기록 접시에있는 노치에 진공 그리스의 얇은 층을 적용합니다.
- 단지 중간 플랫폼의 Sylgard 기지 앞의 구강 대량 배치 될 앞쪽 챔버의 유리 아래로 빠른 젤 슈퍼 접착제의 얇은 층을 적용합니다.
- 조심스럽게 후크 전극의 아무 것도 신경을 손상 할 수있는 단단하게 당기지도되어 있는지 확인하고, 2 절에서 설명 된 녹화 요리 (그림 1)에 대뇌 신경, 구강 신경절 및 구강 질량을 전송할 수 있습니다.
- 조심스럽게 그 복부 표면이 접시의 바닥에 접착되어 있는지 확인하려면 녹음 요리의 전면 챔버에 접착제에 구강 질량을 배치합니다. 접착제가 만져서 신경절과 전극을 유지해야합니다. 접착제를 유도되는, 요리에 Aplysia 생리 8 (460 MM NaCl, 10 MM KCl, 22 MM MgCl 2, 33 MM MgSO 4, 10 MM CaCl 2, 10 MM 포도당, 10 MM 걸레, 산도 7.4-7.5)를 추가 설정할 수 있습니다.
- 음식은 세포 소마 녹음을위한 구강 신경절을 준비하는 다른 현미경을 전송해야하는 경우 후크 전극 매우주의해야합니다. 그룹은 함께 구강 대량의 한쪽면에 전극, 또한 함께 구강 질량의 다른 쪽 그룹 전극을. 조심스럽게 다시 전극의 아무 것도 단단히 당겨되지 않도록 만드는 커넥터 핀을 커버 연구실 테이프를 쥐었고하여 전극을 누르고 있습니다.
- 요리는 현미경, 전극 아래에 위치하는 경우S는 접시 옆에있는 플랫폼에서 음식과 휴식의 측면으로 부드럽게 장식해야합니다.
- 휴식 시간과 실험의 단계 사이에, 수족관 airstone을 사용하여 구강 대량 챔버에 호수가 폭기.
- 대뇌 신경의 칼집을 움켜 잡고 CBCs의 노치를 통해 실행되도록 다시 챔버 내로을 끌어 집게를 사용하십시오. 그대로 CBCs에 손상을 방지하기 위해 CBCs 이외의 신경을 사용하여 대뇌 신경을 핀.
- CBCs보다 진공 그리스를 적용하고 신경절이 완전히 잠기되도록, 요리의 두 방에 더 많은 Aplysia의 생리를 추가합니다. 더 누설은 챔버 사이에 발생하지 않습니다 있도록 진공 그리스의 상단이 Sylgard 벽보다 약간 높은 있는지 확인합니다.
- 구강 신경절을 안정화하려면 먼저 다음 BN3s, 중간 플랫폼 (그림 2)의 Sylgard 바닥에 BN1s 및 엔터프라이즈 네트워크의 끝을 핀. BN3s는 후크 전극을 사용하여 기록되기 때문에S는, 핀 후크 전극의 부착 지점보다 더 distally 배치해야합니다.
- CBCs은 (그림 2) 손상되지 않도록, CBCs을 확장하고 고정 랑 관계로 90도 굽혀 두 개의 핀을 사용합니다.
- 다시 챔버와 구강 신경절 사이의 RN 가지를 핀. 그런 다음 I2 근육은 RNs의 상단에 있습니다. I2 신경을 노출하려면 I2 근육을 움켜 잡고 구강 신경절을 통해 그것을 끌어 집게를 사용합니다. I2 신경에 손상을 방지하기 위해 I2 근육의 두 모서리를 핀.
- 그 두 가지가 I2 근육에 병합되는 시점에 말초 I2 신경을 끊을. 근육은 여전히 생체 녹음에 비교 될 innervated되어 있는지 확인하십시오. I2 근육의 나머지 부분을 떼어과 I2 신경을 돌려 회전시키면서 (그림 2, 삽입 참조) 두 RN 가지 사이를 핀.
- 신경이 너무 느슨한 경우 확장하고 긴장을 추가 할 수있는 핀의 위치를 조정하거나, nerv 경우 긴장을 출시 할e는 너무 꽉 수 있습니다. 추가로 구강 신경절을 안정화하기 위해 신경 사이의 집에 더 많은 핀을 추가 할 수 있습니다.
- 구강 신경절이 꼬리 쪽을 배치되므로 관심있는 뉴런이 뱃 부리 장식이있는쪽에있는 경우, 구강 신경절를 회전 할 수 있습니다. 두 구강 신경절 중 하나를 회전하려면, 그것은 구강 신경절 근처에있는 CBC의 일부 초과 칼집을 잡아 고급 집게를 사용하여 BN2과 BN3 사이를 핀. 일부 신경절에서는 CBC와 BN3 사이를 핀 것이 더 편리 할 수 있습니다.
- 구강 신경의 움직임을 최소화하기 위해 전면 챔버에 가까운 측면에 구강 신경절의 피복에 추가 핀을 추가합니다.
- 구강 신경절를 덮고있는 껍질을 잘라하려면 다시 챔버로 측면 가까이에 칼집을 잡아 고급 집게를 사용하여 다음 셀 몸을 노출시키지 않고 고급 가위로 초과 피복을 떼어. 피해를 최소화하기 위해, 만 셀 몸을보고하기 위해 필요한 피복의 최소 금액을 제거합니다.
- t 후그는 구강 신경절의 집은 구강 신경절 위에 I2 신경과 RNs을 뽑아 더욱 구강 신경절을 회전 할 수있는 구강 신경절 및 프런트 챔버 사이를 내려 핀, 손질하고 있습니다. (그림 2 참조).
- 해부하기 전에 동물을 마취하는 데 사용 된 모든 나머지 염화 마그네슘 8 씻어, 신선한 Aplysia의 식염수에 접시에 Aplysia의 생리를 교체하십시오.
5. 전기 훅 전극을 연결
- 신경절과 근육을 준비 후, 실험에 대한 진동 절연 테이블에 접시를주의 깊게을 송금 할 수 있습니다.
- 증폭기 (AM 시스템 모델 1700 앰프)에 연결 BNC 케이블에 자신 소켓에 대한 모든 전극 핀을 연결합니다. 다시 말하지만,이 일을하는 동안 전극이 단단히 당겨되지 않았는지 확인합니다. 전극이 올바르게 적절한 케이블에 연결하고 극성이 올바른지되어 있는지 확인합니다.
6. 소마 레코딩의 세포 유리 전극을 설정
- 주변 15~20cm의 폴리에틸렌 관의 한 부분에 부착 된 주사기를 사용하여 Aplysia 식염수에 전극을 입력합니다. 유리 전극의 끝으로 폴리에틸렌 관의 자유로운 끝을 연결합니다. Aplysia 식염수에 전극을 기입 할 수있는 주사기의 플런저에 다시 당겨.
- 머니퓰레이터의 소유자의 노치에 채워진 세포 유리 전극을 배치합니다. 구강 신경절을 포함하는 Aplysia의 생리에 전극 팁을 배치 할 수 머니퓰레이터를 사용하십시오.
- 기록 와이어 역할을 할 수있는 전극에 남성 금 커넥터 핀에 납땜 은색 / 실버 염화물 와이어를 삽입합니다. 참조 와이어의 역할을 할 수있는 구강 신경절을 포함하는 기록 접시의 섹션 내에서 Aplysia의 생리에 직접 남성 금 커넥터 핀에 납땜 다른 은색 / 실버 염화물 와이어를 놓으십시오. 일을 모두 연결앰프에 연결 BNC 케이블에 전자 기록 및 참조 전선.
- 더 manipulators에 대한 충분한 공간이있는 경우, 추가 세포 유리 전극은 동시에 여러 뉴런를 기록 추가 할 수 있습니다.
7. 신경 레코딩을위한 흡입 전극을 설정
- 신경의 직경과 일치하는 팁 흡입 전극의 좁은 끝을 잘라. 전극 팁의 내부 직경은 유사한 꼭 흡입을 보장하기 위해 신경의 직경보다 약간 작아야합니다.
- I2 신경과 RN은 서로 매우 가까운 거리에 있습니다 때문에, 그들의 전극은 공간을 절약하기 위해 동일한 속이는으로 개최 할 수 있습니다. 같은 홀더의 두 노치 두 전극을 배치합니다. 두 전극을 회전하고 팁이 다른 가까이에 있습니다 있는지 확인하십시오. I2 신경 녹음 중 하나 인 RN 기록에 대한 다른 하나를 선택합니다.
- recordin 내에서 Aplysia의 생리의 전극 팁을 놓으십시오구강 신경절을 포함하는 g 요리. 흡입 전극에 주사기에서 폴리에틸렌 튜브의 자유로운 끝을 연결합니다. Aplysia 식염수에 전극을 채우기 위해 주사기를 사용하십시오. 가까운 대상 신경의 끝 부분에 전극 팁을 이동 I2 신경 즉, 그리고 전극에 신경을 빨아 주사기를 사용합니다. 전극 내에서 신경의 길이는 방수 밀봉을 보장하기 위해 0.5-1.0 mm에 대해해야합니다.
- RN에 첨부됩니다 전극의 흡입을 반복합니다.
- 6.3 절에 설명 된대로 해당 BNC 케이블에 전극을 연결합니다.
8. I1/I3 근육 수축을 측정 할 수있는 힘 변환기 설정
- 근육에 힘 트랜스 듀서를 연결하려면, 실크 봉합을 사용합니다. 각 봉합의 곡선 바늘을 구부리하고, 힘 변환기에 봉합을 묶어. 부드럽게 잡아 들어 근육의 작은 금액을 집게로하고, 포셉의 다른 세트로 바늘을 잡고 삽입최대 바늘의 구부러진 지점 (그림 1)에 근육을 통해 바늘.
- 트랜스 듀서는 I1/I3 근육에 하나 dorsally 또는 측면 부착 할 수 있습니다. 등쪽 첨부 파일 근육의 왼쪽이나 오른쪽의 활성화에 의해 evoked 수축의 측정을 할 수 있습니다. 측면의 첨부 파일 뉴런의 대부분의 강력한 힘을 보여줍니다하지만, 변환기가 연결되어 할 수있는 측면에 수축의 측정 만 할 수 있습니다.
- I1/I3의 앞, 뒤, 또는 두 가지 모두 지역을 활성화 할 수 있습니다 뉴런을 식별하기 위해 인두 조직 단지 앞, 근육의 뒤쪽 부분에 힘 변환기를 부착하고, 앞쪽 부분에 또 다른 힘 변환기를 부착 근육, 턱 (그림 1; 노트 후크)에서.
- 봉합이 긴장 당겨 때까지 힘 트랜스 듀서을 들어 있지만, overstretch하지 않습니다. 봉합 내가의 일부 여유가있는 경우이를 확인하기 위해 힘 변환기에서 측정을 볼 수측정 약간이 기본 수준 이상 될 때까지 t 한 다음 변환기를 들어.
9. 모터 풀에서 모터 뉴런을 식별
- 이 프로토콜은 extracellularly 모터 수영장에서 모터 뉴런을 식별하기위한 프로세스를 설명합니다. Google은 개별 뉴런 여러 신경, 그리고 근육 (EMG 신호 또는 수축 힘)의 활동을 모니터링 할 수 AxoGraph 소프트웨어를 사용했습니다. 이 프로토콜에서는, 우리는 모터 뉴런을 식별하는 과정에 대한 설명을 같이 근육의 수축 힘을 사용하여, 다른 실험에서, 우리는뿐만 아니라 EMG를 사용하여, 그리고 실험에 대한 설정은 (토론 참조) 매우 유사합니다.
- 후보 뉴런를 찾으려면, 부드럽게 자극 및 녹화 선택성 5 최상의 위치에 있습니다 뉴런 소마 5 (그림 3)의 중심부 위에 칼집에 세포 유리 전극의 끝을 누르 속이는를 사용합니다. 이후 임계 전류 F또는 신경 세포를 활성화하는 전극 - 투 - 소마 거리 5 선형 증가, 자극의 선택성이 더 악화 전극은 이웃 뉴런을 향해 대상 뉴런의 중심부에서 멀리 이동하면 될 것입니다.
- 모터 뉴런을 식별하려면 먼저 직접에만 신경이 발사되어 있는지 확인하기 위해 세포 유리 전극을 사용하여 신경을 자극하고,이 근육을 innervates 여부를 검사합니다. 그런 다음 extracellularly이 뉴런에서 기록 수립하는 일대일의 세포 소마 기록하며 신경 식별에 매우 중요합니다 신경 녹음 사이의 관계.
- 대부분의 세포 앰프는 채널에 동시 자극 및 녹음을 허용하지 않으므로으로 자극하고 기록 소마를 (소마 채널) 자극 모드로하고 간단한 현재 양극 (Aplysia 뉴런 5 예 6 밀리 초)을 적용하는 데 사용되는 채널을 설정 소마 (그림 4A, 5A, 노트 화살표 한 전N 두 그림은), (예 : 200 μA) 저 전류부터 시작하고, 점차적으로 신경 세포의 폭발 때까지 전류를 증가합니다.
- 신경이 폭발 활성화되면, 하나는 즉시 자극 모드에서 녹화 모드 (, 노트 화살표 2 모두 그림의 그림 4A, 5A)에 소마 채널을 전환해야합니다. 그러나, 여전히 때문에 인간의 응답 지연의 소마의 자극 및 녹음 사이 지연 될 수도 있습니다.
- 시간이 합리적인 금액에 대한 신경 세포가 발생하면 관찰 할 수 있어야한다 일대일의 소마 기록에서와 신경 (들)에 해당하는 활동 전위있는을 통해 뉴런 프로젝트 (그림 4B, 5B,주의 점선 ), 신경 (그림 4A, 5A에 의해 생성뿐만 아니라 힘, 메모 파란색 상자). 뉴런은 소마 녹음이 시작되기 전에 해고하지 않으면, 더 이상 시간을 활성화 전류를 증가시킵니다.
- 세포의 신호 대 노이즈 비녹음은 전극 위치와 소마의 크기에 따라 달라집니다. 세포 녹음 소마 크기 증가와 전극 - 투 - 소마 거리 감소와 같은 큰 될 것입니다. 소음은 좁은 범위에서 차이가 있기 때문에, 신호 대 잡음 비율은 또한 소마 크기 증가와 전극 - 투 - 소마 거리 감소로 증가 할 것이다. 신호 대 잡음 비율의 가장 일반적인 범위는 4시 1분에서 8시 1분하는 것입니다.
- 모터 뉴런은 이러한 소마 위치, 신경 투영 및 근육 innervation 4,6,7 등의 특징을 바탕으로 식별 할 수 있습니다. 만 두 BN2s이 BN2s에서 활동을 모니터링하여, 구강 질량에 부착되어 있기 때문에, 하나는 근육 수축 힘은 세포 자극에 의해 활성화 뉴런에 의해 발생되어 있는지 확인 할 수 있습니다.
- 예를 들어, B3는 구강 신경절의 뱃 부리 장식이있는 측면에있는 I1/I3 근육의 대형 모터 뉴런 (200~350g 무게 동물의 소마의 직경 300-400 μm), (그림 3 ). 단지 ipsilateral BN2을 통해 프로젝트, I1/I3 근육의 앞쪽과 뒤쪽 부분을 모두 innervates. 대부분의 시간, 그것을 활성화하면 (9 실험 8 개) 뒤쪽 힘보다 더 큰 앞을 생성합니다.
- 신경 세포가 확인 된 후, 그 활동은 아래에 설명 된 바와 같이 elicited 할 수있는 세포 유리 전극 (도 4 및 5)을 통해 다른 먹이와 같은 행위에 기록 할 수 있습니다. 소마의 세포 녹음이 훨씬 더 구체적인 여러 뉴런의 활동을 포함 신경 녹음보다 수 있습니다.
- egestive 같은 모터 프로그램을 유도하기 위해 펄스 19 1-2 분 (2Hz, 각 펄스 1 밀리 초 임) BN2 -을 자극한다. 이 자극은 안정적으로이 설정에 egestive 패턴을 생성합니다. 충분한 전류를 사용 (예 : 300 μA), 패턴은 자극의 기간 동안 계속 될 수 있습니다. 때때로 한 직후에 발생 하나 더 패턴이있을 것입니다자극이 끝납니다.
- ingestive 같은 모터 프로그램을 유도하기 위해 직접 대뇌 신경 15 집에 고체 carbachol 몇 크리스탈을 배치합니다. 하나는 carbachol 노출의 수준을 제어하기를 원하는 경우, Aplysia 생리의 1-10 밀리미터 carbachol의 솔루션을 사용합니다. 높은 농도는 반응을 유도 할 가능성이 더욱 높아집니다. 반복적 인 패턴은 일반적으로 5 분 이내에 시작 아래로 실행 시작하기 전에 약 10~15분 지속될 수 있습니다.
- carbachol 몇 번을 세정 최소 30 분을 기다리고 후, carbachol의 후속 응용 프로그램은 더 많은 ingestive 같은 모터 패턴을 유도 할 수있는 대뇌 신경에 추가 할 수 있습니다.
- 특정 모터 풀에 대해 여러 모터 뉴런을 식별 및 모터 프로그램 중에 특징 한 후, 하나는 신속하게 미래의 일에 해당 뉴런 (그림 6을 식별하기위한 최소한의 정보를 필요로하는 매우 단순화 된 진단 방법을 개발 할 수 있습니다 </ strong>)을, 예를 들어 중지 된 구강 대량 준비 또는 생체 인치 기준은 소마 크기와 위치, 신경 프로젝션, 신경의 단위 크기, 모터 패턴 동안 활동의 타이밍을 포함 할 수 있습니다.
결과
그림 4와 5는 두 I1/I3 모터 뉴런을 식별하는 데 사용되는 일반적인 결과를 보여줍니다. 그림 4 egestive 같은과 ingestive 같은 패턴 (인물 4C, 4D) 동안 대형 모터 뉴런, B3의 소마 녹음을 보여줍니다. 일대일의 소마 채널 및 B3 소마 기록의 특이성이 패턴 동안 유지되었다는 ipsilateral BN2 채널 (그림 4E) 쇼에 해당하는 스파이크. B3는 패턴의 중간 - 투 - 늦은 후퇴 단계에서 발생합니다. 그림 4와 다른 결과 (미도시)에서, 우리는 B3의 BN2 단위는 항상 가장 큰 BN2 단위입니다 것으로 나타났습니다. 따라서, 또한 BN2 녹음에서 직접 감지 할 수 있습니다.
그림 5는 egestive 같은과 ingestive 같은 패턴 (그림 5C, 5D)에있는 작은 신경, B43의 소마 녹음을 보여줍니다. 일대일의 소마 채널에 해당하는 스파이크그리고 ipsilateral BN2 채널 (그림 5E 호야)도 B43 소마 기록의 특이성이 패턴 동안 유지 된 것으로 나타났습니다. 패턴 중에 후퇴 단계의 말에 신경이 B43 폭발. B43의 BN2 장치가 소형이기 때문에, 그것은 소마 녹음없이 BN2 녹음에서 식별하기 어려운 것, 그것이 BN2 모터 패턴의 끝 부분에 가장 강렬하게 발생하기 때문에 그러나, B43의 버스트의 끝 부분은 여전히 식별 할 수 있습니다 혼자의 BN2 녹음.
그림 6은 훨씬 쉽게 extracellularly 중지 된 구강 대량 준비 또는 생체에서 I1/I3 모터 뉴런을 식별 할 수 기준 등 근육 innervation을 필요로하지 않는 최적화 된 진단 트리를 보여줍니다. 진단 나무는 힘과 EMG의 조치를 사용하여, 그러나, 개발, 따라서이 프로토콜의 기술을 효율적으로 모터 뉴런 식별 될 수있는 방법을 보여줍니다되었습니다.

1 그림. 전체 설치 및 힘 연구를위한 요리의 개략도. 상단 이미지는 평면도를 보여줍니다. 아래 이미지는 사이드 뷰 (평면도 중간에 점선에 해당)를 보여줍니다. 대뇌 신경은 (면적 A) 뒤에 챔버에 Sylgard에 고정되어 있습니다. 구강 신경절은 중간 플랫폼 (지역 C)에 Sylgard에 고정되어 있습니다. 다시 챔버, 중학교 플랫폼은 높은 Sylgard 벽 (지역 B)로 구분됩니다. 뇌성-구강 connectives (CBCs)는 진공 그리스와 봉인, Sylgard 벽에 노치를 통해 전달합니다. 구강 질량은 전면 챔버의 유리 바닥 (면적 D)에 접착되어 있습니다. 구강 신경 2 (BN2s)은 구강 질량에 부착되어 있습니다. 실크 봉합에 부착 된 두 개의 후크는 I1/I3 근육의 앞쪽과 뒤쪽 지역에 삽입됩니다. 티그는 실크 봉합 그런 다음 힘 변환기에 연결되어 있습니다. 그림은 지역 A, B, C, 및 D 어두운 색상, 높은 해당 표면의 표면을 표시하는 어두운 회색, 밝은 회색, 흰색을 사용합니다. 그림은 요리의 중요한 차원을 나타내는 A, B, C, 및 D를 사용합니다. 길이 3-4 음, 다시 챔버 및 중앙 플랫폼을 연결하는 노치의 폭입니다. 길이 B 3-5 음, 중간 플랫폼 (지역 C)와 Sylgard 벽 (지역 B)의 표면 사이의 높이 차이에 있습니다. 길이 C는 5mm 약 노치의 길이를 나타냅니다. 길이 d는 5mm 약 중간 플랫폼 (지역 C)의 폭을 보여줍니다.

그림 2. 구강 신경절의 개략적및 전극 설치가. 그림은 구강 신경 1, 2, 3 (BN1, BN2, 그리고 BN3), 식도 신경 (EN), radular 신경 (RN), I2 신경과 근육 등의 주요 신경의 위치를 보여줍니다 , 그리고 대뇌 구강 결합 (CBC). BN2s는 (그림 1 참조) 구강 질량에 부착되어 있습니다. CBCs은 Sylgard 벽의 노치를 통과, 대뇌 신경에 부착되어 있으며 (그림 1 참조) 진공 그리스로 봉인되어 있습니다. RN과 I2 신경과 근육은 신경절 위에 끌어 구강 질량 (앞 방향)에 인접 고정되어 있습니다. 블루 선은 핀의 위치를 나타냅니다. 두 구부러진 핀 (빨간색 선이 1 표시)은 CBCs를 고정하는 데 사용됩니다. 왼쪽에있는 CBC의 집의 플랩이 접혀과 왼쪽 구강 신경절 (빨간색 선 2로 표시)를 회전 할 수 BN2과 BN3 사이에 아래로 고정되어 있습니다. 일부 신경절에서는 CBC와 BN3 사이에 칼집을 핀 것이 더 편리 할 수 있습니다. 추가 핀 t을 추가EN 더 회전과 안정화를 위해 (레드 라인 3로 표시)에 인접입니다 신경절의 측면을 O. 세포 유리 전극은 세포 자극 및 녹음을위한 소마 위의 집의 상단에 위치합니다. 후크 전극은 BN3s에 부착되어 있으며 장소에있는 신경을 가지고있는 핀은 이러한 후크 전극의 부착 지점보다 더 distally 배치해야합니다. 두 흡입 전극는 RN과 I2 신경과 근육 (I2 신경과 근육의 선명한 전망에 삽입 참조)에 부착된다. 더 큰 그림을 보려면 여기를 클릭하십시오 .

그림 3. I1/I3 모터의 세포 식별 뉴런지도의 사진과 설계도Aplysia 구강 신경절의 뉴런. 상단 사진 오른쪽 구강 신경을 보여줍니다, 입 꼬리 쪽을 겨냥. 구강 신경절, RN과 I2 신경 / 근육을 회전하는 것은 구강 신경절 위에 끌어 EN의 측면에 인접 고정되어 있습니다. CBC 칼집의 플랩도 뱃 부리 장식이있는면이나 꼬리 / 뱃 부리 장식이있는 테두리에있는 뉴런이 볼 수 있도록 통합 및 (그림 2 참조) 회전 고정되어 있습니다. 아래 도식은 상단 사진을 바탕으로 그려집니다. 사진과 설계도 함께 I1/I3 모터 뉴런 B3, B6, B9, B10, B38, B39, B43 6,7과 B82 22,23뿐만 아니라 다른 뉴런의 위치를 나타냅니다. 뉴런 B8a과 B8b는 RN에서 가장 큰 단위에 대한 책임이 있으며, 움켜 잡 기사 6,17를 제어하는 근육 I4을 신경을 분포시키다. B4와 B5 뉴런은 BN3 18 가장 큰 단위에 대한 책임이 있습니다. I1/I3 모터 뉴런의 크기와 위치는 동물의 t에서 변수이지만O 동물은 상대적으로 크기와 위치는 대부분의 뉴런에 매우 신뢰할 수 있습니다 B3, B6, B9, B38, B43, 그리고 B82. 특히 I1/I3 모터 뉴런, 고유 B10와 B39를 식별의 어려움의 일부에 대한 자세한 내용은 토론을 참조하십시오.
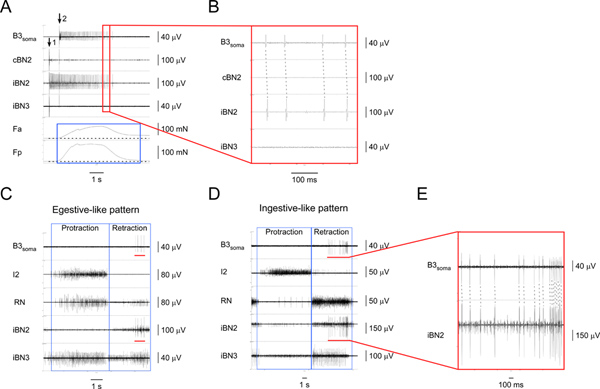
4 그림. I1/I3 모터 뉴런 B3 확인 및 특성화. A) 세포 B3의 자극 (화살표 1의)와 B3 소마 (화살표 2 시작)에서뿐만 아니라 해당 신경과 근육 지역에서 녹화. 위에서 아래로, 채널 B3 소마, contralateral BN2, ipsilateral BN2, ipsilateral BN3, I1/I3 근육의 앞 지역의 수축 힘과의 뒤쪽 지역의 수축 힘에서 녹음 아르 I1/I3 근육.파란색 상자가 I1/I3 근육의 앞쪽과 뒤쪽 지역의 힘의 기간을 강조 표시합니다. 이 경우에는 뒤쪽 힘 앞쪽 힘보다 더 큰 것입니다. A1에 빨간색 상자로 설명이 지역의 B) 요약보기. 하나 하나를위한 B3 소마와 iBN2 채널에 대응하는 행동 잠재력이 ipsilateral BN2에 B3 만 프로젝트. C) 세포 B3 소마에서 녹화 및 egestive 같은 모터 패턴에 신경을 이식 받았다. D) 세포 녹화를 표시에서 B3 소마와 ingestive 같은 모터 패턴에 신경을 이식 받았다. C와 D에서 위에서 아래로, 채널 B3 소마, I2 신경, RN, ipsilateral BN2, 그리고 ipsilateral BN3에서 녹음합니다. 파란색 상자의 패턴 길게 끌기과 후퇴 단계를 나타냅니다. C와 D 모두 B3 소마 채널의 빨간색 막대는 작업 냄비를 강조entials는 B3 소마에서 기록했다. B3는 먹이 모터 패턴 동안 ipsilateral BN2에 사격 할 때 C와 D 모두 iBN2 채널에 빨간색 막대는 해당시기를 나타냅니다. E) 확장 B3 소마의 전망과 빨간색 바가 표시 iBN2 채널을. 점선 표시 할 하나 - 하나에 대한 B3 소마의 행동 잠재력과 iBN2 채널 간 관계입니다.주세요 B3의 BN2 장치가 모든 단위의 최대 값입니다. 따라서, 우리는 또한 소마 녹음없이 BN2 녹음에서 직접 B3의 BN2 단위를 검색 할 수 있습니다. 더 큰 그림을 보려면 여기를 클릭하십시오 .

그림 5. 확인 및I1/I3 모터 뉴런, B43를 특성화. B43의) 세포 자극 (화살표 1시) 및 소마에서 녹화 (화살표 2 시작)뿐만 아니라 해당 신경과 근육 지역에서가. 위에서 아래로, 채널 B43 소마, contralateral BN2, ipsilateral BN2, ipsilateral BN3, I1/I3 근육의 앞 지역의 수축 힘과의 뒤쪽 지역의 수축 힘에서 녹음 아르 I1/I3 근육. 파란색 상자 B43 활동을 통해 I1/I3 근육의 힘 측정을 강조 표시합니다. 활성화 B43는 작은 뒤쪽 힘을 생성,하지만 앞 힘. B) 영역의 확장보기에서 빨간색 상자로 설명했다. 점선 표시 할 하나 - 하나에 해당 ipsilateral BN2 만. C에서 B43 프로젝트) 세포 녹화를 나타냅니다 B43 소마의 행동 잠재력과 iBN2 채널 사이의 관계를egestive 같은 모터 패턴의 B43 소마와 신경에서. B43 소마와 ingestive 같은 모터 패턴에 신경에서 D) 세포 녹음. C와 D에서 위에서 아래로, 채널 B43 소마, I2 신경, RN, ipsilateral BN2, 그리고 ipsilateral BN3에서 녹음합니다. 파란색 상자의 패턴 길게 끌기과 후퇴 단계를 나타냅니다. C와 D 모두 B43 소마 채널의 빨간색 막대는 B43 소마에서 기록 작업 잠재력을 강조 표시합니다. B43이 패턴의 ipsilateral BN2에 사격 할 때 C와 D 모두 iBN2 채널에 빨간색 막대는 해당시기를 나타냅니다. E) 확장 B43 소마의 전망과 D에서 빨간색 막대로 표시 iBN2 채널을. 점선은 B43 소마의 동작 전위 사이의 하나 하나를위한 관계를 보여 및 iBN2 채널. B43의 BN2 단위가 식별하는 다른 방법을 제공 소마 녹음없이 감지 작고 매우 어려운 있지만, BN2 모터 프로그램의 끝 부분에 지속적으로 불합니다. E의 아래쪽 패널에 표시되는 큰 단위가 다른 세포 단위와 B43 소마 단위의 충돌입니다도 있습니다. 큰 그림을 보려면 여기를 클릭하십시오 .

6 그림. 세포 소마 및 신경 녹음을 사용하여 I1/I3 모터 뉴런의 일부를 식별하기위한 최적의 진단 나무.이 진단 방법은 identi에 훨씬 쉽게 만드는 I1/I3 모터 뉴런을 식별하기위한 최소한의 정보가 필요합니다중지 된 구강 대량 준비 또는 생체 내 년도 모터 뉴런. B3는 확인 I1/I3 모터 뉴런 중 가장 큰 BN2 단위가 있습니다. 모터 뉴런, B6와 B9의 나머지 부분에있는 두 유일한 뉴런은 BN2과 BN3 모두에서 프로젝트. B9는 B6보다 더 많은 측면입니다. 만 BN2에 투영 뉴런의 나머지 부분은 두 그룹으로 나눌 수 있습니다. B10와 B39 및 일부 알 수없는 뉴런을 포함 양자 BN2s를 통해 뉴런 프로젝트의 한 그룹. 뉴런의 다른 그룹은 B38, B43, B82를 포함하고있는 만 BN2에 ipsilaterally 계획했다. B38은 B3와 B9 근처에 있습니다. B82는 B8 (그림 3 참조) 근처에 있습니다. B43는 B6 근처에 있습니다. 의 BN2 단위 먹이 패턴의 끝 부분에 작은 폭발이다.

그림 7. 뉴런 내가 성공 요금 비교세포 기술 또는 세포 기술을 사용하여 강제로 실험 기간 동안 dentification. 같은 힘 변환기 설정으로, 우리는을 식별 할 종래의 세포 기술을 (대형 보라색 점)를 사용하여 세포 기술 (작은 파란색 점) 27 실험을 통해 35 실험을 한 I1/I3 모터 뉴런. x 축은 실험의 각 유형에서 확인 된 I1/I3 근육에 모터 뉴런의 최소 수를 나타냅니다. y 축은 실험의 각 유형의 비율 성공률을 나타냅니다. 예를 들어, 세포 실험의 35의 19 아웃 (54 %)에서, 우리는 적어도 다섯 가지 I1/I3 모터 뉴런을 식별 할 수 있었다. 단 1에서 세포 실험의 27 (4 %)의, 우리는 적어도 다섯 I1/I3 모터 뉴런을 식별 할 수 있었다. 이 뉴런을 식별 성공률은 세포 기술을 사용하여 뉴런의 주어진 숫자에 대해 훨씬 높은 것이 분명하다.
토론
예 mollusks (예를 들어, Lymnaea, 나선형, 그리고 Aplysia), 모터 풀의 분석과 같은 대형 식별 뉴런과 동물에서 일반적으로 세포 내 기록 1,2,3,4를 사용하여 수행됩니다. 이 프로토콜에서는, 우리는 고유 세포 기술을 사용하여 모터 풀의 모터 뉴런을 식별하기위한 프로세스에 대해 설명합니다. 우리는이 과정을 그림으로 힘 측정을 사용했습니다. 하나는 또한 근육 innervations를 측정하는 EMG을 사용할 수 있습니다. 간단히 이렇게하려면 프로토콜은 EMG 녹음에 대한 I1/I3 근육의 다른 지역에 훅 전극을 연결하는 변경해야합니다.
세포 기술은 이미 위에서 설명한 된 일부의 세포 기술, 이상 특정 장점이 있습니다. 첫째, 세포 기술은 적은 시간과 실험에 대한 신경절를 준비하는 뉴런에 덜 손상을 발생할 노력이 필요합니다. 보통,이 buc 준비를 20-30 분 소요됩니다세포 실험에 대한 구강 미사에 부착되어있는 구강 신경절를 준비하는 칼 세포 실험에 대한 신경절 및 약 1.5 시간. 시간이 통과하는 근육이 덜 활성화 될 것입니다 때문에, 신경절의 세포 실험에 대한 준비와 세포들 사이의 시간 차이는 실험의 성공을 위해 중요 할 수 있습니다. 그림 7 명의 /의 모터 뉴런을 식별 성공률의 비교를 보여줍니다 I3 근육 힘 연구에서 세포 또는 세포 기술을 사용합니다. 모든 35 세포 힘 실험에서 (100 %), 우리는 I1/I3 근육 하나 이상의 모터 뉴런을 식별 할 수 있었다. 35 (89 %) 세포 실험 31에서, 우리는 적어도 세 I1/I3 모터 뉴런을 식별 할 수 있었다. 세포 실험 35 (54 %)의 아웃 19 년, 우리는 적어도 다섯 가지 I1/I3 모터 뉴런을 식별 할 수 있었다. 반대로, 세포 실험의 성공 속도 샘전자 힘 변환기 설치가 낮은 있었다. 27 (85 %) 세포 실험의 23에서, 우리는 적어도 하나 I1/I3 모터 뉴런을 식별 할 수 있었다. 27 (30 %) 세포 실험에서 8 년, 우리는 적어도 세 I1/I3 모터 뉴런을 식별 할 수 있었다. 세포 실험 만 한 아웃 27 일 (4 %)의에서, 우리는 다섯 I1/I3 모터 뉴런을 식별 할 수 있었다. 따라서, 같은 신경절에서 여러 뉴런을 식별 가능성이 높은 세포 기술에 대조적으로 세포 기술을 사용하고 있습니다.
또한, 세포 기술은 같은 실험이 진행되는 동안 신경절의 양쪽에 많은 뉴런에 액세스 할 수 있습니다. 보통 desheathing 후, 세포 내 전극은 desheathed 된 신경의 측면에서 뉴런에 액세스 할 수 있습니다. 세포 내 전극는 그 뉴런에 액세스 할 수 예를 들어, 두 개의 구강 신경절 (왼쪽에있는 hemiganglion를 예를 들어) 중 하나가 꼬리 쪽을 고정 할 때, 그것은 쉽게 될 것입니다신경절, 예를 들어 B6, B9, B10, B39, 그리고 B43하지만, 이러한 B4, B5, B8a, B8b, B38와 B82 등의 신경절의 뱃 부리 장식이있는 쪽의 뉴런에 액세스하기 어려운 측면. 반면, 세포 전극은 신경의 적절한 회전과 같은 구강 신경절의 양쪽에 많은 뉴런에 액세스 할 수 있습니다. 회전의 정도는 조절 및 치료입니다. 이것은 또한 같은 신경절에서 여러 뉴런을 식별 가능성이 높아집니다.
세포 전극이 부드럽게 뉴런를 덮고있는 껍질에 누를 때문에,이 전극은 막 대형 홀을 생성하고 손상을 일으킬 수있는, 뉴런의 꺼냈다되지 않습니다와 같은 근육 운동 중 세포 내 전극에 발생합니다. 신호 크기는 근육 운동 기간 동안 신경절 이동으로 다양합니다. 때때로 큰 근육 운동하는 동안, 세포 소마 녹음 신호가 감소 될 것입니다 또는 손실됩니다. 그러나, 우리는 MO 쉽게 할 수신경 세포에 세포 전극을 다시 같군하고 원래 신호를 복구합니다. 이 준비는 다른 행동 반응을 생성으로 근육이 큰 수축을 생성하는 동안 행동 연구, 대한 구강 정지 질량 준비 8 세포 기술을 적용하는 것이 가능합니다. 예를 들어, 48 정지 구강 대량 실험 (98 %) 47 아웃에, 우리는 I1/I3 근육 하나 이상의 모터 뉴런을 식별 할 수 있었다. 48 (48 %) 정지 구강 대량 실험 23에서, 우리는 적어도 세 I1/I3 모터 뉴런을 식별 할 수 있었다. 48 (23 %) 정지 구강 대량 실험에서 11에서, 우리는 구강 대량 먹이 같은 동작을 수행하는 과정에서 모터 패턴 동안 그들로부터 I1/I3 근육과 기록을위한 최소한 다섯 모터 뉴런을 식별 할 수 있었다. 세포 기술은 또한 t를 포함하는 절연 헤드 먹이 준비와 같은 다른 더 복잡한 준 그대로 준비, 적용됩니다그 촉수, 입술, 턱, 구강 질량, 구강 신경절, 그리고 뇌성 신경절 12,24,25,26. 감각 입력이 이러한 준비의 먹이 행동을 도출하도록 의도에 매우 중요하기 때문에, 세포 기술 때문에 그 단순성과 덜 유해한 기능을 특히 유용합니다. 이전 연구는 또한 파악하고 만성 생체 18 B4/B5을 기록하는 것이 가능하다는 것을 보여줍니다. 이 이전 실험에서 조사가 선택적으로 B4/B5를 활성화하기 위해 낮은 전류 (10-20 μA) BN2 - 자극을 사용하고 녹음 B4/B5 위의 집에 짧은 폴리에틸렌 관을 접착, 그에 트위스트 쌍을 삽입했다 스테인레스 스틸 와이어. 따라서, 그것은 식별하고 신경절을 (Chestek 및 Chiel, 게시되지 않은 결과) 덮고있는 껍질에 붙어있는 폴리에틸렌 관 전극을 사용하여 생체의 모터 뉴런에서 기록하는 것도 가능합니다.
세포 기술은 또한 몇 가지 limitat이이온. 첫째, 세포 전극이 너무 작거나 신경절에서 너무 깊어 뉴런을 자극하거나 기록하기 어려울 것이다. 이 세포 자극을 통해 표면에없는 뉴런을 활성화 볼 수 있습니다 있습니다. 그러나, 우리의 모델은 5 대상 뉴런의 이웃 뉴런보다 더 깊은 때 자극이 특이성을 잃을 수 있습니다 것으로 나타났다있다. 신경이 깊은 경우, 전극 - 투 - 소마 거리는 현재 인근 다른 표면 뉴런을 활성화 할 수있을만큼 높은이있을 뉴런을 활성화하는 데 필요한 될 것입니다 더 이상 될 것입니다. 신경이 너무 많은 전류 extracellularly 자극하는 경우 둘째,,이 손상 될 수 있으며 더 이상 응답하지, 아주 작은 전류는 세포 자극에 사용되는,하지만 너무 많은 전류가 intracellularly도 뉴런에 손상을 줄 수 있습니다. 때때로 소마 녹음 intracel보다 구체적 대상 뉴런과 인접 뉴런 모두에서 여러 단위를 포함합니다lular 기록. 또한, 세포 전극 자극하고 동시에 같은 신경을 기록 할 수 없기 때문에 정확하게 제어하고 오히려 세포 기술보다 세포를 사용하여 개별 뉴런의 발사 빈도를 모니터링 것이 더 어려울 수 있습니다. 또한, 세포 기술은 premotor의 뉴런에서 시냅스 입력을 기록 할 수 없습니다. 또한, 우리가 그걸 집 27 제거하지 않고 carbachol를 사용하여 신경을 자극하는 것이 가능하다는 것을 보여 주었다 있지만 신경절가 desheathed하지 않는 한 특정 신경 세포에 iontophoretically 신경 전달 물질을 적용하기 어려울 수 있습니다.
세포 식별 기술의 한계를 식별하기 어려운 모터 수영장에서 일부 뉴런했다. O 기반 B3, B6, B9, B38, B43, 그리고 B82 :이 특정 예제에서, 세포 기술은 안정적으로 Aplysia의 I1/I3 근육에 모터 뉴런의 대부분을 확인n은 소마 크기와 위치, 신경 프로젝션, 그리고 근육 innervation. 그러나, 우리는 안정적으로 B10와 B39을 식별 할 수 없었습니다. 이전 세포 작품 6,7은 B10와 B39는 B4/B5 지역과 B6 지역 사이의 구강 신경절의 꼬리 쪽 두 개의 인접한 뉴런입니다 것으로 나타났다. 두 뉴런은 BN2s에 양자 프로젝트. B39는 I1/I3 근육의 앞 지역을 innervates 반면 B10는 I1/I3 근육의 중간과 뒤쪽 지역을 innervates. 소마 위치 및 신경 프로젝션 기준에 따라, 우리는 양자 네 가지 실험에서 BN2s로 해당 프로젝트 두 개 이상의 모터 뉴런을 발견했다. 자신의 소마 위치, 근육 innervations, 그리고 모터 패턴 동안의 활동시기가 동물에서 동물에 변수 있기 때문에, 우리는이 동일한 뉴런라면 확인하지 못했습니다. 따라서, 우리는 안정적으로 인해 일관성의 부족의 세포 기술을 사용하여 B10와 B39 식별 할 수 없습니다. 고유 식별 할 것은,우리는 구강 신경절에서 뉴런의보다 철저한 조사를 할 필요가, 그리고 premotor 뉴런 B4/B5에서 시냅스 입력 및 세포 기술을 필요로 송신기에 응답 같은 추가 기준을해야 할 수도 있습니다.
적절한 수정을 통해이 기술이 다른 모터 수영장 적용됩니다, 예를 들어 Lymnaea stagnalis 2, 나선 pomatia 3, 바퀴벌레 13, I5 근육 (10), I2 근육 11, 및 Aplysia 또는 다른 시스템에 I4 근육 12 예, 그리고 14 zebrafish. 하나 Aplysia의 I5 근육 (또한 액세서리 radular 가까운 근육이나 ARC 10,28라고도 함)에 대한 모터 뉴런에이 기술을 적용하기를 원하는 경우 예를 들어, 하나는 BN2s 대신 구강 질량에 부착 BN3s을 유지해야합니다 때문에 I5 모터 뉴런 B15과 ipsilateral BN3 6,7에서 B16 프로젝트. 그런 다음 t그는 구강 질량은 EMG 또는 강제 조사를위한 I5 근육을 노출 할 수 있도록 준비해야합니다. 뉴런 안정적으로 감소 준비에서 확인 된 후, 최적화 된 진단 방법은 미래의 행동 연구에 대해 생성 될 수 있습니다.
우리가 설명 한 기술은 다중 전극 배열 및 전압에 민감한 염료 등 다른 세포 기술을 우호적 비교합니다. 우리의 세포 전극 및 다중 전극 배열 30 자극 및 녹음 모두에 사용할 수있는 반면, 전압에 민감한 염료 29 기술은, 녹음에 사용됩니다. 다중 전극 배열 29 전압에 민감한 염료 30 모두 동시에 많은 뉴런에서 신호를 기록 할 수 있습니다. 하나의 세포 전극은은 팁 크기와 전극 위치에 따라 하나 또는 두 개의 뉴런에서 기록 할 수는 있지만 동시에 신경절에서 여러 위치를하는 것이 정말로 가능할 것입니다, 우리는 짓을 한거야이 성공적으로. 체외 다중 전극 배열의 표준은 8 X 8 또는 6 × 10 전극 29이 있습니다. 전극이 고르게 배열에 배포됩니다 때문에 종종 여전히 일부의 기본 뉴런이 고르게 분산되지 않기 때문에 녹음가 얻을 수있는 뉴런과 신호의 후 처리 중요한,의 신원을 결정하기 위해 도전하고 있습니다 설명서는이 모호함을 해결하기 위해 수행되어야합니다. 세포 전극이 하나의 somata 위에 위치하기 때문에 반대로, 기본 뉴런의 신원은 분명하다. 그러므로, 멀티 전극 배열 및 전압에 민감한 염료가 여러 동시 레코딩을위한보다 효율적 될 수있는 것 같습니다. 그러나, 우리의 세포 전극 기술은 자극 및 녹음 모두에 대한 더 나은 선택성을 제공 할 수 있습니다.
공개
우리는 공개 할 아무 것도 없습니다.
감사의 말
이 연구는 NIH 보조금 NS047073 및 NSF 보조금 DMS1010434에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 이름 | 회사 | 카탈로그 번호 | 코멘트 |
| 나트륨 염화물 | 피셔 과학 | S671 | 생물학적, 공인 |
| 염화칼륨 | 피셔 과학 | P217 | 인증 ACS |
| 마그네슘 염화물 hexahydrate | Acros의 유기물 | 19,753 | 99% |
| 황산 마그네슘의 heptahydrate | 피셔 과학 | M63 | 인증 ACS |
| 칼슘 염화물 이수화 | 피셔 Scientifc | C79 | 인증 ACS |
| 포도당 (덱스 트로 오스) | 시그마 - 알드리치 | G7528 | BioXtra |
| 걸레는 buffe연구 | Acros의 유기물 | 17,263 | 99% |
| Carbachol | Acros의 유기물 | 10,824 | 99% |
| 수산화 나트륨 | 피셔 과학 | SS255 | 인증 |
| 염산 | 피셔 과학 | SA49 | 인증 |
| 단일 질주 모세관 유리 | AM 시스템 | 6150 | |
| 불타는 브라운 micropipette 풀러 모델 P-80/PC | 셔터 악기 | 필라멘트 사용되는 : FT345B | |
| 에나멜 코팅 된 스테인레스 스틸 와이어 | 캘리포니아 정밀 와이어 | 0.001D, 코팅 H | |
| 가정용 실리콘 II 접착제 | GE | ||
| 겠구나 빠른 젤 superglue | 헨켈 주식회사. | ||
| 시스템 모델 (1700) 앰프에게 AM | AM 시스템 | 필터 설정 : I2 신경 / 근육에 10-500 Hz에서, 모든 다른 신경에 300-500 Hz에서 | |
| Pulsemaster 다 채널 Stimulator | 세계 정밀 계측기 | A300 | |
| 자극 아이솔레이터 | 세계 정밀 계측기 | A360 | |
| AxoGraph X | AxoGraph 과학 | 레코딩을위한 소프트웨어 | |
| 골드 커넥터 핀 | Bulgin | SA3148 / 1 | |
| 골드 커넥터 소켓 | Bulgin | SA3149 / 1 | |
| Sylgard 184 실리콘 엘라스토머 | 다우 코닝 | ||
| 100 X 15mm Crystalizing 요리 | Pyrex | ||
| 높은 진공 그리스 | 다우 코닝 | ||
| Pipet 팁 | 피셔 과학 | 21-375D | |
| Minutien 핀 | 정밀 과학 도구 | 26002-10 | |
| 모델링 점토 | 사전 트 아트 | 22-4400 | |
| 에어 펌프를 속삭 | 테트라 | 77,849 | |
| 수족관 배관 | Eheim | 7783 | 16분의 12 mm |
| 엘리트 Airstone | 하겐 | A962 | |
| Vannas 봄 가위 | 정밀 과학 도구 | 15000-08 | |
| 뒤몽 # 5 좋은 포셉 | 좋은 Scienc전자 도구 | 11254-20 | |
| Kimwipes | 킴벌리 - 클락 | 34,155 |
참고문헌
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유