Method Article
Extrazellulär identifizieren Motor Neurons für einen Muscle Motor Pool in
In diesem Artikel
Zusammenfassung
Bei Tieren mit großen identifizierten Neuronen ( ZB Weichtiere), wird die Analyse des Fuhrparks erfolgt über intrazelluläre Techniken 1,2,3,4. Vor kurzem haben wir eine Technik, um extrazellulär stimulieren und aufzeichnen einzelnen Neuronen in Aplysia californica 5. Wir beschreiben nun ein Protokoll für die Verwendung dieser Technik zur eindeutigen Identifizierung und Charakterisierung Motoneuronen in einem Fuhrpark.
Zusammenfassung
Bei Tieren mit großen identifizierten Neuronen (zB Weichtiere), Analyse von Fuhrparks erfolgt über intrazelluläre Techniken 1,2,3,4. Vor kurzem haben wir eine Technik, um extrazellulär stimulieren und aufzeichnen einzelnen Neuronen in Aplysia californica 5. Wir beschreiben nun ein Protokoll für die Verwendung dieser Technik zur eindeutigen Identifizierung und Charakterisierung Motoneuronen in einem Fuhrpark.
Diese Technik hat extrazellulären Vorteile. Erstens extrazellulären Elektroden stimulieren kann und aufzuzeichnen Neuronen durch die Hülle 5, so dass es nicht entfernt werden müssen. So wird Neuronen gesünder in der extrazellulären Experimenten als im intrazellulären diejenigen. Zweitens, wenn Ganglien gedreht werden durch geeignete Pinning der Hülle können extrazelluläre Elektroden zuzugreifen Neuronen auf beiden Seiten des Ganglion, das es einfacher und effizienter zu mehreren Neuronen in der gleichen Präparation zu identifizieren. Drittens extrazellulärenlar Elektroden brauchen nicht in Zellen eindringen, und somit leicht hin und her bewegt werden zwischen Neuronen, was zu weniger Schäden an ihnen. Dies ist besonders nützlich, wenn man mehrere Neuronen während wiederholenden Bewegungsmuster, die nur für Minuten andauern kann aufzuzeichnen versucht. Viertens extrazellulären Elektroden sind flexibler als intrazelluläre Wieder während Muskelbewegungen. Intrazelluläre Elektroden können herausziehen und beschädigen Neuronen während Muskelkontraktionen. Da im Gegensatz dazu extrazellulären Elektroden sanft auf der Hülle oberhalb Neuronen gedrückt werden, sie in der Regel oberhalb derselben Neuron bleiben während Muskelkontraktionen, und können daher in mehreren intakten Zubereitungen verwendet werden.
Zur eindeutigen Identifizierung Motoneuronen für einen Motor Pool (insbesondere die I1/I3 Muskel in Aplysia) mit extrazellulären Elektroden, kann man Funktionen, die keine intrazelluläre Messungen Kriterien: soma Größe und Lage, axonale Projektion und Muskelinnervation 4, 6,7. Für den bestimmten Motor Pool verwendet, um die Technik zu veranschaulichen, wiesen wir von bukkal Nerven 2 und 3, die Axon-Vorsprünge zu messen, und die gemessene Kontraktionskräfte des I1/I3 Muskel um das Muster der Muskelinnervation für die einzelnen Motoneuronen zu bestimmen.
Wir zeigen den kompletten Prozess der ersten Identifizierung von Motoneuronen mit Muskelinnervation, dann Charakterisierung ihrer Zeit während Bewegungsmuster, die Schaffung eines vereinfachten diagnostisches Verfahren zur schnellen Identifizierung. Die vereinfachte und schnelle diagnostische Verfahren überlegen ist für mehr intakt Zubereitungen, z. B. in der suspendierten bukkalen Masseaufbereitung 8 oder 9 in vivo. Dieses Verfahren kann auch in anderen Motor-Pools aufgebracht werden, 10,11,12 Aplysia oder in anderen tierischen Systemen 2,3,13,14.
Protokoll
Ein. Vorbereitung der Aufnahme Dish
- Während der Kraftwandler Experimenten werden die bukkale Ganglien Cerebralganglion und bukkalen Masse in einem runden Pyrex-Schale, die zur Kraft-Studien spezialisiert platziert ist.
- Um Ingestiv-ähnliche Muster in den Experimenten zu induzieren, müssen wir die nichthydrolysierbare cholinergische Agonist Carbachol zur Cerebralganglion 15 anzuwenden. Um einen direkten Kontakt von Carbachol auf den bukkalen Ganglien und bukkalen Masse zu vermeiden, werden getrennte Kammern benötigt, um die Cerebralganglion von bukkal Ganglien und der bukkalen Masse (Abbildung 1) zu isolieren.
- Da die bukkale Masse ist viel dicker als die bukkale Ganglien, werden sie nicht auf der gleichen Ebene angeordnet werden. Daher sollte diese Schale eine hintere Kammer zur Cerebralganglion (Bereich A in 1), eine mittlere Plattform für die bukkale Ganglien (Bereich C in Fig. 1), und einem viel tieferen vordere Kammer für die bukkale Masse (Bereich D in Abbildung 1).
- Um dieses Gericht zu schaffen, mit einem runden 100x15 Pyrex-Schale (15 mm hoch, 100 mm im Durchmesser) beginnen. Bau der Schale erfordert mehrere schüttet der Sylgard. Befolgen Sie die Anweisungen mit dem Sylgard Produkts. Sylgard muss erlaubt, zwischen verschiedenen schüttet eingestellt werden.
- Die erste ist es, den Stockpunkt höchste Sylgard in die Schüssel (Bereich B in 1), die die Wand zwischen der mittleren Plattform und zurück Kammer zu schaffen.
- Verwenden Sie zwei Modelliermasse Träger, den Bereich für Sylgard Wand (Bereich B in Abbildung 1) zu isolieren. Bestreichen Sie die Modelliermasse Träger mit Plastikfolie, wo sie die Sylgard zur leichteren Entnahme in Verbindung setzen. Stellen Sie sicher, Abdichtungen an den Rändern, wo Modelliermasse das Gericht in Verbindung setzen, um das Auslaufen zu minimieren.
- Gießen Sylgard in den Bereich zwischen den beiden Modelliermasse Träger fast bis an die Spitze der Schale. Lassen Sie die Sylgard vollständig eingerichtet Nacht. Halten Sie die Schüssel an einem warmen Ort veranlassen wirdschnellere Einstellung. Entfernen Sie die Modelliermasse Träger und bereinigen Ton Rückstand auf dem Sylgard.
- Weiter sollte der Rückkammer (Bereich A in 1) und die mittlere Plattform (Bereich C in Fig. 1) eingegossen werden.
- Platzieren einer Modelliermasse Träger etwa 5 mm von der vorderen Oberfläche des Sylgard für den Abschnitt der mittleren Plattform (Bereich C).
- Gießen Sylgard in die Abschnitte für die hintere Kammer (Bereich A) und mittlere Plattform (Bereich C) bis zu einer Höhe von ca. 3-5 mm unterhalb der oberen Ebene des ersten Sylgard Wand (Bereich B). Die Sylgard Fläche der hinteren Kammer sollte etwas geringer als die der mittleren Plattform, um eine Leckage von der Rückseite enthaltende Kammer Carbachol zur Mitte Plattform vermeiden. Wieder ließ die Sylgard vollständig eingerichtet Nacht und entfernen Sie dann die Modelliermasse Rückendeckung.
- Der letzte Schritt besteht darin, eine Kerbe in der Mitte des Sylgard Wand geschnitten, um einen Kanal für die zerebrale-bukkalen Konnektive (CBCs) zu gehen bereitzustellendurch zwischen der mittleren Plattform und hintere Kammer. Die Breite dieser Aussparung sollte ca. 3-4 mm, der breit genug für den CBCs ist. Der Boden der Aussparung sollte nicht niedriger sein als die Sylgard Oberfläche der mittleren Plattform, um eine Leckage zu verhindern. Ein Skalpell verwendet, um die Kerbe geschnitten werden.
2. Vorbereitung der Elektrode
- Ziehen Sie extrazellulären Glaselektroden von einzelnen Läufen Kapillare Glas mit einem Flaming-Brown Feinpipettenziehvorrichtung von McManus et al. 8 in Abschnitt 3.1. Mit dem FT345B Glühfaden in der Abzieher sind unsere typischen Programm-Einstellungen Hitze 480, Pull 50, Velocity 13 und Time 20, aber beachten Sie, dass Einstellungen für verschiedene Filamente. Dieses Programm erzeugt die Elektroden in einem einzigen Zug ohne Feuer-Polieren Bühne. Die Größe der Elektrodenspitze sollte kleiner sein als die Größe der Zellkörper. Für die motorischen Neurone im Bereich von 50 um bis 400 um in Soma Durchmesser, der innere Durchmers der extrazellulären Glaselektroden sollten etwa 40 um betragen und deren Resistenzen sollten etwa 0,1 MOhm sein, wenn sie mit Aplysia Kochsalzlösung gefüllt sind.
- Ziehen Sie Saugelektroden aus Polyethylen-Schlauch mit einem Bunsenbrenner. Schneiden Sie ein Stück aus Polyethylen-Schlauch ca. 10 cm lang. Halten Sie den Schlauch an beiden Enden und legen Sie es ganz in der Flamme durch den Bunsenbrenner generiert schließen, während Drehen des Rohres, bis es weich von der Hitze wird. Dehnen Sie den Schlauch vorsichtig entlang seiner Länge, während Sie es weg von der Flamme. Der mittlere Teil des Schlauchs wird länglichen und verengen als der Schlauch gezogen wird.
- Schneiden Sie den Schlauch in eineinhalb bis zwei Saug-Elektroden zu bilden. Saugelektroden sind allgemein zu den geschnittenen Enden von Nerven oder Muskeln angewendet, wenn dies manchmal nebenbei aufgebracht werden.
- Erstellen Haken Elektroden für Nerven-Aufnahmen nach dem Protokoll von McManus et al 8 in Abschnitten 3,2-3,13 beschrieben. Diese Elektroden sind especiverbünden nützlich, wenn ein Nerv oder Muskel nicht geschnitten wird.
3. Hakenelektrode Anhang
- Sezieren das Tier, und entfernen Sie die bukkale Masse nach dem Protokoll in McManus et al. 8 Abs. 4.
- Zum Aufzeichnen und Stimulation, kann Haken Elektroden an einer Anzahl verschiedener Nerven befestigt werden.
- Um Muster, wie es in vivo durch Cullins und Chiel 9 getan charakterisieren, muss Aufnahmen vom I2 Nerv und Muskel, der die Phase des Zuführens Protraktion 16 die radular Nerv (RN), die die Schließung der Greifer 17 Lebensmitteln, bukkale zeigt anzeigt erhalten werden Nerven 2 (BN2) und bukkalen Nerven 3 (BN3), die Rückziehphase 17,18 anzuzeigen. Die Befestigung der Haken Elektroden folgt einem ähnlichen Verfahren wie dem von McManus et al 8, Abschnitt 5 beschrieben.
- Die Standorte dieser Nerven beziehen sich auf die schematische Darstellung des Aplysia Zuführvorrichtung gezeigt, inAbbildung 2 McManus et al 8. Beachte, dass die BN2 trifurcates in Zweige a, b, und c, bevor sie unterhalb des I1 Muskel an der seitlichen Rille. Zweig A ist der erste Zweig aus dem Hauptstamm zu trennen, und ist neben dem BN3.
- Die Nomenklatur der Zweige a, b und c wurde durch Warman und Chiel 18 verwendet. Zweigen a, b, und c, um Zweige 3, 2 entspricht und 1, jeweils in der Nomenklatur von Nargeot et al. 19. Weiterhin die RN die BN1, BN2 die, und die BN3 an Nerven 1, 6, 5 entsprechen, und 4, die jeweils in der Nomenklatur von Kandel 20 und Scott et al. 21
- Um die Muskelinnervation der I1/I3 Muskel studieren, alle Nerven außer bukkalen Nerven 2 wird von bukkal Masse während der Experimente getrennt werden. Somit verwendeten wir einen Haken Elektrode vom BN2 aufzuzeichnen.
- I2 Da der Nerv und die RN nicht zur bukkalen Masse angebracht werden kann, und sie sind sehr schwer zugänglich Verwendung Haken Elektroden, ist es vorzuziehen, Saugelektroden anzuwenden, um von ihnen statt aufzuzeichnen. Wir werden die Anwendung der Saugelektroden in Abschnitt 7 beschrieben.
- Entweder einen Haken Elektrode oder eine Saugelektrode von der BN3 aufzunehmen, da es leicht zugänglich entweder Art von Elektrode ist. Wir entschieden uns, einen Haken Elektrode für den BN3 Aufnahmen verwenden, um die Anzahl von Manipulatoren zum Halten der Saugelektroden minimieren und um Raum für andere Manipulatoren oder Ausrüstung zu speichern.
- Befestigen Sie einen Haken Elektrode verzweigen a BN2 (BN2-a), um eine Abstoßung-ähnliche Muster während der Experimente zu initiieren. Es ist nützlich, um eine zusätzliche Elektrode mit dem Haken BN2-a auf der anderen Seite befestigen, weil einige Neuronen reagieren unterschiedlich auf der ipsilateralen vs kontralateralen BN2-a Stimulation.
- Um zu unterscheiden Neuronen mit einseitigen vs bilaterale Projektionen, esist auch nützlich, um Hakenelektroden BN2 BN3 befestigen und die auf der anderen Seite der bukkalen Ganglien.
4. Ganglien und Muscle Vorbereitung
- Die bukkale Ganglien Cerebralganglion und bukkalen Masse wird für den Kraftwandler Experimenten hergestellt werden, in dem die Cerebralganglion zur bukkalen über die Ganglien CBCs und die bukkale Masse wird auf der bukkalen Ganglien befestigt über die BN2s nur angebracht ist.
- Nach dem Befestigen der Haken Elektroden geschnitten bukkalen Nerv 1 (BN1) und die Ösophagus-Nerv (DE) bilateral, Schneiden an dem Befestigungspunkt zur bukkalen Masse.
- Ziehen Sie den Cerebralganglion vorne, um ihn aus dem Weg des I2 Muskel. Machen Sie einen Schnitt in den I2 Muskel über dem radular sac, erweitern den Schnitt seitlich und nach vorne in beide Richtungen, und ziehen Sie die Klappe des I2 Muskeln vorn, um den radular Nerven freizulegen. Schneiden Sie die beiden RN Niederlassungen und stellen Sie sicher, dass die Zweige lang genug sind für Saugelektrode Befestigung.
- Ceiter die I2 Schnitt in einem weiten Kreis um die bukkale Ganglien, man aufpassen, nicht die BN2s oder die BN3s geschnitten, bis die bukkale Ganglien und das angeschlossene Teil des I2 Muskel kann vollständig von der bukkalen Masse getrennt werden. Schneiden die bilateralen BN3s an dem Befestigungspunkt zur bukkalen Masse, über den Haken Elektrodenvorrichtung.
- Tragen Sie eine dünne Schicht von Vakuumfett der Kerbe in der Aufnahme Gericht vor, die die hintere Kammer und mittleren Plattform verbindet beschrieben, mit einer Pipettenspitze abholen ein Klumpen Vakuumfett und breitete sie über die Kerbe.
- Tragen Sie eine dünne Schicht von Quick-Gel Superkleber auf den Glasboden der vorderen Kammer, wo die bukkale Masse gelegt werden, nur vor dem Sylgard Basis der mittleren Plattform.
- Transferieren es vorsichtig in die Cerebralganglion, buccal Ganglien und bukkalen Masse der Aufnahme Schale (Abbildung 1) in Abschnitt 2 beschrieben, um sicherzustellen, dass keiner der Haken Elektroden dicht, zog die könnten die Nerven schädigen.
- Vorsichtig die bukkale Masse auf den Leim in der vorderen Kammer der Aufnahme Schale, um sicherzustellen, dass seine ventralen Oberfläche bis zum Boden der Schale geklebt ist. Achten Sie darauf, die Ganglien und Elektroden berühren den Leim zu halten. Fügen Aplysia Kochsalzlösung 8 (460 mM NaCl, 10 mM KCl, 22 mM MgCl 2, 33 mM MgSO 4, 10 mM CaCl 2, 10 mM Glucose, 10 mM MOPS, pH 7,4 bis 7,5) auf der Schale, die den Kleber zu induzieren zu setzen.
- Wenn das Gericht muss zu einem anderen Mikroskop für die Vorbereitung der bukkalen Ganglien für extrazelluläre soma-Aufnahmen übertragen werden, sehr vorsichtig sein mit den Haken Elektroden. Gruppe die Elektroden auf einer Seite der bukkalen Masse zusammen, und auch Gruppen, die Elektroden auf der anderen Seite der bukkalen Masse zusammen. Vorsichtig halten die Elektroden durch Ergreifen des Labor Band, das die Steckerstifte erstreckt, wiederum um sicherzustellen, dass keine der Elektroden fest gezogen werden.
- Wenn die Schale unter dem Mikroskop, die Elektrode positionierts sollte sanft über die Seiten der Schüssel und Ruhe auf der Plattform neben dem Teller drapiert werden.
- In den Pausen und zwischen den Stufen des Experiments, belüften die Salzlösung in die bukkale Masse Kammer unter Verwendung eines Aquariums Ausströmer.
- Pinzette einsetzen, um die Hülle des Cerebralganglion packen und sie in der hinteren Kammer, sicherzustellen, dass die durch die Kerbe CBCs laufen. Pin der Cerebralganglion mit Nerven außer den CBCs um Schäden an den intakten CBCs vermeiden.
- Übernehmen mehr Vakuumfett über die CBCs, und fügen Sie weitere Aplysia Kochsalzlösung beiden Kammern der Schale, so dass die Ganglien vollständig untergetaucht. Sicherzustellen, dass die Spitze des Vakuumfett geringfügig höher als die Sylgard Wand ist, so dass keine Leckage zwischen den Kammern auftreten wird.
- Um die bukkalen Ganglien zu stabilisieren, der erste Stift die Enden der BN3s, dann die BN1s und der ENS auf den Sylgard Basis der mittleren Plattform (Abbildung 2). Da die BN3s aufgezeichnet mit Hakenelektrode werdens, sollten die Stifte weiter distal als die Befestigungspunkte der Haken Elektroden platziert werden.
- Verwenden Sie zwei Stifte, gebogen 90 Grad, wie Haken zu dehnen und zu verankern CBCs, so dass die CBCs nicht beschädigt wird (Abbildung 2).
- Festzunageln die RN Zweige zwischen der hinteren Kammer und der bukkalen Ganglien. Dann wird der I2 Muskel wird auf der Oberseite des RNs sein. Um die I2 Nerven aussetzen, verwenden Pinzette, um die I2 Muskeln greifen und ziehen ihn über den bukkalen Ganglien. Merken zwei Ecken des Muskels I2 um Schäden am I2 Nerven zu vermeiden.
- Sever die I2 Nerven distal zu dem Punkt, an dem seine beiden Zweige gehen in die I2 Muskel. Stellen Sie sicher, dass der Muskel noch innerviert vergleichbar der in vivo-Aufnahmen. Schneiden Sie den Rest des I2 Muskel-und klappen Sie den I2 Nerven zurück und stecken Sie es nach unten zwischen den beiden RN Niederlassungen (siehe Abbildung 2, Einschub).
- Passen Sie die Positionen der Stifte zu strecken und fügen Spannung, wenn ein Nerv ist zu locker oder zu Spannungen, wenn ein nerv freigebene ist zu eng. Zur weiteren Stabilisierung der bukkalen Ganglien, fügen Sie mehr Pins auf der Hülle zwischen Nerven.
- Da die bukkalen Ganglien caudalen Seite platziert up, drehen Sie den bukkalen Ganglien, wenn die Neuronen von Interesse auf der rostralen Seite sind. Um eines der beiden bukkalen Ganglien drehen, verwenden feinen Pinzette etwas überschüssigen Hülle des CBC greifen, wo es in der Nähe der bukkalen Ganglien ist und pin es unten zwischen den BN2 BN3 und dem. In einigen Ganglien, kann es günstiger sein, sie festzunageln zwischen CBC und BN3.
- Hinzufügen eines zusätzlichen Stift am Mantel des bukkalen Ganglion auf der Seite nahe der vorderen Kammer, um die Bewegung der bukkalen Ganglion minimieren.
- Um die Hülle für den bukkalen Ganglien trimmen, verwenden feinen Pinzette, um die Hülle auf der Seite in der Nähe der hinteren Kammer zu packen, und dann schneiden Sie das überschüssige Mantel mit einer feinen Schere, ohne dass die Zellkörper. Um Schäden zu minimieren, entfernen nur den Mindestbetrag des Mantels notwendig, um die Zellkörper zu sehen.
- Nach ter Hülle des bukkalen Ganglien getrimmt ist, ziehen Sie den I2 Nerven und die RNs über den bukkalen Ganglien und hänge sie sich zwischen der bukkalen Ganglien und vordere Kammer weiter drehen Sie den bukkalen Ganglien. (Siehe Abbildung 2).
- Zum Waschen Sie das restliche Magnesiumchlorid 8, die verwendet werden, um das Tier vor dem Sezieren zu betäuben wurde, ersetzen Sie die Aplysia Kochsalzlösung in die Schüssel mit frischem Aplysia Kochsalzlösung.
5. Elektrisch Verbindungshaken Elektroden
- Nachdem die Ganglien und Muskeln bereit sind, transferieren Sie die Antenne zur Schwingungsisolierung Tabelle für die Experimente.
- Bringen Sie alle Elektrodenstiften ihre Buchsen an den BNC-Kabel, die an den Verstärker (AM Systems Modell 1700 Verstärker) anschließen. Wieder stellen Sie sicher, dass die Elektroden nicht fest, während dies zu tun gezogen. Stellen Sie sicher, dass die Elektroden korrekt in die entsprechenden Kabel angeschlossen und die richtige Polarität.
6. Einrichten der extrazellulären Glass Elektroden für Soma Recordings
- Füllen Sie die Elektrode mit Aplysia Kochsalzlösung mit einer Spritze an einem Stück aus Polyethylen-Schlauch von rund 15-20 cm. Befestigen des freien Endes des Polyethylen-Schlauch an das Ende der Glaselektrode. Ziehen Sie den Kolben der Spritze zu füllen die Elektrode mit Aplysia Kochsalzlösung.
- Platzieren des gefüllten extrazellulären Glaselektrode in die Kerbe des Halters am Manipulator. Verwenden Sie den Manipulator an der Elektrodenspitze in die Aplysia Salzlösung, die die bukkale Ganglien platzieren.
- Legen Sie eine Silber / Silberchlorid angelötet zu einem männlichen Gold-Stecker Stift in der Elektrode als die Aufnahme Draht dienen. Stellen Sie ein weiteres Silber / Silberchlorid angelötet zu einem männlichen Gold-Stecker Pin direkt in die Aplysia Kochsalzlösung in dem Abschnitt der Aufnahme Schale mit der bukkalen Ganglien als Referenz Drahtseilakt. Verbinden Sie beide the Aufnahme und Referenz-Kabel an die BNC-Kabel an den Verstärker angeschlossen.
- Wenn es genug Platz für mehr Manipulatoren können zusätzliche extrazelluläre Glaselektroden hinzugefügt, um mehrere Neuronen gleichzeitig aufgezeichnet werden.
7. Einrichten der Saug-Elektroden für den Nerve Recordings
- Schneiden Sie das schmale Ende des Saugelektrode kippen, um den Durchmesser des Nervs entsprechen. Der Innendurchmesser der Elektrodenspitze sollte ähnlich oder etwas kleiner als der Durchmesser Nervs zu engen Ansaugen sicherstellen.
- Da die I2 Nerven und die RN sehr nahe beieinander sind, können ihre Elektroden von der gleichen Manipulator gehalten werden, um Platz zu sparen. Legen Sie zwei Elektroden in zwei Kerben des gleichen Halters. Drehen der zwei Elektroden und sicherzustellen, dass ihre Spitzen in der Nähe einer anderen sind. Wählen Sie eine von ihnen für die I2 Nerven Aufnahme, der andere für die RN Aufnahme.
- Legen Sie die Elektrodenspitze in der Aplysia Kochsalzlösung im recording Schale mit der bukkalen Ganglien. Befestigen des freien Endes des Polyethylenschlauch auf der Spritze zur Saugelektrode. Benutzen Sie die Spritze zu füllen die Elektrode mit Aplysia Kochsalzlösung. Bewegen Sie die Elektrodenspitze kurz vor dem Ende der Ziel-Nerv, dh die I2 Nerven, und verwenden Sie die Spritze, um die Nerven in die Elektrode zu saugen. Die Länge des Nervs in der Elektrode sollte etwa 0,5 bis 1,0 mm betragen, um eine dichte Abdichtung zu gewährleisten.
- Wiederholen Sie die Saug für die Elektrode, die der RN befestigt werden.
- Verbinden Sie die Elektroden mit den entsprechenden BNC-Kabel wie in Abschnitt 6.3 beschrieben.
8. Einrichten der Kraftaufnehmer die I1/I3 Muskelkontraktion messen
- Um die Kraftaufnehmer auf den Muskel legen, verwenden Seidenfäden. Biege den gekrümmten Nadel jedes Nahtmaterials, und binden das Nahtmaterial mit dem Kraftaufnehmer. Schonend zu greifen und anzuheben eine kleine Menge des Muskels mit einer Pinzette und Halten der Nadel in einem anderen Satz von Zangen, einzufügendie Nadel durch die Muskelkraft bis zu dem Punkt in der gebogenen Nadel (Abbildung 1).
- Wandler können entweder nach dorsal oder seitlich am I1/I3 Muskel vorübergehend befestigt werden kann. Dorsalen Befestigung erlaubt die Messung der Kontraktionen durch die Aktivierung entweder der linken oder rechten Seite des Muskels evoziert. Seitlichen Anbau wird stärkere Kräfte für die Mehrzahl von Neuronen zeigen, wird jedoch nur eine Messung der Kontraktion auf der Seite zu dem der Wandler angebracht ist.
- Zur Identifizierung Neuronen, die die vordere, hintere, oder beide Bereiche I1/I3 aktivieren kann, schließen einen Kraftwandler zum hinteren Teil des Muskels, unmittelbar vor dem Rachengewebe und Befestigen einer zusätzlichen Kraftaufnehmer auf den vorderen Teil des Muskel, an den Spannbacken (Figur 1; beachten Haken).
- Heben Sie die Kraftaufnehmer bis die Nähte gezogen werden straff, aber nicht überfordern. Um dies zu überprüfen, zeigen Sie die Messung aus dem Kraftaufnehmer, wenn die Naht hat etwas Spiel in it, und heben Sie dann den Wandler bis die Messung leicht über diesem Ausgangsniveau.
9. Identifizieren Motor Neurons in einem Motor Pool
- Dieses Protokoll ist ein Verfahren zur Identifizierung von extrazellulär Motoneuronen innerhalb eines Fahrbereitschaft. Wir verwendeten AxoGraph Software, um die Aktivität der einzelnen Neuronen, multipler Nerven und Muskel (EMG-Signals oder Kontraktionskräfte) zu überwachen. In diesem Protokoll verwendeten wir die Kontraktion Kräfte des Muskels als Illustration für den Prozess der Identifizierung Motoneuronen; in anderen Experimenten verwendeten wir EMG als auch, und das Setup für solche Experimente ist sehr ähnlich (siehe Diskussion).
- Um einen Kandidaten Neuron suchen, verwenden Sie den Manipulator vorsichtig auf die Spitze der extrazellulären Glaselektrode nach unten auf die Hülle über dem Zentrum des Neurons Soma 5 (Abbildung 3), die der beste Standort für Stimulation und Ableitung Selektivität 5 ist. Da der Schwellenstrom foder Aktivieren eines Neurons steigt linear mit Elektrode zu soma Abstand 5, wird die Stimulation Selektivität schlechter werden, wenn die Elektrode weg von der Mitte des Ziels in Richtung eines benachbarten Neuronen Neuronen bewegt.
- Um einen Motor Neuron zu identifizieren, erste direkt stimulieren das Neuron mit der extrazellulären Glaselektrode, um sicherzustellen, dass nur diese Neuron feuert, und prüfen, ob es den Muskel innerviert. Dann extrazellulär Datensatz aus diesem Neuron zur Einrichtung eines Eins-zu-eins-Beziehung zwischen der extrazellulären soma Aufnahme und den Nerven-Aufnahmen, die auch entscheidend für Neuron Identifizierung.
- Da die meisten extrazellulären Verstärker nicht erlauben gleichzeitige Stimulation und Aufzeichnung in einem Kanal, den Kanal verwendet werden, um zu stimulieren und notieren Sie die soma (das Soma-Kanal) zur Stimulation Modus und gelten einen kurzen anodischen Strom (z. B. 6 ms für Aplysia 5) an die soma (4A, 5A; beachten Pfeile 1 ibeide Zahlen n), ausgehend von einem niedrigen Strom (zB 200 uA) und die schrittweise Erhöhung der aktuellen bis zu den Neuron Bursts.
- Nachdem das Neuron zu platzen aktiviert ist, sollte man sofort schalten Sie den soma-Kanal von der Stimulation Modus in den Aufnahmemodus (4A, 5A; beachten Pfeile 2 in beiden Figuren). Allerdings wird es noch zu Verzögerungen zwischen der soma Stimulation und Ableitung wegen der menschlichen Reaktion Verzögerungen kommen.
- Wenn die Neuron feuert für einen angemessenen Höhe der Zeit, sollte es möglich sein, zu beobachten, Eins-zu-eins entsprechende Aktion Potenziale aus der soma Aufnahme und auf den Nerv (s), durch die die Neuronen Projekte (4B, 5B; beachten gestrichelten Linien ), als auch die Kräfte von dem Neuron (4A, 5A erzeugt; beachten blauen Boxen). Wenn das Neuron stoppt feuern, bevor die soma-Aufnahme beginnt, erhöhen Sie die aktuelle, um es für eine längere Zeit zu aktivieren.
- Das Signal-zu-Rausch-Verhältnis des extrazellulärenAufnahmen hängt von der Elektrode Lage und soma Größe. Die extrazelluläre Aufzeichnung wird größer als soma Größe zu erhöhen und Elektrode-to-soma Abstand abnimmt. Da das Rauschen variiert nur in einem engen Bereich, wird das Signal-zu-Rausch-Verhältnis auch als soma zunehmender Größe und der Elektrode-to-soma Entfernung abnimmt erhöhen. Die häufigste Bereich des Signal-zu-Rausch-Verhältnis von 4:1 bis 8:1.
- Die motorischen Neuronen können auf der Grundlage ihrer Eigenschaften, wie soma Lage, Nerven Projektion und Muskelinnervation 4,6,7 identifiziert werden. Da nur die beiden BN2s zur bukkalen Masse gebunden sind, durch Überwachen der Aktivität auf den BN2s kann man sicherstellen, dass die Muskelkontraktion Kraft nur durch die Neurons durch die extrazelluläre Stimulation aktiviert verursacht.
- Beispielsweise ist eine große B3 Motoneuronen zur I1/I3 Muskel (300-400 um in Soma Durchmesser bei Tieren Gewicht von 200 bis 350 Gramm), auf der Seite des rostralen bukkalen Ganglion befindet (Abbildung 3 ). Es ist nur Projekte durch den ipsilateralen BN2, und innerviert sowohl die vorderen und hinteren Teile des I1/I3 Muskel. Die meisten der Zeit, es zu aktivieren erzeugt einen größeren vorderen als hinteren Kraft (8 von 9 Versuchen).
- Nachdem ein Neuron identifiziert ist, kann seine Aktivität in verschiedenen Zuführungsports wie Verhalten über den extrazellulären Glaselektrode (4 und 5), die ausgelöst werden kann, wie nachfolgend beschrieben aufgezeichnet. Die extrazelluläre Aufzeichnung auf dem Soma wird viel präziser als die Nerven-Aufnahmen, die die Aktivität von vielen verschiedenen Neuronen enthalten.
- Um egestive-artigen motorischen Programmen induzieren, stimulieren BN2-a mit 1-2 min der Impulse 19 (2Hz, ist jeder Impuls 1 ms). Diese Stimulation zuverlässig generiert egestive Muster in dieser Einstellung. Mit ausreichend Strom (zB 300 uA) können Muster für die Dauer der Stimulationsphase persistieren. Manchmal gibt es eine weitere Muster, das kurz nach vorkommtdie Stimulation endet.
- Um ingestive-like motorischen Programmen zu induzieren, platzieren ein paar Kristalle von festen Carbachol direkt auf der Hülle des Cerebralganglion 15. Wenn man das Niveau der Carbachol Exposition kontrollieren will, verwenden Sie eine Lösung von 1 bis 10 mM Carbachol in Aplysia Kochsalzlösung. Höhere Konzentrationen sind eher zu induzieren. Sich wiederholende Muster in der Regel beginnt innerhalb von fünf Minuten und kann für etwa 10 bis 15 Minuten vor Beginn zu heruntergekommen dauern.
- Nach Auswaschen Carbachol mehrmals und wartet für mindestens 30 min, kann eine nachfolgende Anwendung von Carbachol an den Cerebralganglion mehr Ingestiv-ähnliche Bewegungsmuster induzieren zugesetzt werden.
- Nach mehreren motorischen Neuronen für den jeweiligen Fuhrpark identifiziert und charakterisiert wurden während der motorischen Programmen, kann man entwickeln, eine stark vereinfachte diagnostische Methode, die ein Mindestmaß an Informationen für die schnelle Identifizierung dieser Neuronen in der künftigen Arbeit (Abbildung 6 benötigt </ Strong>), z. B. in den suspendierten bukkalen Masse Zubereitungen oder in vivo. Die Kriterien können soma Größe und Lage, Nerven Projektion, Baugröße auf die Nerven, und der Zeitpunkt der Aktivität während der motorischen Mustern.
Ergebnisse
Abbildungen 4 und 5 zeigen typische Ergebnisse verwendet, um zwei I1/I3 Motoneuronen zu identifizieren. Abbildung 4 zeigt die soma-Aufnahmen eines großen Motoneuronen, B3, während egestive-like und ingestive-ähnliche Muster (4C, 4D). Die Eins-zu-eins entsprechende Spikes auf der soma-Kanal und der ipsilateralen BN2 Kanal (4E) zeigen, dass die Spezifität der B3 soma Aufnahme während Mustern wurde beibehalten. B3 feuert während der Mitte bis Ende der Rückzugsphase der Muster. Aus der Abbildung 4 und andere Ergebnisse (nicht gezeigt), fanden wir, dass die Einheit von BN2 B3 immer der größte BN2 Einheit. Somit kann es auch direkt aus BN2 Aufnahmen nachweisen.
Abbildung 5 zeigt die soma-Aufnahmen von einem kleinen Neuron, B43, während egestive-like und ingestive-ähnliche Muster (Abb. 5C, 5D). Die Eins-zu-eins entsprechende Spikes auf der soma-Kanalund der ipsilateralen BN2 Kanal (Abbildung 5E) zeigen auch, dass die Spezifität der B43 soma Aufnahme während Mustern wurde beibehalten. Neuron B43 Bursts am Ende des Rückzugskörpers Phase während Mustern. Da die BN2 Einheit B43 klein ist, wäre es schwierig, sie von den BN2 Aufnahmen ohne Soma Aufzeichnung identifizieren, doch, weil es am intensivsten feuert am Ende des BN2 Motors Muster, das Ende B43 der Burst noch identifiziert werden von BN2 Aufnahmen allein.
Abbildung 6 zeigt einen optimierten diagnostischen Baum, der nicht erfordert Muskelinnervation als Kriterium, das es viel einfacher zu identifizieren extrazellulär I1/I3 Motoneuronen im suspendiert bukkalen Masse Zubereitung oder in vivo ermöglicht. Die diagnostische Baum wurde entwickelt, jedoch durch die Verwendung von Kraft und Maßnahmen EMG, und somit zeigt, wie die Techniken in diesem Protokoll kann von stromlinienförmigen Motoneuronen Identifizierung führen.

Abbildung 1. Schematische Darstellung des gesamten Aufbaus und der Schüssel für die Kraft Studien. Das obere Bild zeigt eine Draufsicht. Das untere Bild zeigt eine Seitenansicht (entsprechend der gestrichelten Linie in der Mitte der Draufsicht). Die Cerebralganglion wird Sylgard in der hinteren Kammer merken (Bereich A). Die bukkale Ganglien sind Sylgard auf der mittleren Plattform (Bereich C) verstiftet. Der hintere Kammer und mittlere Plattform werden durch einen erhöhten Sylgard Wand (Bereich B) getrennt. Die zerebralen-bukkalen Junktoren (CBCs) durchlaufen eine Kerbe in der Sylgard Wand, versiegelt mit Vakuumfett. Die bukkale Masse wird auf den Glasboden der vorderen Kammer (Bereich D) verklebt ist. Die bukkalen Nerven 2 (BN2s) an dem bukkalen Masse befestigt. Zwei Haken befestigt Seidensuturen in die vorderen und hinteren Bereiche des Muskels I1/I3 eingefügt. Ter Seidensuturen werden dann an dem Kraftaufnehmer verbunden. Die Abbildung verwendet dunkelgrau, hellgrau und weiß um die Oberflächen der Bereiche A, B, C und D. Je dunkler die Farbe, desto höher ist die entsprechende Oberfläche anzuzeigen. Die Abbildung nutzt a, b, c und d zu wichtigen Abmessungen des Tellers geben. Länge a beträgt 3-4 mm, die Breite der Kerbe, die den hinteren Kammer und mittlere Plattform verbindet. Länge b ist etwa 3-5 mm, die Höhendifferenz zwischen den Oberflächen der mittleren Plattform (Bereich C) und der Sylgard Wand (Bereich B). Länge c bezeichnet die Länge der Kerbe, die ungefähr 5 mm beträgt. Länge d zeigt die Breite des mittleren Plattform (Bereich C), die etwa 5 mm beträgt.

Abbildung 2. Schematische Darstellung des bukkalen Ganglienund Elektroden-Setup. Die Abbildung zeigt die Lage der wichtigsten Nerven, einschließlich bukkalen Nerven 1, 2, und 3 (BN1, BN2 und BN3), der Speiseröhre Nerv (EN), die radular Nerven (RN), der I2 Nerven und Muskeln und der zerebralen bukkalen Bindegewebe (CBC). Beachten Sie, dass die BN2s zur bukkalen Masse befestigt sind (siehe Abbildung 1). Die CBCs an den Cerebralganglion angebracht, durch die Kerbe des Sylgard Wand und sind mit Vakuumfett abgedichtet (siehe Abbildung 1). Die RN und I2 Nerven und Muskeln sind über den Ganglien gezogen und merken sich proximal zur bukkalen Masse (vorne Richtung). Blaue Linien zeigen die Position der Pins. Zwei verbogene Pins (rote Linien markiert 1) werden verwendet, um die CBCs verankern. Beachten Sie, daß eine Klappe der Hülle des CBC auf der linken Seite gefaltet und nach unten zwischen BN2 BN3 verstiftet und die linke bukkalen Ganglion (rote Linie markiert 2) zu drehen. In einigen Ganglien, kann es günstiger sein, die Hülle festzunageln zwischen CBC und BN3. Ein zusätzlicher Stift t hinzugefügto die Seite des Ganglion, die proximal zu der EN (rote Linie markiert 3) für eine weitere Drehung und Stabilisierung ist. Die extrazelluläre Glaselektrode wird auf der Oberseite der Hülle oberhalb der Soma für extrazelluläre Stimulation und Ableitung angeordnet. Die Haken sind mit den Elektroden BN3s angebracht, und die Stifte, welche diese Nerven an Stelle sollte weiter distal als die Befestigungspunkte dieser Haken Elektroden platziert werden. Zwei Saugelektroden der RN und I2 Nerv und Muskel (siehe Kasten für eine bessere Sicht auf den I2 Nerv und Muskel) befestigt. Klicken Sie hier für eine größere Abbildung zu sehen .

Abbildung 3. Ein Bild und schematische des Neurons Karte für extrazelluläre Identifizierung des I1/I3 MotorsNeuronen in der Aplysia bukkalen Ganglion. Das obere Bild zeigt eine rechte Seite bukkalen Ganglion merken kaudalen Seite nach oben. Um die bukkalen Ganglien, die RN und I2 Nerv / Muskel rotieren über dem bukkalen Ganglien gezogen und merken sich proximal an der Seite der EN. Eine Klappe des CBC Mantel auch gefaltet und merken sich für die Rotation (siehe Abbildung 2), so dass die Neuronen in der rostralen Seite oder am kaudalen / rostral border gesehen werden kann. Die untere schematische wird basierend auf dem Bild oben gezogen. Das Bild und schematische zusammen zeigen die Standorte der I1/I3 Motoneuronen B3, B6, B9, B10, B38, B39, B43 6,7 und B82 22,23, sowie einigen anderen Neuronen. Neuronen B8A und B8b sind verantwortlich für die größte Einheit auf der RN, und innervieren die Muskeln I4 Steuerung des Greifers 6,17. Neuronen B4 und B5 sind verantwortlich für die größte Einheit auf der BN3 18. Obwohl die Größe und Lage der I1/I3 Motoneuronen aus tierischen t variableo Tier, sind die relativen Größen und Positionen recht zuverlässig für die meisten Neuronen: B3, B6, B9, B38, B43 und B82. Siehe Diskussion für mehr Details über den I1/I3 Motoneuronen, vor allem einige der Schwierigkeiten bei der eindeutigen Identifizierung B10 und B39.
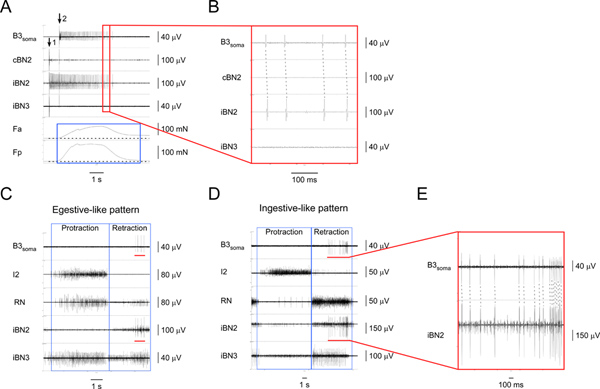
Abbildung 4. Identifizieren und Charakterisieren des I1/I3 Motoneuronen B3. A) Extrazelluläre Stimulation B3 (bei Pfeil 1) und der Aufnahme aus der B3 Soma (ab Pfeil 2) sowie aus den entsprechenden Nerven und Muskel-Regionen. Von oben nach unten sind die Kanäle Aufnahmen aus dem B3 soma, die kontralaterale BN2, die ipsilaterale BN2, die ipsilaterale BN3, die Kontraktionskraft des vorderen Bereich des I1/I3 Muskel, und der Kontraktionskraft des posterioren Bereich der I1/I3 Muskel. Dieblaue Kasten werden die Dauer der Kräfte in den vorderen und hinteren Bereichen des I1/I3 Muskel. In diesem speziellen Fall ist der hintere Kraft größer als die vordere Kraft. B) Expanded Ansicht des Bereichs durch die rote Box in A1 beschrieben. Die Eins-zu-eins entsprechende Aktion Potentiale im B3 Soma und den iBN2 Kanälen zeigen, dass B3 nur Projekte auf der ipsilateralen BN2. C) Extrazelluläre Aufnahme aus dem B3 soma und Nerven in einer egestive-wie Motor-Muster. D) Extrazelluläre Aufnahme von Die B3 soma und Nerven in einer ingestive-wie Motor-Muster. In C und D, von oben nach unten, sind die Kanäle Aufnahmen aus dem B3 soma, die I2 Nerv, der RN, die ipsilaterale BN2 und der ipsilateralen BN3. Die blauen Felder zeigen die protraction und Ausfahren Phasen der Muster. Die roten Balken in der B3 soma-Kanal in C und D markieren die Aktion potentials aufgezeichnet von der B3 Soma. Die roten Balken im iBN2 Kanal in C und D zeigen den entsprechenden Zeitpunkt, B3 im ipsilateralen BN2 Brennen während der Zufuhrmotor Mustern. E) vergrößerte Ansicht des B3 Soma und die iBN2 Kanäle durch die roten Balken gekennzeichnet. Die gestrichelten Linien zeigen die Eins-zu-eins-Beziehung zwischen der Aktionspotentiale in der B3 Soma und den iBN2 Kanäle. Beachten Sie, dass die Einheit von BN2 B3 das größte aller Einheiten ist. So können wir auch erkennen, die BN2 Einheiten B3 direkt von den BN2 Aufnahmen ohne soma Aufnahmen. Klicken Sie hier für eine größere Abbildung zu sehen .

Abbildung 5. Identifizierung undCharakterisieren des I1/I3 Motoneuronen, B43. A) Extrazelluläre Stimulation B43 (bei Pfeil 1) und die Aufnahme von seiner soma (ab Pfeil 2) sowie aus den entsprechenden Nerven und Muskel-Regionen. Von oben nach unten sind die Kanäle Aufnahmen von der B43 soma, die kontralaterale BN2, die ipsilaterale BN2, die ipsilaterale BN3, die Kontraktionskraft des vorderen Bereich des I1/I3 Muskel, und der Kontraktionskraft des posterioren Bereich der I1/I3 Muskel. Die blaue Kiste hebt die Kraftmessungen der I1/I3 Muskel während B43 Aktivität. Aktivieren B43 erzeugt einen kleinen hinteren Kraft, aber keine vorderen Kraft. B) Expanded Ansicht des Bereichs durch die rote Box in A skizziert. Die gestrichelten Linien zeigen die Eins-zu-eins-Beziehung zwischen der Aktionspotentiale in der B43 Soma und den iBN2 Kanäle, was bedeutet, dass B43-Projekte auf der ipsilateralen BN2 nur. C) Extrazelluläre Aufnahme zeigtvon der B43 soma und Nerven in einer egestive-wie Motor-Muster. D) Extrazelluläre Aufnahme von der B43 soma und Nerven in einer ingestive-wie Motor-Muster. In C und D, von oben nach unten, sind die Kanäle Aufnahmen von der B43 soma, die I2 Nerv, der RN, die ipsilaterale BN2 und der ipsilateralen BN3. Die blauen Felder zeigen die protraction und Ausfahren Phasen der Muster. Die roten Balken in der B43 soma-Kanal in C und D markieren die Aktionspotentiale von der B43 soma aufgezeichnet. Die roten Balken in der iBN2 Kanal sowohl in C und D zeigen das entsprechende Timing, wenn B43 in der ipsilateralen BN2 in diesen Mustern Brennen. E) Erweiterte Ansicht der B43 Soma und die iBN2 Kanälen durch den roten Balken in D markiert. Die gestrichelten Linien zeigen die Eins-zu-eins-Beziehung zwischen der Aktionspotentiale in der B43 soma und die iBN2 Kanäle. Beachte, dass die Einheiten von BN2 B43 klein und sehr schwierig, ohne Soma Aufnahmen erkennen sind, aber stets Feuer am Ende des Motors BN2 Programm, Bereitstellen eines weiteren Weg, um sie zu identifizieren. Beachten Sie auch, dass die größere Einheit in der Bodenplatte in E dargestellt eine Kollision eines B43 soma mit anderen extrazellulären Einheit ist. Klicken Sie hier für eine größere Abbildung zu sehen .

Abbildung 6. Die optimierte Diagnose-Baum für die Identifizierung einige der I1/I3 Motoneuronen mit extrazellulären Soma und Nerven Aufnahmen. Diese Diagnose-Methode erfordert die minimalen Information zur Identifizierung der I1/I3 Motoneuronen, so dass es viel einfacher identifiziertfy Motoneuronen im suspendiert bukkalen Masse Zubereitung oder in vivo. B3 hat die größte BN2 Einheit unter den identifizierten I1/I3 Motoneuronen. In den Rest der Motoneuronen, B6 und B9 sind die einzigen zwei Neuronen dieses Projekt sowohl BN2 und BN3. B9 ist lateral als B6. Der Rest der Neuronen vorspringenden nur auf BN2 kann auch in zwei Gruppen eingeteilt werden. Eine Gruppe von Neuronen Projekte bilateral durch die BN2s, die B10 und B39 und einige unbekannte Neuronen enthält. Die andere Gruppe von Neuronen projiziert ipsilateral auf BN2 nur, was beinhaltet B38, B43 und B82. B38 nahe B3 und B9. B82 ist in der Nähe B8 (siehe Abbildung 3). B43 ist in der Nähe B6. BN2 seine Einheit ist klein und Bursts am Ende der Fütterung Mustern.

Abbildung 7. Vergleich von Erfolgsraten von Neuron iRMITTLUNG während Kraft Experimenten entweder mit dem extrazellulären Technik oder die intrazelluläre Technik. Selbes Kraftwandler Setup, haben wir 35 Experimenten unter Verwendung der extrazellulären Technik (kleine blaue Punkte) und 27 Versuche unter Verwendung der herkömmlichen Technik intrazelluläre (große lila Punkte) auf die Identifizierung I1/I3 Motoneuronen. Die x-Achse gibt die geringste Anzahl von Motoneuronen zur I1/I3 Muskel, der in jeder Art von Experiment identifiziert wurden. Die y-Achse gibt die prozentualen Erfolgsquote von jeder Art von Experiment. Zum Beispiel wird in 19 von 35 (54%) der extrazellulären Experimenten konnten wir identifizieren mindestens fünf verschiedene I1/I3 Motoneuronen. In nur 1 von 27 (4%) der intrazellulären Experimenten konnten wir mindestens fünf I1/I3 Motoneuronen zu identifizieren. Es ist klar, dass die Erfolgsrate bei der Identifizierung Neuronen viel höher für jede gegebene Anzahl der Neuronen mit dem extrazellulären Technik ist.
Diskussion
Bei Tieren mit großen identifizierten Neuronen, wie Weichtiere (z. B. Lymnaea, Helix und Aplysia), Analyse von Fuhrparks erfolgt typischerweise mittels intrazellulärer Aufnahme 1,2,3,4. In diesem Protokoll beschreiben wir ein Verfahren zum eindeutigen Identifizieren der Motoneuronen für einen Fuhrpark mit einer extrazellulären Technik. Wir verwendeten die Kraftmessungen als Illustration dieses Prozesses. Man könnte auch EMG, um Muskeln Innervationen messen. Kurz gesagt, dies zu tun, muss das Protokoll geändert werden, um Haken Elektroden an verschiedene Regionen des I1/I3 Muskel für EMG zu befestigen.
Die extrazelluläre Technik hat gewisse Vorteile gegenüber intrazellulären Techniken, von denen einige bereits oben beschrieben. Erstens erfordert die extrazelluläre Technik weniger Zeit und Mühe zu Ganglien für Experimente vorbereiten und weniger Schäden an Nervenzellen verursachen. Normalerweise dauert es 20-30 min die buc vorzubereitencal Ganglien für extrazelluläre Experimente und ca. 1,5 Stunden, um die bukkalen Ganglien, die zur bukkalen Masse für intrazellulären Experimenten verbunden sind vorzubereiten. Da Muskeln werden weniger aktiv als die Zeit vergeht, kann die Zeitdifferenz zwischen den Ganglien Vorbereitungen für extrazelluläre Experimente und intrazelluläre diejenigen entscheidend sein für den Erfolg der Experimente. Abbildung 7 zeigt den Vergleich der Erfolgsquoten für die Ermittlung der motorischen Neuronen für die I1 / I3 Muskeln mit extrazelluläre oder intrazelluläre Technik in Kraft Studien. In allen Experimenten 35 extrazelluläre Kraft (100%), waren wir in der Lage, zumindest einen Motor Neuron für den Muskel I1/I3 identifizieren. In 31 von 35 (89%) extrazellulären Experimenten konnten wir mindestens drei I1/I3 Motoneuronen zu identifizieren. In 19 von 35 (54%) der extrazellulären Experimenten konnten wir identifizieren mindestens fünf verschiedene I1/I3 Motoneuronen. Im Gegensatz dazu die Erfolgsquoten der intrazellulären Experimenten mit dem same Kraftaufnehmer Setup niedriger waren. In 23 von 27 (85%) intrazelluläre Experimenten konnten wir wenigstens einem I1/I3 Motoneuronen zu identifizieren. In 8 von 27 (30%) intrazelluläre Experimenten konnten wir mindestens drei I1/I3 Motoneuronen zu identifizieren. In nur 1 von 27 (4%) intrazellulären Experimenten konnten wir fünf I1/I3 Motoneuronen zu identifizieren. Somit wird die Wahrscheinlichkeit der Identifizierung mehrerer Neuronen in der gleichen Ganglion höher unter Verwendung extrazellulärer Techniken im Gegensatz zur intrazellulären Techniken.
Darüber hinaus können die extrazelluläre Technik viele Neuronen beidseits Ganglien während desselben Experiments übersetzen. Üblicherweise nach desheathing können intrazelluläre Elektroden nur auf Neuronen auf der Seite des Ganglion, die desheathed hat. Wenn beispielsweise einer der beiden bukkalen Ganglien (zB die hemiganglion auf der linken Seite) caudalen Seite hochgesteckt wird, wird es leicht für intrazelluläre Elektroden die Neuronen auf, dass der Zugang zuSeite des Ganglion, zB B6, B9, B10, B39 und B43, aber schwierig, die Neuronen auf der rostralen Seite des Ganglion, wie B4, B5, B8A, B8b, B38 und B82 zugreifen. Im Gegensatz dazu kann extrazellulären Elektroden auf viele Neuronen auf beiden Seiten der gleichen bukkalen Ganglion mit entsprechender Drehung des Ganglion. Der Grad der Drehung einstellbar ist und reversibel. Dies erhöht auch die Wahrscheinlichkeit der Identifizierung mehrerer Neuronen in der gleichen Ganglion.
Da extrazelluläre Elektroden sanft auf den Mantel Abdecken der Neuronen gedrückt werden, diese Elektroden nicht von Neuronen gezogen werden, was u. U. große Löcher in der Membran zu schaffen und zu Beschädigungen, wie sie bei intrazellulären Elektroden während Muskelbewegungen. Das Signal Größe wird den Ganglien Bewegung während der Muskelbewegungen variieren. Beachten Sie, dass manchmal bei großen Muskelbewegungen, die extrazellulären soma Aufzeichnung von Signalen verringert werden oder sogar verloren gehen. Allerdings können wir leicht move die extrazelluläre Elektrode wieder auf dem Neuron und Wiederherstellung der ursprünglichen Signale. Dies macht es möglich, die extrazelluläre Technik auf die suspendierten bukkalen Masseaufbereitung 8 gelten für Verhaltensstudien, während welcher Muskeln erzeugen große Kontraktionen als die Zubereitung generiert unterschiedliche Verhaltensreaktionen. Zum Beispiel wird in 47 von 48 suspendiert bukkalen Massenexperimente (98%), waren wir in der Lage, zumindest einen Motor Neuron für den Muskel I1/I3 identifizieren. In 23 von 48 (48%) suspendiert bukkalen Masse Experimenten konnten wir mindestens drei I1/I3 Motoneuronen zu identifizieren. In 11 von 48 (23%) suspendiert bukkalen Masse Experimenten konnten wir mindestens fünf motorischen Neuronen für die I1/I3 Muskel-und Datensatz aus ihnen zu identifizieren während Bewegungsmuster wie die bukkalen Masse wurde die Durchführung Fütterung-like Verhalten. Die extrazelluläre Technik ist auch anwendbar auf andere, kompliziertere semi-intakten Zubereitungen, wie die isolierten Leiter Fütterung Zubereitungen, t einschließener Tentakeln, Lippen, Kiefer, buccal Masse, buccal Ganglien und Cerebralganglion 12,24,25,26. Da die sensorischen Input ist sehr wichtig zur Auslösung Zuführen Verhalten in solchen Zubereitungen wird der extrazellulären Technik als besonders nützlich wegen ihrer Einfachheit und weniger schädlich Funktionen. Frühere Studien zeigen auch, dass es möglich ist, zu identifizieren und chronisch aufzeichnen B4/B5 in vivo 18. In diesen früheren Versuchen, die Ermittler niedrigen Strom (10-20 uA)-BN2 eine Stimulation verwendet, um selektiv aktiviert und verklebt B4/B5 eine kurze Polyethylen-Rohr an der Hülle oberhalb B4/B5 zur Aufzeichnung, wurden in dem ein Paar von verdrillten eingeschoben Draht aus nichtrostendem Stahl. Somit ist es auch möglich, zu identifizieren und aufzuzeichnen von Motoneuronen in vivo unter Verwendung des Polyethylen-Rohr-Elektrode, die auf dem Mantel Abdecken der Ganglien (Chestek und Chiel, unveröffentlichte Ergebnisse) geklebt ist.
Die extrazelluläre Technik hat auch einige limitatIonen. Zunächst wird es schwierig sein, für die extrazelluläre Elektroden zu stimulieren oder aufzeichnen Neuronen, die zu klein oder zu tief in das Ganglion sind. Beachte, dass es noch möglich ist, Neuronen, die nicht an der Oberfläche über extrazelluläre Stimulation zu aktivieren. Allerdings hat unser Modell 5 zeigten, daß die Stimulation kann Spezifität zu verlieren, wenn die Ziel-Nervenzelle ist tiefer als die benachbarten Neuronen. Wenn das Neuron tiefer ist, wird die Elektrode-zu-Soma Abstand größer und höheren Strom, der benötigt wird, um dieses Neurons, die hoch genug sein, um andere Oberfläche Neuronen Nähe aktivieren kann aktiviert werden. Zweitens, wenn ein Neuron extrazellulär mit zu viel Strom stimuliert, kann es beschädigt werden und nicht mehr reagieren, viel kleinere Ströme sind in intrazellulären Stimulation verwendet, obwohl zu viel Strom intrazellulär können auch Schäden an Nervenzellen. Manchmal ist die soma Aufnahme mehrerer Einheiten sowohl aus dem Ziel-Neuron und benachbarten Neuronen, die weniger spezifisch als intrazelluläre ist enthaltenzelluläre Aufnahme. Darüber hinaus kann es schwieriger sein, eine präzise Steuerung und Überwachung der Abfeuerungsfrequenz eines einzelnen Neurons mit der extrazellulären anstatt der intrazellulären Technik, weil die extrazellulären Elektrode nicht stimulieren können und erfassen den gleichen Neuron gleichzeitig. Darüber hinaus wird die extrazelluläre Technik nicht in der Lage sein, um den Eingang von synaptischen prämotorischen Neuronen aufzuzeichnen. Darüber hinaus kann es schwierig sein, Neurotransmittern iontophoretisch Anwendung auf einen bestimmten Neurons, wenn die Ganglion wird desheathed, obwohl wir gezeigt, dass es möglich ist, ein Ganglion mit Carbachol ohne Entfernen der Hülle 27 zu stimulieren können.
Die Grenzen der extrazellulären Identifikationstechniken machte einige Neuronen im Fuhrpark schwer zu identifizieren. B3, B6, B9, B38, B43, B82 und, bezogen o: In diesem speziellen Beispiel die extrazelluläre Technik zuverlässig meisten der Motoneuronen für den Muskel in I1/I3 Aplysia identifiziertenn soma Größe und Lage, Nerven Projektion und Muskelinnervation. Allerdings waren wir nicht in der Lage, zuverlässig zu identifizieren B10 und B39. Vorherige intrazellulären Arbeit 6,7 zeigte, dass B10 und B39 zwei benachbarte Neuronen auf der kaudalen Seite des bukkalen Ganglien, zwischen der B4/B5 Region und der B6 Region. Beide Neuronen projizieren bilateral auf die BN2s. B10 innerviert den mittleren und hinteren Bereich des I1/I3 Muskeln, während B39 innerviert den vorderen Bereich des I1/I3 Muskel. Basierend auf der soma Lage und Nerven Projektion Kriterien, fanden wir mehr als zwei Motoneuronen dieses Projekt bilateral auf die BN2s in vier verschiedenen Experimenten. Seit ihrer soma Standorten, Muskel Innervationen und Timing der Tätigkeit während Bewegungsmuster waren variabel von Tier zu Tier, waren wir nicht sicher, ob sie die gleichen Neuronen waren. So waren wir nicht in der Lage, zuverlässig zu identifizieren B10 und B39 mit der extrazellulären Technik, weil der Mangel an Konsistenz. Zur eindeutigen Identifizierung ihnen,wir brauchen, um eine gründliche Untersuchung der Neuronen in der bukkalen Ganglien zu tun, und können zusätzliche Kriterien, wie dem synaptischen Input von prämotorischen Neuronen B4/B5, und die Antworten auf Sender, die die intrazelluläre Techniken erfordern müssen.
Mit entsprechenden Modifikationen, diese Technik auch auf andere Fuhrparks, zB die I5 Muskel-10, die I2 Muskel 11 und der I4 Muskel 12 in Aplysia oder in andere Systeme, zB Lymnaea stagnalis 2, Helix pomatia 3, Schabe 13 und Zebrafisch 14. Wenn beispielsweise ein um diese Technik auf die motorischen Neuronen für die I5 Muskel (auch als Zubehörteil radular näher Muskel oder ARC 10,28 bekannt) in Aplysia anwenden will, sollte man halten die BN3s an dem bukkalen Masse anstelle der BN2s , weil die I5 Motoneuronen B15 und B16-Projekt auf der ipsilateralen BN3 6,7. Dann ter bukkalen Masse sollte bereit sein, die I5 Muskel für EMG oder Kraft Studien freizulegen. Nachdem die Neuronen wurden zuverlässig im reduzierten Herstellung identifiziert, konnte eine optimierte Diagnoseverfahrens auch für zukünftige Verhaltensstudien erstellt werden.
Die Technik, die wir beschrieben haben, im Vergleich mit anderen extrazellulären Techniken wie Multi-Elektroden-Arrays und spannungsabhängigen Farbstoffen. Die Spannung Farbstoff 29 Technik wird nur für die Aufzeichnung verwendet, während unsere extrazellulären Elektroden und Multielektrodenarrays 30 sowohl für die Stimulation und Erfassung verwendet werden kann. Sowohl der Multi-Elektroden-Array 29 und spannungsabhängigen Farbstoffen 30 kann Signale von vielen Neuronen gleichzeitig aufzunehmen. Obwohl ein einzelnes extrazellulären Elektrode kann nur von einer oder zwei Neuronen je nach Größe der Spitze und der Elektrode Ort zu speichern, ist es sicherlich möglich, mehrere auf einem Ganglion gleichzeitig zu positionieren, und wir haben getandies erfolgreich. Der Standard in vitro Multi-Elektroden-Array 8 x 8 oder 6 x 10 Elektroden 29. Da die Elektroden in der Anordnung gleichmässig verteilt sind, ist es oft schwierig, die Identität des zugrundeliegenden Neuronen, deren Aufnahmen erhalten wird, werden, da die Neuronen nicht gleichmäßig verteilt sind, und signifikante Nachbearbeitung der Signale, von denen einige noch bestimmen Handbuch, muss getan werden, um diese Mehrdeutigkeit aufzulösen. Im Gegensatz dazu, weil die extrazelluläre Elektroden über einzelne Somata positioniert sind, ist die Identität des zugrunde liegenden Neuronen klar. Somit scheint es, dass Multi-Elektroden-Arrays und spannungsabhängigen Farbstoffen kann effizienter für mehrere gleichzeitige Aufnahmen. Allerdings können unsere extrazellulären Elektroden-Technik eine bessere Selektivität für sowohl die Stimulation und Aufnahme.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von NIH NS047073 und NSF DMS1010434 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name | Firma | Catalog Number | Kommentare |
| Kochsalz | Fisher Scientific | S671 | Biologische, Certified |
| Kaliumchlorid | Fisher Scientific | P217 | Certified ACS |
| Magnesiumchloridhexahydrat | Acros Organics | 19753 | 99% |
| Magnesiumsulfatheptahydrat | Fisher Scientific | M63 | Certified ACS |
| Calciumchloriddihydrat | Fisher Scientifc | C79 | Certified ACS |
| Glucose (Traubenzucker) | Sigma-Aldrich | G7528 | BioXtra |
| MOPS Buffer | Acros Organics | 17263 | 99% |
| Carbachol | Acros Organics | 10824 | 99% |
| Natriumhydroxid | Fisher Scientific | SS255 | Bescheinigt |
| Salzsäure | Fisher Scientific | SA49 | Bescheinigt |
| Mit einem Lauf Kapillargläser | AM-Systems | 6150 | |
| Flaming-Brown Feinpipettenziehvorrichtung Modell P-80/PC | Sutter Instruments | Filament verwendet: FT345B | |
| Enamel Edelstahlseil | California Fine Wire | 0.001D, Beschichtung h | |
| Haushalt Silikon II Kleber | GE | ||
| Duro Quick-Gel Superkleber | Henkel Corp. | ||
| AM Systems Modell 1700 Verstärker | AM-Systems | Filtereinstellungen: 10-500 Hz für die I2 Nerv / Muskel; 300-500 Hz für alle anderen Nerven | |
| PulseMaster Multi-Channel Stimulator | World Precision Instruments | A300 | |
| Stimulus Isolator | World Precision Instruments | A360 | |
| AxoGraph X | AxoGraph Scientific | Software für Aufnahmen | |
| Gold Connector Pins | Bulgin | SA3148 / 1 | |
| Gold Connector Sockets | Bulgin | SA3149 / 1 | |
| Sylgard 184 Siliconelastomer | Dow Corning | ||
| 100 x 15 mm Kristallisieren Dish | Pyrex | ||
| Hochvakuumfett | Dow Corning | ||
| Pipettenspitzen | Fisher Scientific | 21-375D | |
| Minutien Pins | Fine Science Tools | 26002-10 | |
| Modelliermassen | Sargent Art | 22-4400 | |
| Whisper Air Pump | Tetra | 77849 | |
| Aquarium Tubing | Eheim | 7783 | 12/16 mm |
| Elite Ausströmer | Hagen | A962 | |
| Vannas Federschere | Fine Science Tools | 15000-08 | |
| Dumont Nr. 5 feinen Pinzette | Feine Science-Tools | 11254-20 | |
| Kimwipes | Kimberly-Clark | 34155 |
Referenzen
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten