Method Article
Extracellulare Identificazione neuroni motori per un pool di motore muscolare in
In questo articolo
Riepilogo
Negli animali con grandi neuroni identificati ( Ad esempio, Molluschi), l'analisi delle piscine motore viene fatto utilizzando tecniche intracellulari 1,2,3,4. Recentemente, abbiamo sviluppato una tecnica per stimolare extracellulare e registrare i singoli neuroni in Aplysia californica 5. Descriviamo ora un protocollo per utilizzare questa tecnica per identificare e caratterizzare motoneuroni all'interno di un pool motore.
Abstract
Negli animali con grandi neuroni identificati (ad esempio molluschi), analisi di piscine motore viene fatto utilizzando tecniche intracellulari 1,2,3,4. Recentemente, abbiamo sviluppato una tecnica per stimolare extracellulare e registrare i singoli neuroni in Aplysia californica 5. Descriviamo ora un protocollo per utilizzare questa tecnica per identificare e caratterizzare motoneuroni all'interno di un pool motore.
Questa tecnica ha vantaggi extracellulare. Primi elettrodi extracellulari, può stimolare e registrare i neuroni attraverso la guaina 5, quindi non ha bisogno di essere rimosso. Così, i neuroni saranno più sani in esperimenti extracellulari che in quelli intracellulari. Secondo, se gangli sono ruotate di appropriate pinning della guaina, elettrodi extracellulari possono accedere neuroni su entrambi i lati del ganglio, che rende più facile e più efficace per identificare neuroni multipli nella stessa preparazione. In terzo luogo, extracellulareLAR elettrodi non devono penetrare nelle cellule, e quindi può essere facilmente spostato avanti e indietro tra neuroni, causando meno danni. Ciò è particolarmente utile quando si cerca di registrare i neuroni multipli durante ripetere schemi motori che possono persistere per qualche minuto. In quarto luogo, gli elettrodi extracellulari sono più flessibili di quelli intracellulari durante i movimenti muscolari. Elettrodi intracellulari può tirare fuori e danneggiare i neuroni durante le contrazioni muscolari. Al contrario, poiché elettrodi extracellulari pigiate delicatamente sulla guaina sopra neuroni, di solito soggiornare sopra il neurone stesso durante le contrazioni muscolari, e quindi può essere utilizzato in più preparazioni intatti.
Per identificare in modo univoco i neuroni motori per un parco macchine (in particolare, la I1/I3 muscolo in Aplysia) con elettrodi extracellulari, si possono usare le funzioni che non richiedono misure intracellulari come criteri: dimensione del soma e la posizione, la proiezione assonale, e innervazione muscolare 4, 6,7. Per la piscina particolare motore utilizzato per illustrare la tecnica, abbiamo registrato da nervi vestibolari 2 e 3 per misurare proiezioni assonali, e misurato le forze di contrazione del muscolo I1/I3 per determinare il modello di innervazione muscolare per i motoneuroni singoli.
Dimostriamo il processo completo della prima motoneuroni identificano con innervazione del muscolo, quindi caratterizzare la loro tempistica durante schemi motori, la creazione di un metodo semplificato diagnostico per l'identificazione rapida. Il metodo più semplice e rapida diagnosi è superiore per preparazioni più intatte, ad esempio nella preparazione massa sospesa buccale 8 o 9 in vivo. Questo processo può essere applicato anche in altri autoveicoli piscine 10,11,12 in Aplysia o in altri sistemi animali 2,3,13,14.
Protocollo
1. Preparazione del piatto di registrazione
- Durante gli esperimenti dei trasduttori di forza, i gangli buccale, ganglio cerebrale, e la massa buccale sono posti in un piatto tondo Pyrex che è specializzata per gli studi di forza.
- Per indurre ingestive-come modelli negli esperimenti, abbiamo bisogno di applicare la non idrolizzabile carbacolo agonista colinergico al ganglio cerebrale 15. Per evitare il contatto diretto carbacolo sul gangli buccale e massa buccale, camere separati per isolare il ganglio cerebrale dai gangli buccale e la massa buccale (Figura 1).
- Poiché la massa buccale è molto più spesso i gangli buccale, non sarà posto sullo stesso piano. Pertanto, questo piatto dovrebbe avere una camera posteriore del ganglio cerebrale (area A in figura 1), una piattaforma centrale per i gangli buccale (zona C in Figura 1), ed una camera anteriore più profonda per la massa buccale (area D in Figura 1).
- Per creare questo piatto, iniziare con un giro 100x15 Pyrex piatto (15 mm di altezza, 100 mm di diametro). Costruzione del piatto richiede versa diversi Sylgard. Seguire le istruzioni fornite con il prodotto Sylgard. Sylgard deve essere permesso di impostare diversi tra versa.
- La colata prima è creare il massimo livello di Sylgard nel piatto (zona B in Figura 1), che è il muro tra la piattaforma centrale e posteriore della camera.
- Utilizzare due supporti plastilina per isolare la zona per Sylgard parete (zona B in Figura 1). Rivestire le argilla supporti di modellazione di involucro di plastica dove potranno contattare la Sylgard per una più facile rimozione. Garantire guarnizioni di tenuta ai bordi, dove la plastilina si metterà in contatto il piatto, per ridurre la dispersione.
- Versare Sylgard nella porzione tra i due supporti di modellazione argilla quasi fino alla parte superiore del piatto. Lasciate che la Sylgard completamente configurato durante la notte. Mantenere il piatto in un luogo caldo può indurredefinizione più rapida. Rimuovere i supporti di creta per modellare e ripulire eventuali residui di creta sul Sylgard.
- Successivamente, la camera posteriore (area A in figura 1) e la piattaforma centrale (area C in figura 1) deve essere versato.
- Posizionare un supporto plastilina circa 5 mm dalla superficie frontale del Sylgard per la sezione della piattaforma centrale (zona C).
- Versare Sylgard nelle sezioni per la camera posteriore (area A) e piattaforma centrale (zona C) fino ad un'altezza di circa 3-5 mm al di sotto del livello superiore del primo Sylgard parete (zona B). La superficie Sylgard della camera posteriore dovrebbe essere leggermente inferiore a quella della piattaforma centrale per evitare la fuoriuscita dalla camera posteriore contenente carbacolo alla piattaforma centrale. Anche in questo caso, lasciare che il Sylgard completamente configurato durante la notte e quindi rimuovere il supporto plastilina.
- Il passo finale è quello di tagliare una tacca al centro della parete Sylgard per fornire un canale per le cerebrale-buccali connettivi (CBC) per andaretramite tra la piattaforma centrale e camera posteriore. La larghezza di questa tacca deve essere di circa 3-4 millimetri, che è abbastanza ampia per le CBC. Il fondo della tacca non deve essere inferiore alla superficie Sylgard della piattaforma centrale per evitare perdite. Una lama di bisturi può essere usato per tagliare la tacca.
2. Elettrodo Preparazione
- Tirare elettrodi di vetro extracellulari da singolo a canna capillare di vetro con un Flaming-Brown micropipetta estrattore come descritto da McManus et al. 8 nella sezione 3.1. Con il filamento FT345B nella estrattore, le nostre impostazioni del programma sono tipiche di calore 480, Pull 50, velocità 13, e ora 20, ma si noti che le impostazioni sarà diverso per i diversi filamenti. Questo programma crea gli elettrodi in una singola estrazione senza fuoco lucidatura stadio. La dimensione della punta dell'elettrodo dovrebbe essere inferiore alla dimensione dei corpi cellulari. Per i neuroni motori che vanno da 50 micron a 400 micron di diametro soma, il diamete internars degli elettrodi di vetro extracellulari dovrebbe essere di circa 40 pm e le loro resistenze dovrebbe essere di circa 0,1 MW quando sono pieni di Aplysia salina.
- Tirare elettrodi di aspirazione dal tubo di polietilene con un becco Bunsen. Tagliare un pezzo di tubo in polietilene circa 10 cm di lunghezza. Tenere il tubo su entrambe le estremità e metterlo molto vicino alla fiamma generata dal bruciatore Bunsen mentre si ruota il tubo fino a quando diventa morbida dal calore. Allungare il tubo con attenzione lungo la sua lunghezza, mentre allontanandolo dalla fiamma. La parte centrale del tubo sarà allungata e stretta come il tubo viene tirato.
- Tagliare il tubo a metà per formare due elettrodi di aspirazione. Elettrodi di aspirazione sono generalmente applicati alle estremità tagliate di nervi o ai muscoli, anche se a volte può essere applicato en passant.
- Creare elettrodi gancio per registrazioni nervose secondo il protocollo descritto da McManus et al 8 in sezioni 3,2-3,13. Questi elettrodi sono especialleato utile quando un nervo o muscolo non viene tagliato.
3. Hook elettrodo Allegato
- Sezionare l'animale e rimuovere la massa buccale seguendo il protocollo descritto in McManus et al. 8 sezione 4.
- Per la registrazione e la stimolazione, elettrodi gancio può essere attribuita ad una serie di nervi differenti.
- Per caratterizzare schemi come è stato fatto in vivo da Cullins Chiel e 9, le registrazioni devono essere ottenuti dal nervo I2 e muscolare che indica la fase protrazione di alimentazione 16, il nervo radular (RN) che indica la chiusura del cibo grasper 17, buccale nervo 2 (BN2) e del nervo vestibolare 3 (BN3) che indicano la fase di retrazione 17,18. Fissaggio degli elettrodi gancio segue una procedura simile a quella descritta da McManus et al 8, sezione 5.
- Le posizioni di questi nervi riferiscono alla schematica dell'apparato di alimentazione Aplysia mostrato nellaFigura 2 di 8 McManus et al. Si noti che i BN2 trifurcates in rami a, b, e c prima di andare sotto il muscolo I1 a scanalatura laterale. Un ramo è il primo ramo di separare dal tronco principale, ed è adiacente alla BN3.
- La nomenclatura dei rami a, b, c ed è stato utilizzato da Warman e Chiel 18. Rami a, b, e c corrispondono a rami 3, 2 e 1, rispettivamente, la nomenclatura usata da Nargeot et al. 19. Inoltre, la RN, il BN1, il BN2, e la BN3 corrispondono a nervi 1, 6, 5, 4 e, rispettivamente, nella nomenclatura usata da Kandel 20 e Scott et al. 21
- Per studiare l'innervazione del muscolo del muscolo I1/I3, ad eccezione di tutti i nervi nervi vestibolari 2 sarà separata dalla massa buccale durante gli esperimenti. Così, abbiamo utilizzato un elettrodo gancio per registrare dal BN2.
- Poiché il nervo I2 e l'RN non sarà collegato alla massa buccale, e sono molto difficili da accedere usando elettrodi gancio, è preferibile applicare elettrodi di aspirazione per registrare da loro invece. Noi descrivere l'applicazione di elettrodi di aspirazione nella sezione 7.
- Utilizzare un elettrodo gancio o un elettrodo di aspirazione per registrare dal BN3, perché è facile accedere utilizzando tipo di elettrodo. Abbiamo scelto di utilizzare un elettrodo gancio per le registrazioni BN3 ridurre al minimo il numero di manipolatori per mantenere gli elettrodi di aspirazione, e di risparmiare spazio per altri manipolatori o attrezzature.
- Collegare un elettrodo gancio al ramo di un BN2 (BN2-a) di avviare rifiuto-come modelli durante gli esperimenti. È utile per collegare un elettrodo aggiuntivo gancio al BN2-una dall'altra, perché alcuni neuroni rispondono differentemente alla ipsilaterale vs controlaterale BN2-una stimolazione.
- Per distinguere i neuroni con proiezioni unilaterali vs bilaterale,è utile anche per collegare gli elettrodi al gancio BN2 BN3 e dall'altro lato dei gangli buccale.
4. Gangli e preparazione muscolare
- I gangli buccale, ganglio cerebrale e massa buccale sarà preparato per gli esperimenti di trasduttori di forza, in cui il ganglio cerebrale è attaccato al gangli buccale tramite le CBC e la massa buccale è collegata ai gangli buccale tramite i BN2s soli.
- Dopo aver collegato gli elettrodi gancio, taglio del nervo vestibolare 1 (BN1) e il nervo esofageo (EN) bilaterale, il taglio nel punto di attacco alla massa buccale.
- Tirare il ganglio cerebrale in avanti per spostarlo fuori del modo del muscolo I2. Fare un taglio nel muscolo I2 sul sacco radular, estendere il taglio lateralmente e anteriormente, in entrambe le direzioni, e tirare il lembo del muscolo I2 in avanti per esporre il nervo radular. Tagliare i due rami RN e fare in modo che i rami sono abbastanza a lungo per il fissaggio di aspirazione elettrodi.
- Continue il taglio I2 in un ampio cerchio attorno alla gangli vestibolare, facendo attenzione a non tagliare i BN2s o le BN3s, fino a quando i gangli vestibolare e la parte del muscolo allegato I2 può essere completamente separato dalla massa buccale. Tagliare i BN3s bilaterali nel punto di attacco alla massa buccale, oltre l'allegato elettrodo gancio.
- Applicare uno strato sottile di grasso per vuoto per la tacca nel piatto prima descritta che collega la camera posteriore e la piattaforma di mezzo, con una punta di pipetta per raccogliere un poco di grasso per vuoto e stenderlo sopra la tacca.
- Applicare uno strato sottile di Quick-Gel super colla al fondo di vetro della camera anteriore, dove la massa buccale sarà posizionato, proprio di fronte alla base Sylgard della piattaforma centrale.
- Cura trasferire il ganglio cerebrale, gangli buccale e di massa buccale al piatto di registrazione (Figura 1) descritto al punto 2, facendo in modo che nessuno degli elettrodi gancio sono tirata, che potrebbe danneggiare i nervi.
- Posizionare accuratamente la massa buccale sulla colla nella camera anteriore del piatto di registrazione, per garantire che la superficie ventrale è incollato al fondo del piatto. Essere sicuri di mantenere i gangli e gli elettrodi di toccare la colla. Aggiungere Aplysia salina 8 (460 mM NaCl, 10 mM KCl, 22 mM MgCl2, 33 mM MgSO 4, 10 mM CaCl 2, 10 mM di glucosio, 10 mM MOPS, pH 7,4-7,5) al piatto, che indurrà la colla per impostare.
- Se il piatto deve essere trasferito in un altro microscopio per la preparazione del gangli vestibolare per le registrazioni extracellulari soma, essere molto attenti con gli elettrodi gancio. Gruppo elettrodi su un lato della massa buccale insieme, e anche del gruppo di elettrodi sul lato della massa buccale insieme. Afferrare con attenzione gli elettrodi afferrando il nastro laboratorio che copre i pin del connettore, ancora una volta facendo in modo che nessuno degli elettrodi sono tirata.
- Quando il piatto è posizionato sotto il microscopio, l'elettrodos deve essere drappeggiato con delicatezza sopra i lati del piatto e di riposo sulla piattaforma accanto al piatto.
- Durante le pause e tra le fasi dell'esperimento, aerare la soluzione salina nella camera di massa buccale con una pietra porosa acquario.
- Usare pinze per afferrare la guaina del ganglio cerebrale e tirarlo nella camera posteriore, assicurandosi che i CBC attraversano la tacca. Pin il ganglio cerebrale con altri nervi che i CBC per evitare di danneggiare le CBC intatte.
- Applicare grasso per vuoto più nel corso degli CBC, e quindi aggiungere soluzione fisiologica Aplysia di più per entrambe le camere del piatto, in modo che i gangli sono completamente sommerse. Assicurare che la parte superiore del grasso per vuoto è leggermente superiore alla parete Sylgard modo che colature tra le camere.
- Per stabilizzare i gangli buccale, primo perno di estremità dei BN3s, poi le BN1s e l'ENS sulla base Sylgard della piattaforma centrale (Figura 2). Poiché le BN3s verrà registrato con elettrodi gancios, i perni devono essere posizionati più distalmente rispetto ai punti di fissaggio degli elettrodi gancio.
- Utilizzare due perni, piegato a 90 gradi, come ganci per allungare e ancorare le CBC, in modo che le CBC non sarà danneggiato (Figura 2).
- Pin i rami RN tra la camera posteriore e la gangli vestibolare. Poi il muscolo I2 sarà sopra gli RN. Per esporre il nervo I2, utilizzare pinze per afferrare il muscolo I2 e tirarlo sopra i gangli vestibolare. Pin due angoli del muscolo I2 per evitare danni al nervo I2.
- Recidere il nervo I2 distale al punto in cui i due rami fondono nel muscolo I2. Assicurarsi che il muscolo è ancora innervato da essere paragonabile al vivo nelle registrazioni. Tagliare via il resto del muscolo I2 e capovolgere il nervo I2 posteriore e pin verso il basso tra i due rami RN (vedi figura 2, nel riquadro).
- Regolare le posizioni dei perni per allungare e aumentare la tensione, se un nervo è troppo lenta, o per rilasciare la tensione se un nerve è troppo stretto. Per stabilizzare ulteriormente l'gangli buccale, aggiungere ulteriori perni sulla guaina tra i nervi.
- Poiché i gangli buccale sono collocati fianco caudale up, ruotare i gangli buccale se i neuroni di interesse sono sul lato rostrale. Per ruotare uno dei due gangli vestibolare, utilizzare una pinza sottile da acchiappare guaina superiore al CBC, dove è vicino ai gangli vestibolare e il pin giù tra il BN2 e BN3. In alcuni gangli, può essere più conveniente di fissare il presente tra CBC e BN3.
- Aggiungere un ulteriore perno sulla guaina del ganglio vestibolare sul lato vicino alla camera anteriore per ridurre al minimo il movimento del ganglio vestibolare.
- Per tagliare la guaina che copre i gangli vestibolare, utilizzare una pinza sottile per afferrare la guaina sul lato vicino alla camera posteriore, quindi tagliare la guaina in eccesso con le forbici sottili senza esporre i corpi cellulari. Al fine di minimizzare i danni, rimuovere solo la quantità minima di guaina necessario vedere i corpi cellulari.
- Dopo tegli guaina dei gangli buccale viene tagliato, estrarre il nervo I2 e gli RN sul gangli buccale e bloccarli tra i gangli buccale e camera anteriore a ruotare ulteriormente gangli buccale. (Vedi figura 2).
- Per lavare ogni residuo di cloruro di magnesio, 8 che è stato utilizzato per anestetizzare l'animale prima della dissezione, sostituire la soluzione salina Aplysia nel piatto fresco con soluzione salina Aplysia.
5. Elettrico di collegamento elettrodi Hook
- Dopo i gangli e muscoli sono preparati, trasferire accuratamente il piatto al tavolo isolamento dalle vibrazioni per gli esperimenti.
- Collegare tutti gli elettrodi ai loro zoccoli sui cavi BNC che collegano agli amplificatori (AM amplificatore modello Sistemi 1700). Anche in questo caso, assicurarsi che gli elettrodi non sono tirata mentre si fa questo. Assicurarsi che gli elettrodi siano correttamente attaccati ai loro cavi appropriati e che le polarità siano corrette.
6. Impostare gli elettrodi di vetro extracellulari per Soma Recordings
- Riempire l'elettrodo con Aplysia salina utilizzando una siringa collegata ad un pezzo di tubo di polietilene di circa 15-20 cm. Collegare l'estremità libera del tubo di polietilene all'estremità dell'elettrodo di vetro. Tirare indietro lo stantuffo della siringa per riempire l'elettrodo con Aplysia soluzione salina.
- Posizionare l'elettrodo di vetro riempita extracellulare nella tacca del titolare del manipolatore. Utilizzare il manipolatore per posizionare la punta dell'elettrodo nella soluzione salina Aplysia contenente i gangli vestibolare.
- Inserire un argento / cloruro di argento filo saldato ad un pin connettore maschio oro nella elettrodo per servire come il filo di registrazione. Posizionare un altro argento / cloruro di argento filo saldato ad un pin connettore maschio oro direttamente nella salina Aplysia all'interno della sezione del piatto registrazione contenente i gangli buccale di agire come il filo di riferimento. Collegare sia the registrazione e fili di riferimento al cavo BNC che collega all'amplificatore.
- Se vi è spazio sufficiente per più manipolatori, ulteriori elettrodi in vetro extracellulari può essere aggiunto a registrare neuroni contemporaneamente.
7. Configurazione degli elettrodi di aspirazione per le registrazioni Nerve
- Tagliare l'estremità più stretta della punta dell'elettrodo di aspirazione in base al diametro del nervo. Il diametro interno della punta dell'elettrodo dovrebbe essere simile o leggermente inferiore al diametro del nervo garantire aspirazione stretto.
- Poiché il nervo I2 e l'RN sono molto vicini l'uno all'altro, i loro elettrodi possono essere ritenute dal manipolatore stesso per risparmiare spazio. Mettere due elettrodi in due tacche dello stesso titolare. Ruotare i due elettrodi e di garantire che i loro suggerimenti sono vicini gli uni agli altri. Scegliere uno di loro per la registrazione I2 nervo, l'altra per la registrazione RN.
- Posizionare la punta dell'elettrodo nella soluzione salina Aplysia all'interno del Recording piatto contenente i gangli vestibolare. Collegare l'estremità libera del tubo di polietilene sulla siringa per l'elettrodo di aspirazione. Utilizzare la siringa per riempire l'elettrodo con Aplysia salina. Spostare la punta dell'elettrodo in prossimità dell'estremità del nervo target, ossia il nervo I2, e usare la siringa per aspirare il nervo nell'elettrodo. La lunghezza del nervo all'interno dell'elettrodo dovrebbe essere di circa 0,5-1,0 mm per garantire una tenuta ermetica.
- Ripetere l'aspirazione per l'elettrodo che verrà collegata alla RN.
- Collegare gli elettrodi ai cavi BNC corrispondenti come descritto nel paragrafo 6.3.
8. Impostazione del trasduttore di forza per misurare l'I1/I3 contrazione muscolare
- Per collegare i trasduttori di forza al muscolo, utilizzare suture di seta. Piegare l'ago curvo di ogni sutura, e legare la sutura al trasduttore di forza. Afferrare e sollevare delicatamente una piccola quantità di muscoli con una pinza e, tenendo l'ago in un altro set di pinze, inserirel'ago attraverso il muscolo fino al punto piegato in dell'ago (Figura 1).
- Trasduttori può essere attaccata dorsalmente o lateralmente sul muscolo I1/I3. Attacco dorsale permette di misurare contrazioni evocate dall'attivazione il lato sinistro o destro del muscolo. Attacco laterale mostrerà forti forze per la maggior parte dei neuroni, ma consente solo la misurazione della contrazione sul lato a cui è attaccato il trasduttore.
- Per identificare i neuroni che può attivare le regioni anteriore, posteriore o entrambi di I1/I3, collegare un trasduttore di forza per la parte posteriore del muscolo, appena anteriormente al tessuto faringea, e collegare un altro trasduttore di forza per la parte anteriore del muscolare, le ganasce (Figura 1; ganci nota).
- Sollevare i trasduttori di forza fino a quando i punti di sutura sono tesa, ma non sforzatevi. Per verificare questo, visualizzare la misura del trasduttore di forza quando la sutura ha un certo gioco in it, e quindi sollevare il trasduttore fino a quando la misura è leggermente al di sopra di questo livello di base.
9. Identificare i neuroni motori all'interno di un parco macchine
- Questo protocollo descrive un processo per l'identificazione extracellularmente motoneuroni all'interno di un pool motore. Abbiamo utilizzato il software AxoGraph per monitorare l'attività dei singoli neuroni, nervi multipli e il muscolo (segnale EMG o forze di contrazione). In questo protocollo, abbiamo utilizzato le forze di contrazione del muscolo come illustrazione per il processo di identificazione di neuroni motori, in altri esperimenti, abbiamo utilizzato EMG come bene, e la configurazione di tali esperimenti è molto simile (vedi Discussione).
- Per individuare un neurone candidato, utilizzare il manipolatore per premere delicatamente la punta dell'elettrodo di vetro extracellulare giù sulla guaina sopra il centro del soma neurone 5 (Figura 3), che è la posizione migliore per la stimolazione e selettività registrazione 5. Poiché la corrente di soglia fo l'attivazione di un neurone aumenta linearmente con la distanza elettrodo e soma 5, la selettività della stimolazione diventa peggiore quando l'elettrodo viene spostato dal centro del neurone bersaglio verso un neurone adiacente.
- Per identificare un neurone motore, prima direttamente stimolare il neurone con l'elettrodo extracellulare di vetro per garantire che solo il neurone sta sparando, e deciderà se debba innerva il muscolo. Poi, extracellulare record da questo neurone di stabilire un uno-per-uno tra la registrazione soma extracellulare e le registrazioni del nervo, che è anche fondamentale per l'identificazione dei neuroni.
- Poiché la maggior parte amplificatori extracellulari non consentono stimolazione simultanea e la registrazione in un canale, impostare il canale utilizzato per stimolare e registrare il soma (il canale soma) alla modalità di stimolazione e di applicare una corrente anodica breve (ad esempio 6 msec per Aplysia neuroni 5) al soma (figure 4A, 5A, frecce nota 1 in entrambe le figure), partendo da una bassa corrente (ad esempio 200 μA), e aumentando gradualmente la corrente fino allo scoppio del neurone.
- Una volta che il neurone si attiva per scoppiare, si dovrebbe immediatamente cambiare il canale soma dalla modalità di stimolazione per la modalità di registrazione (figure 4A, 5A, frecce nota 2 in entrambe le figure). Tuttavia, ci saranno ancora ritardi tra la stimolazione soma e la registrazione a causa di ritardi di risposta umana.
- Se si aziona il neurone per un ragionevole lasso di tempo, dovrebbe essere possibile osservare uno-per-uno potenziali d'azione corrispondenti della registrazione soma e sul nervo (s) attraverso il quale i progetti dei neuroni (Figure 4B, 5B, linee tratteggiate nota ), nonché le forze generate dal neurone (figure 4A, 5A; scatole note blu). Se il neurone cottura arresta prima della registrazione soma inizia, aumentare la corrente di attivazione per un tempo più lungo.
- Il rapporto segnale-rumore del extracellulareregistrazioni dipende dalla posizione degli elettrodi e le dimensioni soma. La registrazione extracellulare diventerà più grande come l'aumento di dimensione soma e l'elettrodo a soma diminuire della distanza. Poiché il rumore varia solo in un intervallo ristretto, il rapporto segnale-rumore aumenterà anche all'aumentare della dimensione Soma e l'elettrodo a soma distanza diminuisce. Campo più comune del rapporto segnale-rumore è 4:01-08:01.
- I neuroni motori possono essere identificati in base alle loro caratteristiche, come la posizione soma, proiezione del nervo e innervazione del muscolo 4,6,7. Poiché solo i due BN2s sono collegati alla massa buccale, monitorando l'attività sui BN2s, si può assicurare che la forza di contrazione muscolare è causata solo dal neurone attivato dalla stimolazione extracellulare.
- Per esempio, B3 è un motoneurone grande per il muscolo I1/I3 (300-400 micron di diametro soma in animali di peso 200-350 grammi), situato sul lato rostrale del ganglio vestibolare (Figura 3 ). Si solo i progetti attraverso la omolaterale BN2, e innerva sia la parte anteriore e posteriore del muscolo I1/I3. La maggior parte del tempo, attivando genera un anteriore più grande di forza posteriore (8 su 9 esperimenti).
- Dopo un neurone è identificato, la sua attività può essere registrato in diversi alimenti come i comportamenti tramite l'elettrodo di vetro extracellulare (figure 4 e 5), che può essere provocato come descritto di seguito. La registrazione extracellulare sulla soma sarà molto più specifico di registrazioni nervose, che comprendono l'attività di molti neuroni differenti.
- Per indurre egestive-come programmi motori, stimolare BN2-a con 1-2 min di impulsi 19 (2 Hz, ogni impulso è 1 msec). Questa stimolazione genera affidabile modelli egestive in questa impostazione. Con una corrente sufficiente (ad esempio 300 μA), i modelli possono persistere per tutta la durata della stimolazione. A volte ci sarà un altro modello che si verifica poco dopola stimolazione è finita.
- Per indurre ingestive-come programmi motori, posizionare alcuni cristalli di carbacolo solida direttamente sulla guaina del ganglio cerebrale 15. Se si vuole controllare il livello di esposizione carbacolo, utilizzare una soluzione di 1 a 10 mM in carbacolo Aplysia salina. Concentrazioni maggiori hanno maggiori probabilità di indurre risposte. Motivi ripetitivi iniziano generalmente in cinque minuti, e può durare per circa dieci-quindici minuti prima di iniziare a correre giù.
- Dopo lavando carbacolo volte e in attesa per almeno 30 minuti, una successiva applicazione di carbacolo può essere aggiunto al ganglio cerebrale per indurre più ingestive simili schemi motori.
- Dopo motoneuroni più per la piscina motore particolare, sono state identificate e caratterizzate durante i programmi del motore, si può sviluppare un metodo molto semplificato diagnostica che richiede informazioni minime per la rapida identificazione di questi neuroni nel lavoro futuro (Figura 6 </ Strong>), ad esempio nella preparazione massa sospesa buccali o in vivo. I criteri possono includere soma dimensioni e la posizione, la proiezione del nervo, dimensioni dell'unità sui nervi, e la tempistica di attività durante schemi motori.
Risultati
Le figure 4 e 5 mostrano i risultati tipici per identificare due I1/I3 motoneuroni. Figura 4 mostra le registrazioni soma di un grande motoneuroni, B3, durante schemi egestive-simili e ingestive-like (figure 4C, 4D). L'uno-per-uno picchi corrispondenti sul canale soma e il canale ipsilaterale BN2 (figura 4E) mostrano che la specificità di registrazione B3 soma è stata mantenuta durante modelli. B3 incendi durante il medio-tardiva fase di retrazione dei modelli. Dalla figura 4 ed altri (risultati non mostrati), abbiamo trovato che l'unità di BN2 B3 è sempre più grande BN2 unità. Quindi, può anche essere rilevata direttamente da BN2 registrazioni.
La figura 5 mostra le registrazioni soma di un piccolo neurone, B43, durante schemi egestive-simili e ingestive-like (figure 5C, 5D). L'uno-per-uno picchi corrispondenti sul canale somae il canale ipsilaterale BN2 (Figura 5E) mostrano anche che la specificità di B43 registrazione soma è stata mantenuta durante modelli. Neuron B43 burst al termine della fase di retrazione durante pattern. Poiché l'BN2 unità di B43 è piccola, sarebbe difficile identificare dal BN2 registrazioni senza la registrazione soma, tuttavia, poiché spara più intensamente alla fine del pattern motorio BN2, alla fine del burst B43 può ancora essere identificati da BN2 registrazioni da solo.
La figura 6 mostra un albero ottimizzato diagnostica che non richiede innervazione muscolare come criterio, che rende molto più facile identificare le extracellularmente I1/I3 motoneuroni del preparato massa sospesa buccale o in vivo. L'albero di diagnostica è stato sviluppato, tuttavia, utilizzando le misure di forza e EMG, e illustra così come le tecniche di questo protocollo può portare a semplificato motoneuroni identificazione.

Figura 1. Schematica di configurazione generale e il piatto per gli studi di forza. L'immagine superiore mostra una vista dall'alto. L'immagine inferiore mostra una vista laterale (corrispondente alla linea tratteggiata al centro della vista dall'alto). Il ganglio cerebrale viene ancorata Sylgard nella camera posteriore (zona A). I gangli buccale sono appuntato Sylgard sulla piattaforma centrale (area C). La camera posteriore e la piattaforma di mezzo sono separati da una elevata Sylgard parete (zona B). I cerebrale-vestibolari connettivi (CBC) passare per una tacca nel muro Sylgard, sigillati con grasso per vuoto. La massa buccale è incollato al fondo di vetro della camera anteriore (zona D). I nervi vestibolari 2 (BN2s) sono collegati alla massa buccale. Due ganci fissati a suture di seta sono inserite nelle regioni anteriore e posteriore del muscolo I1/I3. Tha punti di sutura in seta sono poi legati al trasduttore di forza. La figura utilizza grigio scuro, grigio chiaro, e bianco per indicare le superfici delle aree A, B, C, e D. La scuro il colore, maggiore è la superficie corrispondente. La figura utilizza a, b, c, d ed indicare importanti dimensioni del piatto. Una lunghezza è di 3-4 mm, la larghezza della tacca che collega la camera posteriore e piattaforma centrale. B lunghezza è di circa 3-5 mm, la differenza di altezza tra le superfici della piattaforma centrale (zona C) e la parete Sylgard (zona B). C lunghezza indica la lunghezza della tacca, che è di circa 5 mm. Lunghezza d indica la larghezza della piattaforma centrale (zona C), che è di circa 5 mm.

Figura 2. Schema dei gangli vestibolaree gli elettrodi di impostazione. La figura mostra le posizioni dei nervi chiave, tra cui i nervi vestibolari 1, 2, e 3 (BN1, BN2 e BN3), il nervo esofageo (EN), il nervo radular (RN), il nervo e del muscolo I2 , e il connettivo cerebrale buccale (CBC). Si noti che i BN2s sono attaccati alla massa buccale (vedi Figura 1). Le CBC sono attaccati al ganglio cerebrale, passando attraverso l'incavo della parete Sylgard e sono sigillati con grasso per vuoto (vedere Figura 1). La RN e il nervo I2 e muscoli sono tirati sopra i gangli e appuntato prossimale alla massa buccale (direzione anteriore). Le linee blu indicano la posizione dei perni. Due piedini piegati (linee rosse etichettati 1) sono utilizzati per ancorare le CBC. Si noti che un lembo della guaina del CBC sul lato sinistro è piegato e immobilizzato tra BN2 BN3 e ruotare il ganglio sinistra buccale (linea rossa etichetta 2). In alcuni gangli, può essere più conveniente per bloccare il fodero giù tra CBC e BN3. Un perno viene aggiunta to il lato del ganglio che è prossimale alla EN (linea rossa etichettata 3) per ulteriore rotazione e stabilizzazione. L'elettrodo di vetro extracellulare è posto sulla sommità della guaina sopra la soma per la stimolazione e la registrazione extracellulare. Gli elettrodi gancio sono fissati ai BN3s e perni di ritenzione quei nervi posto dovrebbe essere posizionato più distalmente rispetto ai punti di fissaggio di questi elettrodi gancio. Due elettrodi di aspirazione sono attaccati alla RN e il nervo I2 e muscoli (vedi riquadro per una visione più chiara del nervo e muscolo I2). Clicca qui per ingrandire la figura .

Figura 3. Una maschera e schematica della mappa neurone extracellulare per l'identificazione del motore I1/I3neuroni del ganglio Aplysia buccale. L'immagine in alto mostra un ganglio vestibolare laterale destra, appuntato lato caudale alto. Per ruotare i gangli buccale, la RN e il nervo I2 / muscoli sono tirati sopra i gangli buccale e appuntato prossimale al lato della EN. Un lembo della guaina CBC viene ripiegato e riposto per la rotazione (vedi figura 2), in modo che i neuroni a lato rostrale o al confine caudale / rostrale può essere visto. Lo schema inferiore è disegnata sulla base dell'immagine superiore. L'immagine e schematica insieme indicano la posizione del motore I1/I3 neuroni B3, B6, B9, B10, B38, B39, B43 e B82 6,7 22,23, così come alcuni altri neuroni. I neuroni B8a e B8b sono responsabili della più grande unità sulla RN, e innervano il muscolo I4 controlla la pinza 6,17. B4 e B5 neuroni sono responsabili per l'unità più grande sul BN3 18. Anche se le dimensioni e le posizioni dei I1/I3 motoneuroni sono variabili da animale to animale, le dimensioni relative e le posizioni sono piuttosto affidabili per la maggior parte dei neuroni: B3, B6, B9, B38, B43, B82 e. Vedere di discussione per ulteriori dettagli sulle I1/I3 motoneuroni, in particolare alcune delle difficoltà di identificare in modo univoco B10 e B39.
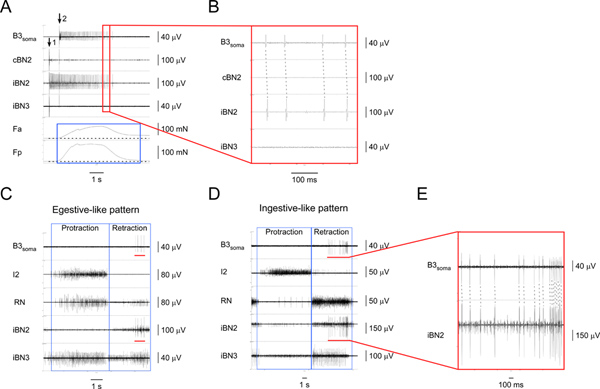
Figura 4. Identificare e caratterizzare il I1/I3 motoneurone B3. A) stimolazione extracellulare di B3 (a freccia 1) e la registrazione dal soma B3 (a partire freccia 2) nonché dai nervi corrispondenti e regioni muscolari. Dall'alto verso il basso, i canali sono registrazioni dal soma B3, il controlaterale BN2, il BN2 omolaterale, il omolaterale BN3, la forza di contrazione della regione anteriore del muscolo I1/I3, e la forza di contrazione della regione posteriore del I1/I3 muscolare. Ilscatola blu mette in evidenza la durata delle forze nelle regioni anteriore e posteriore del muscolo I1/I3. In questo caso particolare, la forza posteriore è maggiore della forza anteriore. B) vista espansa dell'area racchiusa dal riquadro rosso in A1. L'uno-per-uno potenziali d'azione corrispondenti nel soma B3 e le iBN2 canali mostrano che i progetti B3 solo sulla ipsilaterale BN2. C) la registrazione extracellulare dal soma B3 e dei nervi in un egestive-come il modello del motore. D) la registrazione extracellulare da il soma B3 e dei nervi in un ingestive-come il modello del motore. In C e D, dall'alto verso il basso, i canali sono registrazioni dal soma B3, il nervo I2, il RN, il omolaterale BN2, e la ipsilaterale BN3. Le caselle blu indicano il perdurare e le fasi di retrazione dei modelli. Le barre rosse nel canale B3 soma sia in C e D in evidenza il piatto azioneentials registrato dal soma B3. Le barre rosse nel canale iBN2 sia in C e D indicano la tempistica corrispondente quando B3 la cottura in BN2 ipsilaterale durante gli schemi motori di alimentazione. E) vista espansa del soma B3 e le iBN2 canali contrassegnati con le barre rosse. Le linee tratteggiate mostrano l'uno-per-uno tra i potenziali d'azione nel soma B3 e le iBN2 canali. Si noti che l'unità di BN2 B3 è la più grande di tutte le unità. Quindi, possiamo anche rilevare le unità di BN2 B3 direttamente dalle registrazioni BN2 senza registrazioni soma. Clicca qui per ingrandire la figura .

Figura 5. Identificazione ecaratterizzare la I1/I3 motoneurone, B43. A) stimolazione extracellulare di B43 (a freccia 1) e la registrazione dal soma (a partire freccia 2) nonché dai nervi corrispondenti e regioni muscolari. Dall'alto verso il basso, i canali sono registrazioni dal soma B43, controlaterale BN2, il BN2 omolaterale, il omolaterale BN3, la forza di contrazione della regione anteriore del muscolo I1/I3, e la forza di contrazione della regione posteriore del I1/I3 muscolare. La scatola blu evidenzia le misure di forza del muscolo I1/I3 B43 durante l'attività. Attivazione B43 genera una piccola forza posteriore, ma nessuna forza anteriore. B) vista estesa della zona racchiusa dal riquadro rosso in A. Le linee tratteggiate mostrano l'uno-per-uno tra i potenziali d'azione nel soma B43 e le iBN2 canali, il che indica che B43 progetti sul BN2 ipsilaterale solo. C) la registrazione extracellularedal soma B43 e dei nervi in un egestive-come il modello del motore. D) la registrazione extracellulare dalla B43 soma e dei nervi in un ingestive-come il modello del motore. In C e D, dall'alto verso il basso, i canali sono registrazioni dal soma B43, il nervo I2, il RN, il omolaterale BN2, e la ipsilaterale BN3. Le caselle blu indicano il perdurare e le fasi di retrazione dei modelli. Le barre rosse nel canale B43 soma sia in C e D in evidenza i potenziali d'azione registrati dalla soma B43. Le barre rosse nel canale iBN2 sia in C e D indicano la tempistica corrispondente quando B43 la cottura in BN2 omolaterale in questi schemi. E) ampia panoramica sulle B43 soma e le iBN2 canali contrassegnati con la barra rossa in D. Le linee tratteggiate mostrano l'uno-per-uno tra i potenziali d'azione nel soma B43 e le iBN2 canali. Si noti che le unità di BN2 B43 sono piccoli e molto difficili da rilevare senza registrazioni soma, ma il fuoco costantemente alla fine del programma motorio BN2, fornendo un altro modo per identificarli. Si noti inoltre che l'unità più grande mostrata nel pannello di fondo in E è una collisione di una unità B43 soma con un'altra unità extracellulare. Clicca qui per ingrandire la figura .

Figura 6. L'albero ottimizzato diagnostico per identificare alcune delle I1/I3 motoneuroni con soma extracellulare e le registrazioni nervose. Questo metodo di diagnosi richiede le informazioni minime per individuare le I1/I3 motoneuroni, il che rende molto più facile identificazionefy motoneuroni del preparato massa sospesa buccale o in vivo. B3 ha il più grande BN2 unità tra i individuati I1/I3 motoneuroni. Nel resto dei motoneuroni, B6 e B9 sono gli unici due neuroni che proiettano su entrambi BN2 e BN3. B9 è più laterale rispetto B6. Il resto dei neuroni proiettano solo BN2 può anche essere diviso in due gruppi. Un gruppo di progetti neuroni bilaterale, nel BN2s, che comprende B10 e B39 e di alcuni neuroni sconosciuti. L'altro gruppo di neuroni proietta ipsilaterale su BN2 solo, che comprende B38, B43, B82 e. B38 si trova nei pressi B3 e B9. B82 è vicino B8 (vedi Figura 3). B43 è vicino B6. La sua unità BN2 è piccolo e scoppia a fine modelli di alimentazione.

Figura 7. Confronto dei tassi di successo di neurone iNDIVIDUAZIONE forza durante esperimenti utilizzando sia la tecnica extracellulare o la tecnica intracellulare. Con la stessa configurazione trasduttore di forza, abbiamo fatto 35 esperimenti utilizzando la tecnica extracellulare (piccoli punti blu) e 27 esperimenti utilizzando la tecnica convenzionale intracellulare (grandi punti viola) per identificare la I1/I3 motoneuroni. L'asse x indica il numero minimo di neuroni motori del muscolo I1/I3 che sono stati identificati in ogni tipo di esperimento. L'asse y indica il tasso di successo percentuale di ciascun tipo di esperimento. Per esempio, in 19 dei 35 (54%) degli esperimenti extracellulari, siamo stati in grado di identificare almeno cinque differenti I1/I3 motoneuroni. In solo 1 su 27 (4%) degli esperimenti intracellulari, siamo stati in grado di identificare almeno cinque I1/I3 motoneuroni. È chiaro che la percentuale di successo nell'identificare neuroni è molto maggiore per un determinato numero di neuroni con la tecnica extracellulare.
Discussione
Negli animali con grandi neuroni identificati, come molluschi (ad esempio, Lymnaea, Helix, e Aplysia), analisi di piscine motore è in genere fatto utilizzando la registrazione intracellulare 1,2,3,4. In questo protocollo, si descrive un processo per identificare univocamente i neuroni motori per un pool motore utilizzando una tecnica extracellulare. Abbiamo usato le misure di forza, come un esempio di questo processo. Si potrebbe anche usare EMG per misurare innervazioni muscolari. Brevemente, per farlo, il protocollo deve essere modificato per collegare elettrodi gancio di diverse regioni del muscolo I1/I3 per EMG.
La tecnica extracellulare presenta alcuni vantaggi rispetto alle tecniche intracellulari, alcuni dei quali sono già stati descritti sopra. In primo luogo, la tecnica extracellulare richiede meno tempo e fatica per prepararsi gangli per esperimenti e causerà meno danni ai neuroni. Solito, ci vorranno 20-30 minuti per preparare la bucgangli cal per esperimenti extracellulari e circa 1,5 ore per preparare i gangli buccale che sono collegati alla massa buccale per esperimenti intracellulari. Poiché muscoli diventeranno meno attivi come il tempo passa, la differenza di tempo tra i gangli preparativi per esperimenti extracellulari ed intracellulari quelli potrebbe essere critico per il successo di esperimenti. Figura 7 mostra il confronto delle percentuali di successo per identificare i neuroni motori per l'I1 / I3 muscolo usando la tecnica extracellulare o intracellulare in studi forza. In tutti i 35 esperimenti forza extracellulari (100%), siamo stati in grado di identificare almeno un neurone motore per il muscolo I1/I3. In 31 su 35 (89%) esperimenti extracellulari, siamo stati in grado di identificare almeno tre I1/I3 motoneuroni. In 19 su 35 (54%) esperimenti extracellulari, siamo stati in grado di identificare almeno cinque differenti I1/I3 motoneuroni. Al contrario, i tassi di successo degli esperimenti intracellulari con il samla configurazione e la forza del trasduttore sono stati inferiori. In 23 su 27 (85%) esperimenti intracellulari, siamo stati in grado di identificare almeno un I1/I3 motoneurone. In 8 su 27 (30%) esperimenti intracellulari, siamo stati in grado di identificare almeno tre I1/I3 motoneuroni. In solo 1 su 27 (4%) esperimenti intracellulari, siamo stati in grado di identificare cinque I1/I3 motoneuroni. Pertanto, la probabilità di identificare più neuroni del ganglio stesso è superiore utilizzando tecniche extracellulari in contrasto con tecniche intracellulari.
Inoltre, la tecnica extracellulare può accedere molti neuroni su entrambi i lati gangli durante lo stesso esperimento. Di solito, dopo desheathing, elettrodi intracellulari può accedere solo sul lato neuroni del ganglio che è stato Sguainato. Per esempio, quando uno dei due gangli buccale (ad esempio il hemiganglion sul lato sinistro) è bloccato lato caudale up, sarà facile per elettrodi intracellulari per accedere ai neuroni su quellato del ganglio, ad esempio, B6, B9, B10, B39, B43 e, ma di difficile accesso i neuroni nella parte rostrale del ganglio, come B4, B5, B8a, B8b, B38 e B82. In contrasto, elettrodi extracellulari può accedere molti neuroni su entrambi i lati della stessa ganglio vestibolare con un'adeguata rotazione del ganglio. Il grado di rotazione è regolabile e reversibile. Questo aumenta anche la probabilità di identificare più neuroni del ganglio stesso.
Poiché elettrodi extracellulari pigiate delicatamente sulla guaina che copre i neuroni, questi elettrodi non verrà tirato su neuroni, che può creare grandi fori nella membrana e causare danni, come avviene con elettrodi intracellulari durante i movimenti muscolari. La dimensione del segnale varia come il passaggio gangli durante i movimenti muscolari. Si noti che a volte durante i movimenti muscolari di grandi dimensioni, i segnali extracellulari di registrazione soma sarà diminuito o addirittura persi. Tuttavia, si può facilmente move retro extracellulare elettrodo sul neurone e recuperare i segnali originali. Ciò rende possibile applicare la tecnica extracellulare alla preparazione massa sospesa buccale 8 per studi comportamentali, durante i quali generano contrazioni muscolari grandi come la preparazione genera differenti risposte comportamentali. Per esempio, in 47 su 48 esperimenti massa sospesa buccali (98%), abbiamo potuto identificare almeno un neurone motore per il muscolo I1/I3. In 23 su 48 (48%) in sospensione esperimenti di massa buccali, siamo stati in grado di identificare almeno tre I1/I3 motoneuroni. In 11 su 48 (23%) in sospensione esperimenti di massa buccali, siamo stati in grado di identificare almeno cinque neuroni motori per il muscolo I1/I3 e registrare da loro durante schemi motori come la massa buccale si esibiva alimentazione comportamenti simili. La tecnica extracellulare è applicabile anche ad altri più complicati semi-intatte preparazioni, come le preparazioni isolate avanzamento testa che includono tha tentacoli, le labbra, le mascelle, di massa buccale, gangli buccale, e ganglio cerebrale 12,24,25,26. Poiché l'input sensoriale è molto importante per stimolare comportamenti alimentazione in tali preparati, la tecnica extracellulare sarà particolarmente utile per la sua semplicità e funzionalità meno dannosi. Precedenti studi mostrano anche che è possibile individuare e cronicamente registrare B4/B5 in vivo 18. In questi esperimenti precedenti, i ricercatori hanno usato a bassa corrente (10-20 μA) BN2-uno stimolo per attivare selettivamente B4/B5 e incollato un tubicino di polietilene per la guaina sopra B4/B5 per la registrazione, in cui sono stati inseriti un paio di twisted filo di acciaio inossidabile. Così, è possibile identificare e registrare da neuroni motori in vivo utilizzando l'elettrodo tubo di polietilene che è incollato alla guaina di rivestimento gangli (Chestek e Chiel, risultati non pubblicati).
La tecnica extracellulare ha anche alcuni LIMITAioni. Prima, sarà difficile per elettrodi extracellulari di stimolare o registrare i neuroni che sono troppo piccole o troppo in profondità all'interno del ganglio. Si noti che è ancora possibile attivare i neuroni che non sono in superficie attraverso la stimolazione extracellulare. Tuttavia, il nostro modello 5 ha mostrato che la stimolazione può perdere specificità quando il neurone bersaglio è più profonda della neuroni vicini. Quando il neurone è più profonda, l'elettrodo a soma distanza sarà maggiore e correnti maggiori saranno necessari per attivare questo neurone, che può essere sufficientemente elevata per attivare altri neuroni superficie vicina. Secondo, se un neurone è stimolato extracellularmente con troppa corrente, potrebbe essere danneggiato e non rispondono più; correnti molto più piccole vengono utilizzate nella stimolazione intracellulare, se troppa corrente intracellulare può anche danneggiare i neuroni. Talvolta la registrazione soma comprenderà unità multiple sia dal neurone bersaglio e neuroni adiacenti, che è meno specifica intracellulareregistrazione lular. Inoltre, può essere più difficile da controllare e monitorare con precisione la frequenza di emissione di un singolo neurone utilizzando il extracellulare piuttosto che la tecnica intracellulare, poiché l'elettrodo extracellulare non può stimolare e registrare simultaneamente stesso neurone. Inoltre, la tecnica extracellulare non sarà in grado di registrare l'input sinaptico da neuroni premotori. Inoltre, può essere difficile da applicare neurotrasmettitori iontophoretically ad un neurone specifico a meno che il ganglio è Sguainato, sebbene abbiamo dimostrato che è possibile stimolare un ganglio utilizzando carbacolo senza rimuovere la guaina 27.
I limiti delle tecniche di identificazione extracellulari fatto alcuni neuroni in piscina motore difficili da identificare. In questo particolare esempio, la tecnica extracellulare modo attendibile la maggior parte dei neuroni motori per il muscolo I1/I3 in Aplysia: B3, B6, B9, B38, B43, B82 e, sulla base on soma dimensioni e la posizione, la proiezione del nervo, e innervazione del muscolo. Tuttavia, non siamo stati in grado di identificare in maniera attendibile B10 e B39. Precedente lavoro intracellulare 6,7 ha dimostrato che B10 e B39 sono due neuroni adiacenti sul lato caudale dei gangli vestibolare, tra la regione e il B4/B5 B6 regione. Entrambi i neuroni proiettano bilateralmente sui BN2s. B10 innerva la regione centrale e posteriore del muscolo I1/I3, mentre B39 innerva la regione anteriore del muscolo I1/I3. In base alla posizione soma e criteri di proiezione nervosi, abbiamo trovato più di due neuroni motori che del progetto bilaterale sui BN2s in quattro diversi esperimenti. Dal momento che le loro posizioni soma, innervazioni muscolari, e tempi di attività durante schemi motori sono risultati variabili da un animale all'altro, non eravamo sicuri se fossero gli stessi neuroni. Pertanto, non siamo stati in grado di identificare in maniera attendibile B10 e B39 con la tecnica extracellulare a causa della mancanza di coerenza. Per identificarli in modo univoco,abbiamo bisogno di fare un sondaggio più approfondito dei neuroni nei gangli vestibolare, e potrebbe essere necessario ulteriori criteri, come ad esempio l'input sinaptico da premotoria neuroni B4/B5, e le risposte a trasmettitori, che richiedono tecniche intracellulari.
Con opportune modifiche, questa tecnica è applicabile anche ad altre piscine a motore, ad esempio il muscolo I5 10, il muscolo I2 11, e il muscolo I4 12 in Aplysia o ad altri sistemi, ad esempio Lymnaea stagnalis 2, Helix pomatia 3, scarafaggio 13, e Zebrafish 14. Ad esempio, se si vuole applicare questa tecnica ai neuroni motori per il muscolo I5 (noto anche come radular accessorio più muscolare o ARC 10,28) in Aplysia, si dovrebbe tenere i BN3s collegati alla massa buccale invece dei BN2s , perché i neuroni motori I5 B15 e B16 del progetto sulla omolaterale BN3 6,7. Poi tha massa buccale dovrebbero essere pronti a esporre il muscolo I5 per EMG e studi di forza. Dopo i neuroni sono stati individuati affidabile nella preparazione ridotta, un metodo ottimizzato diagnostico potrebbe anche essere creato per futuri studi comportamentali.
La tecnica che abbiamo descritto il confronto con altre tecniche extracellulari come il multi-array e elettrodi di tensione-sensibili coloranti. La tensione colorante sensibile 29 tecnica viene utilizzata solo per la registrazione, mentre i nostri elettrodi extracellulari e multi-elettrodo array 30 può essere utilizzato sia per la stimolazione e la registrazione. Sia il multi-elettrodo matrice 29 e coloranti sensibili tensione-30 può registrare segnali da molti neuroni simultaneamente. Anche se un singolo elettrodo extracellulare può registrare solo da uno o due neuroni a seconda della sua dimensione punta e la posizione degli elettrodi, è certamente possibile posizionare diverse su un ganglio contemporaneamente, e lo abbiamo fattocon successo. Lo standard in vitro multi-electrode array dispone di 8 x 8 o 6 x 10 elettrodi 29. Poiché gli elettrodi sono distribuiti uniformemente nella matrice, è spesso difficile determinare l'identità dei neuroni sottostanti da cui si ottengono registrazioni, poiché i neuroni non sono distribuiti uniformemente e significative post-elaborazione dei segnali, alcune delle quali è ancora manuale, deve essere fatto per risolvere questa ambiguità. Al contrario, poiché gli elettrodi extracellulari sono posizionati sopra somata singolo, l'identità del neurone sottostante è chiara. Quindi, sembra che il multi-array e elettrodi di tensione-sensibili coloranti può essere più efficiente per più registrazioni simultanee. Tuttavia, la nostra tecnica elettrodo extracellulare può fornire una migliore selettività sia per la stimolazione e la registrazione.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questa ricerca è stata sostenuta da sovvenzioni NIH e NSF NS047073 concessione DMS1010434.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome | Azienda | Numero di catalogo | Commenti |
| Cloruro di sodio | Fisher Scientific | S671 | Biologica, certificata |
| Cloruro di potassio | Fisher Scientific | P217 | Certificato ACS |
| Magnesio cloruro esaidrato | Acros Organics | 19753 | 99% |
| Solfato di magnesio eptaidrato | Fisher Scientific | M63 | Certificato ACS |
| Cloruro di calcio diidrato | Fisher Scientifica | C79 | Certificato ACS |
| Glucosio (destrosio) | Sigma-Aldrich | G7528 | BioXtra |
| MOPS buffer | Acros Organics | 17263 | 99% |
| Carbacolo | Acros Organics | 10824 | 99% |
| Soda caustica | Fisher Scientific | SS255 | Certificato |
| Acido cloridrico | Fisher Scientific | SA49 | Certificato |
| Singola canna capillare di vetro | AM Sistemi | 6150 | |
| Flaming-Brown micropipetta estrattore modello P-80/PC | Sutter Instruments | Incandescenza usata: FT345B | |
| Smalto filo rivestito in acciaio inox | California filo sottile | 0.001D, rivestimento h | |
| Delle famiglie in silicone II Colla | GE | ||
| Duro Quick-Gel supercolla | Henkel corp. | ||
| AM Sistemi amplificatore modello 1700 | AM Sistemi | Le impostazioni del filtro: 10-500 Hz per il nervo I2 / muscolare, 300-500 Hz per tutti gli altri nervi | |
| Pulsemaster multicanale Stimolatore | Mondo Strumenti di precisione | A300 | |
| Stimolo Isolator | Mondo Strumenti di precisione | A360 | |
| AxoGraph X | AxoGraph scientifico | Software per le registrazioni | |
| Pin del connettore d'oro | Bulgin | SA3148 / 1 | |
| Gold Connector Sockets | Bulgin | SA3149 / 1 | |
| Sylgard 184 in silicone elastomero | Dow Corning | ||
| 100 x 15 millimetri piatto cristallizzazione | Pyrex | ||
| Vuoto Grasso Alta | Dow Corning | ||
| Pipetta Suggerimenti | Fisher Scientific | 21-375D | |
| Minutien Pins | Strumenti Scienza Belle | 26002-10 | |
| Modellazione argilla | Sargent Art | 22-4400 | |
| Whisper pompa ad aria | Tetra | 77849 | |
| Acquario Tubi | Eheim | 7783 | 12/16 mm |
| Elite Diffusore | Hagen | A962 | |
| Vannas Primavera Forbici | Strumenti Scienza Belle | 15000-08 | |
| Dumont # 5 pinza sottile | Belle SciencStrumenti elettronici | 11254-20 | |
| Kimwipes | Kimberly-Clark | 34155 |
Riferimenti
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon