Method Article
Identifier les motoneurones extracellulaire d'un Motor Pool musculaire dans
Dans cet article
Résumé
Chez les animaux avec de grands neurones identifiés ( Par exemple, Mollusques), l'analyse des piscines moteur est fait en utilisant des techniques intracellulaires 1,2,3,4. Récemment, nous avons développé une technique pour stimuler et enregistrer extracellulaire des neurones individuels dans Aplysia californica 5. Nous allons maintenant décrire un protocole d'utilisation de cette technique pour identifier et caractériser les neurones moteurs au sein d'un parc de véhicules.
Résumé
Chez les animaux avec de grands neurones identifiés (par exemple les mollusques), l'analyse des piscines moteur est fait en utilisant des techniques intracellulaires 1,2,3,4. Récemment, nous avons développé une technique pour stimuler et enregistrer extracellulaire des neurones individuels dans Aplysia californica 5. Nous allons maintenant décrire un protocole d'utilisation de cette technique pour identifier et caractériser les neurones moteurs au sein d'un parc de véhicules.
Cette technique présente des avantages extra-cellulaire. Premièrement, les électrodes extracellulaires peuvent stimuler et enregistrer les neurones à travers la gaine 5, de sorte qu'il n'a pas besoin d'être enlevé. Ainsi, les neurones seront en meilleure santé dans les expériences extra-que dans les intracellulaires. Deuxièmement, si les ganglions sont tournées appropriée la fixation de la gaine, électrodes extracellulaires peuvent accéder à des neurones des deux côtés du ganglion, ce qui rend plus facile et plus efficace d'identifier les neurones multiples dans la même préparation. Troisièmement, extracellulairelar électrodes n'ont pas besoin de pénétrer dans les cellules, et peuvent donc être facilement déplacé d'avant en arrière entre les neurones, ce qui provoque moins de dégâts à eux. Ceci est particulièrement utile quand on essaie d'enregistrer plusieurs neurones au cours de la répétition des schémas moteurs qui ne peuvent persister pendant quelques minutes. Quatrièmement, les électrodes extracellulaires sont plus souples que celles intracellulaires lors des mouvements musculaires. Électrodes intracellulaires peuvent sortir et endommager les neurones pendant les contractions musculaires. En revanche, depuis électrodes extracellulaires sont légèrement pressés sur la gaine au-dessus de neurones, ils restent habituellement au-dessus du même neurone pendant les contractions musculaires, et peut donc être utilisé dans plusieurs préparations intactes.
Pour identifier les neurones moteurs pour un parc de véhicules (en particulier, le muscle chez l'aplysie I1/I3) en utilisant des électrodes extracellulaires, on peut utiliser des fonctionnalités qui ne nécessitent pas de mesures intracellulaires comme critères: la taille et l'emplacement soma, la projection axonale et l'innervation muscle 4, 6,7. Pour le parc de véhicules particulier utilisé pour illustrer la technique, nous avons enregistré des nerfs buccaux 2 et 3 pour mesurer projections axonales, et mesuré les forces de contraction du muscle I1/I3 pour déterminer le modèle de l'innervation musculaire pour les neurones moteurs individuels.
Nous démontrons le processus complet des premiers neurones moteurs identifier en utilisant l'innervation musculaire, puis la caractérisation de leur temps au cours de la motricité, la création d'une méthode simplifiée de diagnostic pour l'identification rapide. Le procédé plus simple et plus rapide de diagnostic est supérieure à la préparation plus intactes, par exemple dans la préparation de masse buccale suspendu 8 ou 9 in vivo. Ce procédé peut aussi être appliqué dans les piscines à moteur autres 10,11,12 chez l'aplysie ou dans des systèmes animaux autres 2,3,13,14.
Protocole
1. Préparation de la vaisselle d'enregistrement
- Au cours des expériences transducteur de force, les ganglions buccale, ganglion cérébral, et la masse buccale sont placés dans un plat rond en pyrex qui est spécialisé pour les études de la force.
- Pour induire ingestion motifs en forme dans les expériences, nous avons besoin d'appliquer le carbachol non hydrolysable agoniste cholinergique du ganglion cérébral 15. Pour éviter le contact direct de carbachol sur les noyaux vestibulaires et la masse buccale, chambres séparées sont nécessaires pour isoler le ganglion cérébral des ganglions buccale et la masse buccale (figure 1).
- Car la masse buccale est beaucoup plus épais que les noyaux buccale, ils ne seront pas placés sur le même plan. Par conséquent, ce plat doit avoir une chambre arrière pour le ganglion cérébral (zone A de la figure 1), une plate-forme centrale pour les noyaux vestibulaires (zone C de la figure 1), et une chambre beaucoup plus profond avant de la masse buccale (zone D dans Figure 1).
- Pour créer ce plat, commencer par un plat rond 100x15 Pyrex (15 mm de hauteur, 100 mm de diamètre). Construction de la parabole, il faudra plusieurs verse de Sylgard. Suivez les instructions fournies avec le produit Sylgard. Sylgard doivent être autorisées à établir entre les différents verse.
- La première coulée est de créer le plus haut niveau de Sylgard dans le plat (zone B de la figure 1), qui est le mur entre la plate-forme de middle et back chambre.
- Utilisez deux supports en pâte à modeler pour isoler la zone de Sylgard paroi (zone B de la figure 1). Enduire les supports en pâte à modeler avec de la pellicule plastique où ils seront en contact avec le Sylgard pour faciliter l'enlèvement. Assurez-joints étanches sur les bords, où la pâte à modeler prendra contact avec le plat, pour minimiser les fuites.
- Verser Sylgard dans la partie située entre les deux supports en pâte à modeler à peu près jusqu'au sommet de la parabole. Laissez le Sylgard pleinement mis du jour au lendemain. Garder le plat dans un endroit chaud va induireune prise plus rapide. Retirez les supports en pâte à modeler et nettoyer tout résidu d'argile sur le Sylgard.
- Ensuite, la chambre arrière (zone A sur la figure 1) et la plate-forme centrale (zone C de la figure 1) doit être versé.
- Placer un support de pâte à modeler environ 5 mm de la surface avant de la Sylgard de la section de la plate-forme centrale (zone C).
- Verser Sylgard dans les sections de la chambre arrière (zone A) et la plate-forme centrale (zone C) jusqu'à une hauteur d'environ 3-5 mm au-dessous du niveau supérieur de la première paroi Sylgard (zone B). La surface de la chambre de Sylgard arrière doit être légèrement inférieure à celle de la plate-forme intermédiaire pour éviter les fuites de la chambre arrière contenant le carbachol à la plate-forme intermédiaire. Encore une fois, laissez le Sylgard pleinement mis en une nuit, puis retirez le support de pâte à modeler.
- La dernière étape consiste à découper une encoche au milieu de la paroi Sylgard pour fournir un canal pour les connecteurs cérébro-buccaux (CBC) pour allerpar le biais entre la plate-forme centrale et la chambre arrière. La largeur de cette encoche devrait être d'environ 3-4 mm, ce qui est assez large pour les CBCs. Le fond de l'encoche doit pas être inférieure à la surface de la plate-forme de Sylgard milieu pour éviter les fuites. Lame de scalpel peut être utilisé pour couper l'encoche.
2. Préparation des électrodes
- Tirez électrodes de verre extracellulaires seul canon capillaire en verre à l'aide d'une micropipette Flaming-Brown extracteur tel que décrit par McManus et al. 8 de la section 3.1. Avec le filament FT345B dans l'extracteur, nos paramètres du programme sont typiques de chaleur 480, Pull 50, vitesse 13, et de l'heure 20, mais notez que les paramètres seront différents pour différents filaments. Ce programme crée des électrodes en un seul geste sans étape poli-feu. La taille de la pointe de l'électrode doit être inférieure à la taille des corps cellulaires. Pour les neurones moteurs allant de 50 um à 400 um de diamètre soma, l'intérieur DIAMETRErs des électrodes de verre extracellulaires doit être d'environ 40 um et leurs résistances devrait être d'environ 0,1 MQ quand ils sont remplis de solution saline aplysie.
- Tirez électrodes d'aspiration à partir de tuyaux en polyéthylène à l'aide d'un bec Bunsen. Coupez un morceau de tube en polyéthylène d'environ 10 cm de long. Maintenir le tube aux deux extrémités et la placer à proximité de la flamme produite par le brûleur Bunsen pendant la rotation du tube jusqu'à ce qu'il devienne mou de la chaleur. Étirer le tube soigneusement le long de sa longueur tout en l'éloignant de la flamme. La partie médiane du tube allongé et se rétrécir lorsque le tube est tiré.
- Couper le tube en deux pour former deux électrodes d'aspiration. Électrodes d'aspiration sont généralement appliqué sur les extrémités coupées des nerfs ou des muscles, mais ils peuvent parfois être appliqué en passant.
- Créer électrodes crochet pour les enregistrements suivants nerveuses le protocole décrit par McManus et coll 8 dans les sections 3.2 à 3.13. Ces électrodes sont especiallié utile quand un nerf ou un muscle n'est pas coupé.
3. Fixation des électrodes crochet
- Disséquer l'animal et enlever la masse buccale selon le protocole décrit dans McManus et coll. 8 Section 4.
- Pour l'enregistrement et la stimulation, des électrodes à crochets peut être attaché à un certain nombre de différents nerfs.
- Pour caractériser les modes comme cela a été fait in vivo par Cullins et Chiel 9, les enregistrements doivent être obtenues à partir du nerf et du muscle I2 qui indique la phase de prolongation de l'alimentation 16, le nerf radular (RN) qui indique la fermeture de la nourriture pince 17, buccale Nerf 2 (BN2) et buccale 3 (BN3) indiquent que la phase de rétraction 17,18. La fixation des électrodes crochet suit une procédure similaire à celle décrite par McManus et coll 8, de l'article 5.
- Les emplacements de ces nerfs se reporter au schéma du dispositif d'alimentation indiqué dans l'aplysieFigure 2 de McManus et coll 8. Notez que les BN2 trifurcates dans les branches a, b, c et avant d'aller sous le muscle I1 à la rainure latérale. Une branche est la branche premier à se séparer du tronc principal, et est adjacente à la BN3.
- La nomenclature des branches a, b, c et a été utilisé par Warman et Chiel 18. Branches a, b, et c correspondent aux branches 3, 2 et 1, respectivement, dans la nomenclature utilisée par Nargeot et al. 19. En outre, le RN, le BN1, BN2 l', et la BN3 correspondent aux nerfs 1, 6, 5, 4 et, respectivement, dans la nomenclature utilisée par Kandel 20 et Scott et al. 21
- Pour étudier l'innervation musculaire du muscle I1/I3, tous les nerfs à l'exception des nerfs buccaux 2 sera séparée de la masse buccale au cours des expériences. Ainsi, nous avons utilisé une électrode de crochet pour enregistrer à partir du BN2.
- Depuis le nerf I2 et la RN ne sera pas attaché à la masse buccale, et ils sont très difficiles d'accès en utilisant des électrodes crochet, il est préférable d'appliquer les électrodes d'aspiration pour enregistrer à partir d'eux à la place. Nous allons décrire l'application des électrodes d'aspiration à l'article 7.
- Utilisez une électrode crochet ou une électrode d'aspiration pour enregistrer à partir de la BN3, car il est facile d'accéder à l'aide ou l'autre type d'électrode. Nous avons choisi d'utiliser une électrode crochet pour les BN3 enregistrements afin de minimiser le nombre de manipulateurs de maintien des électrodes d'aspiration et d'économiser de l'espace pour les manipulateurs ou d'autres équipements.
- Attacher une électrode de crochet à une branche de BN2 (BN2-a) à initier le rejet des motifs de type au cours d'expériences. Il est utile de fixer une électrode crochet supplémentaire à la BN2-un sur l'autre côté, parce que certains neurones réagissent différemment à la ipsilatérale vs controlatéral BN2-stimulation.
- Pour aider à distinguer les neurones avec des projections unilatérales contre bilatéral,est également utile pour fixer les électrodes à crochets et à BN2 la BN3 de l'autre côté des ganglions buccale.
4. Ganglions et préparation musculaire
- Les ganglions buccale, ganglion cérébral et de la masse buccale sera établi pour les expériences transducteurs de force, dans laquelle le ganglion cérébral est fixé aux noyaux buccale par l'intermédiaire des RON et la masse buccale est fixée sur le ganglion buccal par l'intermédiaire des BN2s seulement.
- Après avoir fixé les électrodes crochet, couper nerf buccal 1 (BN1) et le nerf oesophagien (FR) bilatéralement, coupe au point de fixation de la masse buccale.
- Tirez le ganglion cérébral avant de le déplacer hors de la voie du muscle I2. Faites une entaille dans le muscle I2 sur le sac radular, de prolonger la coupe latéralement et en avant dans les deux sens, et tirez le rabat du muscle I2 avant pour exposer le nerf radular. Couper les deux branches RN et assurez-vous que les branches sont assez longues pour la fixation d'électrode d'aspiration.
- Continuer la coupe I2 dans un large cercle autour du ganglion vestibulaire, en faisant attention de ne pas couper les BN2s ou les BN3s, jusqu'à ce que les noyaux vestibulaires et la pièce rapportée du muscle I2 peut être entièrement séparé de la masse buccale. Couper les BN3s bilatéraux au point d'attache à la masse buccale, au-delà de l'électrode de fixation de crochet.
- Appliquez une fine couche de graisse à vide à l'encoche dans le plat d'enregistrement décrit ci-dessus qui relie la chambre arrière et la plate-forme centrale, à l'aide d'une pipette pour ramasser une boule de graisse à vide et l'étaler sur l'encoche.
- Appliquez une fine couche de Quick-Gel super glue pour le fond de verre de la chambre avant où la masse buccale sera placé, juste en face de la base Sylgard de la plate-forme du milieu.
- Transférer délicatement le ganglion cérébral, les ganglions buccale et de la masse buccale à l'antenne d'enregistrement (Figure 1) décrit dans la section 2, en s'assurant qu'aucun des électrodes crochet sont tirés étroitement, ce qui pourrait endommager les nerfs.
- Placer soigneusement la masse buccale sur la colle dans la chambre avant de la cuvette d'enregistrement, de sorte que sa face ventrale est collé au fond de la boîte. Soyez sûr de garder les ganglions et des électrodes de toucher la colle. Ajouter aplysie saline 8 (460 mM NaCl, 10 mM de KCl, 22 mM de MgCl2, 33 mM MgSO 4, 10 mM de CaCl2, 10 mM de glucose, 10 mM MOPS, pH 7.4 à 7.5) à l'antenne, ce qui va induire la colle à définir.
- Si le plat doit être transféré à un autre microscope pour préparer les ganglions buccaux pour les enregistrements extracellulaires soma, être très prudent avec les électrodes crochet. Le groupe des électrodes sur un côté de la masse buccale ensemble, ainsi que les électrodes du groupe de l'autre côté de la masse buccale ensemble. Soigneusement maintenir les électrodes en saisissant la bande de laboratoire qui recouvre les broches du connecteur, à nouveau en s'assurant qu'aucun des électrodes sont tirés fermement.
- Lorsque la capsule est positionnée sous le microscope, l'électrodes devrait être drapé doucement sur les côtés du plat et reposent sur la plate-forme à côté du plat.
- Pendant les pauses et entre les étapes de l'expérience, il faut aérer la solution saline dans la chambre de masse buccale à l'aide d'une pierre à air d'aquarium.
- Utilisez une pince pour saisir la gaine du ganglion cérébral et le placer dans la chambre arrière, veiller à ce que les CBCs courir à travers l'encoche. Pin le ganglion cérébral en utilisant d'autres nerfs que les CBCs pour éviter d'endommager les CBCs intactes.
- Appliquer de la graisse plus vide sur les CBCs, puis ajoutez une solution saline plus aplysie aux deux chambres du plat, afin que les ganglions sont complètement submergées. Faire en sorte que le haut de la graisse à vide est légèrement supérieure à la paroi Sylgard sorte qu'aucune fuite ne se produit entre les chambres.
- Pour stabiliser les ganglions buccale, d'abord cerner les extrémités des BN3s, puis les BN1s et l'ENS sur la base Sylgard de la plate-forme du milieu (Figure 2). Depuis les BN3s seront enregistrées en utilisant électrode crochets, les repères doivent être placés plus distale que les points de fixation des électrodes à crochets.
- Utilisez deux broches, pliés à 90 degrés, comme les crochets pour étirer et à ancrer les CBCs, de sorte que les CBCs ne sera pas endommagé (figure 2).
- Cerner les branches RN entre la chambre arrière et les ganglions buccaux. Puis le muscle I2 sera au-dessus de l'IA. Pour exposer le nerf I2, utiliser une pince pour saisir le muscle I2 et le tirer sur les ganglions buccaux. Pin deux coins du muscle I2 pour éviter d'endommager le nerf I2.
- Sectionner le nerf I2 distale à l'endroit où deux de ses branches se fondre dans le muscle I2. Assurez-vous que le muscle est innervé encore être comparable à l'enregistrements in vivo. Coupez le reste du muscle I2 et I2 retourner le nerf en arrière et l'accrocher vers le bas entre les branches RN deux (voir la figure 2, en médaillon).
- Ajustez l'emplacement des broches pour étirer et ajouter de la tension si un nerf est trop lâche, ou pour relâcher la tension si un nerve est trop serré. Pour stabiliser davantage les ganglions buccaux, ajouter plus de broches sur la gaine entre les nerfs.
- Depuis les ganglions buccaux sont placés côte caudale en place, tourner les noyaux vestibulaire si les neurones d'intérêt sont sur le côté rostral. Pour faire pivoter un des deux ganglions buccaux, utilisez une pince fine pour saisir une gaine excès de Radio-Canada où il est proche des noyaux vestibulaires et il épingler entre le BN2 et le BN3. Dans certains ganglions, il peut être plus commode de le coincer entre la SRC et BN3.
- Ajouter une broche supplémentaire sur la gaine du ganglion buccal sur le côté proche de la chambre avant de réduire au minimum le déplacement du ganglion buccal.
- Pour découper la gaine recouvrant les ganglions buccaux, utilisez une pince fine pour saisir la gaine sur le côté proche de la chambre arrière, puis couper la gaine supérieure avec des ciseaux fins, sans exposer les corps cellulaires. Afin de minimiser les dommages, ne retirez le montant minimum de la gaine nécessaires pour voir les corps cellulaires.
- Après til gaine les ganglions buccale est coupée, retirez le nerf I2 et l'IA sur les noyaux vestibulaires et les clouer entre les noyaux vestibulaires et chambre avant de continuer à faire tourner les noyaux vestibulaire. (Voir figure 2).
- Pour laver toute chlorure de magnésium reste 8 qui a été utilisé pour anesthésier l'animal avant dissection, remplacer la solution saline aplysie dans le plat avec l'aplysie saline fraîche.
5. Raccordement électrique des électrodes crochet
- Après les ganglions et les muscles sont préparés, transférez le plat sur la table isolation contre les vibrations pour les expériences.
- Fixez toutes les broches d'électrodes à leurs prises sur les câbles BNC qui se connectent aux amplificateurs (amplificateur AM Systems Modèle 1700). Encore une fois, assurez-vous que les électrodes ne sont pas bien tiré pendant cette opération. Assurez-vous que les électrodes sont bien attachés à leurs câbles appropriés et que les polarités sont correctes.
6. Mise en place des électrodes en verre pour les enregistrements extracellulaires Soma
- Remplir l'électrode avec une solution saline aplysie aide d'une seringue attachée à un morceau de tube en polyéthylène d'environ 15-20 cm. Fixer l'extrémité libre du tube de polyéthylène à l'extrémité de l'électrode de verre. Tirez sur le piston de la seringue pour remplir l'électrode avec une solution saline aplysie.
- Placer l'électrode de verre rempli extracellulaire dans l'encoche du support sur le manipulateur. Utilisez le manipulateur de placer la pointe de l'électrode dans la solution saline contenant les ganglions de l'aplysie buccale.
- Insérer un fil d'argent / chlorure d'argent soudée à une broche de connecteur mâle or dans l'électrode pour servir de fil d'enregistrement. Placer un autre fil d'argent / chlorure d'argent soudée à une broche de connecteur mâle or directement dans la solution saline dans le Aplysia section de la cuvette d'enregistrement contenant le ganglion buccal pour agir en tant que conducteur de référence. Branchez les deux èmel'enregistrement électronique et les fils de référence pour le câble BNC qui se connecte à l'amplificateur.
- S'il ya assez de place pour plus de manipulateurs, d'autres électrodes de verre extracellulaires peuvent être ajoutés à enregistrer simultanément plusieurs neurones.
7. Mise en place des électrodes d'aspiration pour les enregistrements nerveuses
- Couper l'extrémité étroite de l'électrode de pointe d'aspiration en fonction du diamètre du nerf. Le diamètre intérieur de la pointe de l'électrode doit être semblable ou légèrement inférieur au diamètre du nerf de s'assurer d'aspiration étanche.
- Depuis le nerf I2 et le RN sont très proches les uns des autres, leurs électrodes peut être maintenu par le manipulateur même pour gagner de la place. Placez deux électrodes dans deux encoches du même titulaire. Tournez les deux électrodes et veiller à ce que leurs conseils sont proches les unes des autres. Choisissez l'un d'eux pour l'enregistrement I2 nerf, l'autre pour l'enregistrement RN.
- Placez la pointe de l'électrode dans la solution saline aplysie dans le recording plat contenant des noyaux buccale. Fixer l'extrémité libre du tube de polyéthylène sur la seringue à l'électrode d'aspiration. Utilisez la seringue pour remplir l'électrode avec une solution saline aplysie. Déplacer la pointe de l'électrode à proximité de l'extrémité du nerf cible, à savoir le nerf I2, et d'utiliser la seringue pour aspirer le nerf dans l'électrode. La longueur du nerf dans l'électrode devrait être d'environ 0,5-1,0 mm pour assurer une bonne étanchéité.
- Répétez l'aspiration de l'électrode qui sera jointe à la RN.
- Connectez les électrodes aux câbles correspondants BNC telles que décrites à la section 6.3.
8. Mise en place du capteur de force pour mesurer la contraction musculaire I1/I3
- Pour fixer les capteurs de force au muscle, utiliser des sutures en soie. Plier l'aiguille courbe de chaque fil de suture, et attacher le fil de suture au transducteur de force. Doucement saisir et soulever une petite quantité de muscle avec une pince et, en maintenant l'aiguille dans un autre ensemble de pince, insérezl'aiguille dans le muscle jusqu'à la pointe de l'aiguille courbée (figure 1).
- Transducteurs peut être fixé soit à la face dorsale ou sur le côté du muscle I1/I3. Attache dorsal permet la mesure des contractions provoquées par l'activation de soit le côté gauche ou droit du muscle. Fixation latérale vous montrera une plus grande force pour la majorité des neurones, mais ne permettent la mesure de la contraction sur le côté vers lequel le transducteur est fixé.
- Pour aider à identifier les neurones qui peuvent activer les régions antérieure, postérieure, ou les deux de I1/I3, fixez un capteur de force à la partie postérieure du muscle, juste en avant du tissu du pharynx, et joindre un autre capteur de force à la partie antérieure de l' musculaire, les mâchoires (Figure 1; crochets de note).
- Soulevez les capteurs de force jusqu'à ce que les sutures sont tendu, mais ne pas forcer. Pour le vérifier, voir la mesure du capteur de force lorsque la suture a un peu de mou dans it, puis soulevez le capteur jusqu'à ce que la mesure est légèrement au-dessus de ce niveau de référence.
9. Identification des motoneurones dans un Motor Pool
- Ce protocole décrit un procédé pour identifier extracellulaire des neurones moteurs dans un parc de véhicules. Nous avons utilisé le logiciel AxoGraph de surveiller l'activité de neurones individuels, les nerfs multiples, et le muscle (signal EMG ou des forces de contraction). Dans ce protocole, nous avons utilisé les forces de contraction du muscle comme une illustration pour le processus d'identification des neurones moteurs; dans d'autres expériences, nous avons utilisé EMG ainsi, et la configuration de ces expériences est très similaire (voir Discussion).
- Pour localiser un neurone candidat, utilisez le manipulateur pour appuyer légèrement sur la pointe de l'électrode de verre extracellulaire vers le bas sur la gaine sur le centre du soma des neurones 5 (figure 3), ce qui est le meilleur emplacement pour la stimulation et 5 sélectivité enregistrement. Comme le seuil de courant fou l'activation d'un neurone augmente linéairement avec la distance électrode-à-soma 5, la sélectivité de la stimulation devient pire lorsque l'électrode est éloignée du centre de la cible vers un neurone neurone voisin.
- Pour identifier un neurone moteur, d'abord stimuler directement le neurone en utilisant l'électrode en verre extra pour s'assurer que seul ce neurone est mise à feu, et examiner si elle innerve le muscle. Puis, extracellulaire dossier de ce neurone pour établir une pour-un entre l'enregistrement soma extracellulaire et les enregistrements nerveuses, ce qui est également cruciale pour l'identification des neurones.
- Comme la plupart des amplificateurs extracellulaires ne permettent pas la stimulation et l'enregistrement simultanés dans un canal, réglez le canal utilisé pour stimuler et enregistrer le soma (le canal soma) en mode de stimulation et d'appliquer une brève courant anodique (par exemple 6 ms pour l'aplysie neurones 5) à la soma (figures 4A, 5A; flèches note 1 in les nombres), à partir d'un courant faible (par exemple 200 mA), et en augmentant progressivement le courant jusqu'à ce que les salves de neurones.
- Une fois que le neurone est activé à éclater, il faut immédiatement changer le canal soma du mode de stimulation en mode d'enregistrement (figures 4A, 5A, note 2 flèches dans les deux chiffres). Cependant, il y aura toujours des retards entre le soma et la stimulation d'enregistrement en raison de délais de réponse de l'homme.
- Si les feux de neurones pour un laps de temps raisonnable, il devrait être possible d'observer un pour-un des potentiels d'action correspondants de l'enregistrement soma et sur le nerf (s) à travers lequel les projets de neurones (figures 4B, 5B, les lignes pointillées notes ), ainsi que les forces générées par le neurone (Figures 4A, 5A, les boîtes de correspondance bleu). Si le neurone cesse de tirer avant que l'enregistrement commence soma, augmenter le courant de l'activer pour un temps plus long.
- Le rapport signal-à-bruit de la extracellulaireenregistrements dépend de la localisation et de la taille d'électrode soma. L'enregistrement extracellulaire va devenir plus grand que l'augmentation de la taille soma et diminue la distance électrode-à-soma. Comme le bruit ne varie que dans une fourchette étroite, le rapport signal-sur-bruit augmente également avec l'augmentation de la taille soma et la distance électrode-à-soma diminue. La gamme la plus courante du rapport signal sur bruit est de 4:1 à 8:1.
- Les neurones moteurs peuvent être identifiés en fonction de leurs caractéristiques, telles que l'emplacement soma, la projection nerveuse et musculaire 4,6,7 innervation. Étant donné que seules les deux BN2s sont fixés à la masse buccale, en surveillant l'activité sur les BN2s, on peut faire en sorte que la force de contraction du muscle est uniquement provoqué par le neurone activé par la stimulation extracellulaire.
- Par exemple, B3 est un neurone moteur du muscle grand pour I1/I3 (300-400 um de diamètre soma chez les animaux d'un poids de 200 à 350 grammes), situé sur le côté rostrale du ganglion buccal (figure 3 ). Il ne fait que des projets à travers le BN2 ipsilatérale, et innerve les deux parties antérieure et postérieure du muscle I1/I3. La plupart du temps, il génère une plus grande activation antérieure que postérieure vigueur (8 sur 9 essais).
- Après un neurone est identifié, son activité peut être enregistrée dans différents aliments des comportements similaires via l'électrode en verre extra-cellulaire (figures 4 et 5), qui peut être obtenue comme décrit ci-dessous. L'enregistrement extracellulaire sur le soma sera beaucoup plus précis que les enregistrements nerveuses, qui incluent l'activité de nombreux neurones différents.
- Pour inciter les programmes moteurs egestive type, stimuler BN2-un avec 1-2 min d'impulsions 19 (2Hz, chaque impulsion est de 1 msec). Cette stimulation engendre de manière fiable les modèles egestive dans ce contexte. Avec un courant suffisant (par exemple 300 mA), des motifs peuvent persister pendant toute la durée de la stimulation. Parfois, il y aura encore une tendance qui se produit peu de temps aprèsla stimulation se termine.
- Pour inciter les programmes moteurs ingestion de type, placer quelques cristaux de carbachol solide directement sur la gaine du ganglion cérébral 15. Si l'on veut contrôler le niveau d'exposition carbachol, utilisez une solution de 1 à 10 mM de carbachol chez l'aplysie saline. Des concentrations plus élevées sont plus susceptibles d'induire des réponses. Motifs répétitifs commencent généralement dans les cinq minutes et peut durer pendant environ dix à quinze minutes avant de commencer à courir vers le bas.
- Après lavage carbachol plusieurs fois et attendre au moins 30 minutes, une demande ultérieure de carbachol peut être ajouté à l'ganglion cérébral pour induire plus de patrons moteurs ingestion de type.
- Après neurones moteurs multiples pour le parc de véhicules particulier ont été identifiés et caractérisés au cours de programmes moteurs, on peut développer une méthode très simplifiée de diagnostic qui nécessite un minimum d'informations pour identifier rapidement ces neurones dans les travaux futurs (figure 6 </ Strong>), par exemple dans les préparations en suspension de masse buccale ou in vivo. Les critères peuvent inclure la taille et l'emplacement soma, la projection nerveuse, taille de l'unité sur les nerfs, et le moment de l'activité au cours des schémas moteurs.
Résultats
Les figures 4 et 5 montrent des résultats typiques utilisés pour identifier deux I1/I3 neurones moteurs. Figure 4 montre les enregistrements soma d'un grand neurone moteur, B3, pendant modèles egestive-like et ingestion de type (4C chiffres, 4D). L'un pour-un des pics correspondant sur le canal et le canal de soma ipsilatérale BN2 (figure 4E) montrent que la spécificité de B3 soma enregistrement a été maintenue pendant modèles. B3 feux pendant la phase de rétraction du milieu à la fin des motifs. D'après la figure 4, et d'autres résultats (non représenté), nous avons constaté que l'unité BN2 de B3 est toujours le plus grand BN2 unité. Ainsi, il peut également être détectée directement à partir BN2 enregistrements.
La figure 5 montre les enregistrements soma d'un neurone petite, B43, pendant modèles egestive-like et ingestion de type (figures 5C, 5D). L'un pour-un des pics correspondant sur le canal somaet le canal ipsilatérale BN2 (figure 5E) montrent également que la spécificité de l'enregistrement B43 soma a été maintenue pendant modèles. B43 salves de neurones à la fin de la phase de rétraction au cours de motifs. Comme l'unité BN2 de B43 est petit, il serait difficile de l'identifier parmi les BN2 enregistrements sans l'enregistrement soma, mais parce qu'il tire le plus intensément à la fin de la configuration du moteur BN2, la fin de la salve B43 peut encore être identifiés du BN2 enregistrements seulement.
La figure 6 montre un arbre optimisé diagnostic qui ne nécessite pas l'innervation musculaire comme critère, ce qui le rend beaucoup plus facile d'identifier les I1/I3 extracellulaire des neurones moteurs dans la préparation de la masse buccale suspendu ou in vivo. L'arbre de diagnostic a été développé, cependant, en utilisant des mesures de la force et de l'EMG, et illustre ainsi comment les techniques de ce protocole peut conduire à simplifier l'identification des neurones moteurs.

Figure 1. Schéma de configuration globale et le plat pour les études sur la population. L'image du haut montre une vue de dessus. L'image du bas montre une vue latérale (correspondant à la ligne en pointillés dans le milieu de la vue de dessus). Le ganglion cérébral est épinglée à Sylgard dans la chambre arrière (zone A). Les ganglions buccaux sont épinglés Sylgard sur la plate-forme centrale (zone C). La chambre arrière et la plate-forme du milieu sont séparés par un mur élevé Sylgard (zone B). Les connecteurs cérébro-buccaux (CBC) passent par une entaille dans le mur Sylgard, lubrifiés par graisse à vide. La masse buccale est collé au fond de verre de la chambre avant (zone D). Les nerfs vestibulaires 2 (BN2s) sont fixés à la masse buccale. Deux crochets attachés aux sutures de soie sont insérés dans les régions antérieure et postérieure du muscle I1/I3. Til sutures de soie sont ensuite reliées au transducteur de force. La figure utilise gris foncé, gris clair et blanc pour indiquer les surfaces des zones A, B, C et D. Plus la couleur est élevée, plus la surface correspondante. La figure utilise a, b, c et d pour indiquer les dimensions importantes du plat. Une longueur de 3-4 mm est la largeur de l'entaille qui relie la chambre arrière et la plate-forme intermédiaire. B longueur est d'environ 3-5 mm, la différence de hauteur entre les surfaces de la plate-forme centrale (zone C) et la paroi Sylgard (zone B). C la longueur indique la longueur de l'encoche, qui est d'environ 5 mm. Longueur d affiche la largeur de la plate-forme centrale (zone C), qui est d'environ 5 mm.

Figure 2. Schéma des ganglions buccauxet des électrodes de configuration. La figure montre les emplacements des nerfs principaux, dont les nerfs buccaux 1, 2, et 3 (BN1, BN2, et BN3), le nerf oesophagien (FR), le nerf radular (RN), le nerf et le muscle I2 , et le conjonctif cérébral buccale (CBC). Notez que les BN2s sont attachés à la masse buccale (voir Figure 1). Les CBCs sont attachés au ganglion cérébral, en passant par l'encoche du mur Sylgard et sont scellés avec de la graisse à vide (voir figure 1). Le RN et le nerf et le muscle I2 sont tirés au-dessus du ganglion et épinglé à proximité de la masse buccale (direction avant). Les lignes bleues indiquent l'emplacement des broches. Deux broches tordues (lignes rouges étiquetés 1) sont utilisés pour ancrer les CBCs. Notez qu'un volet de la gaine de la SRC sur le côté gauche est plié et coincé entre BN2 et BN3 pour faire tourner le ganglion vestibulaire gauche (ligne rouge marquée 2). Dans certains ganglions, il peut être plus commode à la broche de la gaine vers le bas entre Radio-Canada et BN3. Une broche supplémentaire est ajoutée to le côté du ganglion qui est proximale par rapport à la norme (ligne rouge marquée 3) pour la poursuite de la rotation et de stabilisation. L'électrode de verre extra-cellulaire est placé sur le dessus de la gaine au-dessus de la soma pour la stimulation et l'enregistrement extracellulaire. Les électrodes de crochets sont fixés sur les BN3s et les tiges de maintien en place de ces nerfs doit être placé plus distale que les points de fixation de ces électrodes à crochets. Deux électrodes d'aspiration sont attachés à la RN et le nerf et le muscle I2 (voir encadré pour une vision plus claire du nerf et du muscle I2). Cliquez ici pour agrandir la figure .

Figure 3. Une photo et le schéma de la carte de neurones pour l'identification extracellulaire du moteur I1/I3neurones dans le ganglion vestibulaire aplysie. L'image du haut montre un ganglion vestibulaire côté droit, côté épinglé caudale vers le haut. À faire tourner les noyaux buccale, le RN et le nerf I2 / muscle est tiré au-dessus du ganglion buccal et mis à proximité du côté de la FR. Un rabat de l'enveloppe CBC est également replié et épinglé pour la rotation (voir figure 2), de sorte que les neurones du côté rostral ou à la frontière caudale / rostrale peut être vu. Le schéma du bas est établi sur la base de la photo du haut. L'image et le schéma ainsi indiquer les lieux de l'B3 I1/I3 neurones moteurs, B6, B9, B10, B38, B39, B43 et B82 6,7 22,23, ainsi que quelques autres neurones. B8a neurones et B8b sont responsables de la plus grande unité sur la RN, et innervent le muscle I4 contrôle de la pince 6,17. Les neurones B4 et B5 sont responsables de la plus grande unité le 18 BN3. Bien que les dimensions et l'emplacement des I1/I3 neurones moteurs sont variables d'un animal to les animaux, les tailles relatives et les lieux sont assez fiables pour la plupart des neurones: B3, B6, B9, B38, B43, B82 et. Voir discussion pour plus de détails sur les I1/I3 neurones moteurs, en particulier certaines des difficultés d'identification unique B10 et B39.
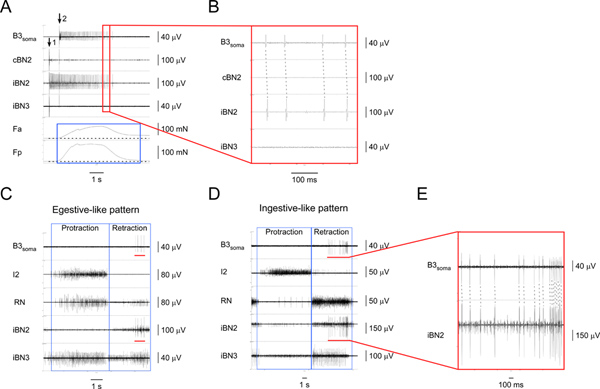
Figure 4. L'identification et la caractérisation des neurones moteurs I1/I3 B3. Une stimulation) extracellulaire de B3 (à flèche 1) et l'enregistrement de la soma B3 (à partir de flèche 2) ainsi que par les nerfs et les régions correspondantes du muscle. De haut en bas, les canaux sont des enregistrements provenant du soma B3, le BN2 controlatéral, la BN2 ipsilatérale, le BN3 ipsilatérale, la force de contraction de la région antérieure du muscle I1/I3, et la force de contraction de la région postérieure de la I1/I3 muscle. Laboîte bleue met en évidence la durée de forces dans les régions antérieures et postérieures du muscle I1/I3. Dans ce cas particulier, la force postérieur est supérieure à la force antérieure. B) vue élargi de la zone délimitée par la boîte rouge dans A1. L'un pour et un potentiel d'action correspondants dans le soma B3 et les canaux iBN2 montrent que les projets B3 seulement sur le BN2 ipsilatérale. C) d'enregistrement extracellulaire du soma B3 et les nerfs dans un schéma moteur egestive-like. D) d'enregistrement extracellulaire de le soma B3 et les nerfs dans un schéma moteur ingestion comparables. En C et D, de haut en bas, les canaux sont des enregistrements provenant du soma B3, le nerf I2, la RN, le BN2 ipsilatéral, et le BN3 ipsilatérale. Les cases bleues indiquent la prolongation et les phases de rétraction des motifs. Les barres rouges dans le canal B3 soma à la fois C et D en évidence le pot d'actionentials enregistré à partir du soma B3. Les barres rouges dans le canal iBN2 à la fois C et D indiquent le moment correspondant lorsque B3 tire dans le BN2 ipsilatérale pendant les schémas moteurs d'alimentation. E) vue élargi de la soma B3 et les iBN2 chaînes marquées par les barres rouges. Les lignes en pointillés représentent l'un-pour-un entre les potentiels d'action dans le soma B3 et les iBN2 canaux. Notez que l'unité BN2 de B3 est la plus grande de toutes les unités. Ainsi, on peut également détecter les unités de BN2 B3 directement à partir des enregistrements BN2 sans enregistrement soma. Cliquez ici pour agrandir la figure .

Figure 5. L'identification et lacaractériser la I1/I3 motoneurone, B43. Une stimulation) extracellulaire de B43 (à flèche 1) et l'enregistrement de sa soma (à partir de flèche 2) ainsi que par les nerfs et les régions correspondantes du muscle. De haut en bas, les canaux sont des enregistrements provenant du soma B43, le BN2 controlatéral, la BN2 ipsilatérale, le BN3 ipsilatérale, la force de contraction de la région antérieure du muscle I1/I3, et la force de contraction de la région postérieure de la I1/I3 muscle. La boîte bleue met en évidence les mesures de force du muscle au cours de I1/I3 B43 activité. Activation B43 génère une petite force postérieure, mais aucune force antérieure. B) vue élargi de la zone délimitée par la boîte rouge dans un. Les lignes en pointillés représentent l'un-pour-un entre les potentiels d'action dans le soma B43 et les iBN2 canaux, ce qui indique que B43 projets sur le BN2 ipsilatéral seulement. C) d'enregistrement extracellulairedu soma B43 et les nerfs dans un schéma moteur egestive-like. D) d'enregistrement extracellulaire du soma B43 et les nerfs dans un schéma moteur ingestion comparables. En C et D, de haut en bas, les canaux sont des enregistrements provenant du soma B43, le nerf I2, la RN, le BN2 ipsilatéral, et le BN3 ipsilatérale. Les cases bleues indiquent la prolongation et les phases de rétraction des motifs. Les barres rouges dans le canal B43 soma à la fois C et D en évidence les potentiels d'action enregistrés à partir du soma B43. Les barres rouges dans le canal iBN2 à la fois C et D indiquent le moment correspondant lorsque B43 est mise à feu dans le BN2 ipsilatéral dans ces modèles. E) vue élargi du soma B43 et les iBN2 canaux marqués par la barre rouge dans D. Les lignes en pointillés montrent la relation un-pour-un entre les potentiels d'action dans le soma B43 et les canaux iBN2. Notez que les BN2 unités de B43 sont petites et très difficile à détecter sans enregistrements soma, mais le feu toujours à la fin du programme moteur BN2, fournissant un autre moyen de les identifier. Notez également que la plus grande unité affichée dans le panneau inférieur dans E est une collision d'une unité B43 soma avec une autre unité extracellulaire. Cliquez ici pour agrandir la figure .

Figure 6. L'arbre optimisé de diagnostic pour identifier quelques-uns des I1/I3 neurones moteurs utilisant soma extracellulaire et enregistrements nerveuses. Cette méthode de diagnostic nécessite un minimum d'informations pour identifier les I1/I3 neurones moteurs, ce qui rend beaucoup plus facile d'identify neurones moteurs de la préparation de la masse buccale suspendu ou in vivo. B3 possède la plus grande unité parmi les BN2 I1/I3 identifiés neurones moteurs. Dans le reste des neurones moteurs, B6 et B9 sont les deux seuls neurones qui se projettent à la fois sur BN2 et BN3. B9 est plus latérale de B6. Le reste des neurones de projection uniquement sur BN2 peut également être divisée en deux groupes. Un groupe de projets neurones bilatéral, par les BN2s, qui comprend B10 et B39 et certains neurones inconnus. L'autre groupe de neurones projette ipsilatérale sur BN2 seulement, qui comprend B38, B43, B82 et. B38 est proche B3 et B9. B82 est proche B8 (voir figure 3). B43 est proche B6. BN2 son unité est petite et éclate à la fin du mode d'alimentation.

Figure 7. Comparaison des taux de réussite de neurone iDENTIFICATION lors des expériences de force en utilisant soit la technique extracellulaire ou intracellulaire de la technique. Avec la configuration même capteur de force, on a fait des expériences 35 utilisant la technique extracellulaire (petits points bleus) et 27 expériences utilisant la technique classique intracellulaire (gros points violets) pour identifier l' I1/I3 neurones moteurs. L'axe des abscisses indique le plus petit nombre de neurones moteurs du muscle I1/I3 qui ont été identifiés dans chaque type d'expérience. L'axe des y indique le taux de réussite en pourcentage de chaque type d'expérience. Par exemple, dans 19 des 35 (54%) des expériences extracellulaires, nous avons pu identifier au moins cinq différentes I1/I3 neurones moteurs. En seulement 1 sur 27 (4%) des expériences intracellulaires, nous avons pu identifier au moins cinq I1/I3 neurones moteurs. Il est clair que le taux de réussite dans l'identification des neurones est beaucoup plus élevé pour un nombre donné de neurones utilisant la technique extracellulaire.
Discussion
Chez les animaux avec de grands neurones identifiés, tels que les mollusques (par exemple, Lymnaea, Helix, et Aplysia), l'analyse des piscines moteur est généralement fait en utilisant un enregistrement intracellulaire 1,2,3,4. Dans ce protocole, nous décrivons un processus pour identifier de manière unique les neurones moteurs pour un parc automobile en utilisant une technique extracellulaire. Nous avons utilisé les mesures de force comme une illustration de ce processus. On pourrait aussi utiliser EMG pour mesurer l'innervation du muscle. En bref, pour ce faire, le protocole doit être modifié pour fixer des électrodes crochet de différentes régions du muscle I1/I3 pour les enregistrements EMG.
La technique extracellulaire présente certains avantages par rapport aux techniques intracellulaires, dont certaines ont déjà été décrites ci-dessus. Tout d'abord, la technique extracellulaire nécessite moins de temps et d'efforts pour préparer les ganglions des expériences et causent moins de dommages aux neurones. Habituellement, cela prendra 20-30 minutes pour préparer le bucganglions cal pour les expériences extracellulaires et environ 1,5 h pour préparer les noyaux buccale qui sont fixés à la masse buccale pour les expériences intracellulaires. Puisque les muscles deviennent moins actifs que le temps passe, la différence de temps entre la préparation des noyaux pour des expériences extracellulaires et intracellulaires ceux pourrait être critique pour le succès des expériences. Figure 7 montre la comparaison des taux de réussite pour identifier les neurones moteurs de la / I1 I3 musculaire en utilisant la technique extracellulaire ou intracellulaire dans les études de la population active. Dans tous les 35 expériences de force extracellulaires (100%), nous avons pu identifier au moins un neurone moteur du muscle I1/I3. Dans 31 des 35 (89%) des expériences extracellulaires, nous avons pu identifier au moins trois I1/I3 neurones moteurs. Dans 19 des 35 (54%) des expériences extracellulaires, nous avons pu identifier au moins cinq différentes I1/I3 neurones moteurs. En revanche, les taux de réussite des expériences intracellulaires avec le samconfiguration e capteur de force étaient plus bas. Dans 23 des 27 (85%) des expériences intracellulaires, nous avons pu identifier au moins un I1/I3 motoneurone. Dans 8 des 27 (30%) des expériences intracellulaires, nous avons pu identifier au moins trois I1/I3 neurones moteurs. En seulement 1 sur 27 (4%) intracellulaires expériences, nous avons pu identifier cinq I1/I3 neurones moteurs. Ainsi, la probabilité d'identifier de multiples neurones dans le ganglion est même plus élevé en utilisant des techniques extracellulaires contrairement aux techniques intracellulaires.
En outre, la technique extracellulaire peuvent accéder à de nombreux neurones des deux côtés de ganglions au cours de la même expérience. Généralement, après dégainage, électrodes intracellulaires ne peut accéder à des neurones du côté du ganglion qui a été desheathed. Par exemple, lorsque l'un des deux ganglions buccale (par exemple le hemiganglion sur le côté gauche) est épinglé côté caudal en place, il sera facile pour les électrodes intracellulaires pour accéder aux neurones sur cecôté du ganglion, par exemple, B6, B9, B10, B39, B43 et, mais difficile d'accéder aux neurones du côté rostral du ganglion, comme B4, B5, B8a, B8b, B38 et B82. En revanche, les électrodes extracellulaires peuvent accéder à plusieurs neurones des deux côtés de la même ganglion buccal avec une rotation appropriée du ganglion. Le degré de rotation est réglable et réversible. Cela augmente également la probabilité d'identifier de multiples neurones dans le ganglion même.
Depuis électrodes extracellulaires sont délicatement pressé sur la gaine recouvrant les neurones, ces électrodes ne sera pas sorti de neurones, ce qui peut créer de gros trous dans la membrane et causer des dommages, comme c'est le cas avec des électrodes intracellulaires lors des mouvements musculaires. La taille du signal varie le déménagement ganglions pendant les mouvements musculaires. Notez que, parfois, lors des mouvements musculaires importants, les signaux extracellulaires enregistrement soma sera diminué ou même perdus. Cependant, nous pouvons facilement move de la contre-électrode extracellulaire sur le neurone et de récupérer les signaux originaux. Il est donc possible d'appliquer la technique à la préparation extracellulaire masse buccale suspendu 8 pour les études comportementales, au cours de laquelle les muscles génèrent des contractions importantes que la préparation génère différentes réponses comportementales. Par exemple, dans 47 des 48 suspendus expériences de masse buccale (98%), nous avons pu identifier au moins un neurone moteur du muscle I1/I3. Dans 23 des 48 (48%) suspendus expériences de masse buccale, nous avons pu identifier au moins trois I1/I3 neurones moteurs. Dans 11 des 48 (23%) suspendus expériences de masse buccale, nous avons pu identifier au moins cinq neurones moteurs du muscle pour I1/I3 et d'enregistrer les cours schémas moteurs comme la masse buccale effectuait alimentation comportements de type. La technique extracellulaire est également applicable à d'autres plus complexes semi-intactes préparations, telles que les préparations isolées d'alimentation de tête qui incluent til tentacules, les lèvres, les mâchoires, la masse buccale, les ganglions buccaux, et le ganglion cérébral 12,24,25,26. Depuis l'entrée sensorielle est très important pour susciter les comportements alimentaires dans ces préparations, la technique extracellulaire sera particulièrement utile en raison de sa simplicité et de fonctionnalités moins dommageables. Des études antérieures montrent également qu'il est possible d'identifier et d'enregistrer B4/B5 chronique in vivo 18. Dans ces expériences antérieures, les chercheurs ont utilisé un faible courant (10-20 mA) BN2-une stimulation pour activer sélectivement B4/B5 et collé un tube de polyéthylène court à la gaine au-dessus B4/B5 pour l'enregistrement, dans lequel ont été insérés une paire torsadée les fils en acier inoxydable. Ainsi, il est également possible d'identifier et d'enregistrer à partir de neurones moteurs in vivo en utilisant l'électrode de tube de polyéthylène qui est collé sur la gaine recouvrant les ganglions (Chestek et Chiel, résultats non publiés).
La technique extracellulaire a aussi une certaine limitations. Tout d'abord, il sera difficile pour les électrodes extracellulaires de stimuler ou d'enregistrer des neurones qui sont trop petites ou trop profondément dans le ganglion. Notez qu'il est toujours possible d'activer les neurones qui ne sont pas à la surface via la stimulation extracellulaire. Cependant, notre modèle 5 a montré que la stimulation peut perdre la spécificité lorsque le neurone cible est plus profond que les neurones voisins. Lorsque le neurone est plus profonde, la distance électrode-à-soma sera plus grande et un courant plus élevé sera nécessaire pour activer ce neurone, qui peut être suffisamment élevée pour activer les neurones de surface d'autres à proximité. Deuxièmement, si un neurone est stimulé extracellulaire avec trop de courant, il peut être endommagé et ne répondent plus, les courants beaucoup plus petits sont utilisés dans la stimulation intracellulaire, bien trop de courant intracellulaire peut également endommager les neurones. Parfois, l'enregistrement soma comprendra plusieurs unités à la fois du neurone cible et les neurones adjacents, ce qui est moins spécifique que intracellulairelume d'enregistrement. En outre, il peut être plus difficile à contrôler avec précision et de contrôler la fréquence de tir d'un neurone individuel en utilisant le extracellulaire plutôt que la technique intracellulaire, parce que l'électrode extracellulaire ne peut pas stimuler et d'enregistrer simultanément le même neurone. En outre, la technique extracellulaire ne sera pas en mesure d'enregistrer l'entrée synaptique des neurones prémotrices. En outre, il peut être difficile d'appliquer neurotransmetteurs par ionophorèse à un neurone spécifique, sauf si le ganglion est desheathed, même si nous avons montré qu'il est possible de stimuler un ganglion à l'aide carbachol sans enlever la gaine 27.
Les limites des techniques d'identification extracellulaires fait quelques neurones dans la piscine du moteur difficile à identifier. Dans cet exemple particulier, la technique extracellulaire identifiés de façon fiable la plupart des neurones moteurs du muscle pour I1/I3 chez l'aplysie: B3, B6, B9, B38, B43, B82 et, sur la base on la taille et l'emplacement soma, la projection nerveuse, et l'innervation musculaire. Cependant, nous n'avons pas été en mesure d'identifier de manière fiable B10 et B39. Les travaux antérieurs ont montré que 6,7 intracellulaire B10 et B39 sont deux neurones adjacents sur le côté caudal du ganglion buccal, entre la région et la région B4/B5 B6. Les deux neurones projettent bilatéralement sur les BN2s. B10 innerve la région moyenne et postérieure du muscle I1/I3, alors B39 innerve la région antérieure du muscle I1/I3. Sur la base de l'emplacement soma et critères de projection nerveuses, nous avons trouvé plus de deux neurones moteurs qui projettent bilatéralement sur le BN2s dans quatre expériences différentes. Depuis leur emplacement soma, innervations musculaires, et le calendrier de l'activité au cours de patrons moteurs étaient variables d'un animal à animal, nous ne savions pas s'ils étaient les mêmes neurones. Ainsi, nous n'avons pas pu identifier de manière fiable B10 et B39 en utilisant la technique extracellulaire en raison du manque de cohérence. Pour les identifier de façon unique,nous devons faire une étude plus approfondie des neurones dans les ganglions buccaux, et peut-être besoin d'autres critères, tels que l'entrée synaptique de neurones prémoteur B4/B5, et les réponses aux émetteurs, qui exigent des techniques intracellulaires.
Avec les modifications appropriées, cette technique est également applicable à d'autres piscines du moteur, par exemple, le muscle I5 10, le muscle I2 11, et le muscle I4 12 dans l'aplysie ou à d'autres systèmes, par exemple Lymnaea stagnalis 2, Helix pomatia 3, cafard 13, et poisson-zèbre 14. Par exemple, si l'on veut appliquer cette technique pour les neurones moteurs pour le muscle I5 (également connu sous le nom radular accessoire muscle de fermeture ou de l'ARC 10,28) chez l'aplysie, il faut garder les BN3s attachés à la masse buccale au lieu de les BN2s , parce que les neurones moteurs B15 et B16 I5 projet sur le ipsilatérale BN3 6,7. Alors til masse buccale doit être prêt à exposer le muscle I5 pour EMG ou études sur la population. Après les neurones ont été identifiés de façon fiable dans la préparation réduite, un procédé optimisé de diagnostic pourrait également être créée pour les futures études comportementales.
La technique que nous avons décrite se compare favorablement à d'autres techniques extracellulaires tels que des tableaux multi-électrodes et les colorants sensibles au voltage. La tension de colorant sensible à la technique 29 est uniquement utilisée pour l'enregistrement, tandis que les électrodes extracellulaires et des matrices d'électrodes multi-30 peut être utilisé à la fois pour la stimulation et l'enregistrement. Tant le tableau multi-électrode 29 et la tension de colorants sensibles 30 peut enregistrer les signaux provenant simultanément de nombreux neurones. Même si une seule électrode extracellulaire ne peut enregistrer à partir d'un ou deux neurones en fonction de sa taille et de l'emplacement de la pointe d'électrode, il est certainement possible de positionner plusieurs sur un ganglion simultanément, et nous avons faitce succès. La norme in vitro réseau d'électrodes multiples dispose de 8 x 8 ou 6 x 10 électrodes 29. Étant donné que les électrodes sont réparties uniformément dans l'ensemble, il est souvent difficile de déterminer l'identité des neurones sous-jacents dont les enregistrements sont obtenus, étant donné que les neurones ne sont pas uniformément réparties, et d'importants post-traitement des signaux, dont certains sont encore manuel, doit être fait pour résoudre cette ambiguïté. En revanche, puisque les électrodes sont positionnées sur extracellulaires somata unique, l'identité du neurone sous-jacente est claire. Ainsi, il semble que les tableaux multi-électrodes et les colorants sensibles au voltage peut être plus efficace pour plusieurs enregistrements simultanés. Toutefois, notre technique électrode extracellulaire peut fournir une meilleure sélectivité pour la stimulation et l'enregistrement.
Déclarations de divulgation
Nous n'avons rien à déclarer.
Remerciements
Cette recherche a été financée par le NIH et la NSF subvention NS047073 subvention DMS1010434.
matériels
| Name | Company | Catalog Number | Comments |
| Nom | Entreprise | Numéro de catalogue | Commentaires |
| De chlorure de sodium | Fisher Scientific | S671 | Biologique, certifié |
| Le chlorure de potassium | Fisher Scientific | P217 | Certifié ACS |
| Chlorure de magnésium hexahydraté | Acros Organics | 19753 | 99% |
| Sulfate de magnésium heptahydraté | Fisher Scientific | M63 | Certifié ACS |
| Chlorure de calcium dihydraté | Fisher Scientifique | C79 | Certifié ACS |
| Le glucose (dextrose) | Sigma-Aldrich | G7528 | BioXtra |
| MOPS Buffer | Acros Organics | 17263 | 99% |
| Carbachol | Acros Organics | 10824 | 99% |
| L'hydroxyde de sodium | Fisher Scientific | SS255 | Agréé |
| Acide chlorhydrique | Fisher Scientific | SA49 | Agréé |
| Seul canon capillaire en verre | Systèmes AM | 6150 | |
| Flaming-Brown micropipette extracteur modèle P-80/PC | Sutter Instruments | Incandescence: FT345B | |
| Émail fil revêtu d'acier inoxydable | Californie Fine Wire | 0.001D, revêtement h | |
| Des ménages Silicone II Colle | GE | ||
| Duro-Gel colle rapide | Henkel corp. | ||
| AM amplificateur Systems Modèle 1700 | Systèmes AM | Les paramètres de filtre: 10-500 Hz pour le nerf I2 / muscle; 300-500 Hz pour tous les autres nerfs | |
| Pulsemaster Multi-Channel Stimulator | World Precision Instruments | A300 | |
| Isolateur de stimulation | World Precision Instruments | A360 | |
| X AxoGraph | AxoGraph scientifique | Logiciel pour les enregistrements | |
| Broches du connecteur Or | Bulgin | SA3148 / 1 | |
| Gold Connector Sockets | Bulgin | SA3149 / 1 | |
| Elastomère silicone Sylgard 184 | Dow Corning | ||
| Boîte de 100 x 15 mm cristalliser | Pyrex | ||
| Graisse à vide élevé | Dow Corning | ||
| Conseils Pipet | Fisher Scientific | 21-375D | |
| Pins minuties | Outils Fine Science | 26002-10 | |
| Pâte à modeler | Sargent Art | 22-4400 | |
| Chuchoter pompe à air | Tetra | 77849 | |
| Tuyau d'aquarium | Eheim | 7783 | 12/16 mm |
| Elite Diffuseur | Hagen | A962 | |
| Vannas Ciseaux Spring | Outils Fine Science | 15000-08 | |
| Dumont # 5 pinces fines | Fin SciencOutils électroniques | 11254-20 | |
| Kimwipes | Kimberly-Clark | 34155 |
Références
- McCrohan, C. R., Benjamin, P. R. Synaptic relationships of the cerebral giant cells with motoneurones in the feeding system of Lymnaea stagnalis. J. Exp. Biol. 85, 169-186 (1980).
- Benjamin, P. R., Rose, R. M. Central generation of bursting in the feeding system of the snail, Lymnaea stagnalis. J. Exp. Biol. 80, 93-118 (1979).
- Peters, M., Altrup, U. Motor organization in pharynx of Helix pomatia. J. Neurophysiol. 52 (3), 389-409 (1984).
- Church, P. J., Cohen, K. P., Scott, M. L., Kirk, M. D. Peptidergic motoneurons in the buccal ganglia of Aplysia californica: immunocytochemical, morphological, and physiological characterizations. J. Comp. Physiol. A. 168 (3), 323-336 (1991).
- Lu, H., Chestek, C. A., Shaw, K. M., Chiel, H. J. Selective extracellular stimulation of individual neurons in ganglia. J. Neural. Eng. 5 (3), 287-309 (2008).
- Church, P. J., Lloyd, P. E. Expression of diverse neuropeptide cotransmitters by identified motor neurons in Aplysia. J. Neurosci. 11 (3), 618-625 (1991).
- Church, P. J., Lloyd, P. E. Activity of multiple identified motor neurons recorded intracellularly during evoked feedinglike motor programs in Aplysia. J. Neurophys. 72 (4), 1794-1809 (1994).
- McManus, J. M., Lu, H., Chiel, H. J. An In Vitro Preparation for Eliciting and Recording Feeding Motor Programs with Physiological Movements in Aplysia californica. J. Vis. Exp. (70), e4320(2012).
- Cullins, M. J., Chiel, H. J. Electrode fabrication and implantation in Aplysia californica for multi-channel neural and muscular recordings in intact, freely behaving animals. J Vis. Exp. (40), e1791(2010).
- Zhurov, Y., Weiss, K. R., Brezina, V. Tight or loose coupling between components of the feeding neuromusculature of Aplysia. J. Neurophysiol. 94 (1), 531-549 (2005).
- Hurwitz, I., Goldstein, R. S., Susswein, A. J. Compartmentalization of pattern-initiation and motor functions in the B31 and B32 neurons of the buccal ganglia of Aplysia californica. J. Neurophysiol. 71 (4), 1514-1527 (1994).
- Morton, D. W., Chiel, H. J. The timing of activity in motor neurons that produce radula movements distinguishes ingestion from rejection in Aplysia. J. Comp. Physiol. A. 173 (5), 519-536 (1993).
- Iles, J. F. Structure and synaptic activation of the fast coxal depressor motoneurone of the cockroach. Periplaneta americana. J. Exp. Biol. 56 (3), 647-656 (1972).
- Westerfield, M., McMurray, J. V., Eisen, J. S. Identified motoneurons and their innervation of axial muscles in the zebrafish. J. Neurosci. 6 (8), 2267-2277 (1986).
- Susswein, A. J., Rosen, S. C., Gapon, S., Kupfermann, I. Characterization of buccal motor programs elicited by a cholinergic agonist applied to the cerebral ganglion of Aplysia californica. J. Comp. Physiol. A. 179 (4), 509-524 (1996).
- Hurwitz, I., Neustadter, D., Morton, D. W., Chiel, H. J., Susswein, A. J. Activity patterns of the B31/B32 pattern initiators innervating the I2 muscle of the buccal mass during normal feeding movements in Aplysia californica. J. Neurophys. 75 (4), 1309-1326 (1996).
- Morton, D. W., Chiel, H. J. In vivo buccal nerve activity that distinguishes ingestion from rejection can be used to predict behavioral transitions in Aplysia. J. Comp. Physiol. A. 172 (1), 17-32 (1993).
- Warman, E. N., Chiel, H. J. A new technique for chronic single-unit extracellular recording in freely behaving animals using pipette electrodes. J. Neurosci. Methods. 57 (2), 161-169 (1995).
- Nargeot, R. N., Baxter, D. A., Byrne, J. H. Contingent-dependent enhancement of rhythmic motor patterns: an in vitro analog of operant conditioning. J. Neurosci. 17 (21), 8093-8105 (1997).
- Kandel, E. R. Behavioral biology of Aplysia. , Freeman. San Francisco. (1979).
- Scott, M. L., Govind, C. K., Kirk, M. D. Neuromuscular organization of the buccal system in Aplysia californica. J. Comp. Neurol. 312 (2), 207-222 (1991).
- Rosen, S. C., Miller, M. W., Cropper, E. C., Kupfermann, I. Outputs of radula mechanoafferent neurons in Aplysia are modulated by motor neurons, interneurons, and sensory neurons. J. Neurophysiol. 83 (3), 1621-1636 (2000).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83 (3), 1605-1620 (2000).
- Weiss, K. R., Chiel, H. J., Koch, U., Kupfermann, I. Activity of an identified histaminergic neuron, and its possible role in arousal of feeding behavior in semi-intact Aplysia. J. Neurosci. 6 (8), 2403-2415 (1986).
- Rosen, S. C., Teyke, T., Miller, M. W., Weiss, K. R., Kupfermann, I. Identification and characterization of cerebral-to-buccal interneurons implicated in the control of motor programs associated with feeding in Aplysia. J. Neurosci. 11 (11), 3630-3655 (1991).
- Jing, J., Weiss, K. R. Generation of variants of a motor act in a modular and hierarchical motor network. Curr. Biol. 15 (19), 1712-1721 (2005).
- Azizi, F., Lu, H., Chiel, H. J., Mastrangelo, C. H. Chemical neurostimulation using pulse code modulation (PCM) microfluidic chips. J. Neurosci. Methods. 192 (2), 193-198 (2010).
- Zhurov, Y., Proekt, A., Weiss, K. R., Brezina, V. Changes of internal state are expressed in coherent shifts of neuromuscular activity in Aplysia feeding behavior. J. Neurosci. 25 (5), 1268-1280 (2005).
- Baker, B. J., Kosmidis, E. K., Vucinic, D., Falk, C. X., Cohen, L. B., Djurisic, M., Zecevic, D. Imaging brain activity with voltage- and calcium-sensitive dyes. Cell. Mol. Neurobiol. 25 (2), 245-282 (2005).
- Fejtl, M., Stett, A., Nisch, W., Boven, K. -H., Möller, A. On Micro-Electrode Array Revival. Advances in Network Electrophysiology Using Multi-Electrode Arrays. Baudry, M., Taketani, M. , Springer Press. New York. 24-37 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon