Method Article
Пространственно-временные манипуляции малых активность ГТФ на субклеточном уровне, и на шкале времени секунды в живых клетках
В этой статье
Резюме
Метод пространственно-временной контроль деятельности малого ГТФ света описывается. Этот метод основан на рапамицин вызванных FKBP-FRB гетеродимеризации и фото-останов системы. Оптимизация светового облучения позволяет пространственно-временном управлять активацией малых ГТФаз на субклеточном уровне.
Аннотация
Динамическое регулирование семьи Ро малого triphosphatases гуанозин (GTPases) с большой пространственно-временной точностью имеет важное значение для различных клеточных функций и мероприятий 1, 2. Их spatiotemporally динамичный характер был выявлен по визуализации их деятельности и локализации в реальном времени 3. Для того чтобы получить более глубокое понимание их роли в различных клеточных функций на молекулярном уровне, то следующим шагом должно быть возмущение белка деятельность в точном внутриклеточной локализации и времени.
Для достижения этой цели мы разработали метод светоиндуцированного, пространственно-временное контролируемое активации малых ГТФаз путем объединения двух методов: (1) рапамицин вызванных FKBP-FRB гетеродимеризации и (2) фото-останов метод рапамицина. С помощью рапамицина опосредованного FKBP-FRB гетеродимеризации, мы разработали метод быстрого индуцибельной активации или инактивации малых ГТФаз includiнг Rac 4, Cdc42 4 RhoA 4 и Рас-5, в котором рапамицин вызывает перемещение FKBP слившихся GTPases или их активаторов, к мембране, где ФРС на якорь. В связи с этим гетеродимеризации системы, мы также разработали фото-останов системы рапамицина аналогов. Фото-клетках соединение маленькие молекулы, чья деятельность подавляется с photocleavable защиты группы, известной как удерживание группы. Для подавления гетеродимеризации деятельность полностью, мы разработали в клетке рапамицина, которые привязаны к макромолекуле такие, что в результате большого комплекса не может пересечь плазматической мембраны, что приводит к практически без фоновой активности в качестве химического dimerizer внутри клеток 6. На рисунке 1 показана схема нашей системы. Благодаря сочетанию этих двух систем, мы набранных на местах Rac активатора плазматической мембраны на шкале времени в секундах и достигли светоиндуцированного Rac активации на субклеточном левэль-6.
протокол
1. Трансфекция ДНК плазмиды
- Добавить плазмидных ДНК, 0,5 мкг мембранного привязанные ФРБ (далее LDR) и 0,5 мкг FKBP-Tiam1 (Т-клеточной лимфомы вторжения и метастаза вызывающие белок 1: Rac активатор) помечены флуоресцентным белком до 37,5 мкл дН 2 O. Добавить 1 мкл FuGENE HD.
- Vortex и инкубировать при комнатной температуре в течение 20 минут. Между тем, приступить к шаги 1.3-1.8.
- Промыть каждую лунку 8-и камеру с 50 мкл поли-D-лизина.
- Вымойте центр каждой лунки с дН 2 O.
- Trypsinize 80-85% сливной NIH-3T3 клеток и развести до 10 мл питательной среды (DMEM с 10% FBS).
- Удалить 375 мкл суспензии и центрифуги при 1750 оборотов в минуту в течение 3 минут.
- Аспирируйте средствах массовой информации, стараясь не нарушать гранул.
- Добавить 750 мкл DMEM Вт / 10% FBS и ресуспендируют.
- Добавить клеточной суспензии для дН 2 O / ДНК / FuGENE HD решение и аккуратно перемешать.
- Добавьте 250мкл клеточной ДНК / подвески в каждую лунку (заполнить до 3-х скважин).
- Инкубируйте трансфицированных клеток при 37 ° С и 5% СО 2 в течение 15-18 часов.
2. Подготовка CRB-решения
- Обобщить клетке рапамицин-биотин аддукт (CRB). См. "Синтетические схемы сгь" для подробностей. Короче говоря, останов и биотин фрагментов готовят отдельно. Останов часть является то, конъюгированных с рапамицин (LC лаборатории), продукт в дальнейшем связан с остатком биотина на средства клик реакция 7 позволить себе CRB.
- Подготовить 1 мкМ фондовый решение сгь в ДМСО.
- Растворите 1 мг авидин в 250 мкл PBS в 0,5 мл трубки Эппендорф.
- Добавить 1 мкл исходного раствора сгь для растворения авидин. Смешайте путем обращения в несколько раз.
- Инкубируйте при комнатной температуре в течение 15 минут, чтобы дать CRB-авидин сопряжены (CRB-) Решение.
- Исключить несвязанных малых молекул и очистить CRB-помощью гель-колонки.
3. Микроскопии и свет Освещение на субклеточном уровне
- Сыворотка голодать трансфицированных клеток в DMEM без FBS в течение 12 часов.
- Осторожно аспирации средства массовой информации от клетки и добавить 250 мкл подготовленного 400 нм CRB-решения (начиная с шага 2.6).
- Для визуализации динамики белков в живых клетках в субклеточных разрешение до и после лечения свет, вращение диска микроскопии (рис. 2а). УФ-освещенности достигается за счет сочетания оптики УФ-светодиодной (365 нм) с эпи-флуоресценции (рис. 2б).
- Метаморфизма программное обеспечение было использовано для захвата изображений флуоресценции трансфицированных клеток каждые 15 секунд.
- Определить координаты и размеры освещение места с помощью стеклянной пластинки покрыта флуоресцентными красителями возбуждается ультрафиолетовым светом. Размер можетбыть изменены путем применения объектива с различными увеличениями и выбрав оптического волокна с различными размерами ядра.
- После определения фонового уровня мембранного ероша, свет УФ облучение на периферии клетки. Следующие два шага, чтобы противопоставить предшествующий локализованных эффектов.
- Глобально облучение клеток с 365 нм свет обеспечивается ртутной лампы.
- Растворите uncaged, таким образом, первоначальный рапамицина в ДМСО, а затем в ФСБ (400 нМ финал), и добавьте решение изображения камеры, чтобы вызвать глобальные последствия.
4. Представитель Результаты
В качестве примера представитель результатов показано на рисунке 3. УФ-облучения светом в малой области вблизи сотовых края быстро индуцированного образования локализованных оборками и только у облученных области. Чтобы убедиться, что это действительно местное деятельности, то мы глобально облученных клеток с УФ, или добавлять рапамицин с объемной информации, как беч индуцированного формирования глобальной раздражение всей мембране. Для количественного анализа, мы разделили клетки-мишени на четыре квадранта, и рассчитывали частоту ряби формирование в каждом секторе на местном, так и после глобального стимулирования в различных условиях, в том числе управления (рис. 4). Только такое сочетание УФ-облучения, CRB-и соответствующие FKBP-FRB конструкции, вызывает местное рассердило.

Рисунок 1. Схема пространственно ограниченных белка в клетке димеризации использования рапамицина-авидин сопряжены (CRB-A) и ультрафиолетового излучения. УФ-облучение расщепляет линкер между рапамицина и биотин, что приводит к высвобождению химических dimerizer (HE-Рапа, C40-O-(2-гидроксиэтил) рапамицин), и его побочных продуктов. Выпустила dimerizer затем диффундирует в клетки и вызывает димеризации между FKBP-POI (белок) и плазменных коррRane якорь ФРБ только в непосредственной близости от области облучения (синий круг). Без УФ-облучения, FKBP и ФРС не связывают (красный крест), следовательно, производить никакого эффекта. (Copyright @ ACS2011) 6

Рисунок 2. Изображение настроенных конфокальной флуоресцентной микроскопии. (А) Фронтальный вид на конфокальной микроскопии (в виде перевернутой Axiovert 200, Zeiss). (Б) Крупный план, вид сверху соединительное устройство для РПИ флуоресценции и ультрафиолетового освещения.
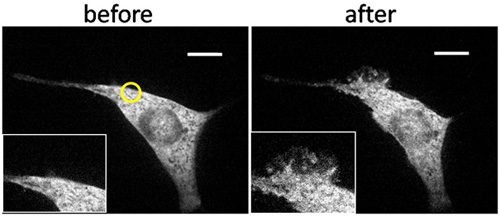
Рисунок 3. Пространственно ограничивается рябить образования в трансфицированных NIH3T3 клетки индуцированные локализованных УФ-облучения. Конфокальной флуоресцентной изображения NIH3T3 клетки фибробластов, которые трансфицированных YFP с метками FKBP-Tiam1 (Rac активатор) и LDR (мембраны закреплены ФРС) подверглись облучению в ограниченном пространстве вблизи ее края с LED свет при 365 нм в течение 15 секунд, начиная с 210 сек при наличии CRB-сопряженных в объеме средств массовой информации. Это обращение последовало глобальное освещение с ртутной лампой в течение 1 сек на 1063 секунд и глобальных добавление рапамицина окончательной 400 Нм при 1560 сек. Клеток показали, почти не шевелил деятельность в начале (а), но показал, пространственно ограниченных ероша после локализованного освещения (желтый круг) (б). Клеток показали глобальное образование раздражение после глобального освещения и добавление рапамицина (CD), что указывает на формирование местных раздражение было вызвано пространственно ограниченных активации Rac. Шкала бар: 10 мкм. (Copyright @ ACS2011) 6
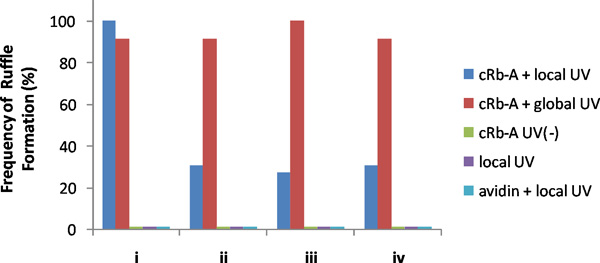
Рисунок 4. Частота рябить образование в квадрантах трансфицированных NIH3T3 клеток. Местное УФ-излучение с CRB-и следующие глобальные УФ-облучения были выполнены на 13 клеток. CRB- дополнение (без УФ-облучение), локальное облучение УФ-с или без авидин было реализовано на 13, 5 и 6 ячеек, соответственно. Ни один из наблюдаемых клеток показали, раздражение образование с CRB-без УФ-облучение или локальном облучении УФ-с или без авидин в объеме средств массовой информации. Мы собрали данные из клеток с низким формирование ряби фона, но имели возможность рапамицина вызванных рябить образование, которое мы проверяли после каждого эксперимента, подтверждающие формирование глобальной рябить в результате того рапамицина (конечная 400 нм). Эти результаты показали, что CRB-и локального облучения УФ необходимые для формирования местных рябить в клетках. (Copyright @ ACS2011) 6
Сокращения:
FKBP: FK506-связывающий белок
ФРБ: FKBP-рапамицин-связывающий белок
Tiam1: Т-клеточная лимфома вторжения и метастаза вызывающие белок 1 (Rac ГЭФ)
LDR: Лин-DSAG компоновщика-FRB (Lyn: N-концевых 11 аминокислот из Лин-киназы)
HE-Рапа: C40-O - (2-гидроксиэтил) рапамицина
сгь: в клетке рапамицин с остатком биотина
CRB-: сгь сопряженных с авидином
Обсуждение
Мы описали технику, которая использует новые соединения в клетках вместе с FKBP-FRB гетеродимеризации системы для того, чтобы манипулировать Rho ГТФ деятельность в точном внутриклеточной локализации на временной шкале в секундах.
Существуют три ограничения данного подхода. Во-первых, потому, что метод основан на предотвращение или разрешение диффузии dimerizer через плазматическую мембрану, цель сотовой место должно быть мембране или его окрестностях. Дальнейшая оптимизация химической структуры сгь может разрешить соединения проникать в клетки, не вызывая димеризацию до облучения светом. С таким dimerizer, мы могли бы в теории управления деятельностью сигнальных молекул в любом месте внутри клетки. Во-вторых, молекулярная диффузия химических dimerizers, FKBP-FRB димеризацию комплекса, или активированный эндогенных сигнальных молекул может существенно повлиять на точное удержание желаемых результатов. Этот эффект особенно заметенна более поздних моментов времени и зависит от параметров, связанных с УФ-облучения (например, ширины пучка, энергия и луч режим (непрерывный по сравнению с импульсным)) и коэффициенты диффузии соединений, участвующих. Дальнейшие эмпирические оптимизации этих параметров позволяет более жесткие удержания сигнала деятельности. В-третьих, ультрафиолетовый свет обладает нетривиальными фототоксичности к клеткам. Один из простых способов улучшения этой проблемы является использование большей длиной волны, таких как 405 нм до выпускать из клетки нитробензиловый группы останов. Двухфотонного освещения для подсветки uncaging позволяет в еще большей длиной волны, а также на крайне локализованной области клеток. В последнее время другие исследователи сообщили элегантный подход к активации Rac на субклеточном местоположение с помощью светочувствительных белков растений 8-11. До сих пор его применение ограничено только несколько белков. По сравнению с их стратегиями, наши нынешние техника более легко адаптироваться к увеличению числа белков-мишеней без обширной и тимне много реорганизации. Мы и другие уже разработали различные димеризации зондов, которые могут управлять деятельностью различных сигнальных молекул в мембране 5, 6, 12-14. Spatiotemporally динамических клеточных событий в настоящее время непосредственно проверяемым.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Это исследование было поддержано НИЗ финансирования научных исследований (DK090868 и GM092930 ТИ). Существует в ожидании патента на клетке рапамицин аналог.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / оборудование | Компания | Номер по каталогу | |
| Рапамицина | Tecoland | RAPA99 | |
| FuGENE HD | Roche | 04709691001 | |
| Авидин | Сигма | A9275-10мг | |
| ДМСО | Сигма | D2650-5X5ML | |
| Гель-колонки | GE Healthcare | Спин Trap G-25 | |
| С прозрачным дном 8-и камера | Thermo Scientific | 12-565-47 | |
| Перевернутый флуоресцентный микроскоп | Zeiss | Axiovert200M | |
| УФ-светодиодный источник света | Рапп Opto Electronics | UVILED | |
| Конфокальной вращающийся диск | Корпорация Yokogawa Electric | CSU10 | |
| CCD камеры | Hamamatsu Photonics | ORCA-ER | |
| Объектив 100x | Zeiss | План Apochromat |
Синтетическая схема CRB (Copyright ACS2011) 6

Синтетические условиям: (а) BnBr, K 2 CO 3, DMF (б) f.HNO 3 АсОН (с) ТФК (г) пропаргил-Br, K 2 CO 3, DMF, (д), глицерин, кот. PTSA, толуол (е) NaBH 3 CN, TiCl 4, MeCN (г) Т 2 O, пиридин (H) метанол HCl, (я) LiAlH 4, ТГФ (к) TsCl, пиридин, CH 2 Cl 2 (к) NaN 3, DMF (л) 8, 2,6-ди-трет-butylpyridine, CH 2 Cl 2 (м) 13, CuSO 4, аскорбиновая кислота, 2-пропанол, H 2 O, CH 2 Cl 2.
Ссылки
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420, 629-635 (2002).
- Takai, Y., Sasaki, T., Matozaki, T. Small GTP-binding proteins. Physiol. Rev. 81, 153-208 (2001).
- Kiyokawa, E., Aoki, K., Nakamura, T., Matsuda, M. Spatiotemporal regulation of small GTPases as revealed by probes based on the principle of Forster Resonance Energy Transfer (FRET): Implications for signaling and pharmacology. Annu. Rev. Pharmacol. Toxicol. 51, 337-358 (2011).
- Inoue, T., Heo, W. D., Grimley, J. S., Wandless, T. J., Meyer, T. An inducible translocation strategy to rapidly activate and inhibit small GTPase signaling pathways. Nat. Methods. 2, 415-418 (2005).
- Komatsu, T. Organelle-specific, rapid induction of molecular activities and membrane tethering. Nat. Methods. 7, 206-208 (2010).
- Umeda, N., Ueno, T., Pohlmeyer, C., Nagano, T., Inoue, T. A photocleavable rapamycin conjugate for spatiotemporal control of small GTPase activity. J. Am .Chem. Soc. 133, 12-14 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. Engl. 40, 2004-2021 (2001).
- Kennedy, M. J. Rapid blue-light-mediated induction of protein interactions in living cells. Nat. Methods. 7, 973-975 (2010).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461, 997-1001 (2009).
- Wu, Y. I. A genetically encoded photoactivatable Rac controls the motility of living cells. Nature. 461, 104-108 (2009).
- Yazawa, M., Sadaghiani, A. M., Hsueh, B., Dolmetsch, R. E. Induction of protein-protein interactions in live cells using light. Nat. Biotechnol. 27, 941-945 (2009).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem. Rev. 110, 3315-3336 (2010).
- Suh, B. C., Inoue, T., Meyer, T., Hille, B. Rapid chemically induced changes of PtdIns(4,5)P2 gate KCNQ ion channels. Science. 314, 1454-1457 (2006).
- Varnai, P., Thyagarajan, B., Rohacs, T., Balla, T. Rapidly inducible changes in phosphatidylinositol 4,5-bisphosphate levels influence multiple regulatory functions of the lipid in intact living cells. J. Cell. Biol. 175, 377-382 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены