Method Article
Räumlich-zeitliche Manipulation kleiner GTPase-Aktivität in subzellulären Ebene und auf Zeitskala von Sekunden in lebenden Zellen
In diesem Artikel
Zusammenfassung
Verfahren zum räumlichen-zeitlichen Steuerung der GTPase-Aktivität durch Licht beschrieben. Dieses Verfahren basiert auf Rapamycin-FKBP-induzierte FRB Heterodimerisierung und Foto einschließende Systeme. Optimierung der Licht-Bestrahlung ermöglicht die raum-zeitlich kontrollierte Aktivierung der kleinen GTPasen auf subzellulärer Ebene.
Zusammenfassung
Dynamischen Regulation der Rho-Familie kleiner Guanosin Triphosphatasen (GTPasen) mit großer Präzision raumzeitlichen ist essentiell für verschiedene zelluläre Funktionen und Ereignisse 1, 2. Ihre raumzeitlich dynamische Natur wurde durch Visualisierung der ihre Aktivität und Lokalisierung in Echtzeit 3 enthüllt worden. Um ein tieferes Verständnis ihrer Rollen in diversen zellulären Funktionen auf molekularer Ebene zu gewinnen, sollte der nächste Schritt Störung der Protein-Aktivitäten sein, an einer präzisen subzelluläre Ort und Zeitpunkt.
(1) Rapamycin-FKBP-induzierte FRB Heterodimerisierung und (2) ein Foto einschließende Verfahren Rapamycin: Um dieses Ziel zu erreichen, haben wir ein Verfahren zur lichtinduzierten, räumlich-zeitlich kontrollierte Aktivierung der kleinen GTPasen durch Kombinieren von zwei Techniken entwickelt. Mit der Verwendung von Rapamycin-FKBP-vermittelte Heterodimerisierung FRB, haben wir ein Verfahren zur schnellen induzierbare Aktivierung oder Inaktivierung der kleinen GTPasen includi entwickeltng Rac 4, Cdc42 4, RhoA 4 und Ras 5, bei dem Rapamycin induziert Translokation von FKBP-kondensierten GTPasen, oder deren Aktivatoren, der Plasmamembran, wo FRB verankert ist. Für die Kopplung mit diesem Heterodimerisierung System haben wir auch ein Foto-Käfighaltung von Rapamycin-Analoga-System entwickelt. Ein Foto-caged Verbindung ist ein kleines Molekül, dessen Aktivität mit einem photospaltbaren Schutzgruppe als Käfighaltung Gruppe bekannt unterdrückt. Um Heterodimerisierung Aktivität vollständig zu unterdrücken, haben wir ein Käfig Rapamycin, die an ein Makromolekül, so dass die daraus resultierende große Komplex kann nicht über die Plasmamembran gebunden wird, was zu praktisch ohne Hintergrund-Aktivität als eine chemische Dimerisierer innerhalb der Zellen 6. Abbildung 1 zeigt ein Schema unserer System. Mit der Kombination dieser beiden Systeme haben wir vor Ort rekrutierten eine RAC-Aktivator zur Plasmamembran auf einer Zeitskala von Sekunden und erreicht durch Licht induzierten Rac-Aktivierung an der subzellulären levEL 6.
Protokoll
1. Die Transfektion von Plasmid-DNA
- In Plasmid-DNA, 0,5 ug Membran-gebundenen FRB (nachstehend bezeichnet LDR) und 0,5 ug FKBP-TIAM1 (T-Zell-Lymphom Invasion und Metastasierung-induzierenden Proteins 1: Rac Aktivator) mit fluoreszierendem Protein auf 37,5 ul dH 2 O markiert Fügen Sie 1 ul FuGENE HD.
- Vortex und Inkubation bei Raumtemperatur für 20 Minuten. Inzwischen, um Schritte von 1,3 bis 1,8 gehen.
- Waschen Sie jede Vertiefung eines 8-Well-Kammer mit 50 ul Poly-D-Lysin.
- Waschen der Mitte jeder Vertiefung mit dH 2 O
- 80-85% konfluent trypsinieren NIH-3T3-Zellen und mit Wasser auf 10 ml Kulturmedium (DMEM mit 10% FBS).
- Nehmen Sie 375 ul von Federungs-und zentrifugieren bei 1750 rpm für 3 Minuten.
- Saugen Sie die Medien, die man aufpassen, nicht, um das Pellet zu stören.
- Fügen Sie 750 ul DMEM w / 10% FBS und resuspendieren.
- Fügen Sie Zellsuspension dH 2 O / DNA / FuGENE HD-Lösung und vorsichtig mischen.
- Eintragen von 250ul Zell / DNA-Suspension in jede Vertiefung (füllt bis zu 3 Brunnen).
- Inkubieren der transfizierten Zellen bei 37 ° C und 5% CO 2 für 15-18 Stunden.
2. Vorbereitung der CRB-A-Lösung
- Synthetisieren Käfig Rapamycin-Biotin-Addukt (CRB). Siehe "Synthetische Schema der CRB" für Details. Kurz gesagt werden Käfighaltung und Biotinreste separat hergestellt. Die Einheit wird dann Einsetzens konjugiert Rapamycin (LC lab), das Produkt anschließend an das Biotin-Komponente durch eine mittels Klickreaktion 7 bis CRb leisten gekoppelt ist.
- Bereiten Sie eine 1 uM Stammlösung der CRB in DMSO.
- Auflösen 1mg Avidin in 250 ul PBS in einem 0,5 ml Eppendorf-Röhrchen.
- Fügen Sie 1 ul der CRB-Stammlösung zu Avidin aufgelöst. Mischen Sie durch mehrmaliges Wenden.
- Bei Raumtemperatur für 15 min auf CRB-Avidin-Konjugat (CRB-A liefern)-Lösung.
- Ausschließen ungebundenen kleine Moleküle und reinigen CRB-A mit einem Ausschluss-Säule.
3. Microscopy and Light Beleuchtung an subzellulären Ebene
- Serum hungern transfizierten Zellen in DMEM ohne FBS für 12 Stunden.
- Vorsichtig absaugen Sie die Medien aus den Zellen und 250 ul der vorbereiteten 400 nM CRB-Eine Lösung (aus Schritt 2.6).
- Zur Dynamik von Proteinen in lebenden Zellen an subzelluläre Auflösung vor und nach der Behandlung Licht sichtbar zu machen, wurde Spinning-Disk-Mikroskopie (Abbildung 2a). UV-Beleuchtung wurde durch die Kopplung Optiken für UV-LED-Licht (365 nm) mit Auflicht-Fluoreszenz Licht (Abbildung 2b) erreicht.
- MetaMorph Software wurde benutzt, um Fluoreszenz-Aufnahmen von transfizierten Zellen alle 15 Sekunden zu erfassen.
- Definieren der Koordinaten und die Größe eines Beleuchtungsfleck mit einer Glasplatte mit fluoreszierenden Farbstoffen, die durch UV-Licht angeregt beschichtet. Die Größe kanndurch die Anwendung Objektiv mit unterschiedlichen Vergrößerungen und durch die Auswahl optischer Fasern mit verschiedenen Core-Größe variiert werden.
- Nach der Bestimmung Hintergrundwerte der Membran Kräuseln, UV-Licht bestrahlt an der Peripherie der Zellen. Die folgenden beiden Schritte sind, um den Kontrast vor lokalisierte Effekte.
- Weltweit bestrahlen Zellen mit 365 nm Licht einer Quecksilberlampe bereitgestellt.
- Lösen Sie demaskiert, so original Rapamycin in DMSO und dann in PBS (400 nm endg.), und fügen Sie die Lösung für das Imaging-Kammer zur globalen Effekte zu induzieren.
4. Repräsentative Ergebnisse
Ein Beispiel für repräsentative Ergebnisse ist in 3 gezeigt. UV-Licht-Bestrahlung mit einer kleinen Bereich in der Nähe einer Kante zellulären schnell Bildung von lokalisierten induzierte Rüschen nur in und um den bestrahlten Bereich. Um zu bestätigen, dass dies tatsächlich lokale Aktivität, wir dann global Zellen mit UV bestrahlt, oder hinzugefügt Rapamycin zu den Bulk-Medien, die beide which induzierte globale Rüsche Bildung in der gesamten Membran. Für eine quantitative Analyse, teilten wir Zielzellen in vier Quadranten, und zählte die Häufigkeit der Rüsche Bildung in jedem Quadranten auf lokale als auch globale nach Stimulation unter verschiedenen Bedingungen einschließlich der Kontrollen (Abbildung 4). Es ist nur diese Kombination von UV-Bestrahlung, CRB-A, und geeignete FKBP-FRB-Konstrukten, die lokalen Kräuseln induziert.

Abbildung 1. Schematische Darstellung der räumlich begrenzten Proteindimerisierung mit Käfig Rapamycin-Avidin-Konjugat (CRB-A) und UV-Licht. UV-Bestrahlung spaltet die Linker zwischen Rapamycin und Biotin, was zur Freisetzung von chemischen Dimerisierer (HE-Rapa, C40-O-(2-Hydroxyethyl)-rapamycin) und dem Nebenprodukt. Das freigesetzte Dimerisierer diffundiert dann in die Zellen und induziert die Dimerisierung zwischen FKBP-POI (Protein von Interesse) und Plasma membrane verankert FRB nur in der Nähe des bestrahlten Bereichs (blauer Kreis). Ohne UV-Bestrahlung, tun FKBP und FRB nicht Associate (rotes Kreuz), es kommt zu keinen Effekt. (Copyright @ ACS2011) 6

Abbildung 2. Bild des angepassten konfokalen Fluoreszenzmikroskop. (A) Frontalansicht des konfokalen Mikroskop (Axiovert 200, Zeiss). (B) Nahaufnahme, Draufsicht einer Koppeleinheit für EPI-Fluoreszenz-und UV-Beleuchtung.
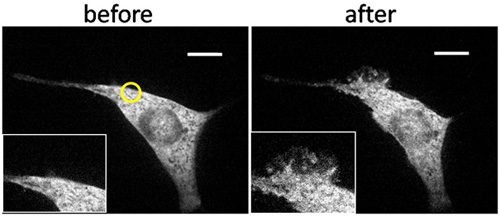
Abbildung 3. Räumlich begrenzten Rüsche Bildung in einer transfizierten NIH3T3-Zellen durch lokalisierte UV-Bestrahlung induziert. Konfokale Fluoreszenzbilder einer NIH3T3-Fibroblasten, die mit YFP-markierten FKBP-TIAM1 (Rac-Aktivator) und LDR (FRB-Membran verankert) transfiziert wird unterzog Bestrahlung in einem begrenzten Gebiet in der Nähe ihres Randes mit LED Licht bei 365 nm für 15 Sekunden ab 210 Sek. in Gegenwart von CRB-A-Konjugat in den Bulk-Medien. Diese Behandlung wurde von Global Illumination mit Quecksilber-Lampe für 1 s bei 1063 Sek. und globale Zugabe von Rapamycin letzten 400 Nm bei 1.560 Sek. gefolgt. Die Zelle zeigte fast keine zerzauste Aktivitäten zu Beginn (a), zeigte aber räumlich begrenzten Kräuseln nach lokalisierten Beleuchtung (gelber Kreis) (b). Die Zelle zeigte globalen Rüsche Bildung nach Global Illumination und Zugabe von Rapamycin (CD), was darauf hinweist, dass die lokale Bildung von Rüsche räumlich begrenzten Aktivierung von Rac verursacht wurde. Maßstab: 10 um. (Copyright @ ACS2011) 6
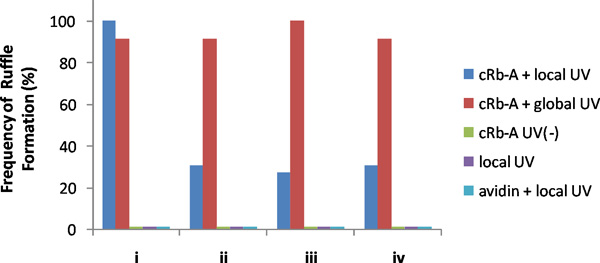
Abbildung 4. Häufigkeit der Rüsche Bildung in den Quadranten von transfizierten NIH3T3-Zellen. Lokale UV-Bestrahlung mit CRB-A und UV-Bestrahlung folgende globale wurden am 13. Zellen durchgeführt. CRB-A Addition (keine UV-Bestrahlung), wurden lokale UV-Bestrahlung mit oder ohne Avidin auf 13, 5 und 6 Zellen durchgeführt, jeweils. Keine der untersuchten Zellen zeigten Rüschen Formation mit CRB-A ohne UV-Bestrahlung oder lokale UV-Bestrahlung mit oder ohne Avidin den ersten Medien. Wir haben Daten aus den Zellen mit geringen Hintergrund Rüschen Bildung, aber die in der Lage waren von Rapamycin-induzierte Bildung Rüschen, die wir nach jedem Experiment überprüft durch Bestätigen globalen Rüschen Bildung als Folge der Zugabe von Rapamycin (finalen 400 nM). Diese Ergebnisse zeigten, dass CRB-A und UV-Bestrahlung lokalen Ort brauchen Rüschen-Bildung in den Zellen sind. (Copyright @ ACS2011) 6
Abkürzungen:
FKBP: FK506-bindende Protein
FRB: FKBP-Rapamycin-bindenden Proteins
TIAM1: T-Zell-Lymphom Invasion und Metastasierung-induzierenden Protein 1 (Rac-GEF)
LDR: Lyn-Linker DSAG-FRB (Lyn: N-terminalen 11 Aminosäuren von Lyn-Kinase)
HE-Rapa: C40-O - (2-Hydroxyethyl)-rapamycin
CRB: Käfig mit Rapamycin Biotinanteil
CRB-A: CRB konjugiert an Avidin
Diskussion
Wir beschrieben eine Technik, die eine neuartige Verbindung Käfigen beschäftigt zusammen mit dem FKBP-FRB Heterodimerisierung System, um Rho GTPase-Aktivität zu einem bestimmten subzellulären Ort auf einer Zeitskala von Sekunden zu manipulieren.
Es gibt drei Einschränkungen des vorliegenden Ansatzes. Erstens, weil das Verfahren zur Verhinderung oder die Diffusion von Dimerisierer über die Plasmamembran basiert, muss das Ziel zelluläre Lokalisation die Plasmamembran oder deren Umgebung sein. Eine weitere Optimierung der chemischen Struktur der CRB gestatten die Verbindung zu Zellen ohne eine Dimerisierung bis Lichteinstrahlung eingeben. Mit einem solchen Dimerisierer, könnten wir theoretisch manipulieren Aktivität von Signalmolekülen überall innerhalb der Zellen. Zweitens kann die molekulare Diffusion von chemischen dimerizers, FKBP-FRB Dimerisierung komplex, oder aktivierte endogene Signalmoleküle stark beeinflussen präzise Einschluss der beabsichtigten Wirkungen. Dieser Effekt ist besonders ausgeprägt,zu späteren Zeitpunkten und ist abhängig von Parametern mit UV-Bestrahlung (zB Strahlbreite, Energie-und Strahl-Modus (kontinuierliche vs gepulsten)) und den Diffusionskoeffizienten der beteiligten Verbindungen verbunden sind. Weitere empirische Optimierung dieser Parameter ermöglicht strengere Beschränkung des Signal-Aktivitäten. Drittens zeigt ein UV-Licht nicht-triviale Phototoxizität auf Zellen. Ein einfacher Weg, dieses Problem zu lindern ist es, eine längere Wellenlänge wie 405 nm zu verwenden, um Nitrobenzyl photolabilen Uncage. Zwei-Photonen-Beleuchtung für Uncaging ermöglicht Beleuchtung bei einer noch längeren Wellenlänge als auch bei sehr begrenzten Bereich von Zellen. In jüngster Zeit haben andere Forscher einen eleganten Ansatz zur Rac an einer subzellulären Ort mit lichtempfindlichen pflanzlichen Proteine aktivieren 8-11 gemeldet. Bisher ist ihre Anwendung auf nur wenige Proteine beschränkt. Im Vergleich zu ihren Strategien ist in unserem aktuellen Technik immer leicht anpassbar, um die Anzahl der Target-Proteine ohne umfangreiche und zeigen timich aufwändige Re-Engineering. Wir und andere haben bereits eine Vielzahl von Sonden Dimerisierung, die die Aktivität verschiedener Signalmoleküle an der Plasmamembran 5, 6, 12-14 manipulieren entwickelt. Raumzeitlich dynamischen zellulären Vorgänge sind nun direkt prüfbar.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Studie wurde vom NIH Forschungsförderung (DK090868 und GM092930 zu TI) unterstützt. Es gibt eine schwebende Patentanmeldungen auf einem Käfig Rapamycinanalog.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz / Ausrüstung | Firma | Katalog-Nummer | |
| Rapamycin | Tecoland | RAPA99 | |
| FuGENE HD | Roche | 04709691001 | |
| Avidin | Sigma | A9275-10MG | |
| DMSO | Sigma | D2650-5X5ML | |
| Größenausschlußsäule | GE Healthcare | Spin-Trap-G-25 | |
| Glasboden 8-Well-Kammer | Thermo Scientific | 12-565-47 | |
| Invertierten Fluoreszenzmikroskop | Zeiss | Axiovert200M | |
| UV-LED-Lichtquelle | Rapp Opto Electronics | UVILED | |
| Konfokale drehende Scheibe | Yokogawa Electric Corp | CSU10 | |
| CCD-Kamera | Hamamatsu Photonics | ORCA-ER | |
| 100x Objektiv | Zeiss | Plan Apochromat |
Syntheseschema der CRB (Copyright ACS2011) 6

Synthetische Bedingungen: (a) BnBr, K 2 CO 3, DMF (b) f.HNO 3, AcOH (c) TFA (d) Propargyl-Br, K 2 CO 3, DMF, (e) Glycerin, Katze. PTSA, Toluol (f) NaBH 3 CN, TiCl 4, MeCN (g) Tf 2 O, Pyridin (h) Methanol-HCl, (i) LiAlH 4, THF (j) TsCl, Pyridin, CH 2 Cl 2 (k) NaN 3, DMF (l) 8, 2,6-Di-t-Butylpyridin, CH 2 Cl 2 (m) 13, CuSO 4, Ascorbat, 2-Propanol, H 2 O, CH 2 Cl 2.
Referenzen
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420, 629-635 (2002).
- Takai, Y., Sasaki, T., Matozaki, T. Small GTP-binding proteins. Physiol. Rev. 81, 153-208 (2001).
- Kiyokawa, E., Aoki, K., Nakamura, T., Matsuda, M. Spatiotemporal regulation of small GTPases as revealed by probes based on the principle of Forster Resonance Energy Transfer (FRET): Implications for signaling and pharmacology. Annu. Rev. Pharmacol. Toxicol. 51, 337-358 (2011).
- Inoue, T., Heo, W. D., Grimley, J. S., Wandless, T. J., Meyer, T. An inducible translocation strategy to rapidly activate and inhibit small GTPase signaling pathways. Nat. Methods. 2, 415-418 (2005).
- Komatsu, T. Organelle-specific, rapid induction of molecular activities and membrane tethering. Nat. Methods. 7, 206-208 (2010).
- Umeda, N., Ueno, T., Pohlmeyer, C., Nagano, T., Inoue, T. A photocleavable rapamycin conjugate for spatiotemporal control of small GTPase activity. J. Am .Chem. Soc. 133, 12-14 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. Engl. 40, 2004-2021 (2001).
- Kennedy, M. J. Rapid blue-light-mediated induction of protein interactions in living cells. Nat. Methods. 7, 973-975 (2010).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461, 997-1001 (2009).
- Wu, Y. I. A genetically encoded photoactivatable Rac controls the motility of living cells. Nature. 461, 104-108 (2009).
- Yazawa, M., Sadaghiani, A. M., Hsueh, B., Dolmetsch, R. E. Induction of protein-protein interactions in live cells using light. Nat. Biotechnol. 27, 941-945 (2009).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem. Rev. 110, 3315-3336 (2010).
- Suh, B. C., Inoue, T., Meyer, T., Hille, B. Rapid chemically induced changes of PtdIns(4,5)P2 gate KCNQ ion channels. Science. 314, 1454-1457 (2006).
- Varnai, P., Thyagarajan, B., Rohacs, T., Balla, T. Rapidly inducible changes in phosphatidylinositol 4,5-bisphosphate levels influence multiple regulatory functions of the lipid in intact living cells. J. Cell. Biol. 175, 377-382 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten