Method Article
במרחב ובזמן מניפולציה של פעילות GTPase קטן ברמת subcellular ועל לוח זמנים של שניות בתאים חיים
In This Article
Summary
שיטה לשליטה במרחב ובזמן פעילות GTPase קטן לאור המתואר. שיטה זו מבוססת על heterodimerization FKBP-FRB rapamycin הנגרמת צילום-caging מערכות. אופטימיזציה של הקרנת אור מאפשר הפעלה מבוקרת spatio-temporally של GTPases קטנים ברמה subcellular.
Abstract
ויסות דינאמי של משפחת רו של triphosphatases guanosine קטנים (GTPases) עם דיוק רב spatiotemporal חיוני לתיפקוד התאי ואירועים שונים 1, 2. הדינאמיות spatiotemporally שלהם נחשף על ידי הדמיה של פעילות שלהם לוקליזציה ב 3 בזמן אמת. על מנת לקבל הבנה עמוקה יותר של תפקידם תפקודים תאיים שונים ברמה המולקולרית, הצעד הבא צריך להיות הפרעה של פעילות חלבון במקום העיתוי subcellular מדויק.
כדי להשיג מטרה זו, פיתחנו שיטה קלה הנגרמת, spatio-temporally הפעלה מבוקרת של GTPases קטנות על ידי שילוב של שתי טכניקות: (1) rapamycin הנגרמת FKBP-FRB heterodimerization ו (2) שיטת צילום caging של rapamycin. עם השימוש heterodimerization FKBP-FRB rapamycin בתיווך, פיתחנו שיטה מהירה מושרה ההפעלה או איון של קטן GTPases including RAC 4, 4 Cdc42, RhoA 4 ו 5 ראס, שבו rapamycin גורם טרנסלוקציה של FKBP-התמזגו GTPases או activators שלהם, קרום הפלזמה שבו FRB מעוגן. עבור צימוד עם מערכת זו heterodimerization, פיתחנו גם מערכת צילום caging של אנלוגים rapamycin. מתחם צילום בכלוב היא מולקולה כימית קטנה, אשר הפעילות מדוכאת עם קבוצת הגנה photocleavable הידועה כקבוצה caging. כדי לדכא את פעילות heterodimerization לחלוטין, עיצבנו rapamycin בכלוב כי הוא קשור מקרומולקולה כך מורכבת גדול וכתוצאה מכך אינו יכול לחצות את הממברנה הפלסמטית, המוביל פעילות כמעט ללא רקע כמו dimerizer כימי בתוך התאים 6. איור 1 מדגים התוכנית שלנו המערכת. עם שילוב של שתי מערכות אלו, אנו מקומי גייס activator RAC קרום הפלזמה על זמנים של שניות והשיג אור הנגרמת ההפעלה RAC על לב subcellularאל 6.
Protocol
1. Transfection של DNA פלסמיד
- הוסף DNAs פלסמיד, 0.5 קרום קשור מיקרוגרם FRB (להלן: LDR) ו -0.5 מיקרוגרם FKBP-Tiam1 (T-cell לימפומה הפלישה גרורות-התרמה חלבון 1: RAC activator) מתויג עם חלבון פלואורסצנטי כדי μl 37.5 DH 2 א ' הוסף 1 μl FuGENE HD.
- מערבולת ו דגירה בטמפרטורת החדר למשך 20 דקות. בינתיים, המשך הצעדים 1.3-1.8.
- לשטוף היטב בכל חדר 8-גם עם 50 μl פולי-D-ליזין.
- שטפו את מרכז גם כל אחד עם DH 2 א '
- Trypsinize 80-85% confluent-NIH 3T3 תאים לדלל עד בינוני 10 מ"ל התרבות (DMEM עם FBS 10%).
- הסרה של 375 μl של השעיה ו סרכזת ב 1750 סל"ד למשך 3 דקות.
- Aspirate התקשורת, נזהר לא להפריע גלולה.
- הוסף 750 μl של DMEM FBS w / 10% ו resuspend.
- הוסף ההשעיה התא DH 2 O / DNA / פתרון FuGENE HD ומערבבים בעדינות.
- הוספת 250μl ההשעיה תא / DNA אחד טוב (ימלא עד 3 בארות).
- דגירה התאים transfected על 37 מעלות צלזיוס, 5% CO 2 עבור 15-18 שעות.
2. הכנת פתרון CRB-
- לסנתז בכלוב rapamycin-ביוטין adduct (CRB). ראה "תוכנית סינתטית של CRB" לקבלת פרטים. בקצרה, moieties caging ו ביוטין מוכנים בנפרד. מחצית caging אז הוא מצומדות כדי rapamycin (LC מעבדה), המוצר יחד לאחר מכן מחצית ביוטין באמצעות תגובת לחץ 7 להרשות לעצמם CRB.
- הכן 1 מיקרומטר המניות הפתרון של CRB ב DMSO.
- ממיסים avidin במינון של 1 ב 250 μl של PBS על צינור 0.5 Eppendorf מ"ל.
- הוסף 1 μl של פתרון המניות CRB כדי avidin מומס. מערבבים כמה פעמים על ידי היפוך.
- דגירה בטמפרטורת החדר למשך 15 דקות להניב CRB-avidin המצומד (CRB-) פתרון.
- הכללה של מולקולות קטנות מאוגד ולטהר-CRB באמצעות עמודה בגודל הדרה.
3. מיקרוסקופיה תאורה אור ברמת subcellular
- סרום להרעיב תאים transfected ב DMEM ללא FBS במשך 12 שעות.
- בעדינות לשאוב התקשורת את התאים ומוסיפים 250 μl של 400 ננומטר מוכן CRB-פתרון (משלב 2.6).
- כדי להמחיש את הדינמיקה חלבונים בתאים חיים ברזולוציה subcellular לפני ואחרי הטיפול האור, מיקרוסקופיה דיסק מסתובב שימש (איור 2 א). תאורה UV הושג על ידי צימוד עבור אופטיקה אור LED UV (365 ננומטר) עם אור EPI-פלואורסצנטי (איור 2b).
- MetaMorph תוכנה נעשה שימוש כדי ללכוד תמונות הקרינה של תאים transfected כל 15 שניות.
- להגדיר את הקואורדינטות ואת הגודל של המקום תאורה באמצעות צלחת זכוכית מצופה צבעי ניאון נרגש על ידי אור UV. גודל יכוללהיות מגוונים על ידי יישום היעד עם העדשה בהגדלה שונות על ידי בחירת סיבים אופטיים עם גודל הליבה שונה.
- לאחר קביעת רמות הרקע של עלעול קרום אור, להקרין UV בשולי התאים. את שני השלבים הם לעמת הקודמת השפעות מקומיות.
- ברחבי העולם להקרין תאים עם אור 365 ננומטר מסופק על ידי מנורת כספית.
- ממיסים שברחה מכלוב, ובכך rapamycin המקורי DMSO ולאחר מכן PBS (400 nm הסופי), ולהוסיף את הפתרון לחדר ההדמיה לגרום השפעות גלובליות.
4. נציג תוצאות
דוגמה תוצאות נציג מוצגת באיור 3. הקרנת אור UV על אזור קטן ליד קצה נייד המושרה במהירות היווצרות מקומית סלסולים רק וליד אזור מוקרן. כדי לאשר כי אכן הפעילות המקומית, לאחר מכן מוקרן ברחבי העולם תאים עם UV, או להוסיף rapamycin לתקשורת בכמות גדולה, הן של WHIפרק המושרה היווצרות קפלים העולמי לאורך הממברנה. לניתוח כמותי, חילקנו תאים היעד לתוך ארבעת הרבעים, וספרו את תדירות היווצרות קפלים ברביע זה על מקומי, כמו גם בעקבות גירוי גלובלית בתנאים שונים, כולל בקרות (איור 4). רק שילוב זה של קרינה UV, CRB-A, ו-המתאימות FKBP FRB בונה שגורם עלעול המקומית.

באיור 1. סכמטי של חלבון dimerization מוגבל מרחבית באמצעות בכלוב rapamycin-avidin המצומד (CRB-) אור אולטרה סגול. קרינת UV המסלקת מקשר בין rapamycin ו ביוטין, והתוצאה היא שחרור של חומר כימי dimerizer (HE-ראפה, C40-O-(2-hydroxyethyl) rapamycin) ו תוצר לוואי שלה. Dimerizer מכן שוחרר מתמוסס לתוך התאים וגורם dimerization בין FKBP-POI (חלבון של עניין) ו פלזמה membRane מעוגנת FRB רק בקרבת האזור המוקרן (עיגול כחול). ללא קרינה UV, FKBP ו FRB לא שותף (הצלב האדום), ומכאן לייצר כל השפעה. (כל הזכויות שמורות @ ACS2011) 6

איור 2. תמונה של מיקרוסקופ פלואורסצנטי confocal אישית. (א) צפה הקדמי של מיקרוסקופ confocal (הפוך Axiovert 200, Zeiss). (ב) צילום מקרוב, צפה מעל יחידת צימוד עבור EPI הקרינה ואת התאורה UV.
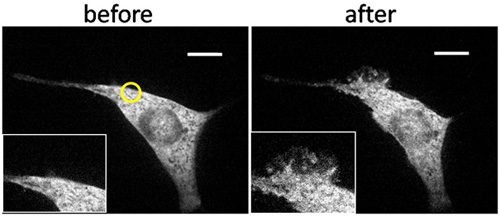
איור 3. היווצרות קפלים מוגבל מרחבית בתא NIH3T3 transfected הנגרמת על ידי קרינה UV מקומי. תמונות הקרינה confocal של תאים פיברובלסטים NIH3T3 כי הוא transfected עם YFP-מתויג FKBP-Tiam1 (RAC activator) ו LDR (קרום מעוגנת FRB) עברו הקרנה באזור מצומצם ליד הקצה עם LED אור 365 ננומטר במשך 15 שניות החל מ 210 שניות בנוכחות המצומד CRB-בתקשורת בתפזורת. טיפול זה בעקבות גלובל תאורה עם כספית מנורה 1 שניות ב בנוסף שניות והעולמית 1063 של rapamycin 400 nm האחרונים ב 1560 שניות. תא הראו כמעט שום פעילות פורעת בראשית (א), אך הראה מוגבל מרחבית פורעת לאחר תאורה מקומית (עיגול צהוב) (ב). התא הראה היווצרות קפלים העולמי אחרי ההארה הגלובלית תוספת של rapamycin (CD), המציין את היווצרות קפלים המקומי נגרם על ידי הפעלה מוגבלת מרחבית של RAC. סרגל קנה מידה: 10 מיקרומטר. (כל הזכויות שמורות @ ACS2011) 6
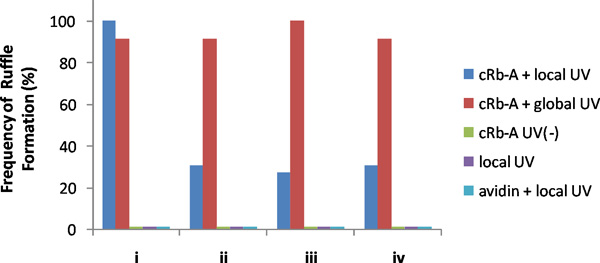
איור 4. תדירות היווצרות לפרוע ב הרביעים של NIH3T3 תאים transfected. קרינה UV מקומי עם CRB-A ו-UV הבאה קרינה גלובלית בוצעו על 13 תאים. CRB- בנוסף (ללא קרינה UV), קרינה UV מקומית עם או בלי avidin יושמו על תאים 13, 5 ו -6, בהתאמה. אף אחד התאים שנצפו הראו היווצרות קפלים עם CRB, ללא קרינה UV או קרינה UV מקומית עם או בלי avidin בתקשורת בתפזורת. אספנו נתונים מכל התאים עם רקע היווצרות נמוכה לפרוע אך היה היכולת של היווצרות קפלים rapamycin-Induced, אשר בדקנו לאחר כל ניסוי תאשר הקמת לפרוע העולמית כתוצאה תוספת של rapamycin (סופי 400 ננומטר). תוצאות אלה הראו כי CRB-A ו-UV הקרנה מקומית נחוצים ליצירת קפלים המקומי בתאים. (כל הזכויות שמורות @ ACS2011) 6
קיצורים:
FKBP: FK506 מחייב חלבון
FRB: FKBP-rapamycin מחייב חלבון
Tiam1: T-cell לימפומה הפלישה גרורות-התרמה חלבון 1 (RAC GEF)
LDR: Lyn-DSAG מקשר-FRB (לין: N-מסוף 11 חומצות אמינו של לין קינאז)
HE-ראפה: C40-O - (2-hydroxyethyl) rapamycin
CRB: rapamycin בכלוב עם מחצית ביוטין
CRB-: CRB מצומדות כדי avidin
Discussion
תיארנו טכניקה המשתמשת רומן בכלוב המתחם יחד עם מערכת FKBP-FRB heterodimerization כדי לתפעל פעילות Rho GTPase במיקום subcellular מדויק בקנה מידה זמן של שניות.
יש שלוש מגבלות הגישה הנוכחית. ראשית, כי השיטה מבוססת על מניעת או לאפשר דיפוזיה של dimerizer דרך הממברנה פלזמה, מיקום היעד הסלולר צריך להיות קרום הפלזמה או בקרבתה. אופטימיזציה נוספת של המבנה הכימי של CRB עשוי לאפשר מתחם להיכנס תאים ללא גרימת dimerization עד הקרנת אור. עם dimerizer כזה, היינו יכולים בתיאוריה לשנות פעילות של מולקולות איתות לכל מקום בתוך התאים. שנית, דיפוזיה מולקולרית של dimerizers כימיים, FKBP-FRB מורכבים dimerization, או הופעלו מולקולות איתות אנדוגני יכול מאוד להשפיע על הלידה המדויק של תופעות המיועדים. השפעה זו בולטת במיוחדב מאוחר יותר נקודות זמן והוא תלוי בפרמטרים הקשורים קרינה UV (כגון רוחב הקרן, אנרגיה, מצב הקורה (רציפה לעומת פעמו)) ואת מקדמי דיפוזיה של חומרים המעורבים. אופטימיזציה אמפירית נוספת של פרמטרים אלו מאפשר כליאה מחמירים יותר של פעילויות האות. שלישית, אור UV מפגין לא טריוויאלית phototoxicity לתאים. אחת דרך קלה לשפר את הבעיה היא להשתמש אורך גל ארוך יותר, כגון 405 ננומטר ל uncage קבוצות caging nitrobenzyl. שני הפוטונים תאורה עבור משחררות רפרוף מאפשר תאורה באורך גל ארוך אף יותר, כמו גם על האזור מקומי מאוד של תאים. לאחרונה, חוקרים אחרים דיווחו על הגישה האלגנטית להפעיל RAC במיקום subcellular באמצעות הרגישים לאור חלבונים צמחיים 8-11. עד כה, היישום שלה מוגבל רק כמה חלבונים בלבד. לעומת האסטרטגיות שלהם, טכניקה הנוכחי שלנו הוא יותר בקלות להתאמה להרחיב את מספר חלבונים היעד ללא נרחב TIבי רב הנדסה מחדש. אנחנו ואחרים כבר פיתחו מגוון רחב של בדיקות dimerization שיכולים לשנות את הפעילות של מולקולות איתות שונות על קרום הפלזמה 5, 6, 12-14. אירועים הסלולר דינמיים Spatiotemporally כעת ניתנת לבדיקה באופן ישיר.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
מחקר זה נתמך על ידי NIH מחקר מימון (DK090868 ו GM092930 ל TI). יש פטנט על אנלוגי rapamycin בכלוב.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב / ציוד | חברה | מספר קטלוגי | |
| Rapamycin | Tecoland | RAPA99 | |
| FuGENE HD | רוש | 04709691001 | |
| Avidin | סיגמא | A9275-10 מ"ג | |
| DMSO | סיגמא | D2650-5X5ML | |
| גודל הדרה עמודה | GE Healthcare | ספין מלכודת G-25 | |
| תחתית זכוכית 8-גם קאמרית | Thermo Scientific | 12-565-47 | |
| מיקרוסקופ פלואורסצנטי הפוכה | Zeiss | Axiovert200M | |
| UV-LED כמקור אור | ראפ Opto אלקטרוניקה | UVILED | |
| דיסק מסתובב confocal | Yokogawa החשמל | CSU10 | |
| מצלמת CCD | Hamamatsu Photonics | ORCA-ER | |
| העדשה המטרה 100x | Zeiss | תוכנית Apochromat |
תוכנית סינתטית של CRB (כל הזכויות שמורות ACS2011) 6

תנאי סינתטיים: (א) BnBr, K 2 CO 3, DMF (ב) f.HNO 3, AcOH (ג) TFA (ד) Propargyl-BR, K 2 CO 3, DMF, (ה), חתול גליצרול. pTsA, טולואן (ו) CN 3 NaBH, TiCl 4, MeCN (ז) TF 2 O, Pyridin (ח) מתנול HCl, (אני) LiAlH 4, THF (י) TsCl, פירידין, CH 2 Cl 2 (k) NaN 3, DMF (L) 8, 2,6-di-t-butylpyridine, CH 2 Cl 2 (מ) 13, CuSO 4, ascorbate, 2-propanol, H 2 O, CH 2 Cl 2.
References
- Etienne-Manneville, S., Hall, A. Rho GTPases in cell biology. Nature. 420, 629-635 (2002).
- Takai, Y., Sasaki, T., Matozaki, T. Small GTP-binding proteins. Physiol. Rev. 81, 153-208 (2001).
- Kiyokawa, E., Aoki, K., Nakamura, T., Matsuda, M. Spatiotemporal regulation of small GTPases as revealed by probes based on the principle of Forster Resonance Energy Transfer (FRET): Implications for signaling and pharmacology. Annu. Rev. Pharmacol. Toxicol. 51, 337-358 (2011).
- Inoue, T., Heo, W. D., Grimley, J. S., Wandless, T. J., Meyer, T. An inducible translocation strategy to rapidly activate and inhibit small GTPase signaling pathways. Nat. Methods. 2, 415-418 (2005).
- Komatsu, T. Organelle-specific, rapid induction of molecular activities and membrane tethering. Nat. Methods. 7, 206-208 (2010).
- Umeda, N., Ueno, T., Pohlmeyer, C., Nagano, T., Inoue, T. A photocleavable rapamycin conjugate for spatiotemporal control of small GTPase activity. J. Am .Chem. Soc. 133, 12-14 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. Engl. 40, 2004-2021 (2001).
- Kennedy, M. J. Rapid blue-light-mediated induction of protein interactions in living cells. Nat. Methods. 7, 973-975 (2010).
- Levskaya, A., Weiner, O. D., Lim, W. A., Voigt, C. A. Spatiotemporal control of cell signalling using a light-switchable protein interaction. Nature. 461, 997-1001 (2009).
- Wu, Y. I. A genetically encoded photoactivatable Rac controls the motility of living cells. Nature. 461, 104-108 (2009).
- Yazawa, M., Sadaghiani, A. M., Hsueh, B., Dolmetsch, R. E. Induction of protein-protein interactions in live cells using light. Nat. Biotechnol. 27, 941-945 (2009).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem. Rev. 110, 3315-3336 (2010).
- Suh, B. C., Inoue, T., Meyer, T., Hille, B. Rapid chemically induced changes of PtdIns(4,5)P2 gate KCNQ ion channels. Science. 314, 1454-1457 (2006).
- Varnai, P., Thyagarajan, B., Rohacs, T., Balla, T. Rapidly inducible changes in phosphatidylinositol 4,5-bisphosphate levels influence multiple regulatory functions of the lipid in intact living cells. J. Cell. Biol. 175, 377-382 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved