Técnica Asséptica em Ciências Ambientais
Visão Geral
Fonte: Laboratórios do Dr. Ian Pepper e Dr. Charles Gerba - Universidade do Arizona
Autora de Demonstração: Luisa Ikner
A técnica asséptica é uma habilidade fundamental amplamente praticada no campo da microbiologia ambiental que requer um equilíbrio de atenção plena e prática em laboratório. O uso adequado desta técnica reduz a probabilidade de contaminação bacteriana ou fúngica de reagentes, meios culturais e amostras ambientais. A técnica asséptica também é vital para garantir a integridade dos dados e manter a pureza das bibliotecas culturais que podem ser compostas por isolados muito raros e difíceis de cultura. As fontes de contaminação no ambiente laboratorial incluem microrganismos aéreos (incluindo aqueles que aderiram a partículas de poeira e fiapos), micróbios presentes no espaço de trabalho do banco de laboratório ou em vidros ou equipamentos não esterilizados, e micróbios transferidos do corpo e cabelo do pesquisador. O uso da técnica asséptica também é uma medida de segurança que reduz o potencial de transmissão de microrganismos aos pesquisadores, o que é particularmente importante quando se trabalha com patógenos.
Princípios
O objetivo do uso de técnicas assépticas é criar e manter um ambiente de trabalho estéril, equipamentos e reagentes, de modo a minimizar a contaminação de amostras biológicas. Para isso, o espaço de trabalho e algumas ferramentas podem ser desinfetados com produtos químicos como 70% de etanol e alvejante diluído. Também é importante que o pesquisador use equipamentos de proteção individual (EPI), como jaleco, luvas e óculos de segurança.
A mídia e os reagentes podem ser esterilizados usando aparelhos de esterilização de filtros que empregam filtros de 0,22 μm, que efetivamente removem a maioria dos microrganismos, como bactérias. Alternativamente, muitos reagentes e equipamentos também podem ser esterilizados em alto calor. Por exemplo, micróbios ligados ou em ferramentas, vidros e mídia líquida podem ser mortos pelo calor em uma autoclave, que é uma câmara que esteriliza o conteúdo através da exposição ao vapor pressurizado de alta temperatura. Além disso, algumas ferramentas podem ser esterilizadas pelo calor usando uma fonte de chama, como um queimador Bunsen.
O uso de uma fonte de chama também é uma das formas mais comuns de estabelecer um ambiente de trabalho asséptico. O calor da chama causa convecção de ar, gerando uma corrente ascendente que eleva qualquer contaminante aéreo para longe das proximidades do queimador, e criando um "campo estéril" para realizar um trabalho experimental asséptico.
Procedimento
1. Preparação para o trabalho asséptico
- Obtenha e aplique os seguintes itens epi: jaleco, luvas de látex ou nitríis (livre de lágrimas ou orifícios) e óculos de segurança(Figura 1). Para segurança no caso de usar uma chama aberta, amarre o cabelo comprido.

Figura 1: EPI: Um jaleco, luvas de látex e óculos de segurança. - Um segundo aspecto importante da técnica asséptica é a esterilização e armazenamento adequados de mídia/reagentes a serem utilizados em laboratório. Prepare o meio de caldo líquido (por exemplo,caldo de soja tripptic) e mídia à base de ágar (porexemplo,R2A) pesando a quantidade adequada de pó de base seca, que é adicionado à quantidade apropriada de água desionizada.
- Para o meio do caldo, dissolva o pó em uma placa quente com fogo baixo aplicado e dispense o líquido em volumes de 100 mL em frascos de vidro ou em volumes de 10 mL em tubos de teste de vidro. Com uma barra de mexida magnética, mexa o meio agarose no agitador de placa quente até que o pó esteja totalmente dissolvido.
- Aplique fita autoclave nos recipientes e autoclave a mídia de acordo com as instruções do fabricante (por exemplo,20 min a 121 °C) (Figuras 2 e 3). Observe que a cor das listras na fita autoclave deve mudar de branco (pré-autoclave) para preto (pós-autoclave). Embora a mudança de cor geralmente indique que a esterilização foi bem sucedida, verificações de esterilidade usando kits de tiras de esporos podem ser realizadas para verificar o processo de autoclavagem.

Figura 2: Fita autoclave sendo aplicada ao material.
Figura 3: Observe a mudança de cor das listras na fita autoclave do branco (pré-autoclave) para o preto (pós-autoclave). - Esfrie os caldos líquidos à temperatura ambiente e, em seguida, armazene à temperatura ambiente ou refrigerado a 4 °C.
- Esfrie o meio de agarose colocando o recipiente em um banho de água definido para ~50 °C. Uma vez resfriado, a mídia pode ser derramada em pratos petri estéreis. Deixe o meio esfriar e solidificar e, em seguida, consolidar-se para armazenamento em temperaturas especificadas pelo fabricante.
- Existem várias variedades de meios de cultura que não podem ser autoclavadas à medida que as altas temperaturas degradam ingredientes críticos. Esterilização destes requer esterilização de filtros usando um sistema de filtragem de vácuo que emprega um filtro de 0,22 μm, seguido de armazenamento na temperatura apropriada.
- Antes de realizar o trabalho no banco, desinfete a superfície usando uma solução apropriada (por exemplo,alvejante de 500 ppm). Isso reduz o risco de transferência de contaminantes da superfície de trabalho para culturas e mídia estéril.
- Para estabelecer um campo estéril, ligue um bico bunsen. O tipo de chama mais adequado para esterilizar laços de inoculação metálica é uma chama azul intensa, com um cone azul definitivo observado no meio(Figura 4).

Figura 4: Uma transferência de bactérias de uma placa de Petri mostrando o crescimento de um isolado cultivado para outra placa petri não inoculada contendo um meio de crescimento à base de ágar. - Passe lentamente o laço inoculante através da parte mais quente da chama (ponta do cone azul). O laço deve ficar vermelho quente para fins de esterilização.
2. Transferências Bacterianas: Da Placa de Petri para a Placa de Petri
- Um cenário de transferência de bactérias é de uma placa de Petri que mostra o crescimento de um isolado cultivado para outra placa Petri estéril contendo um meio de crescimento à base de ágar.
- Para começar, abra ligeiramente a placa de Petri contendo a cultura bacteriana pura, e bata suavemente o laço inoculante quente e esterilizado na superfície do ágar.
- Recupere uma colônia isolada da superfície da placa usando o laço inoculante resfriado e feche a placa de Petri.
- Execute uma raia para isolamento usando uma placa petri fresca contendo meio de cultura, com a tampa ligeiramente entreaberta.
- Para cada porção da raia de isolamento (3 total por placa), esterilizar a alça inoculante pouco antes de ser usada. Além disso, a chama esteriliza o laço logo após a raia final é realizada a fim de evitar a contaminação da superfície do banco e como uma consideração para outros no laboratório que podem mais tarde usar ou entrar em contato com os laços inoculadores.
- Coloque as placas listradas em uma incubadora para crescimento durante a noite.
3. Transferências Bacterianas: Da Cultura do Caldo à Placa de Petri
- Um segundo cenário de transferência de bactérias é de uma cultura de caldo que apresenta crescimento, como geralmente observado pela turbidez, para uma placa de Petri estéril contendo meio de crescimento.
- Remova a tampa do tubo de ensaio (ou frasco) contendo a cultura bacteriana pura e passe a abertura do recipiente 2-3x através da porção mais quente da chama. Para evitar contaminação, não coloque a tampa no banco.
- Abaixe cuidadosamente a alça de inoculação esterilizada no tubo/frasco e pressione suavemente contra a lateral do recipiente para esfriar antes de inserir na cultura do caldo.
- Remova um loopful de cultura de caldo(Figura 5),e substitua imediatamente a tampa.

Figura 5: Um loopful de cultura de caldo. - Execute uma raia para isolamento usando uma placa petri fresca contendo meio de cultura, com a tampa ligeiramente entreaberta.
- Para cada porção da raia (3 total por placa), esterilizar a alça inoculante pouco antes de ser usada. Além disso, a chama esteriliza o laço logo após a raia final é realizada a fim de evitar a contaminação da superfície do banco e como uma consideração para outros no laboratório que podem mais tarde usar os laços inoculadores.
- Coloque as placas listradas para isolamento em uma incubadora para crescimento durante a noite.
4. Transferências Bacterianas: Da placa de Petri com crescimento para meio líquido estéril
- Um terceiro cenário de transferência de bactérias é de uma placa de Petri contendo uma raia de cultura isolada para um tubo/frasco contendo meio de crescimento líquido estéril.
- Abra ligeiramente a placa de Petri contendo a cultura bacteriana pura, e esfrie o laço inoculante quente batendo-o suavemente na superfície do ágar.
- Recupere uma colônia isolada da superfície da placa usando o laço inoculante resfriado e feche a placa de Petri.
- Remova a tampa do tubo de ensaio (ou frasco) contendo o meio de crescimento líquido estéril e passe a abertura do recipiente 2 a 3 vezes através da porção mais quente da chama. Para evitar contaminação, não coloque a tampa nobanco.
- Abaixe cuidadosamente a colônia extraída no meio do caldo líquido e agitar suavemente o laço para liberar as bactérias. Substitua imediatamente a tampa.
- Esterilizar a alça inoculante para evitar a contaminação da superfície do banco e como uma consideração para outros no laboratório que podem mais tarde usar os laços inoculadores.
- Coloque o frasco em uma incubadora para crescer durante a noite.
- Remova o frasco da incubação no dia seguinte. Realizar uma série de diluição para enumerar a cultura.
- Emplaque as diluições da série para a mídia cultural agarose, e incubar as placas durante a noite.
- Remova as placas no dia seguinte e observe se há alguma contaminação.
5. Transferências Bacterianas: Da Cultura do Caldo ao Meio de Crescimento Líquido Estéril
- Um quarto cenário de transferência de bactérias é de uma cultura de caldo que exibe crescimento para um tubo/frasco contendo meio de crescimento líquido estéril.
- Remova a tampa do tubo de ensaio (ou frasco) contendo a cultura bacteriana pura e passe a abertura do recipiente duas vezes através da porção mais quente da chama. Para evitar contaminação, não coloque a tampa no banco.
- Abaixe cuidadosamente a alça de inoculação no tubo/frasco e pressione suavemente contra a lateral do recipiente para esfriar antes de inserir na cultura do caldo.
- Remova um loopful de cultura de caldo e substitua imediatamente a tampa.
- Remova a tampa do tubo de ensaio (ou frasco) contendo o meio de crescimento líquido estéril e passe a abertura do recipiente duas vezes através da porção mais quente da chama. Para evitar contaminação, não coloque a tampa no banco.
- Abaixe cuidadosamente o loopful extraído no meio de caldo líquido estéril e agitar suavemente o laço para liberar as bactérias. Substitua imediatamente a tampa.
- Esterilizar a alça inoculante(Figura 6)para evitar a contaminação da superfície do banco e como uma consideração para outros no laboratório que podem mais tarde usar os laços inoculadores.

Figura 6: Loop inoculante ficando vermelho quente enquanto é esterilizado com um queimador Bunsen. - Coloque o frasco em uma incubadora para crescer durante a noite.
- Remova o frasco da incubação no dia seguinte. Realizar uma série de diluição para enumerar a cultura.
- Emplaque as diluições da série para a mídia cultural agarose, e incubar as placas durante a noite.
- Remova as placas no dia seguinte e observe se há alguma contaminação.
Resultados
O resultado do procedimento demonstra técnica asséptica adequada e má técnica asséptica. A Figura 7 ilustra a contaminação que pode surgir da má técnica asséptica ao derramar placas de agarose (placa superior: meio estéril; placas inferiores: mídia contaminada).
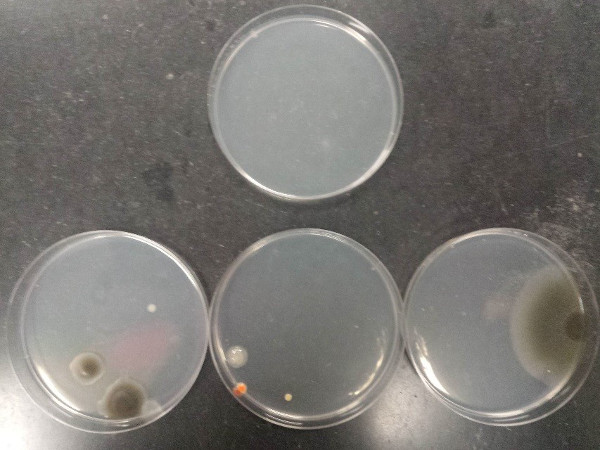
Figura 7: Contaminação que pode surgir da má técnica asséptica ao derramar placas de ágarose. Placa superior: meio estéril; placas inferiores: mídia contaminada.
Aplicação e Resumo
Além do uso de queimadores Bunsen, ambientes de trabalho assépticos também podem ser mantidos em estações de trabalho especializadas conhecidas como capas de fluxo laminar, que usam fluxo de ar direcionado e filtros para manter a esterilidade.
O uso adequado da técnica asséptica é vital para microbiologistas ambientais na amostragem no campo e no laboratório quando se trabalha com mídia, reagentes e isolados cultivados. A má técnica asséptica no campo pode resultar na transferência de microrganismos do técnico para amostras ambientais críticas, bem como na contaminação cruzada de micróbios de uma amostra para outra. Tais eventos são importantes, por exemplo, em estudos de ecologia microbiana que buscam identificar e comparar populações bacterianas e fúngicas que possam estar presentes em um determinado bioma. A contaminação dessas amostras pode resultar em perda de integridade dos dados. A técnica asséptica também é fundamental para a manutenção de isolados de cultura laboratorial originários da amostragem de campo ou de repositórios de cultura microbiana e celular bem estabelecidos. Os custos de tempo, trabalho e financeiro que seriam exigidos de um laboratório em um esforço para "limpar" ou substituir culturas contaminadas, particularmente isolados raros de ambientes únicos, poderiam ser muito altos e proibitivos, pois alguns isolados podem ser insubstituíveis.
Pular para...
Vídeos desta coleção:

Now Playing
Técnica Asséptica em Ciências Ambientais
Environmental Microbiology
126.3K Visualizações

Determinação do teor de umidade no solo
Environmental Microbiology
359.1K Visualizações

Coloração de Gram de bactérias de fontes ambientais
Environmental Microbiology
100.0K Visualizações

Visualização de Microrganismos do Solo por Meio do Ensaio de Lâmina de Contato e Microscopia
Environmental Microbiology
42.1K Visualizações

Fungos Filamentosos
Environmental Microbiology
57.2K Visualizações

Extração de DNA de comunidades de colônias bacterianas
Environmental Microbiology
28.8K Visualizações

Detecção de Microrganismos Ambientais com Reação em Cadeia da Polimerase e Eletroforese em Gel
Environmental Microbiology
44.5K Visualizações

Análise de RNA de amostras ambientais usando RT-PCR
Environmental Microbiology
40.3K Visualizações

Quantificando Microorganismos e Vírus Ambientais Usando qPCR
Environmental Microbiology
47.8K Visualizações

Análise da Qualidade da Água por Organismos Indicadores
Environmental Microbiology
29.5K Visualizações

Isolamento de bactérias fecais de amostras de água por filtração
Environmental Microbiology
39.3K Visualizações

Detecção de Bacteriófagos em Amostras Ambientais
Environmental Microbiology
40.7K Visualizações

Cultivo e Enumeração de Bactérias de Amostras de Solo
Environmental Microbiology
184.0K Visualizações

Análise da Curva de Crescimento Bacteriano e suas Aplicações Ambientais
Environmental Microbiology
295.7K Visualizações

Contagem de Algas em Métodos de Cultura
Environmental Microbiology
13.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados