Technique aseptique en sciences de l'environnement
Vue d'ensemble
Source : Laboratoires du Dr Ian poivre et Dr Charles Gerba - Université de l’Arizona
Démonstration d’auteur : Luisa Ikner
Une technique aseptique est une compétence fondamentale largement pratiquée dans le domaine de la microbiologie environnementale qui nécessite un équilibre de pleine conscience et la pratique en laboratoire. Bonne utilisation de cette technique réduit le risque de contamination bactérienne ou fongique des réactifs, milieux de culture et les échantillons environnementaux. Une technique aseptique est également essentielle d’assurer l’intégrité des données et maintenir la pureté des bibliothèques de culture qui peut être composé de très rares et difficiles à souches. Sources de contamination dans l’environnement de laboratoire comprennent les micro-organismes aéroportés (y compris ceux adhérant à la poussière et les peluches de particules), les microbes présent sur l’espace de travail laboratoire banc ou sur verrerie non stérilisé ou équipement et microbes transféré depuis le corps et les cheveux du chercheur. L’utilisation d’une technique aseptique est également une mesure de sécurité qui abaisse le potentiel pour la transmission des micro-organismes pour les chercheurs, qui est particulièrement important lorsque vous travaillez avec des agents pathogènes.
Principles
À l’aide de techniques aseptiques vise à créer et maintenir un environnement de travail stérile, matériel et réactifs, afin de minimiser la contamination des échantillons biologiques. Pour ce faire, l’espace de travail et certains outils peuvent être désinfectés avec des produits chimiques tels que l’éthanol à 70 % et diluer l’eau de Javel. Il est également important pour le chercheur d’enfiler l’équipement de protection individuelle (EPI) comme une blouse, des gants, et lunettes de sécurité.
Milieux et réactifs peuvent être stérilisés à l’aide d’appareils de stérilisation de filtre qui emploient des filtres 0,22 µm qui éliminent efficacement la plupart des micro-organismes comme les bactéries. Par ailleurs, beaucoup de réactifs et d’équipements aussi sont stérilisables en vif. Par exemple, microbes sur ou dans les milieux liquides, verrerie et outils peuvent être tués par la chaleur à l’autoclave, qui est une chambre qui stérilise le contenu par l’exposition à la vapeur sous pression haute température. En outre, certains outils peuvent être à l’aide d’une source de flamme, comme un bec Bunsen appertisé.
L’utilisation d’une source de flamme est également une des façons plus courantes d’établir un environnement de travail aseptique. La chaleur de la flamme provoque la convection de l’air, générant un courant ascendant qui soulève tous les contaminants aéroportés l’Ecart du brûleur et la création d’un « champ stérile » où mener des travaux expérimentaux aseptique.
Procédure
1. préparation pour travail aseptique
- Obtenir et d’appliquer les articles suivants de la PPE : blouse, des gants en latex ou nitrile (exempts de déchirures ou trous) et des lunettes de sécurité (Figure 1). Pour la sécurité en cas d’utilisation d’une flamme nue, attacher les cheveux long.

Figure 1 : EPI : une blouse de laboratoire, gants en latex et des lunettes de sécurité. - Un deuxième aspect important d’une technique aseptique est l’autoclavage et le stockage des médias et les réactifs à utiliser dans le laboratoire. Préparer le bouillon liquide de culture (p. ex., bouillon trypticase soja) et axée sur la gélose médias (p. ex., R2A) par pesée la quantité appropriée de poudre séchée base, qui est ajoutée à la quantité appropriée d’eau déionisée.
- Pour le bouillon de culture, dissoudre la poudre sur une plaque chauffante avec faible chaleur appliquée et diluer le liquide soit en volumes de 100 mL dans des fioles de verre bouchon vissé, ou en volumes de 10 mL dans des éprouvettes de verre bouchon vissé. À l’aide d’une barre magnétique remuer, remuer le milieu d’agarose sur l’agitateur de plaque chauffante jusqu'à ce que la poudre soit complètement dissoute.
- Appliquer le Ruban autoclave pour les conteneurs et stériliser les médias selon les instructions du fabricant (p. ex., 20 min à 121 ° C) (Figures 2 et 3). Notez que la couleur des rayures sur le Ruban autoclave doit changer du blanc (autoclave avant) au noir (autoclave après). Bien que le changement de couleur indique généralement que la stérilisation a réussi, stérilité vérifie à l’aide de kits de bande de spores peut être effectuée pour vérifier le processus d’autoclavage.

Figure 2 : Ruban Autoclave appliqué au matériel.

Figure 3 : Note du changement de couleur des bandes sur ruban autoclave du blanc (autoclave avant) au noir (après autoclavage). - Cool les bouillons liquides à température ambiante et ensuite stocker à température ambiante ou au réfrigérateur à 4 ° C.
- Refroidir le milieu d’agarose en plaçant le récipient dans un bain d’eau réglé à ~ 50 ° C. Une fois refroidis, les médias peuvent être versés dans des plats de Pétri stérile. Laisser le milieu à refroidir et se solidifier, puis consolider à stocker sous températures spécifiées par le fabricant.
- Il existe plusieurs variétés de milieux de culture qui ne peuvent être stérilisés à l’autoclave, car les températures élevées dégradent ingrédients essentiels. Stérilisation ceux-ci nécessitent filtre-stérilisation à l’aide d’un système de filtration sous vide utilisant un filtre de 0,22 µm, suivi par un stockage à la température appropriée.
- Avant d’exécuter des travaux sur la paillasse, désinfecter la surface à l’aide d’une solution appropriée (p. ex., eau de Javel 500 ppm). Cela réduit le risque de transfert des contaminants de la surface de travail pour les cultures et milieux stériles.
- Pour établir un champ stérile, allumer un bec Bunsen. Le type de flamme mieux adapté pour stérilisation métal öses est une flamme bleue intense, avec un cône bleu définitif observé au milieu (Figure 4).

Figure 4 : Isoler les transfert de bactéries d’un Pétri affichant la croissance d’une culture à une autre plaque non inoculée de Petri contenant un milieu de croissance axée sur la gélose. - Lentement, passer la boucle inoculer dans la partie la plus chaude de la flamme (pointe du cône bleu). La boucle doit devenir rouge chaud aux fins de stérilisation.
2. bactériennes transferts : De Pétri de Pétri
- Un scénario de transfert de bactéries provient un Pétri affichant la croissance d’une souche à l’autre, stérile Pétri cultivée contenant un milieu de croissance axée sur la gélose.
- Pour commencer, ouvrez légèrement la plaque de Petri contenant la culture bactérienne pure et Tapotez doucement la boucle inoculer chaude, stérilisée à la surface de la gélose.
- Récupérer une colonie isolée de la surface de la plaque à l’aide de la boucle inoculer refroidie et ferme la Pétri.
- Effectuer une strie d’isolement à l’aide d’un frais de Pétri contenant le milieu de culture, avec le couvercle légèrement entrouvert.
- Pour chaque partie de la strie d’isolement (3 au total par plaque), flamme-stériliser l’inoculation boucle juste avant leur utilisation. En outre, flamme-stériliser la boucle juste après que la séquence finale est effectuée afin de prévenir la contamination de la surface du banc et en contrepartie à des tiers dans le laboratoire, qui peut-être par la suite utiliser ou entrent en contact avec les boucles inoculer.
- Placez les géloses ensemencées dans un incubateur pour la croissance du jour au lendemain.
3. bactériennes transferts : Du bouillon de Culture à Pétri
- Un deuxième scénario de transfert de bactéries provient d’un bouillon de culture présentant la croissance, comme généralement observée par la turbidité, sur une plaque de Petri stérile contenant du milieu de croissance.
- Enlever le bouchon de l’éprouvette (ou ballon) contenant la culture bactérienne pure et l’ouverture du conteneur du passer 2-3 x à travers la partie la plus chaude de la flamme. Pour prévenir la contamination, ne définissez pas de la PAC vers le bas sur la table.
- Déposez délicatement la boucle inoculer stérilisée dans le tube/ballon et appuyez doucement contre la paroi du récipient refroidir juste avant l’insertion dans le bouillon de culture.
- Supprimer une anse du bouillon de culture (Figure 5) et immédiatement remettre le couvercle.

Figure 5 : Une anse du bouillon de culture. - Effectuer une strie d’isolement à l’aide d’un frais de Pétri contenant le milieu de culture, avec le couvercle légèrement entrouvert.
- Pour chaque portion de la séquence (3 au total par plaque), flamme-stériliser l’inoculation boucle juste avant leur utilisation. En outre, flamme-stériliser la boucle juste après que la séquence finale est effectuée afin de prévenir la contamination de la surface du banc et en contrepartie à des tiers dans le laboratoire, qui peut-être par la suite utiliser les boucles inoculer.
- Placer les plaques striées pour l’isolement dans un incubateur pour la croissance du jour au lendemain.
4. bactériennes transferts : De Pétri avec une croissance à un milieu liquide stérile
- Un troisième scénario de transfert de bactéries provient d’une plaque de Petri contenant une strie de culture isolée dans une tube/fiole contenant le milieu de culture liquide stérile.
- Un peu ouvrir la plaque de Petri contenant la culture bactérienne pure et refroidir la boucle chaude inoculer en tapant doucement sur la surface de la gélose.
- Récupérer une colonie isolée de la surface de la plaque à l’aide de la boucle inoculer refroidie et ferme la Pétri.
- Enlever le bouchon de l’éprouvette (ou ballon) contenant le liquide stérile milieu de croissance et passez l’ouverture du conteneur 2 à 3 fois par le biais de la partie la plus chaude de la flamme. Pour prévenir la contamination, ne définissez pas le bouchon vers le bas sur la table.
- Déposez délicatement la colonie extraite dans le milieu de bouillon liquide et agiter délicatement la boucle afin de libérer les bactéries. Le reboucher immédiatement.
- Flamme-stériliser la boucle à inoculation afin de prévenir la contamination de la surface du banc et en contrepartie à des tiers dans le laboratoire, qui peut-être par la suite utiliser les boucles inoculer.
- Placer le ballon dans un incubateur pour la croissance du jour au lendemain.
- Retirer le flacon d’incubation le lendemain. Effectuer une série de dilution afin d’énumérer la culture.
- Les dilutions de la série sur les milieux de culture d’agarose sur plaque et incuber les boîtes pendant la nuit.
- Enlever les plaques le lendemain et observer toute contamination.
5. bactériennes transferts : Du bouillon de Culture au milieu de culture liquide stérile
- Un quatrième scénario de transfert de bactéries provient d’un bouillon de culture présentant la croissance dans une tube/fiole contenant le milieu de culture liquide stérile.
- Enlever le bouchon de l’éprouvette (ou ballon) contenant la culture bactérienne pure et passez l’ouverture du contenant deux fois par le biais de la partie la plus chaude de la flamme. Pour prévenir la contamination, ne définissez pas de la PAC vers le bas sur la table.
- Déposez délicatement la boucle inoculer dans le tube/ballon et appuyez doucement contre la paroi du récipient refroidir juste avant l’insertion dans le bouillon de culture.
- Supprimer une anse du bouillon de culture et immédiatement remettre le couvercle.
- Enlever le bouchon de l’éprouvette (ou ballon) contenant le liquide stérile milieu de croissance et passez l’ouverture du contenant deux fois dans la partie plus chaude de la flamme. Pour prévenir la contamination, ne définissez pas de la PAC vers le bas sur la table.
- Déposez délicatement l’anse extraite dans le milieu du bouillon liquide stérile et agiter délicatement la boucle afin de libérer les bactéries. Le reboucher immédiatement.
- Flamme-stériliser l’inoculation boucle (Figure 6) afin de prévenir la contamination de la surface du banc et en contrepartie à des tiers dans le laboratoire, qui peut-être par la suite utiliser les boucles inoculer.

Figure 6 : Inoculant boucle tournant rouge chaud tout en étant stérilisé avec un bec Bunsen. - Placer le ballon dans un incubateur pour la croissance du jour au lendemain.
- Retirer le flacon d’incubation le lendemain. Effectuer une série de dilution afin d’énumérer la culture.
- Les dilutions de la série sur les milieux de culture d’agarose sur plaque et incuber les boîtes pendant la nuit.
- Enlever les plaques le lendemain et observer toute contamination.
Résultats
Le résultat de la procédure démontre une technique aseptique appropriée et mauvaise technique aseptique. La figure 7 illustre la contamination pouvant résulter de la mauvaise asepsie lors du versement d’agarose plaques (plaque supérieure : milieu stérile ; plaques de fond : contaminés par les médias).
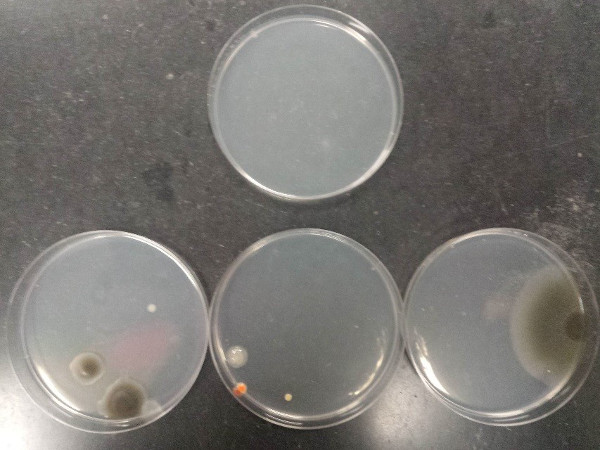
Figure 7 : Contamination pouvant résulter de la mauvaise asepsie lors du versement des plaques de gel d’agarose. Plateau supérieur : milieu stérile ; plaques de fond : contaminés par les médias.
Applications et Résumé
Autre que l’utilisation de brûleurs Bunsen, des environnements de travail aseptique aussi peuvent être maintenues que dans les stations de travail spécialisées appelées hottes à flux laminaire, dont l’usage a ordonné à débit d’air et filtres pour maintenir la stérilité.
Utilisation correcte de l’asepsie est vitale pour les microbiologistes environnementaux lors de l’échantillonnage sur le terrain et en laboratoire, lorsque vous travaillez avec les médias, réactifs et isolats de culture. Mauvaise technique aseptique dans le domaine peut entraîner le transfert des micro-organismes d’au technicien d’échantillons environnementaux critiques, ainsi que la contamination croisée des microbes dans un échantillon à l’autre. Ces événements sont d’importance, par exemple, dans les études sur l’écologie microbienne qui cherchent à identifier et comparer les populations bactériennes et fongiques qui peuvent être présentes dans un biome donné. La contamination de ces échantillons peut entraîner une perte d’intégrité des données. Une technique aseptique est également essentielle pour le fonctionnement du laboratoire culture isolats originaires d’échantillonnage sur le terrain ou de référentiels de culture microbiennes et cellule bien établies. Le temps, la main-d'œuvre et des coûts financiers qui seraient nécessaires d’un laboratoire dans le but de « nettoyage » ou remplacer les cultures contaminées, particulièrement rares isolats provenant d’environnements uniques, pourrait être très élevé et prohibitif, comme certains isolats peuvent être irremplaçables.
Passer à...
Vidéos de cette collection:

Now Playing
Technique aseptique en sciences de l'environnement
Environmental Microbiology
126.3K Vues

Détermination de la teneur en humidité du sol
Environmental Microbiology
359.1K Vues

Coloration de Gram des bactéries provenant de sources environnementales
Environmental Microbiology
100.0K Vues

Visualisation des micro-organismes du sol grâce aux lames de contact et à la microscopie
Environmental Microbiology
42.1K Vues

Champignons filamenteux
Environmental Microbiology
57.2K Vues

Extraction d'ADN communautaire à partir de colonies bactériennes
Environmental Microbiology
28.8K Vues

Détection des micro-organismes environnementaux avec la réaction en chaîne par polymérase et l'électrophorèse sur gel
Environmental Microbiology
44.5K Vues

Analyse d'ARN d'échantillons environnementaux à l'aide de la RT-PCR
Environmental Microbiology
40.3K Vues

Quantification des micro-organismes et des virus environnementaux à l'aide de la qPCR
Environmental Microbiology
47.8K Vues

Analyse de la qualité de l'eau via des organismes indicateurs
Environmental Microbiology
29.5K Vues

Isolement des bactéries fécales à partir des échantillons d'eau par filtration
Environmental Microbiology
39.3K Vues

Détection de bactériophages dans des échantillons environnementaux
Environmental Microbiology
40.7K Vues

Culture et dénombrement des bactéries dans un échantillon de sol
Environmental Microbiology
184.0K Vues

Analyse de la courbe de croissance bactérienne et ses applications environnementales
Environmental Microbiology
295.7K Vues

Dénombrement des algues via une méthodologie de culture
Environmental Microbiology
13.7K Vues